La insuficiencia cardiaca aguda constituye un problema de salud pública importante y creciente en todo el mundo, con una morbilidad, una mortalidad y un coste elevados. A pesar de los avances realizados en el tratamiento farmacológico, el pronóstico de los pacientes con insuficiencia cardiaca aguda descompensada continúa siendo malo. Por consiguiente, se están desarrollando abordajes no farmacológicos que se emplean de manera creciente. Estas técnicas pueden incluir varias modalidades de ventilación, ultrafiltración, apoyo circulatorio mecánico, revascularización miocárdica y tratamiento quirúrgico, entre otras. En este artículo se revisan los métodos no farmacológicos de tratamiento de la insuficiencia cardiaca aguda, sus indicaciones y las consecuencias pronósticas.
Palabras clave
La insuficiencia cardiaca aguda (ICA) constituye un estado clínico con una fisiopatología compleja, y se define como un síndrome heterogéneo formado por signos y síntomas de nueva aparición o por un empeoramiento gradual/rápido de la insuficiencia cardiaca (IC), que requiere un tratamiento de urgencia1. A pesar de los avances que se han realizado en el tratamiento farmacológico, su morbilidad y su mortalidad continúan siendo elevadas. Por consiguiente, se están desarrollando abordajes no farmacológicos que se emplean de manera creciente.
TRATAMIENTO DE PRESIÓN POSITIVA EN LAS VÍAS AÉREASLa presión positiva en las vías aéreas (PAP, positive airway pressure) surgió como un instrumento importante en el tratamiento de varias formas de insuficiencia respiratoria aguda, y constituye un instrumento no farmacológico útil en el tratamiento de la ICA. Se basa en mantener la PAP con métodos invasivos o no invasivos.
En el contexto clínico de la IC, la PAP produce varios efectos sobre la hemodinámica: a) reducción del retorno venoso sistémico y disminución de la carga ventricular derecha al aumentar la presión intratorácica2, y b) cambios en la resistencia vascular pulmonar total, que es el principal factor determinante de la poscarga ventricular derecha3. La resistencia vascular pulmonar total se caracteriza por una curva en forma de U respecto a la variación del volumen pulmonar (la resistencia vascular pulmonar más baja es la que puede observarse con un volumen pulmonar próximo a la capacidad residual funcional).
La PAP ejerce también diversos efectos sobre el sistema respiratorio en la IC: a) reclutamiento alveolar y evitación del colapso alveolar, con mejora del intercambio de gases y de la oxigenación; b) inducción del desplazamiento de líquidos que vuelven de los alvéolos y el espacio intersticial a la circulación pulmonar, y c) reducción de la carga de los músculos respiratorios y del trabajo de la respiración4.
Tipos o modos de presión positiva en las vías aéreas para el tratamiento de la insuficiencia cardiacaEn la IC pueden contemplarse varios tipos o modos de tratamiento con PAP. Todos ellos aplican una PAP, en concreto una presión positiva teleespiratoria, y cada tipo lo hace con una finalidad distinta. A continuación se presentan los principales tipos de PAP disponibles para el tratamiento de la ICA.
Ventilación invasivaSi es necesaria una ventilación invasiva, deben aplicarse modos que protejan el pulmón para evitar una lesión pulmonar.
Ventilación no invasivaLa ventilación con presión positiva no invasiva (VPPN) se ha utilizado ampliamente y debe fomentarse su empleo para aliviar los signos y síntomas de dificultad respiratoria causados por el edema pulmonar cardiogénico. La evidencia existente hasta la fecha sobre el posible efecto beneficioso de la VPPN deriva de series de casos y de ensayos controlados y aleatorizados relativamente pequeños. La mayoría de ellos comparan la PAP continua (CPAP) o la PAP binivel con el tratamiento estándar, e indican que la ventilación no invasiva mejora los síntomas y las variables fisiológicas, y que reduce las tasas de uso de ventilación invasiva y de mortalidad en pacientes seleccionados5–8. En la actualidad no está clara la trascendencia pronóstica real de la VPPN en el contexto de la ICA.
En un reciente ensayo clínico aleatorizado con pacientes con ICA se puso de manifiesto que ninguno de los dos tipos de VPPN redujo la mortalidad a corto plazo ni la tasa de intubación traqueal, en comparación con el tratamiento estándar, a pesar de las mejoras iniciales de los síntomas y de los parámetros indirectos indicativos de la gravedad de la enfermedad9. Sin embargo, una reciente revisión Cochrane ha mostrado una menor mortalidad y una reducción en las tasas de intubación con el empleo de la VPPN durante la hospitalización, en comparación con el tratamiento médico estándar solo en los pacientes con ICA10.
Continúa pendiente de respuesta la pregunta de si la VPPN en la ICA aporta un mayor beneficio en los pacientes con disfunción sistólica. Algunos autores plantean que, en los pacientes con una disfunción de predominio diastólico (que necesitan una presión de llenado relativamente elevada), los efectos del tratamiento con presión positiva podrían afectar el retorno venoso11.
Presión positiva continua en las vías aéreasEste tratamiento es el modo de PAP más ampliamente utilizado en los pacientes con IC. Proporciona un valor constante de presión positiva para mantener la permeabilidad de la vía aérea durante la respiración espontánea.
Los estudios observacionales sobre los efectos de la presión positiva en la fisiología cardiaca en el contexto del edema pulmonar agudo han mostrado que la CPAP mejora el gasto cardiaco y la distensibilidad pulmonar, al tiempo que reduce la resistencia pulmonar y de las vías aéreas12. Algunos estudios han mostrado también que la CPAP, en los pacientes con ICA, reduce el tono simpático, la presión arterial y la frecuencia cardiaca13. Al combinar en un metanálisis los ensayos clínicos aleatorizados de alta calidad, el tratamiento con CPAP se asoció a una tasa de intubación un 26% inferior y a una tendencia a una menor mortalidad global14.
Presión positiva en las vías aéreas binivelLa PAP binivel proporciona dos valores fijos de PAP: una presión mayor durante la inspiración (PAP inspiratoria) y una presión menor durante la espiración (PAP espiratoria). Su principal diferencia respecto a la CPAP es que aporta un apoyo de presión (diferencia entre la PAP inspiratoria y la PAP espiratoria) durante la inspiración.
El nivel de PAP inspiratoria desempeña un papel importante en la descarga de los músculos respiratorios, con lo que reduce el trabajo de la respiración, controla la hipopnea obstructiva, mantiene la ventilación alveolar y reduce la PaCO2 (presión parcial de anhídrido carbónico).
La PAP espiratoria produce unos efectos hemodinámicos y respiratorios similares a los de la CPAP. En un análisis retrospectivo15 se señaló que el uso de una PAP binivel en pacientes con edema pulmonar agudo se asociaba a una tasa de intubación baja y a una limitación de la estancia en la unidad de cuidados intensivos.
Sin embargo, las ventajas teóricas respecto a la CPAP no se han demostrado en algunos estudios comparativos no aleatorizados llevados a cabo en pacientes con ICA, que han señalado un posible efecto negativo16. En estudios de comparación del uso de la PAP binivel frente a la CPAP en el edema pulmonar agudo se ha descrito que la PAP binivel fue superior a la CPAP para aumentar la oxigenación, reducir el dióxido de carbono y la frecuencia respiratoria, y mejorar los síntomas17,18. Sin embargo, un reciente ensayo clínico aleatorizado no ha mostrado diferencias en eficacia ni en seguridad entre los dos métodos de ventilación no invasiva9. Serán necesarios más ensayos clínicos comparativos para responder a estas preguntas, y es esencial una monitorización estricta y una selección adecuada de los pacientes.
Las guías europeas recomiendan generalmente el uso de VPPN en los pacientes con ICA que tienen una frecuencia respiratoria > 20 resp/min y signos de edema de pulmón sin shock (grado de recomendación IIa B)19.
Hay varios factores para los que se ha descrito su asociación con el éxito de la ventilación no invasiva: a) sincronía paciente-respirador; b) puntuación en la escala de coma de Glasgow > 9; c) aceptación de la técnica por el paciente; d) poca cantidad de secreciones; e) puntuación APACHE II(Acute Physiology and Chronic Health Evaluation II) < 21; f) hipercapnia; g) pH arterial inicial > 7,1; h) respuesta adecuada en la primera hora de tratamiento, e i) presión arterial elevada en situación basal.
La retirada suele ser progresiva, en general en las siguientes situaciones: a) mejoría de la disnea, sin uso de los músculos accesorios; b) frecuencia cardiaca < 100 lpm; c) frecuencia respiratoria < 30resp/min; d) FiO2 (fracción inspirada de oxígeno) ≤ 50%, respiración espontánea sin VPPN, SaO2 (saturación arterial de oxígeno) > 90% y paciente que se encuentra cómodo, y e) PaO2 (presión arterial de oxígeno) > 70mmHg o cociente PaO2/FiO2 > 200mmHg.
Contraindicaciones y posibles complicaciones de la ventilación no invasivaNo hay un consenso claro sobre las contraindicaciones absolutas y relativas para el uso de la VPPN20, algunas de las cuales se incluyen como criterios de exclusión en muchos estudios. Véanse las posibles contraindicaciones y complicaciones en la tabla 1.
Contraindicaciones y posibles complicaciones de la ventilación no invasiva
| Contraindicaciones absolutas |
| Imposibilidad de proteger las vías aéreas |
| Neumotórax |
| Imposibilidad de retirar las secreciones |
| Fracturas faciales/anomalías anatómicas importantes |
| Hemorragia digestiva o de vías aéreas altas activa |
| Cirugía gastrointestinal o de vías aéreas altas reciente |
| Inestabilidad hemodinámica |
| Contraindicaciones relativas |
| Náuseas y vómitos |
| Agitación |
| Isquemia cardiaca o infarto agudo de miocardio |
| Traumatismo torácico importante |
| Hipoxemia intensa (PaO2/FiO2 < 75) |
| Complicaciones posibles |
| Molestias del paciente |
| Intolerancia a la técnica: asincronía |
| Lesiones del puente nasal |
| Claustrofobia |
| Sequedad de mucosas |
| Distensión gástrica |
| Hipotensión |
FiO2: fracción inspirada de oxígeno; PaO2: presión arterial de oxígeno.
La congestión y la retención de líquidos, que constituyen la característica distintiva de la IC, son la causa de alrededor del 90% de las hospitalizaciones por IC21 y su gravedad se asocia a una peor evolución clínica. La presencia de congestión manifiesta caracteriza a los pacientes con una mayor activación neurohumoral, en especial del sistema renina-angiotensina-aldosterona, disregulación celular y microvascular intrarrenal, y estrés oxidativo. En estos pacientes, la filtración glomerular suele estar disminuida, la reabsorción de sodio en el túbulo proximal está aumentada y la excreción de sodio en orina se reduce.
En varios estudios se ha demostrado el efecto adverso de una congestión persistente sobre los resultados clínicos. En el estudio ESCAPE22, la elevación de la presión capilar pulmonar enclavada fue uno de los factores predictivos independientes de la mortalidad más potentes tras el alta en los pacientes con ICA.
El aumento de la presión venosa central se asocia de manera independiente al deterioro de la función renal, el empeoramiento de la función renal y una evolución clínica desfavorable23. El incremento de la cantidad de sodio y de agua reabsorbida por el riñón como consecuencia de una mayor actividad neurohumoral sistémica e intrarrenal llena predominantemente la circulación venosa distensible, con lo que eleva la presión venosa central y la presión intraglomerular, y deteriora aún más la filtración renal24.
La determinación de cuál es el método óptimo para alcanzar una descongestión satisfactoria al tiempo que se reducen al mínimo las alteraciones de la función renal y la activación neurohumoral continúa siendo un campo de intensa investigación en la actualidad. Además, no puede considerarse que el tratamiento satisfactorio de la congestión se traduzca sin más en una mejoría renal o clínica.
Los diuréticos del asa por vía intravenosa siguen siendo el tratamiento de primera línea para la ICA22. A pesar del uso generalizado de estos fármacos, todavía existen dudas acerca de su perfil de seguridad y de la posología apropiada. Es importante señalar que la resistencia a los diuréticos y el empeoramiento de la función renal pueden ser cuestiones relevantes en los pacientes con ICA25. Aproximadamente a un 40% de los pacientes hospitalizados por IC se les da de alta con una congestión no resuelta26, lo cual se traduce en un aumento de las tasas de rehospitalización y de mortalidad27.
La ultrafiltración veno-venosa periférica, que es una estrategia mecánica destinada a la extracción de líquido, ha surgido como modalidad terapéutica alternativa o complementaria al tratamiento diurético en la ICA que cursa con congestión sistémica y pulmonar. Esta técnica utiliza una consola de ultrafiltración portátil junto con un circuito de sangre extracorpóreo desechable. Permite una eliminación efectiva de sodio y agua a través de una membrana semipermeable, en respuesta a un gradiente transmembrana creado por la diferencia de presión hidrostática. Los solutos de un tamaño molecular inferior al de los poros de la membrana, como los electrólitos y la urea, contenidos en esa cantidad de agua del plasma, se extraen a la misma concentración que en el agua del plasma. Sin embargo, no cabe prever una corrección significativa de las alteraciones electrolíticas y metabólicas ni una extracción importante de sustancias de alto peso molecular (por ejemplo, factores depresores del miocardio y citocinas) con la ultrafiltración aislada, debido a sus características operativas. Así, el producto ultrafiltrado es isotónico, mientras que la diuresis producida por los diuréticos del asa es predominantemente hipotónica, lo cual reduce al mínimo las anomalías electrolíticas y la activación neurohumoral. La ultrafiltración elimina más sodio (y menos potasio) que los diuréticos, para una pérdida de volumen equivalente28. Por consiguiente, los efectos favorables no se reproducen con la extracción de un volumen de líquido equivalente mediante un diurético intravenoso en dosis altas.
La ultrafiltración puede contribuir a producir una mejoría clínica a corto plazo de los pacientes con IC congestiva por varias vías que están relacionadas con la interacción del corazón y los pulmones: a) acción mecánica directa mediante la corrección de la sobrecarga de líquidos, que reduce la presión auricular derecha, la presión arterial pulmonar, las resistencias vasculares pulmonares y las presiones de llenado ventricular; b) reducción del edema cardiaco, que mejora la función diastólica y el rendimiento cardiaco global; c) corrección del desequilibrio neurohumoral y del componente de infrallenado arterial relativo inducido por la IC y por el tratamiento diurético, y d) reducción del agua extravascular del pulmón, el efecto de cortocircuito y el espacio muerto, con una mejora del intercambio de gases y de la oxigenación29,30.
Los mecanismos que subyacen en el efecto positivo de la ultrafiltración a largo plazo continúan sin estar claros. Es probable que las diferencias existentes en la respuesta neurohumoral a la extracción de líquido puedan desempeñar algún papel, a pesar de la similar capacidad que tienen la ultrafiltración y el tratamiento diurético de mejorar los síntomas y fomentar una estabilización clínica a corto plazo en los pacientes sin IC refractaria. De hecho, la descongestión obtenida con la ultrafiltración, en comparación con la proporcionada por el tratamiento diurético, no fomenta, o incluso desactiva, los mecanismos de compensación neurohumorales, con lo que da lugar a un mantenimiento del beneficio clínico a largo plazo y, por consiguiente, a una reducción de las hospitalizaciones posteriores31.
La pregunta que se plantea es cuándo pueden obtener los pacientes con congestión un mayor efecto beneficioso de la ultrafiltración, y cuándo deberían ser tratados con esta técnica como tratamiento de primera línea. Además del momento adecuado para iniciar la ultrafiltración, otro factor importante es la tasa de filtración, puesto que una extracción de volumen que supere la tasa de rellenado del plasma puede conducir a depleción de volumen intravascular, hipotensión e hipoperfusión renal. Deberá hacerse lo posible por identificar las subpoblaciones en las que pueda ser más probable la obtención de un efecto beneficioso con la ultrafiltración. A este respecto, un estudio reciente ha comparado prospectivamente pacientes con ICA tratados con ultrafiltración estratificados según la fracción de eyección ventricular izquierda, y no se observaron diferencias entre los grupos en cuanto a las respuestas terapéuticas, la duración global de la hospitalización ni la mortalidad intrahospitalaria32. Los resultados de este estudio indican que la ultrafiltración podría aplicarse de modo seguro a los pacientes con congestión, con independencia de cuál sea su fracción de eyección.
En general, son pocos los ensayos clínicos rigurosos existentes sobre la ultrafiltración como tratamiento de la ICA, y la mayor parte son de pequeño tamaño, retrospectivos, sin controles y con un seguimiento corto. Además, las diferencias existentes en las poblaciones de pacientes con IC y en las técnicas de ultrafiltración dificultan la comparación de los resultados. No obstante, la evidencia disponible señala que la ultrafiltración mejora la congestión pulmonar y periférica, la función pulmonar y la hemodinámica sin causar efectos adversos sobre la función renal. Los cambios hemodinámicos favorables que se observan con la ultrafiltración pueden ser consecuencia de la mejora de la función renal y del restablecimiento de la capacidad de respuesta a los diuréticos33,34.
El ensayo RAPID-CHF34 fue el primer estudio controlado y aleatorizado sobre la ultrafiltración en el tratamiento de la ICA. Se incluyó a 40 pacientes en la aleatorización para recibir una única sesión de ultrafiltración o la asistencia médica habitual. Por lo que respecta al objetivo primario, consistente en la pérdida de peso a las 24h, no hubo diferencias significativas entre los grupos. Sin embargo, la eliminación de líquido al cabo de 24h y la disnea y los síntomas de IC a las 48h mejoraron de manera significativa con la ultrafiltración.
En el ensayo UNLOAD35, el más amplio realizado en este campo, se incluyó en la aleatorización a 200 pacientes con ICA que se asignaron a ultrafiltración (tratamiento principal) o a un tratamiento con diuréticos del asa en las 24h siguientes a su ingreso. Se excluyó a los pacientes con disfunción renal grave y los que presentaban inestabilidad hemodinámica. Los objetivos primarios fueron la pérdida de peso, el alivio de la disnea a las 48h y la tasa de reingresos. En el grupo de ultrafiltración se observó una mayor pérdida de peso, pero no hubo diferencias en lo relativo a la disnea percibida por los pacientes. Es de destacar que el ensayo UNLOAD mostró una disminución de las rehospitalizaciones por IC con la ultrafiltración en comparación con el tratamiento diurético. Sin embargo, este objetivo de eficacia secundario se basó en un número de eventos relativamente bajo. Asimismo, también cabe destacar que hubo una tendencia al empeoramiento de la función renal en el grupo de ultrafiltración.
En un estudio de comparación retrospectivo de 25 pacientes tratados con ultrafiltración, 25 tratados con diuréticos intravenosos y 25 tratados con nesiritida, los del grupo de ultrafiltración fueron los que presentaron un mayor aumento de la urea y de la creatinina en sangre. A pesar del empeoramiento de la función renal, las rehospitalizaciones por cualquier causa en 30 días fueron menos frecuentes en los pacientes tratados con ultrafiltración (12% frente a 24% con diuréticos y 28% con nesiritida)36. Estos resultados indican que la descongestión en los pacientes con ICA puede mejorar los resultados aunque la diuresis intensa produzca un deterioro de la función renal.
En el ensayo CUORE37, los pacientes asignados aleatoriamente a ultrafiltración presentaron una frecuencia de rehospitalizaciones por IC congestiva significativamente inferior que los individuos del grupo control, y este efecto favorable se mantuvo durante un periodo de hasta 1 año. La reducción de las rehospitalizaciones se asoció a un mantenimiento del peso corporal y a una función renal más estables, así como a una dosis de diuréticos inferior en los primeros 6 meses siguientes al alta, en comparación con los controles. Estas reducciones, como en el ensayo UNLOAD, confirman que la congestión constituye uno de los principales factores determinantes del pronóstico, y señalan también que la descongestión por sí sola no es suficiente, puesto que el grado de extracción de líquidos fue el mismo en ambos grupos.
El ensayo Cardiorenal Rescue Study in Acute Decompensated Heart Failure (CARRESS-HF)38, que es el segundo estudio multicéntrico más amplio realizado en este campo, incluyó pacientes que presentaban también un síndrome cardiorrenal y una congestión persistente, y se les asignó aleatoriamente a recibir un tratamiento farmacológico basado en un algoritmo o ultrafiltración como tratamiento de rescate. El objetivo primario bivariante fue el cambio de la cifra de creatinina sérica y del peso corporal a las 96h de la inclusión en el estudio. Los pacientes del grupo de ultrafiltración no mostraron una mayor pérdida de peso y presentaron un aumento significativo de la creatinina sérica y una tasa más alta de acontecimientos adversos, como sepsis. Debido a la falta de evidencia de un efecto beneficioso de la ultrafiltración y al mayor número de acontecimientos adversos, la inclusión finalizó antes de lo programado. No obstante, los grupos de estudio no eran totalmente comparables: a) no se autorizó el uso de fármacos inotrópicos y de vasodilatadores en el grupo de ultrafiltración, y sí en los pacientes con tratamiento farmacológico al cabo de 48h, según la diuresis, y b) la dosis de diuréticos se ajustó en el grupo de tratamiento farmacológico, mientras que la tasa de ultrafiltración aplicada fue uniforme. Los resultados del estudio CARRESS-HF y de otros similares39 plantearon dudas acerca del papel de la ultrafiltración después de la aparición de resistencia a los diuréticos, disfunción renal progresiva y síndrome cardiorrenal.
No obstante, hay algunos puntos que cabe señalar respecto a estos dos últimos estudios. En primer lugar, las indicaciones clínicas para la ultrafiltración y la población con IC estudiada fueron diferentes, de tal manera que la ultrafiltración fue un tratamiento de primera línea electivo en el ensayo CUORE y un tratamiento de rescate en la IC complicada por una lesión renal aguda en el CARRESS-HF. En segundo lugar, el protocolo de descongestión utilizado en los pacientes tratados con ultrafiltración en el ensayo CARRESS-HF no se individualizó, y es probable que fuera demasiado agresivo en cuanto a la rapidez y la cantidad total de extracción de líquido. En tercer lugar, el uso de un tratamiento farmacológico escalonado en el grupo de control del ensayo CARRESS-HF, con vasodilatadores y fármacos inotrópicos, tuvo como finalidad mantener un objetivo de diuresis predefinido. La adición de tratamientos adyuvantes en el grupo de ultrafiltración no se autorizó a menos que se consideraran necesarios como tratamiento de rescate. En cuarto lugar, en el ensayo CARRESS-HF, al igual que en el estudio UNLOAD, los diuréticos del asa se suspendieron o no se autorizó su empleo durante la ultrafiltración.
La seguridad y la eficacia de la ultrafiltración dependen de la capacidad de eliminación de líquido sin causar una inestabilidad hemodinámica o un empeoramiento de la función renal. Para alcanzar este objetivo es preciso establecer claramente la cantidad y la rapidez de extracción de líquido. Si la velocidad de ultrafiltración es demasiado alta, se produce una inestabilidad hemodinámica ya que el rellenado del espacio intravascular a partir del intersticio no puede compensar la reducción del volumen intravascular. Una velocidad de ultrafiltración inferior da lugar a un rellenado intravascular gradual a partir del espacio intersticial que reduce el líquido extracelular sin inducir una depleción del volumen intravascular. En la práctica, la ultrafiltración debe prescribirse inicialmente a una velocidad baja (100-200ml/h); ha dejado de recomendarse el uso de una velocidad de ultrafiltración que supere los 250ml/h. Es de destacar que los pacientes con una IC de predominio derecho, o los pacientes con IC y una función sistólica preservada, son especialmente propensos a la depleción de volumen intravascular. En consecuencia, todos los pacientes deben ser cuidadosamente evaluados y hay que supervisar su estado clínico mientras se aplica la ultrafiltración. Puede realizarse una vigilancia de los cambios en el hematocrito mediante sensores en línea como marcadores indirectos sustitutivos de la rapidez de rellenado del plasma. La vigilancia ecocardiográfica de los cambios que se producen en el diámetro de la vena cava inferior y de las aurículas, el análisis de la impedancia y la determinación de biomarcadores se encuentran entre otras posibles opciones.
Complicaciones de la ultrafiltraciónLos datos de estudios aleatorizados sobre los posibles acontecimientos adversos asociados a la ultrafiltración son subóptimos. En el estudio CARRESS-HF se observó que la incidencia de acontecimientos adversos graves fue significativamente superior en el grupo de ultrafiltración que en el grupo de tratamiento farmacológico (72 frente a 57%; p = 0,03), lo que se atribuyó principalmente a la IC y la insuficiencia renal. La velocidad de ultrafiltración elevada y el balance de líquidos muy negativo no constituyen limitaciones técnicas, sino clínicas. La tolerancia individual a la extracción de líquido durante la ultrafiltración aislada depende de una interrelación compleja de varios factores que influyen en la rapidez del rellenado vascular. Como regla general, un abordaje intensivo del cambio de peso mediante ultrafiltración aislada podría tener consecuencias negativas en la hemodinámica sistémica y, por consiguiente, también en la función renal.
Aparte de las complicaciones renales y hemodinámicas, la ultrafiltración aislada comporta problemas que son comunes a cualquier otra técnica de tratamiento sustitutivo renal basado en circulación extracorpórea; los más frecuentes son los ligados al uso de un catéter (p. ej., la infección de la vía de acceso venoso) y la coagulación en el circuito. La hemolisis y la hemorragia son complicaciones muy poco frecuentes.
La ultrafiltración ha surgido como una opción atractiva para el tratamiento de la ICA basándose en los avances recientes de los conocimientos existentes sobre los mecanismos que subyacen en la cardiopatía y el síndrome cardiorrenal, así como por la eficacia y la seguridad subóptimas de los tratamientos convencionales. Sin embargo, los resultados globales introducen una nueva complejidad por lo que respecta a las relaciones entre las estrategias de extracción de líquido, la función renal y los resultados clínicos. Serán necesarios nuevos estudios para definir mejor el papel del tratamiento con ultrafiltración en este contexto.
APOYO CIRCULATORIO MECÁNICOLa ICA incluye un amplio espectro de trastornos clínicos, incluido el shock cardiogénico (SC), un estado de hipoperfusión de los órganos finales causado por la disfunción ventricular, según criterios clínicos y hemodinámicos, que se asocia a un mal pronóstico global. Existen numerosas causas de SC, pero el infarto de miocardio con fallo ventricular izquierdo sigue siendo la más frecuente. El fundamento general para el uso de un apoyo circulatorio mecánico (ACM) en los pacientes con SC es restablecer una presión de perfusión sistémica suficiente, con el fin de ganar tiempo para permitir la recuperación del ventrículo. A lo largo de las últimas décadas, la innovación en este campo ha modificado el tratamiento del SC.
Hasta la fecha no se ha alcanzado un consenso universal respecto a las indicaciones del ACM en la ICA, pero las más frecuentes son: a) SC después de un infarto; b) miocarditis fulminante; c) IC crónica con descompensación aguda que no responde a los fármacos inotrópicos; d) incapacidad de desconexión de un bypass cardiopulmonar después de la cirugía cardiaca; e) fallo del injerto después de un trasplante de corazón, y f) estado posterior a un paro cardiaco. En esos contextos, el papel del ACM puede ser uno de los siguientes:
- •
Tratamiento puente para un trasplante.
- •
Tratamiento de destino: una alternativa en los pacientes en quienes está contraindicado el trasplante de corazón
- •
Tratamiento puente para la recuperación.
- •
Tratamiento puente para puente: en los pacientes que presentan un shock grave o después de haber tenido un paro cardiaco y que reciben apoyo con un dispositivo de uso temporal para evaluar si pueden ser candidatos a un apoyo a largo plazo.
- •
Tratamiento puente para la decisión: se utiliza cuando no está claro cuál es la mejor opción para un determinado paciente en el momento de implantar el dispositivo.
El dispositivo ideal debe proporcionar tanto apoyo hemodinámico como protección del miocardio. Los dispositivos existentes para la aplicación del ACM son: bomba de balón intraaórtico (BBIA), apoyo vital extracorpóreo (AVEC) y dispositivos de asistencia ventricular (DAV). Las actuales guías europeas recomiendan que se contemple el uso de un dispositivo de asistencia percutáneo para el ACM en el SC refractario con el objeto de proporcionar un efecto de inicio rápido y sencillo, y no expresan ninguna preferencia en la elección del dispositivo (grado de la recomendación IIa C)40. Una descripción detallada de los diferentes dispositivos de asistencia queda fuera del ámbito de este artículo, pero pueden consultarse revisiones al respecto en otras publicaciones41–43; en consecuencia, aquí solo se presentarán las consideraciones generales. En la actualidad, los datos obtenidos en ensayos clínicos aleatorizados sobre la efectividad y la seguridad, las indicaciones y el momento de aplicación óptimo de cada dispositivo son limitados.
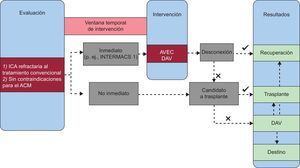
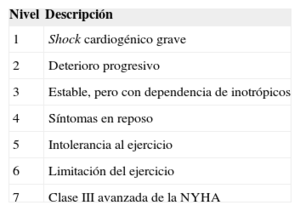
Los principales factores determinantes del éxito en el campo del ACM para la IC son la selección de los pacientes (a menudo basada en criterios subjetivos) y el momento de implantación del dispositivo (efecto dual de un uso temprano: equilibrio entre eficacia y complicaciones derivadas del dispositivo). En INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support), un registro de los Estados Unidos en el que se consignan datos de pacientes con el apoyo de unos pocos registros aprobados por la Food and Drug Administration, los pacientes de las clases III y IV de la New York Heart Association se clasifican en siete perfiles clínicos según sus signos y síntomas (tabla 2) para definir las diferencias clínicamente importantes en la gravedad de la enfermedad entre los distintos pacientes con IC avanzada44.
Perfiles clínicos del Interagency Registry for Mechanically Assisted Circulatory Support
| Nivel | Descripción |
|---|---|
| 1 | Shock cardiogénico grave |
| 2 | Deterioro progresivo |
| 3 | Estable, pero con dependencia de inotrópicos |
| 4 | Síntomas en reposo |
| 5 | Intolerancia al ejercicio |
| 6 | Limitación del ejercicio |
| 7 | Clase III avanzada de la NYHA |
NYHA: New York Heart Association.
Casi el 70% del total de DAV registrados se han implantado en el subgrupo de pacientes con IC en estado más grave (perfiles de INTERMACS 1 y 2). Sin embargo, los perfiles bajos de INTERMACS se han asociado de manera uniforme con una mayor mortalidad perioperatoria45. En los últimos años se han producido cambios en este campo. A la mayoría de los pacientes se los trata ahora con apoyo circulatorio percutáneo transitorio, como forma de respaldar la circulación y realizar una selección para el posterior empleo de un DAV de uso prolongado.
A la hora de evaluar la forma de ACM más apropiada para cada paciente hay varios factores que deben tenerse en cuenta en la estrategia inicial:
- •
Etiología de la disfunción cardiaca.
- •
Marco temporal de la implantación: si se requiere una acción inmediata (por ejemplo, en los pacientes de la clase 1 de INTERMACS) se descartan los DAV implantados quirúrgicamente; en estos casos, las opciones son la BBIA, el AVEC o un DAV implantable por vía percutánea. La BBIA se reserva para las formas «menos graves», con una presión arterial media superior a 40mmHg. En las formas más avanzadas, los DAV implantados por vía percutánea consiguen respaldar la circulación hasta que la función cardiaca se reemplaza por completo. Cuando también es necesario un apoyo pulmonar, el AVEC es la única opción disponible.
- •
Evolución temporal prevista de la recuperación.
- •
Elegibilidad para un DAV a largo plazo o un trasplante.
- •
Reserva de función ventricular.
- •
Vía de acceso arterial y tamaño del vaso.
- •
Gravedad de la disfunción pulmonar.
En la figura se presenta un algoritmo simplificado para el tratamiento de los pacientes con ICA cuando se contempla el uso de un ACM.
Algoritmo propuesto para el tratamiento de los pacientes con insuficiencia cardiaca aguda cuando se contempla un apoyo circulatorio mecánico. ACM: apoyo circulatorio mecánico; AVEC: apoyo vital extracorpóreo; DAV: dispositivo de asistencia ventricular; ICA: insuficiencia cardiaca aguda; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support.
La BBIA es la forma de ACM más actual y menos costosa. Funciona como un dispositivo de desplazamiento de volumen. Al hinchar y deshinchar el balón, de manera sincronizada con el ciclo cardiaco, mejora la presión diastólica máxima y el flujo sanguíneo coronario, al tiempo que reduce la presión aórtica, la poscarga y el consumo de oxígeno del miocardio. Es fácil y rápida de colocar, pero requiere una cierta función cardiaca para que resulte efectiva.
Antes del ensayo IABP-SHOCK46, que se concibió para respaldar finalmente una práctica clínica contemporánea con una evidencia real, toda recomendación para el tratamiento con BBIA en el infarto de miocardio con elevación del segmento ST que cursaba con SC se basaba en consideraciones fisiopatológicas y en la opinión de expertos. Los resultados no mostraron un efecto beneficioso con el uso de la BBIA por lo que respecta a la mortalidad a 30 días ni en ninguno de los objetivos secundarios clave. Este estudio fue un ensayo multicéntrico, abierto, que incluyó a 600 pacientes de 37 centros. Los pacientes, que presentaban infarto agudo de miocardio complicado por SC, se asignaron aleatoriamente a un grupo con BBIA u otro sin BBIA. En más del 95% de ellos se realizó una intervención coronaria percutánea primaria, con implantación de stents en el 90%. A los 30 días no hubo diferencias significativas en el resultado primario de mortalidad, ni en ninguno de los objetivos secundarios, entre los pacientes en quienes se utilizó la BBIA y los del grupo de control. En el ensayo IABP-SHOCK II47 se llevó a cabo un seguimiento de 6 y de 12 meses, en el cual no se observó ningún efecto beneficioso a largo plazo. El empleo de la BBIA no se asoció a aumento significativo alguno de los acontecimientos adversos, incluidos el reinfarto, la trombosis de stent, la hemorragia, la sepsis y el ictus. Otra limitación importante es que la tasa de mortalidad global de los pacientes incluidos en el estudio fue inferior (40 frente a 42-48%) a la observada en otros registros, lo que sugiere que se trataba de casos de shock más leves o de gravedad moderada. Los autores apuntan que el amplio uso (90%) de catecolaminas reflejaba de hecho la gravedad del SC en el estudio. Es cierto, sin embargo, que este uso de catecolaminas podría haber contrarrestado los posibles efectos beneficiosos de la BBIA. Además, la BBIA tendría que haberse utilizado como tratamiento primario en el grupo de BBIA, en vez de como un tratamiento añadido a las catecolaminas. Finalmente, el momento de colocación de la BBIA se dejó a criterio del investigador, y en la inmensa mayoría de los casos se colocó después de la intervención coronaria percutánea. Tras la publicación de los resultados del ensayo, las guías de la European Society of Cardiology de 2012 sobre el infarto de miocardio con elevación del segmento ST redujeron la indicación para el apoyo con BBIA en el SC posterior al infarto de la clase IC a la IIb B. En resumen, no hay evidencia ni recomendaciones que respalden el uso de la BBIA en los pacientes con SC.
Apoyo vital extracorpóreoEl AVEC en la configuración venosa-arterial puede reemplazar por completo la función cardiopulmonar y está indicado en las formas graves de SC y en el paro cardiaco refractario. La sangre se extrae a través del sistema venoso (en general de la vena femoral o la aurícula derecha) y se bombea para hacerla pasar por un oxigenador, donde tiene lugar el intercambio gaseoso de oxígeno y dióxido de carbono; a continuación, se retorna al sistema arterial (en general en la arteria femoral o la aorta ascendente). En los pacientes con insuficiencia renal puede integrarse en el circuito un sistema de hemofiltración. Requiere una vigilancia cuidadosa de la anticoagulación y se ha concebido para un apoyo a corto o medio plazo, que comporta una tasa nada desdeñable de complicaciones (de forma característica, la hemorragia en el lugar de la canulación o la isquemia de miembros inferiores), que aumenta de manera exponencial con la duración del uso del apoyo.
Dada la ventaja teórica de la canulación y del apoyo inmediato casi en cualquier lugar, es adecuado para un contexto de urgencias. Aunque proporciona un apoyo para la circulación como tratamiento de primera línea en los pacientes en paro cardiaco o con SC refractario, la capacidad del AVEC periférico de respaldar la función del ventrículo izquierdo es limitada. En presencia de una reducción grave de la función del ventrículo izquierdo puede producirse una disparidad significativa de la poscarga y, por consiguiente, una descompresión ventricular insuficiente. Además, el flujo sanguíneo continúa retornando a la aurícula izquierda procedente de la circulación bronquial. El aumento de la tensión en la pared afecta la perfusión miocárdica y aumenta el consumo de oxígeno, con lo que se reduce la probabilidad de la recuperación del ventrículo48. Las presiones altas del ventrículo y de la aurícula izquierda pueden inducir un edema pulmonar grave; para evitarlo, algunos centros utilizan una BBIA conjuntamente con el AVEC periférico para reducir la poscarga del ventrículo izquierdo y la congestión pulmonar. A este respecto, un estudio49 evaluó a 253 pacientes que se trataron con AVEC por un SC, un 24% de ellos con empleo simultáneo de BBIA (grupo de BBIA). La tasa de desconexión satisfactoria del AVEC fue significativamente mayor en el grupo de BBIA en comparación con el grupo de control (61,7 frente a 42,0%; p = 0,008). Sin embargo, no hubo diferencias significativas en la mortalidad intrahospitalaria entre los dos grupos (68,6 frente a 72,0%; p = 0,58).
Hay algunos otros métodos para la descarga ventricular en los pacientes tratados con un AVEC periférico (por ejemplo, cánulas auriculares izquierdas transeptales percutáneas o apicales conectadas a la vía venosa mediante un conector en Y) que fomentan la descongestión pulmonar y la recuperación ventricular.
Dispositivos de asistencia ventricularLos DAV son bombas de flujo continuo conectadas a la circulación del paciente que sustituyen la función del corazón izquierdo, el corazón derecho o ambos. Las bombas pueden ser centrífugas o axiales. Los DAV implantados por vía percutánea (intravasculares o extracorpóreos) están destinados a un uso transitorio o a corto plazo, mientras que los implantados quirúrgicamente (intracorpóreos o paracorpóreos, axiales o centrífugos) están destinados a un uso a medio o largo plazo. Así pues, estos últimos no son de primera elección para el ACM en la ICA. Las guías para el ACM recientemente publicadas por la International Society for Heart and Lung Transplantation ofrecen recomendaciones respecto a las opciones de ACM a largo plazo en los pacientes con IC avanzada50.
Existen muchos tipos de DAV, con diferentes lugares y técnicas de implantación. La tecnología del DAV ha tenido enormes avances, que han comportado una mejora de la evolución de los pacientes con IC.
En el contexto de la ICA o en el SC refractario, un dispositivo de tratamiento puente para la decisión debe ser fácil de implantar, proporcionar un apoyo biventricular cuando sea necesario y generar un flujo suficiente. Actualmente se sabe que un DAV izquierdo implantable para un uso a largo plazo, aunque es un tratamiento excelente para la IC crónica, no suele ser una elección apropiada en este contexto. Los DAV implantados de manera percutánea para un uso a corto plazo utilizan en general una cánula interna y una bomba externa; se han desarrollado para esa aplicación y han pasado a ser una opción terapéutica ampliamente aceptada51.
La guía de 2014 de la European Society of Cardiology y la European Association for Cardio-Thoracic Surgery sobre revascularización miocárdica52 recomienda la implantación de un DAV izquierdo en los pacientes de menor edad que no tienen contraindicaciones para un trasplante cardiaco, como tratamiento puente hasta el trasplante, así como en aquellos que no son aptos para el trasplante como tratamiento puente para la recuperación o con el objetivo de que constituya un tratamiento de destino. Sin embargo, no se dispone de evidencias definitivas respecto a su aplicación sistemática. Tres ensayos aleatorizados y un amplio estudio de registro han demostrado un mayor apoyo hemodinámico con el empleo de sistemas de ACM percutáneos en comparación con la BBIA, sin hallar diferencias en la mortalidad, pero con un aumento del riesgo de acontecimientos adversos53–56.
El registro Impella-EUROSHOCK57 constituye hasta la fecha el trabajo más amplio que ha investigado el empleo de apoyo de urgencia con el dispositivo Impella-2.5 para el SC refractario al tratamiento, con un total de 120 pacientes. Todos presentaban un SC después de un infarto de miocardio y recibieron apoyo circulatorio transitorio con el DAV izquierdo percutáneo Impella-2.5. El objetivo primario fue la mortalidad a los 30 días, mientras que los objetivos secundarios fueron los parámetros de eficacia y seguridad del dispositivo. La mortalidad a 30 días fue del 64,2%, debido probablemente al uso del dispositivo en pacientes muy graves. Un 44,5% de los pacientes pudieron ser desconectados con éxito del dispositivo. Después de la implantación del DAV se registró una disminución significativa de los valores del lactato, y la incidencia de complicaciones mayores fue desdeñable.
Contraindicaciones para el uso del apoyo circulatorio mecánicoEn general, en los pacientes con un daño neurológico irreversible, en los que presentan una enfermedad maligna no tratada y en aquellos con una esperanza de vida inferior a 1 año está contraindicado el uso de un ACM. Otras contraindicaciones son específicas para cada dispositivo y dependen básicamente de aspectos técnicos.
TRASPLANTE CARDIACOEl trasplante cardiaco se considera el método de referencia en el tratamiento de la IC refractaria en fase terminal. Desde el primer trasplante de corazón realizado con éxito en 1967, se han producido importantes mejoras en cuanto a la selección de donantes y receptores, las técnicas quirúrgicas y la asistencia posoperatoria. El trasplante proporciona un aumento significativo de la supervivencia, de la capacidad de ejercicio y de la calidad de vida, en comparación con el tratamiento convencional. Sin embargo, el número de posibles donantes de órganos no se ha modificado, a pesar del número creciente de pacientes incluidos en lista de espera. Para superar esta limitación, la United Network for Organ Sharing puso en marcha un sistema de asignación que da prioridad para la recepción de órganos a los pacientes de la lista en estado más grave.
Nos remitimos a las recomendaciones para la selección de los pacientes para el trasplante de corazón avaladas por la mayor parte de las sociedades de este ámbito58. La realización de un trasplante puede contemplarse como opción en la ICA grave que se sabe que tiene una mala evolución clínica. Sin embargo, no es posible realizar el trasplante hasta que se ha estabilizado el estado del paciente. En este contexto, el ACM desempeña un papel esencial, como se ha señalado antes.
REVASCULARIZACIÓN MIOCÁRDICALas recomendaciones para el tratamiento de los pacientes con ICA en el contexto de los síndromes coronarios agudos57 establecen que la revascularización miocárdica urgente (percutánea o quirúrgica) está indicada en aquellos con infarto de miocardio con elevación del segmento ST o con un SC debido a un infarto de miocardio sin elevación del segmento ST (clase de recomendación IB). En la subpoblación de pacientes con un SC aparecido como complicación de un infarto de miocardio, las guías actuales recomiendan una intervención coronaria percutánea multivaso sobre todas las estenosis graves o las lesiones muy inestables, además de sobre la lesión culpable (clase de recomendación IIa B).
La aplicación de una revascularización temprana ha aumentado notablemente en la práctica clínica. Sin embargo, las tasas aún son insatisfactorias y van del 50 al 70% en los registros59.
TRATAMIENTO QUIRÚRGICOLa intervención quirúrgica está indicada para algunas causas de ICA (tabla 3). Las opciones quirúrgicas incluyen la revascularización coronaria, la corrección de las lesiones anatómicas, la sustitución o la reconstrucción valvulares, y el ACM. Suele realizarse una angiografía coronaria porque se cree que la revascularización concomitante puede mejorar el pronóstico.
Causas cardiovasculares de insuficiencia cardiaca aguda que requieren un abordaje quirúrgico
| Shock cardiogénico después de un infarto agudo de miocardio (intervención percutánea no indicada) |
| Comunicación interventricular tras un infarto |
| Rotura de pared ventricular libre |
| Descompensación aguda de una valvulopatía cardiaca preexistente |
| Disfunción de válvula protésica |
| Síndrome aórtico agudo con rotura en el saco pericárdico |
| Insuficiencia mitral aguda (isquémica o no isquémica) |
| Insuficiencia aórtica aguda |
| Rotura de aneurisma del seno de Valsalva |
| Insuficiencia cardiaca aguda que requiere apoyo circulatorio mecánico |
| Fístula arteriovenosa |
| Tromboembolia pulmonar |
El empleo de marcapasos y la cardioversión eléctrica se recomiendan en los pacientes con afectación hemodinámica a causa de una bradicardia grave o una taquidisritmia, respectivamente, con el fin de mejorar el estado clínico (clase de la recomendación IC).
CONCLUSIONESEn resumen, el tratamiento no farmacológico de la ICA se usa de manera creciente para complementar los tratamientos intravenosos. En los pacientes con ICA y sin inestabilidad hemodinámica, la VPPN puede aportar un efecto beneficioso; tiene muy pocas complicaciones y la carga de trabajo de enfermería es mínima. En los pacientes con una gran congestión, aumento reciente del peso corporal y resistencia a los diuréticos, todo ello asociado a un estado de bajo gasto cardiaco pero sin signos de shock, la ultrafiltración podría aportar un importante efecto beneficioso. Aunque el empleo de una BBIA en el SC carece de evidencia que lo sustente, el AVEC y el DAV deben recomendarse lo antes posible para limitar el uso de catecolaminas, que deben administrarse en la dosis más baja posible y durante el menor tiempo posible.
CONFLICTO DE INTERESESNinguno.