En los últimos años las técnicas de imagen han revolucionado el diagnóstico de la insuficiencia cardiaca. Ante un cuadro clínico compatible con descompensación aguda, la instauración precoz de las medidas generales y el tratamiento etiológico determina en gran medida el pronóstico. Dada su rentabilidad diagnóstica y su portabilidad, la exploración con ultrasonidos se ha convertido en una herramienta fundamental en este contexto, y actualmente se encuentra en todos los ámbitos médicos que rodean al paciente crítico. La resonancia magnética cardiaca y la tomografía computarizada permiten caracterizar en detalle múltiples aspectos previamente inasequibles de la anatomía y la función cardiacas. Esto permite guiar y monitorizar la mayor parte de las decisiones terapéuticas en esta población de una forma completamente no invasiva. El presente artículo tiene por objeto revisar la utilidad de las técnicas de imagen clínicamente relevantes en el contexto de un episodio agudo de insuficiencia cardiaca. Se enfatizan con especial detalle sus indicaciones y limitaciones, y se proporcionan las bases para interpretar adecuadamente sus resultados.
Palabras clave
La insuficiencia cardiaca (IC) es una de las principales causas de morbimortalidad en los países occidentales1. Esta alta prevalencia explica que la IC genere la mayor parte de las consultas por disnea en los servicios de urgencias, bien como IC de reciente aparición, bien como descompensación aguda de pacientes con IC crónica2. La gravedad de la descompensación puede ser variable, desde un empeoramiento de la disnea de esfuerzo hasta una situación de edema agudo de pulmón o shock cardiogénico3.
Con el paso de los años, las técnicas de imagen han adquirido un papel fundamental en los pacientes con IC4. Por rentabilidad diagnóstica, ausencia de riesgo, versatilidad y portabilidad, los ultrasonidos son la herramienta de primera línea a la cabecera del paciente con IC aguda. Esta técnica ya está ampliamente validada para la filiación de la enfermedad subyacente, la evaluación hemodinámica, la guía terapéutica y la estratificación pronóstica de estos pacientes5. Además, en los últimos años la miniaturización y el abaratamiento de los equipos de ultrasonidos han generalizado la técnica fuera de la especialidad de cardiología. El examen con ultrasonidos ya se utiliza habitualmente en la evaluación y la clasificación de los pacientes con disnea en los servicios de urgencias o cuidados intensivos6,7.
La ecocardiografía transtorácica es la herramienta fundamental en la evaluación de los cambios funcionales y estructurales causantes o asociados a la IC3. En situaciones determinadas, la ecocardiografía transesofágica, la ecocardiografía tridimensional y las técnicas de deformación miocárdica pueden aportar información adicional tras la estabilización inicial de los pacientes. La tomografía computarizada (TC) desempeña un papel muy valioso en situaciones agudas que cursan con síntomas de disnea y dolor torácico8. La resonancia magnética (RM) cardiaca ofrece información insustituible para filiar la naturaleza y la extensión del daño miocárdico asociado.
En el presente artículo se revisan el valor y las limitaciones de las técnicas de imagen cardiaca en el contexto del paciente con IC aguda. Se analiza con especial énfasis las indicaciones de cada una de las técnicas y se proporcionan unos principios generales para la interpretación adecuada de los resultados (tabla).
Principales aplicaciones y limitaciones de las técnicas de imagen cardiaca en el diagnóstico y manejo de pacientes con insuficiencia cardiaca aguda
| Principales aplicaciones | Limitaciones | |
|---|---|---|
| Radiografía de tórax | Diagnóstico de ICDiagnóstico de enfermedades extracardiacas concurrentes (neumotórax, derrame pleural, consolidación, etc.) | Especificidad bajaCorrelación limitada con parámetros hemodinámicos |
| ETT focused | Valoración global de la función y morfología cardiaca en situaciones agudasValoración cualitativa de:• Derrame pericárdico• Volumen intravascular• Tamaño y función ventricularEcografía pulmonar | Inferioridad técnica de los equiposEntrenamiento específicoSituación de estrésRiesgo de obviar anomalías importantesVentana |
| ETT reglada | Diagnóstico sindrómico (FEVI preservada frente a deprimida)Diagnóstico etiológico (isquemia, valvulopatías, miocardiopatías, etc.)Valoración hemodinámica no invasiva | Entrenamiento específicoVentana |
| ETE | Igual que ETTEndocarditis, trombos intracavitarios, disección aórticaValvulopatías (gravedad y mecanismo)Monitorización de procedimientos terapéuticosPosibilidad de monitorización continua (sondas miniaturizadas) | Entrenamiento adecuadoSondaje esofágico |
| TC | Triple rule out: angiografía coronaria no invasiva, tromboembolia pulmonar, síndrome aórtico agudoDiagnóstico de enfermedades pulmonares y torácicas concurrentes | RadiaciónContraste yodado (hipersensibilidad, nefrotoxicidad) |
| RM | Caracterización del miocardioCuantificación de la gravedad de valvulopatíasAortografía | Inestabilidad hemodinámicaDispositivos, implantes metálicos, etc.DisponibilidadContrastes con gadolinio |
ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; RM: resonancia magnética; TC: tomografía computarizada.
La instauración precoz del tratamiento específico de IC aguda ha demostrado un gran impacto en la estancia9 y la mortalidad hospitalarias10. La anamnesis y la exploración física tienen un rendimiento limitado en el momento de la admisión del paciente agudo por la inespecificidad de los síntomas y la frecuente comorbilidad. Si bien los péptidos natriuréticos facilitan la clasificación de los pacientes11, existe una extensa zona gris en la que se requieren técnicas adicionales. La radiología de tórax convencional es de indicación absoluta para todo paciente con sospecha o diagnóstico de IC de reciente comienzo11. Aunque su sensibilidad es relativamente baja, la radiografía de tórax proporciona signos muy específicos de IC (redistribución vascular, líneas septales, edema alveolar, etc.) y permite descartar alternativas diagnósticas extracardiacas.
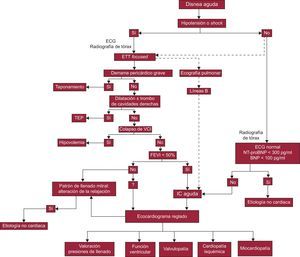
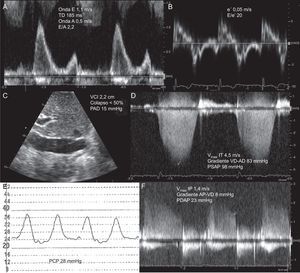
Ante la sospecha de IC aguda, se recomienda realizar un ecocardiograma transtorácico, que debe hacerse inmediatamente si hay inestabilidad hemodinámica (figura 1)3,11–13. Hay tendencia creciente a que el médico que proporciona la atención inicial al paciente con disnea sea quien practique la primera exploración ultrasónica14. Los objetivos y procedimientos de esta exploración ecográfica general (focused o point-of-care ultrasound) han quedado bien establecidos en documentos específicos, y esa exploración no sustituye al examen ecocardiográfico reglado interpretado por cardiólogos especialistas (comprehensive ecocardiography)7,13. Los objetivos de esta exploración ultrasónica inicial son descartar derrame pericárdico, valorar la función biventricular y estimar la volemia mediante la visualización de la vena cava inferior (VCI) (figura 1)5. Así, la identificación cualitativa de disfunción sistólica ventricular izquierda y de una VCI no colapsable ha mostrado elevada especificidad para el diagnóstico de IC aguda15. Para los pacientes con sospecha de IC aguda sin inestabilidad hemodinámica, se considera que la determinación de péptidos natriuréticos es una estrategia alternativa a la ecocardiografía inmediata3, pero la estrategia basada en una exploración ecocardiográfica precoz se ha demostrado más rápida y más específica16.
Algoritmo diagnóstico de insuficiencia cardiaca aguda. BNP: péptido natriurético cerebral; ECG: electrocardiograma; ETT: ecocardiografía transtorácica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; TEP: tromboembolia pulmonar; VCI: vena cava inferior.
Además, cualquier equipo de ultrasonidos convencional permite realizar una exploración pulmonar. Esta exploración aporta información etiológica muy útil en la insuficiencia respiratoria aguda. La presencia de edema pulmonar, neumotórax o derrame pleural se puede identificar con gran sensibilidad y especificidad mediante esta técnica5. La imagen ecográfica de edema pulmonar intersticial (líneas B) consiste en estructuras hiperecoicas lineales bilaterales que nacen en la pleura en forma de «cola de cometa» y son producto del engrosamiento de los septos interlobulillares y de la ocupación alveolar. Este patrón ecográfico se correlaciona con los valores de presión capilar pulmonar y el volumen extravascular pulmonar17.
Tras esta exploración inicial, a todo paciente con diagnóstico de IC aguda se le debe realizar un ecocardiograma reglado. Esto permite establecer el diagnóstico definitivo, caracterizar lesiones asociadas, evaluar la situación hemodinámica y obtener información relevante para determinar el pronóstico. Estará indicado repetir exploraciones ante cualquier cambio en la situación clínica o tras maniobras terapéuticas que puedan tener impacto en la función cardiaca11.
En muchas ocasiones, la disnea y el dolor torácico concurren sin datos electrocardiográficos específicos de isquemia miocárdica. Tanto un evento coronario agudo como una embolia de pulmón o un síndrome aórtico agudo pueden presentarse de esta forma, y en todos los casos el diagnóstico precoz es de vital importancia. Actualmente la TC multidetector permite no solo una angiografía coronaria de alta calidad, sino también aortografía y angiografía pulmonar, de manera que en una sola exploración radiológica se puede descartar afecciones en esas áreas (triple rule out)18.
VALORACIÓN DE LA FUNCIÓN SISTÓLICA DEL VENTRÍCULO IZQUIERDOEl índice de función sistólica del ventrículo izquierdo (VI) más establecido en la práctica clínica es la fracción de eyección (FE). En función de la FE, se debe subdividir a los pacientes con IC en dos grupos sindrómicos: aquellos con disfunción del VI sistólica (FE < 50%) y aquellos con función del VI normal o «preservada» (FE ≥ 50%)11,19.
Están disponibles múltiples métodos para el cálculo de la FE mediante ecocardiografía. La exactitud de la estimación visual por cardiólogos experimentados en ecocardiografía es excelente20, y también es buena con otro personal sanitario debidamente formado13,21. No obstante, se recomienda medirla mediante el método volumétrico de Simpson biplano siempre que sea posible22. La ecocardiografía tridimensional proporciona medidas de volumen sin presunciones geométricas, pero su adquisición y posprocesado dependen en gran medida de la calidad de la imagen. Esto limita su utilización sistemática en situaciones agudas. La ecocardiografía con contraste mejora la visualización del borde endocárdico y permite evaluar de manera más fiable la FE y detectar anomalías en la contracción segmentaria; su seguridad y su coste-efectividad en pacientes críticos ya está bien establecida23. Para pacientes con ausencia de ventana ultrasónica transtorácica (ventilación mecánica, perioperatorio de cirugía cardiaca, etc.), el estudio transesofágico es la alternativa óptima. También lo es ante la sospecha clínica de enfermedad aórtica, disfunción protésica, endocarditis o trombos auriculares, para los que la sensibilidad de la ecocardiografía transesofágica es superior a la transtorácica5,24. La RM y la TC proporcionan información precisa de la morfología y la función cardiacas y son las técnicas de referencia en la estimación de la FE11. Sin embargo, la medición de la FE no es una indicación clínica habitual para la realización de estas exploraciones en el contexto agudo (véase más adelante).
Independientemente de la técnica utilizada, la FE tiene limitaciones inherentes como medida de la función sistólica del VI que son especialmente importantes en la IC aguda. Su sensibilidad a las condiciones de carga (volemia, poscarga, frecuencia cardiaca, valvulopatías, etc.) obliga a interpretar la FE como un valor instantáneo obtenido en una situación hemodinámica determinada. Esto ha llevado a los investigadores a implementar nuevos métodos para una cuantificación más robusta de la función sistólica del VI que sean menos sensibles a las condiciones instantáneas de carga.
La ecocardiografía de deformación miocárdica permite cuantificar la función miocárdica tanto regional como global. En la actualidad estas medidas se obtienen fundamentalmente a partir del posprocesado de imágenes ecocardiográficas bidimensionales mediante seguimiento de los elementos reflectantes de la pared del miocardio (speckle-traking). El índice de deformación más implementado en la ecocardiografía clínica es el strain lagrangiano, que se define como el cambio de longitud del miocardio en determinada dirección (longitudinal, radial o circunferencial) respecto a su longitud basal. De entre estos, el strain longitudinal obtenido en los planos apicales es el índice más utilizado en la práctica clínica22,25. El strain-rate hace referencia a la tasa de cambio del strain por unidad de tiempo, y es menos sensible a la poscarga que el strain26.
Varios estudios han demostrado el valor de estas técnicas de deformación para detectar disfunción miocárdica subclínica. En pacientes con IC aguda y FE normal, se han demostrado valores anormales de deformación radial y longitudinal en presencia de función circunferencial preservada27. Estos hallazgos podrían indicar cierto grado de disfunción sistólica pese a que los valores de la FE se encuentren en límites normales28, pero también podrían estar en relación con las diferentes dependencias de las condiciones de carga de los tres componentes espaciales del strain29. Por otra parte, se ha descrito que los parámetros de deformación pueden aportar más información pronóstica que la FE en pacientes con IC aguda30.
Otra aproximación a la caracterización de la función sistólica de la cámara se puede obtener mediante el estudio de la dinámica de fluidos de la sangre en el interior del VI31. Se conoce desde hace tiempo que la capacidad de aceleración de la sangre durante la eyección se correlaciona con la elastancia máxima al final de la sístole, parámetro de referencia de la función sistólica del VI32. Sobre esta base, nuestro grupo ha implementado y validado un método basado en el posprocesado de imágenes Doppler color en modo M. La medida del gradiente pico intraventricular sistólico obtenido con este método es una metodología fácilmente aplicable a la práctica clínica33 y proporciona información precisa de la función del VI29,34,35.
Todos estos métodos tienen como objeto medir la función contráctil del VI. Por ello, en el contexto de una situación hemodinámica inestable, los resultados de la medición de la función sistólica deben interpretarse siempre en relación con la terapia de soporte aplicada. Actuaciones como la estimulación inotrópica, la ventilación mecánica, la isquemia o la revascularización miocárdica tienen siempre un efecto inmediato en cualquiera de estos índices11.
DIAGNÓSTICO ETIOLÓGICOCardiopatía isquémicaLa enfermedad arterial coronaria aterosclerótica puede producir IC aguda como complicación de un síndrome coronario agudo (SCA) (un 10-20% de los casos) o por descompensación de una miocardiopatía isquémica crónica establecida36. Aun en ausencia de dolor torácico, la isquemia miocárdica es el factor precipitante en una cuarta parte de los casos de descompensación aguda de IC y a menudo está infradiagnosticada36. La detección de enfermedad coronaria determina el manejo terapéutico de los pacientes que se presentan con IC aguda.
En la tercera definición universal de infarto de miocardio, la imagen cardiaca se incorporó formalmente a los criterios diagnósticos de un infarto agudo de miocardio. Así, el hallazgo de alteraciones de novo de la contracción segmentaria en el contexto de elevación de marcadores de daño miocárdico define un infarto agudo de miocardio37.
En pacientes que se presentan con IC y disfunción sistólica del VI, es imperativo descartar posible enfermedad coronaria asociada11,38. En pacientes con función sistólica normal, el estudio de la anatomía coronaria se puede supeditar a la clínica de angina o a una prueba de detección de isquemia positiva. En la IC aguda, si no se trata de un SCA y la sospecha de enfermedad coronaria es intermedia, la coronariografía mediante TC es la técnica de elección para estudio del árbol coronario. Esto se aplica tanto a pacientes con disfunción sistólica39 como a aquellos con FE normal40. La RM cardiaca con gadolinio permite identificar la viabilidad miocárdica41 y predecir la evolución clínica tras la revascularización en función de la proporción de miocardio viable (hibernado o aturdido)42. Recientemente se ha demostrado que esta caracterización del miocardio también puede hacerse mediante TC43.
Las técnicas de imagen tienen un papel determinante en la IC aguda grave o el shock cardiogénico en contexto de un SCA. La afección isquémica del ventrículo derecho (VD) aislada es rara y se asocia generalmente a un infarto inferior. La ecocardiografía muestra un VD dilatado y disfuncionante, un movimiento anómalo del septo y, en ocasiones, una insuficiencia funcional tricuspídea, todo ello en ausencia de presiones pulmonares elevadas. La disminución de la precarga que ocasiona el infarto de VD puede enmascarar una disfunción grave del VI. Se debe tener en consideración estos aspectos siempre que se valoran las opciones de asistencia ventricular5.
Las complicaciones mecánicas son otra causa frecuente de IC aguda en el SCA. Aunque la rotura de la pared libre del VI suele causar un cuadro catastrófico, ocasionalmente puede presentarse como derrame pericárdico subagudo y evolucionar a la formación de un seudoaneurisma. Las técnicas de TC o RM pueden ser útiles para el diagnóstico diferencial de la rotura subaguda tras un infarto agudo de miocardio44. La comunicación interventricular tras el infarto requiere intervención quirúrgica emergente y se suele diagnosticar mediante ecocardiografía. Las características del tejido circundante a la comunicación interventricular se pueden evaluar por RM si la situación clínica del paciente lo permite. La insuficiencia mitral aguda en el SCA es habitualmente secundaria a la disfunción ventricular y la alteración de la geometría del aparato subvalvular, con desplazamiento apical del área de coaptación mitral y disminución las fuerzas de cierre. Excepcionalmente, la insuficiencia mitral puede deberse a la rotura del músculo papilar posterior; en ese caso la ecocardiografía muestra una estructura móvil triangular acoplada al velo que prolapsa y se introduce en la aurícula izquierda en sístole. Esta complicación mecánica suele caracterizarse en detalle mediante ecocardiografía transesofágica, a ser posible durante el acto quirúrgico.
Miocardiopatía por estrés y miocarditisEn ocasiones el paciente que se presenta con IC aguda sufre alteraciones regionales de la motilidad segmentaria que no son causadas por enfermedad coronaria epicárdica. La miocardiopatía por estrés se caracteriza por una disfunción transitoria del VI secundaria a una descarga catecolaminérgica, generalmente relacionada con un estrés identificable. El patrón ecocardiográfico típico es la acinesia o discinesia de los segmentos medios y apicales de todas las caras, hipercontractilidad de los segmentos basales y disfunción ventricular en grado variable. Aunque haya signos ecocardiográficos que indican miocardiopatía por estrés (anomalías de la contracción segmentaria que afectan a más de un territorio coronario), la coronariografía invasiva urgente es obligada para descartar un SCA45.
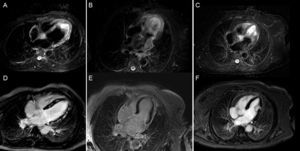
Una cuarta parte de los pacientes con miocardiopatía por estrés sufren clínica de IC y hasta un 7%, shock cardiogénico46,47. Tras el diagnóstico, el ecocardiograma permite identificar a los pacientes con mayor riesgo de complicaciones cardiacas. Además del grado de disfunción ventricular, la presencia de presiones de llenado elevadas o insuficiencia mitral se relaciona de forma independiente con la tasa de eventos cardiovasculares. Otros factores que determinan la gravedad del cuadro son la obstrucción del tracto de salida del VI, el número de segmentos afectados, la presión sistólica pulmonar y el grado de afección del VD46. En ocasiones el diagnóstico inicial puede ser indistinguible de un evento embólico o una miocarditis48. La RM cardiaca permite el diagnóstico diferencial en fase subaguda. Las secuencias potenciadas en T2 muestran un edema difuso de distribución transmural, coincidente con los segmentos miocárdicos disfuncionantes, que no sigue una distribución vascular y generalmente desaparece a las 2 semanas de iniciarse los síntomas. El estudio de realce tardío con gadolinio es característicamente negativo (figura 2).
Utilidad de la resonancia magnética cardiaca en el diagnóstico diferencial de pacientes con insuficiencia cardiaca aguda, elevación de marcadores de daño miocárdico y coronarias sin lesiones. Imágenes correspondientes a secuencias T2-STIR (arriba) y de realce tardío tras la administración de gadolinio (abajo) en 3 pacientes. A y D: estudio compatible con miocarditis aguda con marcada hiperintensidad (edema) en septo y cara lateral (A) y extenso realce tardío mesocárdico parcheado (D). B y E: estudio compatible con miocardiopatía por estrés con edema que afecta a los dos tercios distales de todas las caras (B) sin evidencia de realce tardío (E). C y F: estudio compatible con infarto embólico en contexto de emergencia hipertensiva con edema localizado en el tercio medio de la cara lateral (C) y realce transmural focal en la misma localización (F).
En raras ocasiones, la miocarditis aguda origina un cuadro devastador de IC aguda y shock cardiogénico. Se estima que las miocarditis justifican el 10% de los cuadros de IC aguda inexplicada49. Clínico-patológicamente se distinguen dos cuadros: la miocarditis fulminante y la miocarditis aguda50. La miocarditis fulminante se caracteriza por pródromos virales claros, un infiltrado linfocitario inflamatorio grave y un deterioro grave de la función ventricular. Habitualmente evoluciona a la recuperación completa, por lo que, si la situación hemodinámica lo exige, son imprescindibles las medidas de soporte. La miocarditis de células gigantes es una entidad extremadamente infrecuente, de etiología autoinmunitaria, de muy mal pronóstico e indistinguible de la instauración de una miocarditis viral fulminante51. La miocarditis aguda aparece de manera más tórpida, frecuentemente sin pródromos claros; es característico que el miocardio presente una infiltración parcheada y evolucione más frecuentemente a miocardiopatía dilatada52.
Los hallazgos ecocardiográficos, aunque inespecíficos, pueden indicar uno de los dos patrones clínicos. Un VI no dilatado, disfuncionante y con aumento de los espesores parietales indica miocarditis fulminante; un VI dilatado con espesores parietales normales apunta al diagnóstico de miocarditis aguda52,53. En ambos casos puede haber anomalías de la contracción segmentaria y distintos grados de disfunción diastólica. También, en ambos casos, no es infrecuente encontrar cierto grado de derrame pericárdico y/o trombos intraventriculares. La disfunción ventricular derecha es infrecuente, pero su aparición es un importante predictor de mortalidad y/o necesidad de trasplante cardiaco. La monitorización de parámetros de formación miocárdica podría ser útil para identificar a los pacientes más susceptibles de evolucionar a miocardiopatía dilatada54.
Por su capacidad para detectar inflamación miocárdica, la RM es la técnica de elección para el diagnóstico diferencial de miocarditis55 (figura 2). Actualmente está indicada en pacientes sintomáticos con evidencia de daño miocárdico agudo y sospecha de etiología viral56. Los criterios de RM de miocarditis son el aumento de la señal miocárdica en las secuencias potenciadas en T2 (edema), el realce precoz tras la administración de gadolinio (hiperemia y aumento de la permeabilidad capilar) y/o la presencia de realce tardío (necrosis-fibrosis). Dos positivos de estos tres criterios tienen una exactitud diagnóstica del 79%55.
MiocardiopatíasLa IC aguda puede ser la forma de presentación de la miocardiopatía dilatada alcohólica/tóxica, la cardiopatía chagásica o las miocardiopatías primarias. Se puede realizar una primera orientación etiológica en función de la edad, los factores de riesgo cardiovascular, los antecedentes de ingesta de tóxicos o el área geográfica de procedencia del paciente.
No es habitual que la miocardiopatía hipertrófica se presente como un cuadro de IC aguda. Cuando ocurre, puede precipitarse por taquiarritmias, insuficiencia mitral aguda (rotura de cuerda o endocarditis), isquemia miocárdica o comorbilidad (anemia, hipertiroidismo, etc.)57. La ecocardiografía en este contexto es fundamental para valorar si hay obstrucción intraventricular, localizar y monitorizar la gravedad de la obstrucción y valorar el grado de insuficiencia mitral y su mecanismo. Ante un VI hipertrófico con FE dentro de la normalidad, ecogenicidad parietal anómala, patrón de llenado restrictivo y disminución franca del acortamiento longitudinal, se debe sospechar una miocardiopatía infiltrativa, generalmente secundaria a amiloidosis5,58. Para los pacientes con miocardiopatías primarias de probable origen genético o sospecha de enfermedades de depósito, la RM es una técnica fundamental y debe incluirse siempre en el algoritmo diagnóstico.
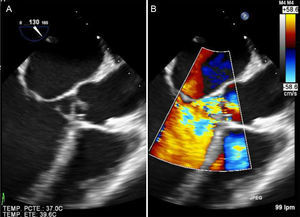
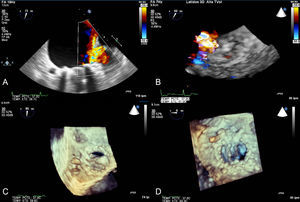
ValvulopatíasLa IC aguda grave de causa valvular suele ser secundaria a valvulopatías izquierdas graves o disfunción protésica5. La pérdida de la anatomía normal del aparato valvular mitral, generalmente secundaria a endocarditis, puede ser catastrófica. Aunque la ecocardiografía transtorácica puede ser diagnóstica, un estudio transesofágico es obligado tras la estabilización inicial del paciente (figura 3).
A: ecocardiografía transesofágica bidimensional. B: Doppler-color en plano medioesofágico a 130°. Se muestra una insuficiencia aórtica masiva secundaria a la eversión y rotura de la cúspide aórtica no coronaria en paciente con insuficiencia cardiaca aguda grave. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La IC aguda en un paciente con estenosis mitral reumática suele precipitarse por su entrada en fibrilación auricular o por un aumento del volumen circulante (p. ej., con el embarazo). La IC aguda en pacientes portadores de prótesis mitral exige descartar siempre disfunción protésica; las causas más temidas son la trombosis protésica y la endocarditis. El ecocardiograma transesofágico habitualmente confirma el diagnóstico, pero puede ser útil estudiar la mecánica protésica mediante fluoroscopia o TC. La insuficiencia aórtica puede dar lugar a un cuadro grave de IC, generalmente si su aparición es brusca. En este caso, es necesario descartar disección aórtica (TC) y endocarditis (ecocardiografía transesofágica)5,59,60 (figura 3).
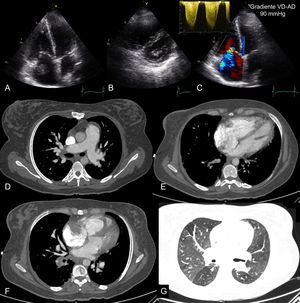
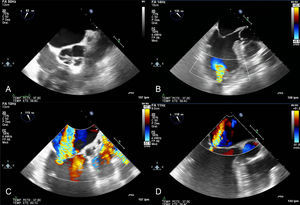
Insuficiencia cardiaca aguda derechaLa tromboembolia pulmonar puede no producir dolor torácico y dar signos aislados de IC derecha aguda y grave (disnea, bajo gasto y signos de elevación de la presión venosa central). La angiografía pulmonar con TC es actualmente el método de elección para visualizar el árbol vascular pulmonar y descartar tromboembolia pulmonar. Sin embargo, ante un paciente con disnea e inestabilidad hemodinámica súbita, la ecocardiografía transtorácica emergente ofrece gran rendimiento. En este contexto, la sobrecarga aguda de presión del VD condiciona gran dilatación y disfunción del VD, habitualmente fácil de identificar. Por el contrario, un VD normal prácticamente descarta una tromboembolia pulmonar masiva. Esta exploración ultrasónica es especialmente relevante porque, en presencia de shock, la sobrecarga de presión del VD justifica la instauración de terapia de reperfusión, aun sin estudio radiológico61. Aunque es muy poco frecuente, la visualización directa de trombo en cavidades derechas establece el diagnóstico de tromboembolia pulmonar e implica una elevada mortalidad precoz62 (figura 4).
Ecocardiografía y tomografía computarizada en paciente con tromboembolia pulmonar aguda y enfermedad tromboembólica crónica. Imágenes de ecocardiografía transtorácica en planos apicales (A y C) y eje corto paraesternal (B) que muestran grave dilatación de cavidades derechas e imagen de trombo en aurícula derecha. El espectro de Doppler continuo de regurgitación tricuspídea es compatible con hipertensión pulmonar grave (C). D: angiografía pulmonar que muestra defectos de repleción en ramas pulmonares segmentarias compatibles con tromboembolia pulmonar aguda y dilatación del tronco arterial pulmonar como signo de hipertensión pulmonar precapilar. E: plano axial de cuatro cámaras que muestra la grave dilatación del ventrículo derecho, con una relación ventrículo derecho/ventrículo izquierdo > 1. F: imagen compatible con trombo en aurícula derecha. G: patrón de atenuación del parénquima pulmonar en mosaico como signo de hipertensión pulmonar precapilar. AD: aurícula derecha; VD: ventrículo derecho. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En pacientes con tromboembolia pulmonar sin inestabilidad hemodinámica, la dilatación y la disfunción del VD tienen valor pronóstico63. Mediante ecocardiografía también se puede detectar un cortocircuito derecha-izquierda a través de un foramen oval permeable61. Además, la ecocardiografía permite detectar signos de sobrecarga crónica del VD, como la hipertrofia ventricular derecha, o signos indirectos de hipertensión pulmonar tromboembólica crónica (figura 4).
MONITORIZACIÓN NO INVASIVAEstimación de la situación hemodinámicaEn el paciente con IC aguda, frecuentemente se utilizan técnicas de monitorización hemodinámica hasta lograr la estabilización clínica. Sin embargo, no se ha demostrado que la monitorización invasiva en los pacientes con IC aguda mediante catéteres de Swan-Ganz tenga impacto en la supervivencia64. Por ello, la ecocardiografía Doppler convencional se ha propuesto como una herramienta no invasiva y asequible para caracterizar la situación hemodinámica de estos pacientes65,66. Las sondas de ecocardiografía transesofágica monoplanares desechables permiten una monitorización cualitativa basada en imagen y sus resultados preliminares son prometedores67,68.
Los parámetros hemodinámicos que se suele monitorizar mediante técnicas combinadas de ecocardiografía Doppler son la presión auricular derecha (PAD), las funciones sistólica y diastólica del VI, sus presiones de llenado, el volumen latido y las presiones pulmonares. De estas medidas básicas derivan índices como el gasto cardiaco, las resistencias vasculares, etc.
Presión auricular derechaLa medición del diámetro y el índice de colapsabilidad de la VCI permiten una estimación directa y rápida de la PAD69,70. Un incremento de la PAD dilata la VCI de forma que un diámetro > 2 cm se correlaciona con una PAD > 10mmHg71. Durante los movimientos respiratorios, la trasmisión de la presión torácica durante la inspiración causa el colapso parcial de la VCI entre el 35 y el 50%; ante un esfuerzo inspiratorio mayor y breve (sniff), el colapso asciende supera el 50%. En función del diámetro y el grado de colapso de la VCI, algunos autores establecen valores específicos de PAD70. En pacientes conectados a ventilación mecánica, la valoración del tamaño y la colapsabilidad de la VCI no es posible, pero una VCI colapsada indica hipovolemia. Para este grupo de pacientes puede ser útil determinar el patrón de flujo en las venas hepáticas utilizando Doppler pulsado. En condiciones normales, el flujo sistólico de llenado predomina sobre el llenado diastólico, pero cuando la PAD está elevada, la preponderancia de la onda sistólica se pierde (S < D)72.
Función diastólica y estimación de presiones de llenadoLa disfunción diastólica es el principal mecanismo de elevación de la presión capilar pulmonar en pacientes con IC y FE normal. Son varios los mecanismos que pueden dar lugar a la disfunción diastólica en estos pacientes. Así, el gradiente auriculoventricular encargado del llenado se puede alterar como consecuencia de: a) relajación enlentecida; b) pérdida de la succión generada por el retroceso elástico; c) aumento de la rigidez del miocardio, y/o d) aumento de los volúmenes ventriculares operativos por un manejo inadecuado de la volemia. Estos mismos mecanismos también causan la elevación de la presión auricular izquierda en los pacientes con disfunción sistólica.
Caracterizar con exactitud la contribución de cada uno de estos cuatro mecanismos a la disfunción diastólica de un paciente determinado solo es posible mediante el análisis de las curvas de presión-volumen obtenidas con catéteres de alta fidelidad e intervención sobre la precarga73,74. La complejidad de esta técnica en la práctica clínica ha llevado a los investigadores a buscar aproximaciones no invasivas basadas en imagen. De entre ellas, el Doppler pulsado transmitral combinado con el Doppler pulsado tisular del anillo mitral proporciona información muy útil para la toma de decisiones clínicas para pacientes con IC65. Habitualmente se combinan varios parámetros ecocardiográficos para estimar la función diastólica y las presiones de llenado del VI.
La velocidad del llenado rápido mitral (onda E) depende fundamentalmente de la presión auricular izquierda y el grado de despresurización del VI (relajación y retroceso elástico). El tiempo de deceleración del llenado rápido está condicionado por la rigidez operativa ventricular. La velocidad del llenado tardío (onda A) está condicionada por la función contráctil auricular y la rigidez ventricular. Además, la velocidad diastólica precoz del anillo mitral (e’) es especialmente útil. Aunque es un parámetro muy dependiente del gradiente de presión auriculoventricular, la alteración de la relajación retrasa y disminuye el movimiento longitudinal del anillo. Sobre esta base se ha propuesto la relación E/e’ como indicador de elevación presiones de llenado izquierdas.
En presencia de disfunción sistólica del VI, un llenado restrictivo (una relación E/A > 2 con un tiempo de deceleración < 150 ms) indica una presión auricular izquierda elevada. Por el contrario, un patrón de llenado de alteración de la relajación (E/A < 1, E < 50cm/s) indica presiones de llenado izquierdas normales. En pacientes con IC conocida, una relación E/A < 1 se considera un buen marcador de que el tratamiento está adecuadamente optimizado. En este sentido, los cambios en el patrón transmitral obtenidos con diversas intervenciones se han propuesto como posibles marcadores pronósticos en pacientes con IC aguda. Así, un patrón restrictivo reversible tras la infusión de nitroprusiato identifica a un grupo de pacientes con una tasa de eventos más baja y con mejor respuesta y tolerancia a los bloqueadores beta75.
Para el grupo de pacientes cuya relación E/A se encuentre entre 1 y 2, se recomienda utilizar otros parámetros Doppler76. El parámetro más utilizado es la relación E/e’, puesto que el estudio del flujo de las venas pulmonares tiene poco valor en el contexto agudo. En pacientes con disfunción sistólica e IC aguda, una relación E/e’ > 15 predice una presión capilar pulmonar > 15mmHg65. El valor predictivo es peor en pacientes con IC avanzada, ventrículos remodelados, insuficiencia mitral significativa o asincronía o portadores de dispositivos de resincronización77. No obstante, el índice E/e’ está validado como método fiable de monitorización de la presión capilar pulmonar durante las intervenciones terapéuticas65.
En pacientes con función sistólica normal, la correlación de los parámetros de llenado transmitral con los parámetros hemodinámicos es pobre. Por ello, el diagnóstico de IC con FE normal habitualmente exige demostrar una relación E/e’ ≥ 15 (figura 5). Si el valor de la E/e’ oscila entre 8 y 15, otros parámetros deben apoyar el diagnóstico de elevación de la presión auricular izquierda76.
Estimación de presiones de llenado izquierdas mediante ecocardiografía Doppler en un paciente con disnea y función ventricular izquierda normal. A: Doppler-pulsado de llenado mitral que muestra un patrón de llenado restrictivo. B: Doppler tisular del anillo mitral lateral que permite estimar una relación E/e’ > 15. C: plano subcostal de la vena cava inferior. D: Doppler continuo de regurgitación tricuspídea y estimación de la presión sistólica pulmonar. E: señal de presión capilar pulmonar obtenida con catéter de Swan-Ganz. F y G: Doppler de regurgitación pulmonar y estimación de la presión diastólica pulmonar. AD: aurícula derecha; AP: arteria pulmonar; IP: insuficiencia pulmonar; IT: insuficiencia tricuspídea; PAD: presión auricular derecha; PCP: presión capilar pulmonar; PDAP: presión diastólica en arteria pulmonar; PSAP: presión sistólica en arteria pulmonar; TD: tiempo de deceleración de llenado precoz mitral; VCI: vena cava inferior; VD: ventrículo derecho: Vmáx: velocidad máxima. Onda A: velocidad de llenado auricular mitral. Onda E: velocidad máxima del llenado precoz mitral. Onda e’: velocidad protodiastólica del anillo mitral lateral.
En pacientes sometidos a ventilación mecánica, el patrón de llenado mitral y la valoración de la relación E/e’ pueden ayudar al diagnóstico diferencial entre IC y síndrome de distrés respiratorio y predecir el éxito de las maniobras de retirada de las medidas de soporte ventilatorio78,79.
Con base en esta evidencia, las sociedades europea y americana de ecocardiografía han establecido un algoritmo completo para la estimación de las presiones de llenado izquierdas76. Aunque este algoritmo se ha validado aceptablemente en pacientes con IC aguda, se sigue explorando alternativas más exactas65. El strain protodiastólico global parece que aporta estimaciones de la presión auricular izquierda más exactas que la e’80. De la misma forma, la diferencia de presión inversa entre el ápex y el tracto de salida del VI puede aumentar la precisión de la estimación de las presiones de llenado81. No obstante, el valor de estos índices alternativos en el contexto agudo está por demostrar.
Cálculo del volumen latido, gasto cardiaco y resistencias sistémicasEl método más fiable para estimar el volumen latido del VI mediante ultrasonidos se basa en las medidas de la integral de velocidad-tiempo a nivel del tracto de salida del VI y el área de sección en ese mismo punto. Esta metodología es factible en el contexto de IC aguda y presenta una buena correlación con las determinaciones invasivas. A partir del gasto cardiaco, la estimación de la PAD y la presión arterial media obtenida por esfigmomanometría es posible calcular las resistencias vasculares sistémicas65.
Presiones en arteria pulmonarLos espectrogramas de Doppler continuo de las regurgitaciones tricuspídea y pulmonar permiten aproximar las presiones sistólica y diastólica pulmonares respectivamente. En ausencia de afección pulmonar y/o hepática, la elevación de la presión sistólica pulmonar traduce elevación de la presión auricular izquierda82. En los casos en que sea posible obtenerla, la presión diastólica pulmonar se puede utilizar como parámetro sustituto de la presión capilar pulmonar83 (figura 5).
Diagnóstico de complicaciones tras procedimientos invasivosTras una intervención quirúrgica, la aparición de IC aguda o inestabilidad hemodinámica exige realizar una exploración urgente. Generalmente la técnica de elección es la ecocardiografía transesofágica dirigida a valorar la función biventricular y descartar derrame pericárdico.
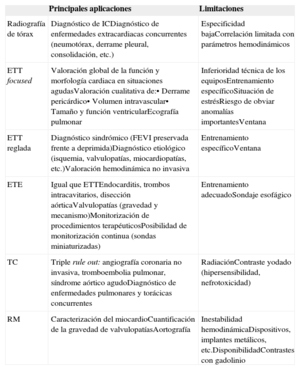
Tras un procedimiento percutáneo la complicación más frecuente es el taponamiento cardiaco, que se diagnostica fácilmente con ecocardiografía transtorácica. Sin embargo, tras procedimientos estructurales, un cuadro de inestabilidad hemodinámica exige valorar la normoposición de dispositivos implantados (figura 6)84. La migración de una prótesis aórtica transcatéter o de dispositivos de cierre de comunicaciones interauriculares, cierre de orejuela o plicatura mitral puede condicionar una obstrucción grave de la válvula mitral o del tracto de salida del VI o, en el caso de las prótesis aórticas transcatéter, una insuficiencia aórtica masiva85.
Paciente portador de prótesis mecánica mitral que ingresó por insuficiencia cardiaca aguda y aumento del gradiente transprotésico mitral. El estudio transesofágico muestra una insuficiencia mitral paravalvular grave a nivel anteroseptal. A: imagen bidimensional de Doppler-color en plano medioesofágico. B: imagen de ecocardiografía Doppler-color tridimensional en tiempo real; Se realiza cierre percutáneo con monitorización mediante ecocardiografía tridimensional transesofágica en tiempo real. Se muestra la vaina atravesando la dehiscencia paravalvular (C) y el momento en que el dispositivo está a punto de ser liberado (D). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Las terapias de circulación extracorpórea o asistencia ventricular son utilizadas cada vez con mayor frecuencia en pacientes críticos, bien como puente a la recuperación o al trasplante, bien como terapia de destino. En este contexto, la ecocardiografía se ha convertido en una herramienta fundamental para seleccionar a los pacientes candidatos, elegir el tipo de soporte requerido, optimizarlo y valorar su retirada o «destete»5,86.
En los pacientes candidatos a dispositivos de asistencia ventricular, el estado de la función del VD determina la necesidad de implantar un dispositivo univentricular o biventricular87. Una vez implantados, se debe utilizar la ecocardiografía, generalmente transesofágica, para optimizar los parámetros del dispositivo y asegurar una posición septal centrada, la apertura intermitente de la válvula aórtica y una insuficiencia mitral ligera que asegure una adecuada descarga del VI (figura 7). La determinación dinámica de las dimensiones del VI y la función valvular mediante ecocardiografía durante protocolos en rampa permite la detección de complicaciones trombóticas88.
Estudio transesofágico en paciente portador de dispositivo de asistencia biventricular Berlin Heart Excor® con cerclaje de la válvula aórtica. A: eje corto de la valvula aórtica. B: cánula posicionada en el apéx del ventrículo izquierdo sin evidencia de trombosis adyacente. C: Doppler-color a nivel de la válvula mitral que muestra insuficiencia mitral grave (IV/IV) funcional por dilatación del anillo. Tras el ajuste de los parámetros del dispositivo, la insuficiencia mitral se corrigió parcialmente (D). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Al igual que en otros escenarios de la cardiología moderna, las técnicas de imagen son indispensables para la toma de decisiones clínicas para los pacientes con IC aguda. Solo mediante el conocimiento de las indicaciones, el valor y las limitaciones de las técnicas de imagen en este contexto, es posible realizar una adecuada caracterización etiológica del cuadro, aproximarse a su gravedad, guiar su tratamiento y establecer el pronóstico de los pacientes con IC aguda.
FINANCIACIÓNEste trabajo ha sido financiado por la Red de Investigación Cardiovascular (RD12/0042), PI12/02885 y CM12/00273 del Instituto de Salud Carlos III, Madrid, España y por la Fundación de Investigación Biomédica Gregorio Marañón.