En la población general, los eventos cardiacos ocurren más frecuentemente durante las primeras horas de la mañana, los lunes y durante el invierno. Sin embargo, la cronobiología de la muerte en la insuficiencia cardiaca no se ha analizado. El objetivo de este estudio es determinar la variabilidad circadiana, de día de la semana y estacional de la mortalidad por cualquier causa en la insuficiencia cardiaca crónica.
MétodosSe analizó a todos los pacientes consecutivos seguidos en una unidad de insuficiencia cardiaca desde enero de 2003 a diciembre de 2008. El momento circadiano de la muerte se analizó en intervalos de 6 h y se determinó revisando los informes médicos y mediante información aportada por los familiares del paciente.
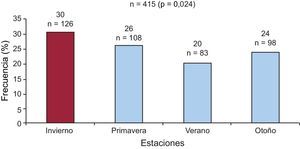
ResultadosDe los 1.196 pacientes (media de edad, 69±13 años; el 62% varones), 418 (34,9%) murieron durante un seguimiento medio de 29±21 meses. Los supervivientes eran más jóvenes, tenían mayores índice de masa corporal, fracción de eyección del ventrículo izquierdo, tasa de filtrado glomerular, hemoglobina y natremia y menores puntuaciones de riesgo de Framingham, valores de fracción aminoterminal del propéptido natriurético tipo B, troponina T y uratos. Recibían con más frecuencia tratamiento con antagonistas de los receptores de la angiotensina II, bloqueadores beta, antagonistas de los receptores mineralocorticoideos, digoxina, nitratos, hidralazina, estatinas, diuréticos de asa y tiacidas. El análisis de la variabilidad circadiana y semanal no reveló diferencias significativas entre los intervalos de 6 h o los días de la semana. La mortalidad fue más frecuente durante el invierno (30,6%) que en otras estaciones (p=0,024).
ConclusionesLa mortalidad por cualquier causa no sigue un patrón circadiano, pero sí un ritmo estacional, en pacientes con insuficiencia cardiaca. Este hallazgo contrasta con el ritmo circadiano de los eventos cardiovasculares observado en la población general.
Palabras clave
Se ha descrito una mayor incidencia de eventos cardiacos durante las primeras horas de la mañana, principalmente por la variación circadiana que afecta al funcionamiento del sistema cardiovascular. La acentuación de la actividad del sistema nervioso simpático después del despertar y la consiguiente activación de neurohormonas y trombosis pueden tener un papel importante. Se han observado picos de incidencia de infarto agudo de miocardio, isquemia miocárdica, parada cardiaca extrahospitalaria, muerte súbita y fibrilación auricular paroxística en la población general durante las primeras horas después de despertar1–8. Sin embargo, a pesar de la alta prevalencia de insuficiencia cardiaca (IC), las variaciones circadianas de la muerte en este síndrome siguen sin estar claras. Solo tres estudios han analizado el patrón circadiano de la muerte en la IC y sus resultados son diferentes. Dos estudios evaluaron la muerte súbita y uno, la muerte por IC en fase terminal. Moser et al9 estudiaron el patrón de muerte súbita en 566 pacientes con IC avanzada y observaron un pico a primera hora de la mañana (de las 6:00 a las 11:59). En cambio, Carson et al10, en un ensayo multicéntrico realizado en 1.153 pacientes, no observaron el pico matinal, sino que describieron un pico de muerte súbita a última hora de la tarde en el subgrupo de pacientes isquémicos. Más recientemente, Aronow et al11 presentaron los datos de un estudio sobre la hora de la muerte por IC congestiva tras un infarto de miocardio en pacientes de más de 60 años de edad, y observaron el mismo pico matinal de otros eventos cardiovasculares en la población general. Sin embargo, hasta ahora no se ha determinado el patrón circadiano de la muerte por cualquier causa en pacientes con IC.
Se ha descrito también previamente un aumento de las incidencias de infarto agudo de miocardio y de muerte súbita en la población general los lunes12–18. Sin embargo, no se sabe si se da la misma distribución semanal en los pacientes con IC. A pesar de los nuevos enfoques terapéuticos, la IC sigue teniendo mal pronóstico. La identificación de la causa y el momento de aparición de los eventos clínicos en estos pacientes puede permitir un abordaje más individualizado para mejorar el pronóstico, como un seguimiento más estricto en ciertos meses del año o un tratamiento orientado al estrés. Con este objetivo, se analizó la hora de la muerte en una gran cohorte de pacientes con IC para determinar la distribución de la mortalidad por cualquier causa según el patrón circadiano, el día de la semana y el mes y la estación del año.
MÉTODOSPoblación en estudioLa población en estudio la formaron 1.233 pacientes consecutivos tratados en una unidad de IC multidisciplinaria de un hospital terciario universitario con programa de trasplante cardiaco, entre enero de 2003 y diciembre de 2008. Todos los pacientes presentaban IC sintomática y recibían tratamiento según las guías de la Sociedad Europea de Cardiología19. Se excluyó del análisis a los pacientes que recibieron un trasplante cardiaco durante el seguimiento. La etiología de la IC se determinó a partir de la historia clínica y con los resultados de las exploraciones de imagen cardiacas. El estudio fue aprobado por el comité de ética de investigación del centro y se atiene a los principios establecidos en la Declaración de Helsinki20.
Variables del estudioSe registraron datos demográficos, clínicos, ecocardiográficos y terapéuticos de todos los pacientes.
Determinación del modo y la hora de la muerteLas muertes se dividieron en las siguientes categorías: muerte súbita, muerte por IC progresiva, otras muertes cardiovasculares y muerte no cardiovascular, según las definiciones propuestas por Narang et al21. La muerte súbita se definió como la muerte presenciada o no en ausencia de fallo circulatorio preexistente u otros modos de muerte, la reanimación de una parada cardiaca en ausencia de fallo circulatorio preexistente u otros modos de muerte, seguida de fallecimiento del paciente en un plazo de 24 h, o la ocurrida a pacientes similares durante el intento de reanimación. Las muertes debidas a un fallo de bomba progresivo se definieron por la presencia de al menos una de las siguientes situaciones en el momento de la muerte: shock cardiogénico, edema pulmonar, síntomas o signos de IC con necesidad de tratamiento intravenoso continuo o administración de oxígeno y confinamiento en cama a causa de los síntomas de IC. Otras muertes cardiovasculares incluyeron muerte por ictus, muerte perioperatoria, muerte por infarto mesentérico, muerte por oclusión vascular periférica y otras. Además, la muerte cardiovascular incluyó la muerte súbita, la muerte por IC progresiva, la muerte por ictus y otros eventos cardiovasculares. Las muertes no cardiovasculares incluyeron las debidas a infección, cáncer y otras.
Se realizó una llamada telefónica de seguimiento a todos los pacientes 1 año después de la inclusión. En caso de muerte del paciente, los investigadores del estudio clasificaron de manera retrospectiva el modo y el momento de la muerte. Si el paciente había fallecido en el hospital, los datos se obtuvieron mediante revisión de la historia clínica. Si el paciente había fallecido fuera del hospital, la información se obtuvo de los familiares. Dado que no siempre fue posible que la familia indicara la hora exacta de la muerte, se dividió el día en intervalos de 6 h, para asegurar que el margen de tiempo de cada muerte fuera correcto. En los casos en que fue imposible contactar con la familia, se consultó el registro de mortalidad del Servicio Catalán de Salud para determinar la fecha de la muerte. De estos pacientes, no se pudo obtener las circunstancias y la hora de la muerte, ya que esos datos no constan en este registro oficial.
Análisis estadísticoComo primer paso, se realizaron análisis descriptivos. Las variables discretas se describieron mediante frecuencia y porcentaje y las variables continuas, con media±desviación estándar. Las características basales de los pacientes de las dos categorías de mortalidad se examinaron con la prueba de la χ2 para las variables discretas o con la prueba exacta de Fisher, en caso necesario. La comparación de las variables continuas entre los grupos se llevó a cabo con la prueba de la t de Student para datos no apareados, una vez demostrada la normalidad (prueba de Kolmogorov-Smirnov); de lo contrario, se utilizó una prueba no paramétrica (prueba de la U de Mann-Whitney). Se utilizó la prueba de la χ2, o la exacta de Fisher en caso necesario, para determinar si las diferentes distribuciones de la mortalidad en momentos diferentes eran estadísticamente significativas. Todos los análisis se realizaron con el programa SPSS para Windows (versión 17) y se consideró estadísticamente significativo un valor de p<0,05.
RESULTADOSCaracterísticas generalesDurante el periodo de estudio, se incluyó a un total de 1.233 pacientes, con una media de seguimiento de 29±21 meses. De estos pacientes, 37 recibieron trasplante durante el periodo de seguimiento, por lo que se los excluyó del análisis. De los 1.196 pacientes restantes (media de edad, 69±13 años; el 62% varones), fallecieron 418 (34,9%). Hubo 69 muertes súbitas (16,5%), 148 muertes debidas a IC progresiva (35,4%), 30 muertes cardiovasculares de otro tipo (7,2%) y 104 muertes no cardiovasculares (24,9%). En 67 pacientes (16%), no se pudo determinar el modo de muerte.
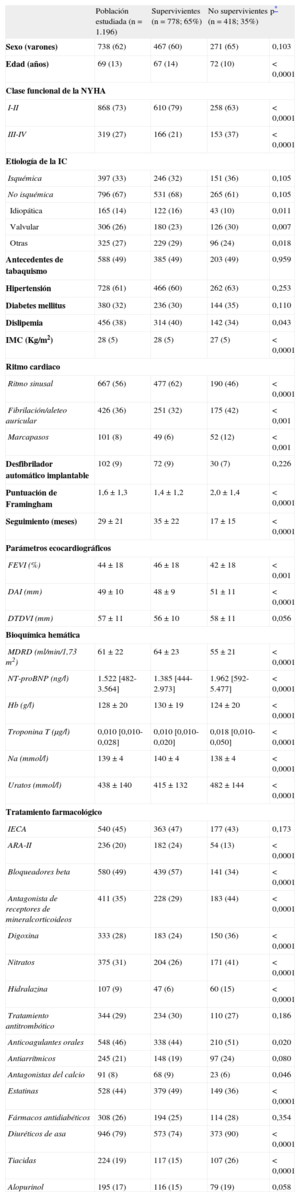
Las características clínicas de los pacientes en su conjunto se muestran en la tabla 1, junto con las diferencias entre supervivientes y no supervivientes. Los no supervivientes recibían más frecuentemente tratamiento con fármacos utilizados en las clases funcionales más avanzadas. Conviene señalar que no hubo diferencias de supervivencia asociadas al sexo, la etiología isquémica o no isquémica de la IC o los siguientes factores de riesgo: antecedentes de tabaquismo, hipertensión y diabetes mellitus.
Características clínicas de los pacientes del estudio comparados según su estado vital
| Población estudiada (n=1.196) | Supervivientes (n=778; 65%) | No supervivientes (n=418; 35%) | p* | |
| Sexo (varones) | 738 (62) | 467 (60) | 271 (65) | 0,103 |
| Edad (años) | 69 (13) | 67 (14) | 72 (10) | <0,0001 |
| Clase funcional de la NYHA | ||||
| I-II | 868 (73) | 610 (79) | 258 (63) | <0,0001 |
| III-IV | 319 (27) | 166 (21) | 153 (37) | <0,0001 |
| Etiología de la IC | ||||
| Isquémica | 397 (33) | 246 (32) | 151 (36) | 0,105 |
| No isquémica | 796 (67) | 531 (68) | 265 (61) | 0,105 |
| Idiopática | 165 (14) | 122 (16) | 43 (10) | 0,011 |
| Valvular | 306 (26) | 180 (23) | 126 (30) | 0,007 |
| Otras | 325 (27) | 229 (29) | 96 (24) | 0,018 |
| Antecedentes de tabaquismo | 588 (49) | 385 (49) | 203 (49) | 0,959 |
| Hipertensión | 728 (61) | 466 (60) | 262 (63) | 0,253 |
| Diabetes mellitus | 380 (32) | 236 (30) | 144 (35) | 0,110 |
| Dislipemia | 456 (38) | 314 (40) | 142 (34) | 0,043 |
| IMC (Kg/m2) | 28 (5) | 28 (5) | 27 (5) | <0,0001 |
| Ritmo cardiaco | ||||
| Ritmo sinusal | 667 (56) | 477 (62) | 190 (46) | <0,0001 |
| Fibrilación/aleteo auricular | 426 (36) | 251 (32) | 175 (42) | <0,001 |
| Marcapasos | 101 (8) | 49 (6) | 52 (12) | <0,001 |
| Desfibrilador automático implantable | 102 (9) | 72 (9) | 30 (7) | 0,226 |
| Puntuación de Framingham | 1,6±1,3 | 1,4±1,2 | 2,0±1,4 | <0,0001 |
| Seguimiento (meses) | 29±21 | 35±22 | 17±15 | <0,0001 |
| Parámetros ecocardiográficos | ||||
| FEVI (%) | 44±18 | 46±18 | 42±18 | <0,001 |
| DAI (mm) | 49±10 | 48±9 | 51±11 | <0,0001 |
| DTDVI (mm) | 57±11 | 56±10 | 58±11 | 0,056 |
| Bioquímica hemática | ||||
| MDRD (ml/min/1,73 m2) | 61±22 | 64±23 | 55±21 | <0,0001 |
| NT-proBNP (ng/l) | 1.522 [482-3.564] | 1.385 [444-2.973] | 1.962 [592-5.477] | <0,0001 |
| Hb (g/l) | 128±20 | 130±19 | 124±20 | <0,0001 |
| Troponina T (μg/l) | 0,010 [0,010-0,028] | 0,010 [0,010-0,020] | 0,018 [0,010-0,050] | <0,0001 |
| Na (mmol/l) | 139±4 | 140±4 | 138±4 | <0,0001 |
| Uratos (mmol/l) | 438±140 | 415±132 | 482±144 | <0,0001 |
| Tratamiento farmacológico | ||||
| IECA | 540 (45) | 363 (47) | 177 (43) | 0,173 |
| ARA-II | 236 (20) | 182 (24) | 54 (13) | <0,0001 |
| Bloqueadores beta | 580 (49) | 439 (57) | 141 (34) | <0,0001 |
| Antagonista de receptores de mineralcorticoideos | 411 (35) | 228 (29) | 183 (44) | <0,0001 |
| Digoxina | 333 (28) | 183 (24) | 150 (36) | <0,0001 |
| Nitratos | 375 (31) | 204 (26) | 171 (41) | <0,0001 |
| Hidralazina | 107 (9) | 47 (6) | 60 (15) | <0,0001 |
| Tratamiento antitrombótico | 344 (29) | 234 (30) | 110 (27) | 0,186 |
| Anticoagulantes orales | 548 (46) | 338 (44) | 210 (51) | 0,020 |
| Antiarrítmicos | 245 (21) | 148 (19) | 97 (24) | 0,080 |
| Antagonistas del calcio | 91 (8) | 68 (9) | 23 (6) | 0,046 |
| Estatinas | 528 (44) | 379 (49) | 149 (36) | <0,0001 |
| Fármacos antidiabéticos | 308 (26) | 194 (25) | 114 (28) | 0,354 |
| Diuréticos de asa | 946 (79) | 573 (74) | 373 (90) | <0,0001 |
| Tiacidas | 224 (19) | 117 (15) | 107 (26) | <0,0001 |
| Alopurinol | 195 (17) | 116 (15) | 79 (19) | 0,058 |
ARA-II: antagonistas del receptor de la angiotensina II; DAI: diámetro auricular izquierdo; DTDVI: diámetro telediastólico ventricular izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; Hb: hemoglobina; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; MDRD: filtrado glomerular estimado mediante la fórmula Modification of Diet in Renal Disease; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B; NYHA: New York Heart Association.
Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
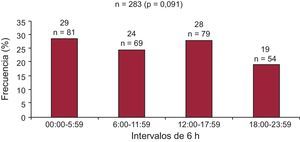
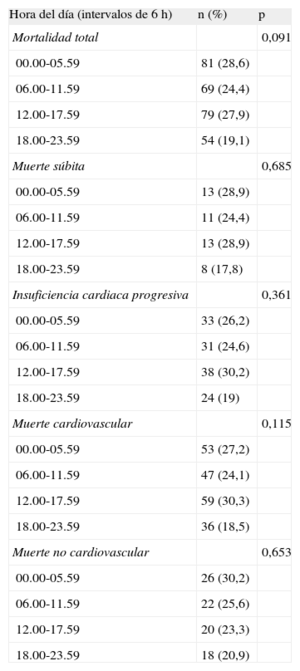
Se pudo determinar la hora de la muerte, dentro de un intervalo de 6 h, en 283 de los 418 no supervivientes (68%). El análisis de la hora de la muerte no reveló diferencias significativas de la distribución entre los cuatro intervalos de 6 h (figura 1). No se observaron diferencias significativas en las características clínicas de los pacientes con hora de la muerte conocida respecto a los pacientes con hora de la muerte desconocida. La distribución podría variar por diferentes factores; en consecuencia, examinamos los eventos incluidos en las categorías preespecificadas de muerte súbita, muerte debida a IC progresiva, muerte cardiovascular en general, muerte no cardiovascular, grupos isquémico y no isquémico, índice de masa corporal, clase funcional de la New York Heart Association y fracción de eyección del ventrículo izquierdo. No hubo diferencias significativas en la distribución horaria de las muertes en ninguno de estos grupos (p=0,05 para todas las comparaciones). Los datos de mayor interés se indican en la tabla 2.
Análisis de subgrupos del patrón circadiano de la mortalidad
| Hora del día (intervalos de 6 h) | n (%) | p |
| Mortalidad total | 0,091 | |
| 00.00-05.59 | 81 (28,6) | |
| 06.00-11.59 | 69 (24,4) | |
| 12.00-17.59 | 79 (27,9) | |
| 18.00-23.59 | 54 (19,1) | |
| Muerte súbita | 0,685 | |
| 00.00-05.59 | 13 (28,9) | |
| 06.00-11.59 | 11 (24,4) | |
| 12.00-17.59 | 13 (28,9) | |
| 18.00-23.59 | 8 (17,8) | |
| Insuficiencia cardiaca progresiva | 0,361 | |
| 00.00-05.59 | 33 (26,2) | |
| 06.00-11.59 | 31 (24,6) | |
| 12.00-17.59 | 38 (30,2) | |
| 18.00-23.59 | 24 (19) | |
| Muerte cardiovascular | 0,115 | |
| 00.00-05.59 | 53 (27,2) | |
| 06.00-11.59 | 47 (24,1) | |
| 12.00-17.59 | 59 (30,3) | |
| 18.00-23.59 | 36 (18,5) | |
| Muerte no cardiovascular | 0,653 | |
| 00.00-05.59 | 26 (30,2) | |
| 06.00-11.59 | 22 (25,6) | |
| 12.00-17.59 | 20 (23,3) | |
| 18.00-23.59 | 18 (20,9) |
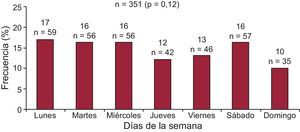
Se dispuso de información sobre el día de la semana en 351 (84%) de las 418 muertes. No hubo diferencias en la mortalidad total en función del día de la semana (figura 2) ni al analizar los diferentes subgrupos de muerte súbita, muerte debida a IC progresiva, muerte cardiovascular en general, muerte no cardiovascular, etiología isquémica o no isquémica de la IC, índice de masa corporal, clase funcional de la New York Heart Association o fracción de eyección del ventrículo izquierdo (p≥0,05 para todas las comparaciones). Tampoco hubo diferencias cuando se realizó el subanálisis en función de la edad (mayor o menor de 65 años; p=0,425).
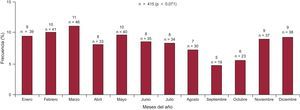
Análisis mensual y estacionalLa mortalidad (determinada en el 99,3% de los pacientes) se produjo con mayor frecuencia durante el invierno (30,6%), entre enero y marzo (figura 3); tan solo la comparación por pares (verano-invierno) con corrección de Bonferroni fue estadísticamente significativa (p=0,024) (figura 4). Se observó también la misma distribución de frecuencias estacional de las muertes al analizar todos los subgrupos de pacientes.
El factor tiempo hasta la muerte no mostró ninguna influencia: no hubo diferencias de tiempo de seguimiento entre los niveles de cada variable de exposición (circadiano, día de la semana, mensual y estacional).
DISCUSIÓNRitmo circadiano de la mortalidadHasta donde se sabe, este es el primer estudio en el que se evalúa el patrón circadiano de la muerte en pacientes de todas las clases funcionales de la New York Heart Association (I-IV) de la IC. No se observa ninguna variabilidad circadiana de la mortalidad total entre los cuatro intervalos horarios establecidos. Además, el subanálisis de la distribución circadiana de la mortalidad cardiovascular de esta población mostró una distribución similar, sin picos de frecuencia de muertes en ninguno de los intervalos de tiempo.
Estos resultados contrastan con los picos horarios de eventos cardiovasculares observados en la población general. En estudios poblacionales grandes se ha observado una distribución circadiana no uniforme de los eventos cardiacos, con un pico matinal (entre las 6:00 y las 11:59)1–8. Además, se describió también un pico secundario al anochecer (entre las 18:00 y las 23:59)1,2,6, lo cual indica un pico de eventos bimodal. El pico matinal de eventos cardiacos se ha atribuido a la acentuación de la actividad del sistema nervioso simpático después del despertar. En cambio, las razones que explican un segundo máximo al anochecer son menos obvias y es posible que reflejen un proceso diferente.
Dado que el sistema nervioso simpático se activa de manera característica en la IC, causando una estimulación neurohormonal crónica22, se esperaba observar una distribución más uniforme del patrón circadiano de la mortalidad. En este síndrome, la activación neurohormonal constante podría ser la causa de la desaparición del máximo matinal de la mortalidad descrita en la población general. Además, es posible que los tratamientos de la IC, que generalmente comportan un bloqueo neurohormonal, y los bloqueadores beta amortigüen el aumento de la actividad neurohormonal y otros cambios relacionados con las catecolaminas que se producen en las primeras horas de la mañana.
Ritmo semanal de la mortalidadLa prevalencia de los eventos cardiovasculares los lunes, en comparación con el resto de la semana, se atribuye al paso de un periodo de actividad no programada a uno de actividad programada12. El inicio de un infarto agudo de miocardio muestra un pico los lunes, sobre todo en la población laboralmente activa13, lo cual respalda la hipótesis de que los factores desencadenantes externos pueden desempeñar un papel en la causalidad aguda de esta enfermedad, probablemente estimulando también la actividad del sistema nervioso simpático. Además, al analizar el patrón semanal de la muerte súbita, el aumento de la mortalidad los lunes es aun más pronunciado en los pacientes ≤ 65 años en comparación con los más ancianos, aparentemente jubilados14. Sin embargo, en nuestra población con IC, no se observó un pico semanal de los episodios en los dos grupos de edad (menor o mayor que 65 años), lo cual puede respaldar la hipótesis de que una activación simpática permanente y el tratamiento específico de estos pacientes causan la desaparición de los picos de eventos, cuya distribución se normaliza. No se registró la situación laboral de los pacientes, pero la mayoría de ellos estaban en edad de jubilación y se debe tener en cuenta que los pacientes con IC grave no suelen estar activos; por lo tanto, no se puede extraer conclusiones definitivas al respecto.
Ritmo estacional de la mortalidadSe observó una variación estacional significativa con una incidencia máxima de mortalidad en invierno. Esta distribución es similar al patrón estacional de mortalidad descrito anteriormente para los eventos cardiovasculares en la población general14,23–25. Además, cuando se estudió una población con IC, se describió el mismo patrón de mortalidad estacional15–18. Hay varios mecanismos fisiológicos que pueden intervenir en esta variación estacional17. En primer lugar, el estrés hemodinámico y la activación neurohumoral relacionados con una disminución de la temperatura ambiente pueden agravar la IC. En segundo lugar, la isquemia miocárdica y las arritmias inducidas por el descenso de la temperatura podrían aumentar el riesgo de descompensación de la IC. En tercer lugar, en invierno puede haber mayor incidencia de infecciones respiratorias que agraven la IC. En cuarto lugar, los picos invernales de consumo de alcohol pueden agravar la IC al reducir la contractilidad del miocardio e inducir fibrilación auricular26,27. Además, debe señalarse que los ancianos tienen menos capacidad de regulación de la temperatura corporal y son más vulnerables a las infecciones respiratorias, lo cual podría hacer que fueran más propensos a la descompensación que otros grupos de edad. Para evaluar mejor las diferencias estacionales, se debe recordar que durante el verano los ingresos por IC tienden a ser menos en los grandes hospitales urbanos debido a las estancias en localidades rurales o en la costa durante las vacaciones. En consecuencia, un análisis de la mortalidad intrahospitalaria comparada con la extrahospitalaria sería de interés para futuros estudios.
Limitaciones del estudioEste estudio tiene ciertas limitaciones. En primer lugar, el diseño es retrospectivo, por lo que no se realizaron autopsias para establecer la causa de la muerte y la potencia estadística es insuficiente para rechazar la hipótesis nula para todos los distintos modos de muerte. La hora de la muerte pudo determinarse en intervalos de 6 h en el 68% de los pacientes. No obstante, no se observaron diferencias significativas en las características clínicas de los pacientes entre hora de la muerte conocida y desconocida. Otras variables no registradas, como las comorbilidades o la situación laboral, pueden desempeñar un papel en los resultados obtenidos. Por último, se debe comentar el porcentaje sorprendentemente bajo de pacientes tratados con inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina II y bloqueadores beta. La unidad de IC en la que se atendió a la población estudiada es una unidad especializada a la que se remite a pacientes con una IC evolucionada. Explicaciones frecuentes para no utilizar estos fármacos fueron la hipotensión en pacientes con necesidad de dosis altas de diuréticos o pacientes isquémicos que requieren dosis altas de vasodilatadores, la insuficiencia renal avanzada o la hiperpotasemia.
Implicaciones clínicasA pesar de estas limitaciones, nuestros resultados pueden tener consecuencias importantes en el tratamiento clínico de estos pacientes. En invierno se debería monitorizar de manera más estricta para detectar y corregir las exacerbaciones en un estadio inicial. Además, fomentar la vacunación podría reducir el agravamiento de la IC asociado a las infecciones en invierno.
CONCLUSIONESEn esta serie amplia, los pacientes con IC no mostraron picos de mortalidad circadianos ni por día de la semana, a diferencia del patrón de eventos cardiovasculares que se da en la población general. Esta observación respalda la existencia de cambios fisiopatológicos importantes en la IC y puede aportar una perspectiva adicional respecto al mecanismo de la muerte y las posibles formas de prevenirla. Por último, se ha descrito un pico sustancial de mortalidad en invierno, lo cual indica que una monitorización más estricta de estos pacientes durante ese periodo del año puede mejorar su pronóstico.
FINANCIACIÓNEste trabajo ha recibido apoyo económico del Instituto de Salud Carlos III, REDINSCOR (Red de investigación clínica y básica en insuficiencia cardiaca) RD06/0003/0015 y RETICS (REdes Temáticas de investigación Cooperativa en Salud): Red Cardiovascular (RD12/0042/0047), Ministerio de Economía y Competitividad (Juan de la Cierva, JCI-2012-14025) y TerCel (Red de Terapia Celular) (RD12/0019/0029).
CONFLICTO DE INTERESESNinguno.