
La resonancia magnética cardiaca con realce tardío de gadolinio (RMC-RTG) permite la detección no invasiva de la fibrosis auricular izquierda en pacientes con fibrilación auricular (FA). Sin embargo, se desconoce si se puede utilizar la misma metodología en la aurícula derecha (AD). Nuestro objetivo fue definir un umbral estandarizado para caracterizar la fibrosis auricular derecha mediante RMC-RTG.
MétodosSe realizaron RMC-RTG de 3 T en 53 personas; se segmentó la AD y se calculó la razón de intensidad de imagen (RII) para la pared de la AD utilizando 1.557.767 píxeles de RII (40.994±10.693 por paciente). El límite superior de la normalidad de la RII (RII promedio+2 desviaciones estándar) se estimó en voluntarios sanos (n = 9); para establecer el umbral de cicatriz densa, se utilizó a los pacientes que se habían sometido previamente a una ablación del flutter auricular típico (n = 9). Se incluyó a pacientes con FA paroxística y persistente (n=10 cada grupo) para la validación. Los valores de RII se correlacionaron con un mapa de voltaje bipolar de alta densidad en 15 pacientes sometidos a ablación de FA.
ResultadosEl límite superior de la normalidad (umbral de fibrosis total) en voluntarios sanos se fijó en RII = 1,21. En el grupo postablación, el 60% del píxel de la RII máximo (umbral de fibrosis densa) se calculó como RII = 1,29. El voltaje bipolar endocárdico mostró una correlación con la RII débil pero significativa. La precisión general entre el mapa electroanatómico y la RMC-RTG para caracterizar la fibrosis fue del 56%.
ConclusionesSe determinó una RII > 1,21 como umbral para la detección de fibrosis de la aurícula derecha, mientras que una RII > 1,29 diferencia la fibrosis intersticial de la cicatriz densa. A pesar de las diferencias entre las aurículas izquierda y derecha, se pudo evaluar la fibrosis con RMC-RTG con umbrales similares en ambas cámaras.
Palabras clave
La fibrosis auricular es un factor decisivo en la patogenia de la fibrilación auricular (FA). Los avances técnicos durante los últimos años han permitido la caracterización no invasiva de la fibrosis auricular mediante resonancia magnética cardiaca con realce tardío de gadolinio (RMC-RTG)1, lo que ha fomentado numerosas aplicaciones clínicas potenciales. La RMC-RTG puede ser útil para personalizar una primera intervención de ablación de la FA2 y posibles reintervenciones3, que se benefician de la caracterización previa de la fibrosis auricular4. Se ha demostrado que la discontinuidad en las lesiones anatómicas inducidas por ablación predice recurrencias de FA5. Por último, la RMC-RTG podría ayudar a la selección de pacientes que necesitan anticoagulación crónica para la prevención primaria del ictus6. Sin embargo, la falta de algoritmos estandarizados para la evaluación de la fibrosis y su reproducibilidad variable han limitado la adopción y el uso generalizado de la RMC-RTG en la práctica clínica7.
Existen diferencias anatómicas, funcionales y moleculares entre la aurícula izquierda (AI) y la aurícula derecha (AD). La contribución de la AD a la afección por FA continúa siendo controvertida, pero los conocimientos clínicos consolidan el papel fundamental de la AD en algunos pacientes. La AD puede ser muy sensible al daño infligido por la apnea del sueño y otras enfermedades respiratorias8,9, y los focos ectópicos que sostienen la FA se han localizado, en ocasiones, en la AD10. Lamentablemente, nuestro conocimiento sobre la contribución de la AD al sustrato de la FA está comprometido, al menos en parte, por limitaciones técnicas. Por ejemplo, los esfuerzos de los últimos años se han dirigido hacia la identificación no invasiva de la fibrosis auricular en la AI, pero ningún estudio ha demostrado todavía si algoritmos similares son aplicables a la AD. Pocos estudios y con un reducido número de pacientes han empleado la RMC para medir la fibrosis en la AD y, entre ellos, una serie de casos11. En pacientes con FA y disfunción del nódulo sinusal, Akoum et al.12 encontraron que la carga de fibrosis era mayor en la AI que en la AD. Sin embargo, estos algoritmos nunca se habían validado para la evaluación de la fibrosis de la AD.
Nuestro objetivo es definir y validar un método estandarizado, sistemático, reproducible y sólido para identificar la fibrosis miocárdica en la AD por medio de RMC-RTG.
MÉTODOSEl protocolo del estudio se ajusta a la Declaración de Helsinki y fue aprobado por el comité de ética en investigación de nuestro centro (HCB/2018/0382). Todos los pacientes firmaron el consentimiento informado. Los datos que respaldan los resultados de este estudio están disponibles previa solicitud razonable al autor para correspondencia. Se ofrece una descripción completa en .
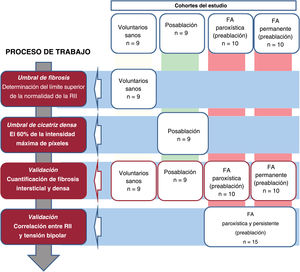
Diseño del estudio y cohortes en estudioSe llevó a cabo un proceso de trabajo sistemático y secuencial13 en varias cohortes (figura 1) para determinar la intensidad de la pared de la AD, diferenciando el tejido sano del fibrótico así como la fibrosis intersticial de la cicatriz densa. Este estudio técnico descriptivo pretendía sentar las bases para la interpretación de la fibrosis medida por RMC-RTG en la AD (figura 2).
Figura central. Cuantificación de la fibrosis de la aurícula derecha mediante RMC-RTG. A: evaluación de la fibrosis total de la AD y los umbrales de cicatriz densa en voluntarios sanos y pacientes con aleteo auricular típico y ablación de la FA en la misma intervención respectivamente; aplicación de los umbrales obtenidos a grupos de FA paroxística y permanente. B: correlación entre RMC-RTG y mapa electroanatómico en un grupo prospectivo de pacientes intervenidos con ablación de la FA. AD: aurícula derecha; AI: aurícula izquierda; FA: fibrilación auricular; RII: razón de intensidad de imagen; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
En etapas consecutivas de este estudio se incluyó a 53 personas exploradas por RMC-RTG. Inicialmente, los umbrales para identificar la fibrosis en la AD se determinaron en voluntarios sanos (personas de 18-30 años que habían sido inscritas para evaluar el umbral de fibrosis de la AI13, n=9) y pacientes sometidos a ablación del aleteo auricular y la FA en la misma intervención (n=9, RMC-RTG 3 meses después de la ablación). Posteriormente, se utilizó a pacientes con FA paroxística (n=10) o persistente (n=10) para la validación (RMC-RTG obtenida 2 semanas antes de la intervención de ablación). Por último, se evaluó la correlación entre la razón de intensidad de imagen (RII) y el mapa de voltaje bipolar electroanatómico (MEA) en una cohorte prospectiva adicional de pacientes tratados con una primera intervención de ablación de la FA (n=15).
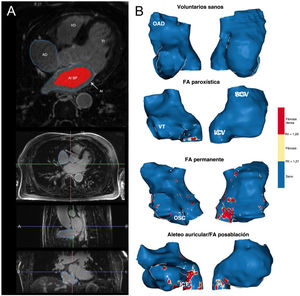
Tanto la AD como la AI se segmentaron en RMC-RTG de 3 T (Magnetom Prisma Siemens Healthcare, Alemania) con el programa informático ADAS 3D (figura 3) y se construyeron estructuras en 3D. La intensidad de la señal de cada píxel de la pared de la AD se normalizó a la intensidad sanguínea media de la AI para calcular la RII. Todos los valores de la RII se representaron en histogramas y el umbral de fibrosis total se estableció como el valor medio de la RII en el grupo de voluntarios sanos más 2 desviaciones estándar (DE), lo que aseguró que un ≈97,5% de todos los píxeles en el grupo de voluntarios sanos se encontraran por debajo de este umbral. El umbral de cicatriz densa se definió como el valor de la RII correspondiente al 60% del píxel de intensidad máxima normalizada en la AD de los pacientes sometidos a ablación del istmo cavotricuspídeo, como se definió previamente en la AI3. En resumen, el tejido sano, la fibrosis intersticial y la cicatriz densa se derivaron de los valores de la RII.
A: posprocesamiento de imágenes de RMC-RTG; en la imagen superior, los contornos de la AD y la AI se dibujaron manualmente en un plano axial; la sangre de la AI se muestra en rojo; las 3 imágenes inferiores muestran los planos axial, sagital y frontal de una RMC durante la segmentación de la AD. B: vistas anteroseptal (derecha) y posterolateral (izquierda) de ejemplos representativos de la AD en todos los grupos de estudio. AD: aurícula derecha; AI: aurícula izquierda; BP: sangre (blood pool); FA: fibrilación auricular; ICT: istmo cavotricuspídeo; OAD: orejuela de la aurícula derecha; OSC: ostium del seno coronario; VCI: vena cava inferior; VCS: vena cava superior; VD: ventrículo derecho; VI: ventrículo izquierdo; VT: válvula tricúspide.
Finalmente, en 15 pacientes consecutivos sometidos a ablación de la FA, el voltaje bipolar en un MEA intraprocedimiento de alta densidad punto por punto de la AD (catéteres Lasso o Pentarray, CARTO 3, Biosense-Webster, Estados Unidos) se correlacionó con los valores de la RII. Solo se utilizaron los puntos del MEA proyectados en la estructura de la RMC con menos de 10mm de separación. Se utilizaron umbrales de voltaje estándar de 0,1 y 0,5mV para caracterizar la cicatriz densa auricular, la fibrosis intersticial y el tejido sano.
Análisis estadísticosLas variables continuas se muestran como media ± DE o mediana [intervalo intercuartílico] a menos que se indique otra cosa, y los grupos se compararon con ANOVA unidireccional. La correlación entre la RII y el MEA se evaluó con el coeficiente de correlación de Pearson (r) y se empleó un modelo mixto lineal generalizado con intersección aleatoria para incluir las mediciones repetidas de la RII en cada paciente. Se utilizó un error de tipo I bilateral del 5% para todas las pruebas. Todos los análisis se realizaron con R v3.5.1 (R project for Statistical Computing).
RESULTADOSCaracterísticas basales de la poblaciónLas características de los 4 grupos de estudio se muestran en la tabla 1. La mayoría de los participantes eran varones (71%). Se seleccionó a jóvenes sin factores de riesgo para el grupo de voluntarios sanos. Los grupos de FA reunían a personas de mediana edad con una carga similar de factores de riesgo cardiovascular; la cardiopatía estructural fue poco frecuente. Solo se hicieron ecocardiografías a pacientes con FA y mostraron un aumento leve del diámetro anteroposterior de la AI (41 ± 6mm). La RMC mostró un aumento progresivo de la AD de voluntarios sanos a FA permanente.
Características de todas las cohortes
| Voluntarios sanos(n=9) | FA paroxística(n=10) | FA permanente(n=10) | Posablación(n=9) | p ómnibus(solo pacientes con FA) | |
|---|---|---|---|---|---|
| Datos clínicos | |||||
| Varones | 4 (44) | 8 (80) | 8 (80) | 7 (78) | 0,99 |
| Edad (años) | 26±0 | 58±10 | 57±9 | 59±8 | 0,85 |
| Hipertensión | 0 | 3 (30) | 5 (50) | 5 (56) | 0,49 |
| Diabetes | 0 | 0 | 1 (10) | 1 (11) | 0,57 |
| Apnea del sueño | 0 | 1 (10) | 0 | 0 | 0,41 |
| Cardiopatía estructural | 0 | 0 | 1 (10) | 4 (44)* | 0,03 |
| Ecocardiografía | |||||
| FEVI (%) | N/A | 60±7 | 59±4 | 52±10* | 0,03 |
| DTDVI (mm) | N/A | 51±4 | 49±7 | 51±5 | 0,70 |
| Diámetro de la AI (mm) | N/A | 38±3 | 40±7 | 45±4* | 0,02 |
| Resonancia magnética | |||||
| Área de la AD (cm2) | 94±16 | 137±30 | 149±24 | 129±25 | 0,29 |
| Volumen de la AD (ml) | 77±20 | 121±36 | 139±38 | 104±28 | 0,10 |
AI: aurícula izquierda; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo.
Salvo otra indicación, los valores expresan n (%) (variables cualitativas) o media ± desviación estándar (variables cuantitativas).
En general, se obtuvieron valores normalizados de intensidad de RMC-RTG (es decir, RII) de 2.283.069 píxeles de las 2 aurículas de todos los participantes: 1.557.767 píxeles de la AD (40.994±10.693 píxeles por paciente) y 725.302 píxeles de la AI (19.087 ± 11.414 píxeles por paciente). Cuando se analizó juntos a todos los participantes, la RII media fue mayor en la AI que en la AD (RII = 0,99; intervalo de confianza del 95% [IC95%], 0,97-1,02; frente a RII = 0,77; IC95%, 0,74-0,79; p<0,0001) (tabla 2).
Valores descriptivos del histograma de la razón de intensidad de imagen de las aurículas derecha e izquierda
| Voluntarios sanos | FA paroxística | FA permanente | Posablación | |
|---|---|---|---|---|
| RII | ||||
| AD | 0,76±0,23 | 0,77±0,24 | 0,79±0,24 | 0,73±0,28 |
| AI | 0,94±0,19 | 0,95±0,21 | 1,01±0,24 | 1,05±0,26 |
| Curtosis | ||||
| AD | 4,66 | 4,57 | 3,63 | 4,00 |
| AI | 11,70 | 3,76 | 4,52 | 5,46 |
| Asimetría | ||||
| AD | 0,71 | 0,70 | 0,36 | 0,78 |
| AI | 1,31 | -0,31 | 0,39 | 0,99 |
AD: aurícula derecha; AI: aurícula izquierda; FA: fibrilación auricular; RII: razón de intensidad de imagen.
Los valores de la RII expresan media ± desviación estándar. La curtosis y la asimetría son parámetros sin unidades.
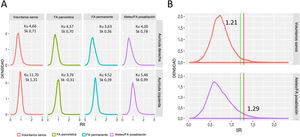
La figura 4A muestra los histogramas de la RII de la AD; se presentan histogramas de la AI como referencia. Primero se caracterizaron estos histogramas para determinar cómo se distribuyeron los valores de la RII (es decir, fibrosis auricular) en la AD. En todos los grupos, el histograma de la RII fue asimétrico, con una distribución larga de la cola derecha (asimetría media, 0,64; un valor de 0 indica una distribución simétrica), que indica que hay áreas de la AD con parches de fibrosis muy densos. Los pacientes con FA persistente tuvieron la curtosis más pequeña (3,63; una curtosis de 3 caracteriza una distribución normal), lo que demuestra una mayor dispersión de los valores de la RII. En cambio, la mayor curtosis (4,66), que refleja una menor dispersión de los valores de la RII alrededor de la media, se observó en voluntarios sanos.
A: distribución de densidad de los valores de la RII de la AD y la AI en todos los subgrupos. B: identificación de umbrales del tejido miocárdico sano (línea verde, medida en una población sana) y de cicatriz densa (línea roja, medida en pacientes con ablación previa) sobre histogramas de la AD de todos los subgrupos. FA: fibrilación auricular; Ku: curtosis; RII: razón de intensidad de imagen; Sk: asimetría. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
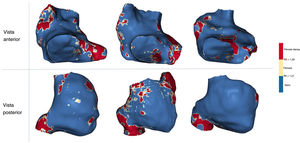
Los valores normales de la RII del miocardio de la AD se definieron a partir de personas jóvenes y sanas. Se calculó que el límite superior de la normalidad (RII media + 2 DE) era RII=1,21 (figura 4B). Por lo tanto, se consideró que todos los valores con una RII >1,21 representaban fibrosis auricular en la AD. Después se estableció el umbral de cicatriz densa en el grupo de pacientes intervenidos con ablación del istmo cavotricuspídeo. Como era de esperar, en la mayoría de los casos el valor de los píxeles de máxima intensidad en la AR se localizó en el istmo cavotricuspídeo (figura 3B, cuadro inferior), mientras que otros píxeles de alta intensidad localizaron la vena cava superior e inferior, la orejuela auricular, el tabique interauricular y el ostium coronario perisinusal (figura 5). El 60% del píxel de intensidad máxima se calculó como RII=1,29, que por tanto se utilizó para discriminar la fibrosis intersticial de la cicatriz densa (figura 4B).
La reproducibilidad interindividual se evaluó con el coeficiente de correlación de concordancia de Lin interobservadores en un subconjunto de 10 AD seleccionadas aleatoriamente y segmentadas por 2 observadores independientes. La correlación fue 0,92 (0,68-0,98) para la fibrosis total y 0,97 (0,89-0,99) para la cicatriz densa (tabla 3).
Reproducibilidad de la evaluación de la fibrosis
| Total | FA paroxística | FA permanente | |
|---|---|---|---|
| Coeficiente de concordancia de Lin (IC95%) | |||
| Fibrosis total | 0,92 (0,68-0,98) | 0,97 (0,63-1,00) | 0,89 (0,20-0,99) |
| Cicatriz densa | 0,97 (0,89-0,99) | 0,91 (0,64-0,98) | 0,98 (0,83-1,00) |
FA: fibrilación auricular; IC95%: intervalo de confianza del 95%.
Se utilizó el coeficiente de correlación de concordancia de Lin para evaluar la concordancia de fibrosis total y cicatriz densa (de la muestra total y por tipo de FA) en 10 aurículas derechas segmentadas por 2 observadores independientes.
Los porcentajes de píxeles de fibrosis total, intersticial y cicatriz densa de la AD se cuantificaron en todos los grupos para validar los umbrales. Los resultados se muestran en la tabla 4. Los voluntarios sanos presentaron la menor carga de fibrosis total de la AD, seguidos por los pacientes con FA paroxística y permanente, y la mayor cantidad de fibrosis de la AD se encontró en los pacientes posablación. Posteriormente, la fibrosis intersticial y la cicatriz densa se cuantificaron por separado. Los voluntarios sanos y los pacientes con FA paroxística mostraron la menor fibrosis intersticial, mientras que los pacientes con FA permanente mostraron la mayor. Por último, la posablación mostró la cicatriz más densa, como se esperaba. Se encontró una fuerte asociación entre la carga de fibrosis intersticial y el área de la AD (r=0,84).
Fibrosis total, fibrosis intersticial y cicatriz densa de la aurícula derecha en todos los grupos
| Fibrosis total | Fibrosis intersticial | Cicatriz densa | |
|---|---|---|---|
| Umbral | RII > 1,21 | 1,21 < RII ≤ 1,29 | IIR > 1,29 |
| Subgrupo | |||
| Voluntarios sanos | 3,78 (3,71-3,85) | 1,28 (1,24-1,32) | 2,50 (2,45-2,56) |
| FA paroxística | 4,19 (4,13-4,25) | 1,68 (1,64-1,71) | 2,52 (2,47-2,56) |
| FA permanente | 4,49 (4,44-4,55) | 2,11 (2,07-2,15) | 2,38 (2,34-2,43) |
| Posablación | 5,97 (5,88-6,05) | 2,07 (2,02-2,12) | 3,90 (3,83-3,97) |
| p (ómnibus) | < 0,001* | < 0,001* | < 0,001* |
FA: fibrilación auricular; RII: razón de intensidad de imagen.
Los valores expresan porcentaje (intervalo de confianza del 95%).
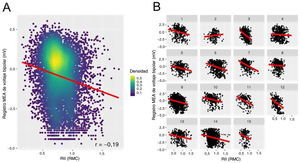
Se evaluó una correlación punto por punto entre el MEA y la RII de la AD en 15 pacientes con una primera intervención de ablación de la FA. En general, se registraron 11.404 valores de voltaje y 8.830 (407 [324-560]) puntos por paciente permanecieron después de la exclusión de los separados más de 10mm de la estructura de la RMC. Se encontró una correlación negativa débil pero significativa entre el voltaje bipolar con transformación logarítmica y la RII (r = −0,19; p<0,0001 en el análisis de correlación; β =−1,39; IC95%, −1,54 a −1,23; p<0,0001 en la modelización mixta lineal generalizada) (figura 6).
Correlación entre voltaje bipolar y RII en los 15 pacientes intervenidos mediante ablación de la FA. A: correlación general en la cohorte agrupada; en lugar de una regresión lineal simple, el análisis se realizó con un modelo mixto lineal generalizado con intersección aleatoria para tener en cuenta las mediciones de la RII repetidas por paciente. B: análisis por paciente. MEA: mapa electroanatómico; RII: razón de intensidad de imagen; RMC: resonancia magnética cardiaca.
A continuación se etiquetó cada uno de los puntos emparejados con MEA y RII como tejido sano, fibrosis intersticial o cicatriz densa, y se probó la concordancia entre ambos (tabla 5). En comparación con el MEA, la RMC-RTG tendió a subestimar la fibrosis de la AD (RMC del tejido sano, 81,0% [IC95%, 80,2-81,8] frente a MEA, 60,6% [IC95%, 59,6-61,6]). La concordancia global entre las 2 técnicas fue del 56%.
Coherencia entre las técnicas en la categorización de la fibrosis
| MEA (voltaje bipolar) | |||
|---|---|---|---|
| RMC-RTG (RII) | Densa | Intersticial | Sano |
| Densa | 216 | 211 | 399 |
| Intersticial | 180 | 213 | 458 |
| Sano | 1.068 | 1.592 | 4.493 |
MEA: mapa electroanatómico; NS: no significativa; RII: razón de intensidad de imagen; RMC-RTG: resonancia magnética cardiaca con realce tardío de gadolinio.
Los valores expresan recuento (número de píxeles). Concordancia entre los píxeles clasificados como tejido sano, fibrosis intersticial o cicatriz densa tanto en el MEA como en la RMC-RTG.
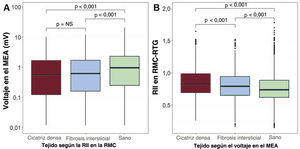
Luego se realizó un promedio del voltaje bipolar en cada una de las 3 áreas de RMC-RTG (tejido sano, fibrosis intersticial, cicatriz densa). El voltaje bipolar aumentó progresivamente de áreas etiquetadas con RMC-RTG como cicatriz densa (valor bipolar medio de MEA, 0,91mV; IC95%, 0,52-1,31) a fibrosis intersticial (1,11mV; IC95%, 0,72-1,50) y a tejido sano (1,77mV; IC95%, 1,40-2,15; p<0,0001). De manera similar, la RII disminuyó progresivamente de áreas etiquetadas con MEA como cicatriz densa (RII media, 0,87; IC95%, 0,82-0,91) a fibrosis intersticial (RII, 0,81; IC95%, 0,76-0,86) y a tejido sano (RII, 0,76; IC95%, 0,72-0,81; p<0,0001) (figura 7).
Gráficos de cajas comparativos (mediana [intervalo intercuartílico]). A: voltaje bipolar (MEA) en áreas clasificadas como tejido sano, fibrosis intersticial y cicatriz densa por la RII (RMC). B: valores de la RII (RMC) en áreas clasificadas como tejido sano, fibrosis intersticial y cicatriz densa por el MEA. MEA: mapa electroanatómico; RII: razón de intensidad de imagen; RMC: resonancia magnética cardiaca.
Las AI de los mismos 15 pacientes se utilizaron como comparador de la precisión. En 15.479 puntos del MEA (968 [700-1.382] puntos por paciente), se obtuvo una correlación negativa débil pero significativa entre el voltaje bipolar con transformación logarítmica y la RII (r=−0,17; p<0,0001; β=−1,52; IC95%, −1,62 a −1,42; p<0,0001), similar a los resultados en la AD.
DISCUSIÓNEn este estudio se describe un método estandarizado para evaluar la fibrosis de la AD por medio de RMC-RTG. Nuestros resultados muestran que: a) una RII>1,21 caracteriza la fibrosis miocárdica en la AD, mientras que una cicatriz densa puede ser identificada por una RII>1,29, y b) la RII muestra una asociación débil pero significativa con el voltaje bipolar en la AD.
Los umbrales de la RMC-RTG para la fibrosis auricular son similares en las aurículas izquierda y derechaSe han propuesto varios métodos para caracterizar la fibrosis de la AI1. El método UTAH2 validado se basa en la distribución bimodal (saludable frente a fibrosis) de la intensidad de píxeles de la AI, pero depende en gran medida de la elección de un umbral dirigido por expertos14. La RII se diseñó más tarde para mejorar la reproducibilidad interindividual15. La posterior caracterización de los voluntarios sanos y los pacientes sometidos a aislamiento de las venas pulmonares permitió la categorización estandarizada en miocardio auricular sano, fibrosis intersticial y cicatriz densa13. Se eligió a voluntarios sanos con muy bajo riesgo de FA (es decir, menores de 30 años) para minimizar el grado de fibrosis intersticial causada por el envejecimiento, con lo que se estableció un umbral de fibrosis a partir del cual hay un aumento del riesgo de FA. Aplicando un método análogo, en el presente estudio se encontró que, aunque los valores de la RII que caracterizan la fibrosis en la AD eran diferentes de los previamente establecidos para la AI, estas diferencias eran escasas y posiblemente de poca relevancia clínica. De hecho, una RII>1,21 identificó fibrosis en la AD y una RII>1,29 diferenció la fibrosis intersticial de la cicatriz densa, en comparación con una RII>1,20 y una RII>1,32 para la fibrosis total y la cicatriz densa en la AI respectivamente. Las diferencias estructurales, moleculares y funcionales entre la AI y la AD quedan demostradas por sus RII medias distintas. Sin embargo, a pesar de estas diferencias entre las 2 aurículas16, la fibrosis podría evaluarse con RMC-RTG utilizando umbrales similares en ambas cámaras.
Como hallazgo interesante, la correlación entre MEA y RMC fue estadísticamente significativa, pero de una intensidad débil, similar a los hallazgos en la AI17. Al menos parcialmente, una correlación tan baja podría ser el resultado de imprecisiones técnicas y otros factores que explican una disminución de la correlación, como el tamaño de las aurículas17. Cabe destacar que la evaluación histológica es el único método de referencia para la evaluación de la fibrosis auricular, pero no es viable en personas sanas. Por otro lado, la precisión del voltaje auricular para estimar la fibrosis auricular es dudosa. Es probable que los datos estructurales de la RMC y funcionales del MEA ofrezcan información complementaria sobre la remodelación auricular. Por último, el RTG se encuentra en áreas con fibrosis, pero también puede representar inflamación o porciones de origen embriológico venoso.
Fibrosis de la aurícula derecha y remodelación en la afección por fibrilación auricularEl papel esencial de la AI en el mantenimiento de la FA en la mayoría de los pacientes está ampliamente reconocido. Sin embargo, la AD también experimenta cambios notables y los datos de RMC12, tomografía computarizada18 y MEA19 indican una intensidad de remodelación similar en las 2 aurículas. En algunos casos, sin embargo, la AD podría ser especialmente relevante en la afección por FA y su tratamiento. Algunas afecciones superponen una presión excesiva y una sobrecarga de volumen en la AD20. Entre los pacientes con FA, aquellos con apnea obstructiva del sueño muestran menor velocidad de conducción, menor voltaje del electrograma y mayor complejidad en la AD que aquellos sin apnea del sueño; a pesar de ello, la remodelación electrofisiológica también es evidente en los pacientes con apnea del sueño9. En pacientes con defectos del tabique auricular sometidos a cierre, la disfunción de la AD es mejor predictor de FA nueva que los índices ecocardiográficos de la AI21. Esto también puede ser cierto en casos de cardiopatía congénita o arritmias reentrantes después de cirugía cardiaca, entre otros casos.
En general, se ha comunicado en algunos pacientes una «FA de origen derecho», caracterizada por ectopia de la AD y un gradiente de frecuencia dominante de derecha a izquierda22,23. La «FA derecha» se asocia con unas venas pulmonares, una AI y una orejuela izquierda más pequeñas, pero con una orejuela derecha más grande22. Estos datos ponen de manifiesto la necesidad de una mejor caracterización del sustrato biauricular en pacientes con FA. Nuestros resultados permitirán una caracterización más detallada y no invasiva de la fibrosis de la AD en pacientes con FA y, en especial, aquellos cuya AD podría tener un papel fisiopatológico principal.
Implicaciones clínicas de la evaluación de la fibrosis de la aurícula derechaLa fibrosis miocárdica es un rasgo característico de la afección por FA y su caracterización en la práctica clínica diaria puede tener importantes implicaciones preventivas, pronósticas y terapéuticas. La RMC-RTG ha surgido como una técnica potencialmente eficaz para evaluar de forma no invasiva la fibrosis auricular, con la mayoría de los esfuerzos centrados en la AI. Lamentablemente, son escasos los datos sobre un método optimizado para la cuantificación de la fibrosis de la AD, por lo que continúa poco explorada.
El estudio DECAAF demostró que la fibrosis de la AI preexistente detectada por RMC-RTG predice los resultados tras la ablación2, pero se desconoce si la caracterización de la fibrosis de la AD aporta información adicional. Se han encontrado focos extrapulmonares que confirman la FA en aproximadamente el 20% de los pacientes con FA e incluso el 35% de aquellos con FA permanente10. Los protocolos de ablación personalizados dirigidos a la fibrosis extrapulmonar en la AI se han investigado en ensayos clínicos aleatorizados. Los recientes estudios DECAAF II24 y ALICIA25 no han mostrado mejores resultados cuando se han ablacionado los parches de fibrosis. Sin embargo, la ablación de focos fuera de las venas pulmonares, que surgen de la vena cava superior e inferior, la cresta terminal, el foramen oval y el ostium del seno coronario10 pueden terminar con la FA en algunos pacientes. Se necesitan estudios específicos para establecer si la determinación de parches de fibrosis de la AD detectados con RMC-RTG servirá para personalizar las intervenciones de ablación.
Por último, el papel de la estimación de la fibrosis de la AI para identificar a las personas en alto riesgo de FA de nueva aparición continúa siendo una especulación, aunque respaldada por pequeños estudios26. Si se confirmara, los pacientes con «FA derecha» podrían beneficiarse de la estimación de la fibrosis de la AD. Las pruebas para estas aplicaciones potenciales precisa una metodología específica, optimizada y refinada para cuantificar la fibrosis de la AD; nuestros hallazgos son fundamentales a tal efecto.
LimitacionesHay que reconocer algunas limitaciones de nuestro trabajo. Aunque la normalización de la sangre tiene como objetivo compensar la variabilidad interindividual, otros parámetros pueden explicar la importante variabilidad en los análisis de correlación. La distancia entre electrodos, la colocación del catéter y la densidad del mapeo podrían no ser completamente comparables entre los grupos y podrían modificar los resultados. No se debe ignorar las inexactitudes técnicas. Los errores de registro en el MEA debido a la presión en la pared auricular o los movimientos cardiacos y respiratorios pueden producir cambios sutiles en la posición del catéter que podrían tener un importante impacto en los análisis de correlación. Los análisis de correlación se realizaron punto por punto en estructuras 3D; los métodos alternativos de aplanamiento27 o la reducción de la distancia de tolerancia del MEA a la RMC (es decir, 10mm en nuestro estudio) pueden producir correlaciones más precisas17.
La reproducibilidad externa de nuestros umbrales es fundamental para garantizar una amplia aplicación clínica de la evaluación de la fibrosis de la AD. Se utilizó una configuración de RMC de 3,0T, que produce un alto cociente señal/ruido, y mejora la resolución de la imagen. Los umbrales de la AI derivados previamente de imágenes de 3,0T13 se han validado recientemente en configuraciones de 1,5T28; se debe probar si pueden aplicarse umbrales de la AD en configuraciones de RMC de 1,5T. De manera similar, las imágenes se obtuvieron 20min después de la administración de gadolinio para obtener suficiente contraste de imágenes29; plazos más breves pueden generar diferentes umbrales. Por último, nuestros umbrales de la AD se obtuvieron con parámetros específicos (véase ) generalmente utilizados para la evaluación de la fibrosis de la AI, lo que permite el uso de una sola secuencia para la evaluación de la fibrosis de la AI y la AD; no se puede garantizar la validez con diferentes parámetros. Hace poco se han demostrado buenas reproducibilidades intraobservador e interobservadores, incluso en manos de cirujanos inexpertos30.
CONCLUSIONESEl umbral de la RII de la AD para determinar el tejido sano/fibrótico se estableció en 1,21, cerca del valor utilizado en la AI. La cuantificación de la fibrosis con RMC-RTG es factible y podría ser útil en ambas aurículas.
FINANCIACIÓNEste trabajo fue posible en parte gracias a una subvención del Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea, en virtud del acuerdo de subvención [n.o 633196] (proyecto CATCH ME); Instituto de Salud Carlos III [PI16/00435, PI19/00573]; Agència de Gestió d’Ajuts Universitaris i de Recerca [AGAUR, 2017 SGR 1548]; Fundació la Marató de TV3 [20152730]; Programa CERCA/Generalitat de Catalunya. El patrocinador no participó en el diseño del estudio, la recopilación de datos, el análisis o la interpretación de los resultados, la redacción del artículo o la decisión de publicarlo.
CONTRIBUCIÓN DE LOS AUTORESC. Gunturiz-Beltrán: conceptualización, metodología, validación, análisis formal, investigación, recursos, tratamiento de datos, redacción del borrador del original, revisión del borrador y edición, visualización. R. Borràs: metodología, software, análisis formal. F. Alarcón, P. Garre, R.M. Figueras i Ventura: metodología, software. E.M. Benito: conceptualización, metodología. G. Caixal, T.F. Althoff, J.M. Tolosana, E. Arbelo, I. Roca, J. Brugada: conceptualización, visualización. S. Prat-González, R.J. Perea: software, visualización. M. Sitges: conceptualización, visualización, validación. E. Guasch: conceptualización, metodología, validación, análisis formal, investigación, recursos, revisión del borrador y edición, visualización, supervisión. L. Mont: conceptualización, metodología, validación, recursos, revisión de borradores y edición, supervisión, administración del proyecto, obtención de fondos. E. Guasch y L. Mont comparten la autoría principal.
CONFLICTO DE INTERESESL. Mont ha recibido becas de investigación, apoyo de un programa de becas y honorarios como asesor y conferenciante de Abbott, Boston Scientific, Medtronic y Biosense, y es accionista de Galgo Medical S.L. M. Sitges ha recibido becas de investigación y honorarios como asesora y conferenciante de Abbott, Medtronic y Edwards Lifesciences. El resto de los autores declaran no tener conflictos de intereses.
- –
La fibrosis auricular es un factor decisivo en la patogénesis de la FA como parte de la remodelación estructural.
- –
La RMC-RTG permite la caracterización no invasiva de la fibrosis auricular y podría utilizarse para personalizar la ablación de la FA.
- –
La investigación se ha centrado en la determinación de la fibrosis en la AI, pero ningún estudio había evaluado antes la fibrosis de la aurícula derecha con la resonancia magnética. Esto limita nuestra capacidad de caracterizar de manera integral su contribución a la afección por FA.
- –
Umbrales que identifican la fibrosis de la AD en RMC-RTG: los valores de la RII por encima de 1,21 identifican la fibrosis auricular total (fibrosis intersticial y cicatriz densa si la hay) y los valores de la RII por encima de 1,29 diferencian la cicatriz densa de la fibrosis intersticial.
- –
Los valores de la RII para localizar la fibrosis miocárdica son similares en la AI y la AD.
- –
El voltaje bipolar endocárdico se correlaciona con la RII en la AD.









![Gráficos de cajas comparativos (mediana [intervalo intercuartílico]). A: voltaje bipolar (MEA) en áreas clasificadas como tejido sano, fibrosis intersticial y cicatriz densa por la RII (RMC). B: valores de la RII (RMC) en áreas clasificadas como tejido sano, fibrosis intersticial y cicatriz densa por el MEA. MEA: mapa electroanatómico; RII: razón de intensidad de imagen; RMC: resonancia magnética cardiaca. Gráficos de cajas comparativos (mediana [intervalo intercuartílico]). A: voltaje bipolar (MEA) en áreas clasificadas como tejido sano, fibrosis intersticial y cicatriz densa por la RII (RMC). B: valores de la RII (RMC) en áreas clasificadas como tejido sano, fibrosis intersticial y cicatriz densa por el MEA. MEA: mapa electroanatómico; RII: razón de intensidad de imagen; RMC: resonancia magnética cardiaca.](https://static.elsevier.es/multimedia/03008932/0000007600000003/v1_202302231900/S0300893222002494/v1_202302231900/es/main.assets/thumbnail/gr7.jpeg?xkr=eyJpdiI6IlgzSUUrTVQzdWMwdTQ5eXFmNzhhZ3c9PSIsInZhbHVlIjoiZzlCVlhpd0NaNGVKNzRLRG9KYmN1cnl0ZHJMU2sxMHpIZnMwTzd5TE5jTT0iLCJtYWMiOiJiODE0ZDk4ZDRkMDEyYmYxNTg5NDIyM2M2YjRiZGNlOGJkODgwNmFiNzliZDJkNTRlYzc4Y2IzMDk4NDI5MzlhIiwidGFnIjoiIn0=)