Se sabe que los factores relacionados con el paciente y con la intervención se asocian con insuficiencia aórtica después de un implante percutáneo de válvula aórtica. No obstante, también puede causarla una interacción específica entre el dispositivo y el huésped como consecuencia de las propiedades biomecánicas de las válvulas, con independencia de los factores clínicos. El objetivo de este estudio es esclarecer el papel de la geometría de la válvula en la aparición de insuficiencia aórtica después del implante de las válvulas Medtronic CoreValve® y Edwards SAPIEN®.
MétodosSe llevó a cabo un estudio observacional que incluyó a 134 pacientes tratados con implante percutáneo de válvula aórtica empleando las válvulas Medtronic CoreValve® y Edwards SAPIEN®. El análisis geométrico se realizó en tres niveles predefinidos de ambas válvulas mediante angiografía rotacional con compensación de movimiento usando un programa informático específicamente desarrollado para este fin. Se estableció una distinción entre los pacientes con insuficiencia aórtica nula o leve y los pacientes con insuficiencia aórtica moderada o grave según la ecocardiografía.
ResultadosLas características basales eran similares con ambas válvulas. A pesar del mayor uso de predilatación en el grupo de CoreValve® (el 95,2 frente al 82,0%; p=0,012), el mayor exceso de tamaño de prótesis/anillo aórtico (perímetro, el 114±7% frente al 103±7%; p<0,001) y la misma profundidad de implante (seno no coronario, 7±4 frente a 8±2mm; seno coronario izquierdo, 8±4 frente a 8±2mm), esta válvula tuvo menos expansión (el 83±7% frente al 92±4%; p<0,001) y fue más excéntrica (el 82±8% frente al 95±3%; p<0,001) que la válvula Edwards SAPIEN®, también tras introducir un ajuste de la excentricidad respecto a la excentricidad del anillo valvular del paciente (el 4±13% frente al 21±11%; p<0,001). La excentricidad y la excentricidad ajustada se asociaron con insuficiencia aórtica moderada o grave.
ConclusionesIndependientemente de los factores relacionados con el paciente y con la intervención, existe una interacción entre dispositivo y huésped que es específica del dispositivo y explica la insuficiencia aórtica existente después de un implante percutáneo de válvula aórtica.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) se usa cada vez más en pacientes con estenosis aórtica grave que tienen riesgo alto para una sustitución valvular quirúrgica; se ha demostrado que es una técnica segura y efectiva comparada con la sustitución de válvula aórtica en esos pacientes1–5. No obstante, es frecuente que se produzca insuficiencia aórtica (IA), que suele ser paravalvular. Es más común tras el implante del sistema autoexpandible Medtronic CoreValve® (MCS) que tras el empleo de la válvula expandible con balón Edwards SAPIEN® (ESV)6–8.
Se ha identificado que las variables relacionadas con el paciente y con la intervención, como la cantidad y la distribución de la calcificación de la raíz aórtica, las dimensiones del anillo valvular y la profundidad y el tamaño del implante, son factores determinantes de la IA después de TAVI9,10. No obstante, la IA puede ser consecuencia también de una interacción específica entre el dispositivo y el huésped a causa de las propiedades biomecánicas intrínsecas de las válvulas, que a su vez pueden afectar a la geometría y el grado de expansión y contribuir a que se produzca la IA. La evidencia derivada del análisis mediante tomografía computarizada multicorte (TCMC) en algunos pacientes seleccionados indica que la expansión no circular y la mala aposición son más frecuentes tras el implante del MCS que tras implantar ESV11–14. Para esclarecer mejor el papel que desempeñan la geometría de la estructura y el grado de expansión en relación con las variables relacionadas con el paciente y con la intervención asociadas a la IA, se ha incorporado el uso de la angiografía rotacional con un programa específicamente desarrollado para la reconstrucción de imágenes tridimensionales con compensación del movimiento inmediatamente después de TAVI15. El objetivo de este estudio es evaluar y comparar mediante angiografía rotacional los datos geométricos de MCS y ESV y su asociación con la IA.
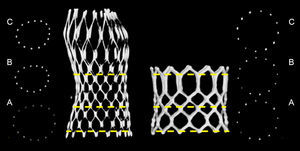
MÉTODOSPacientesSe llevó a cabo un estudio prospectivo observacional en una población formada por 150 pacientes consecutivos con estenosis aórtica grave sintomática tratados mediante TAVI con MCS o ESV, a los que se examinó con angiografía rotacional15. Solo se incluyó en el estudio a pacientes con un único implante valvular (es decir, se excluyó a los pacientes con una intervención de «válvula en válvula») en una válvula aórtica nativa (es decir, se excluyó a los pacientes con un fallo de bioprótesis) y con una calidad de imagen suficiente para la evaluación de la geometría de la estructura (grados 1, 2 o 3), aplicando la siguiente puntuación: grado 1, calidad de imagen excelente (struts visibles sin artefactos); grado 2, struts claramente visibles, es posible distinguir entre struts y artefactos; grado 3, struts visibles, pero en algunas regiones no se puede distinguir entre struts y artefactos; grado 4, degradado (los struts están borrosos y distorsionados), y grado 5, degradación intensa (los struts y los artefactos no se diferencian) (figura 1). Se excluyó del análisis a un total de 16 pacientes (MCS, 14; ESV, 2) debido a una calidad de imagen de grado 4 (8 pacientes) o 5 (8 pacientes). En consecuencia, la población total del estudio fue de 134 (MCS, 84; ESV, 50).
El TAVI se realizó en todos los pacientes con anestesia general a través de la arteria femoral o la subclavia o el ápex ventricular izquierdo, tras analizar el caso en el equipo cardiaco multidisciplinario (heart team). Se utilizó la TCMC para determinar el tamaño en todos los pacientes excepto 916. Primero se examinó a los pacientes en la clínica ambulatoria, y estos dieron su consentimiento informado por escrito para la obtención prospectiva de datos anonimizados, con fines de investigación clínica (proyecto TAVI Care and Cure, MEC-2014-277).
Angiografía rotacional, reconstrucción tridimensional y análisis geométrico de la estructuraLa angiografía rotacional se realizó inmediatamente después del TAVI con el sistema de fluoroscopia rotatoria Artis zee (Siemens Healthcare GmbH; Forchheim, Alemania) con un detector de 20 × 20cm y una longitud de píxel isotrópico de 180μm. Se realizó la adquisición de un total de 133 imágenes en 5 s, a lo largo de un arco de 198° (de la proyección oblicua anterior derecha de 99° a la proyección oblicua anterior izquierda de 99°) mientras el paciente aguantaba la respiración, con una dosis de entrada del detector de 0,36μm por marco.
Reconstrucción tridimensionalA partir de las imágenes de las proyecciones, se reconstruyó una imagen tridimensional con compensación del movimiento, mediante un prototipo de programa informático (Siemens Healthcare GmbH) con una matriz de 256 y 0,5mm3 de tamaño de vóxel, utilizando un procedimiento normalizado de trabajo15. De manera resumida, se realizó una reconstrucción sincronizada con el electrocardiograma utilizando la fase telediastólica (el 75% del ciclo cardiaco), ya que en ese momento es cuando teóricamente hay menos movimiento. El electrocardiograma se utilizó como referencia para realizar la compensación de movimiento. El conjunto del proceso requirió aproximadamente 5min. A continuación se procesó la reconstrucción tridimensional de la prótesis (p. ej., recorte) antes del análisis. Se utilizaron las imágenes de cortes transversales para el análisis de la geometría de la estructura.
Análisis de la geometría de la estructuraEl análisis de la geometría de la estructura se realizó en tres niveles predefinidos de ambas válvulas. Se midieron tres dimensiones de la MCS en la entrada (0mm), el nadir o parte inferior de los velos (a 12mm de la entrada) y la coaptación central de los velos (a 24mm de la entrada), según lo previamente descrito13. Se midieron tres dimensiones de la ESV en la entrada (0mm), en el segmento medio (al 50% en el caso de XT, en el tercer corte transversal en el caso de S3) (figura 2) y en la salida (arriba). En cada uno de estos niveles, se midió manualmente el diámetro mínimo (Dmín), el diámetro máximo (Dmáx), el área y el perímetro, utilizando el punto central del strut o los struts (figura 2).
El tamaño de la válvula con respecto al anillo aórtico nativo se definió dividiendo el tamaño nominal de la válvula por las medidas del anillo obtenidas en la TCMC (Dmín, Dmáx, Dmedio y perímetro) × 100 (%). Se calculó el grado de expansión de la prótesis dividiendo el perímetro medido por el perímetro nominal de ese nivel (perímetroestructura-medido/perímetroestructura-nominal), así como relacionando el grado de expansión con el perímetro del anillo (es decir, el grado de expansión ajustado) mediante el siguiente cálculo: perímetroválvula-medido/perímetroanillo. En el caso de la válvula MCS, se utilizaron los siguientes perímetros nominales: entrada, 72,3, 81,7, 91,1 y 97,4mm para 23, 26, 29 y 31mm respectivamente; nadir, 64,4, 75,4, 79,8 y 83,9mm para 23, 26, 29 y 31mm, y coaptación central, 68,8, 69,1, 72,6 y 76,3mm para 23, 26, 29 y 31mm (fuente: Medtronic Inc.; Minneapolis, Estados Unidos). En el caso de la ESV, se utilizó el perímetro nominal calculado de la entrada (es decir, π × Dnominal) en todos los niveles, dada la forma tubular que tiene la ESV. La excentricidad de la estructura se calculó mediante la fórmula Destructura-mín/Destructura-máx en todos los niveles. La excentricidad en el nadir (MCS) y en el segmento medio (ESV) se ajustó respecto a la excentricidad de la válvula nativa empleando la siguiente ecuación: (excentricidad en nadir o segmento medio – excentricidad de anillo nativo/excentricidad de anillo nativo) × 100. Esto se hizo porque esta es la parte de la estructura más próxima al anillo nativo.
Evaluación de la insuficiencia aórticaSe utilizó angiografía con contraste y ecocardiografía Doppler para evaluar la IA inmediatamente después del TAVI y al alta hospitalaria. Por lo que respecta a la angiografía con contraste, la gravedad de la IA se definió con la clasificación de Sellers (0=ninguna, 1=leve, 2=moderada, 3=moderada a grave y 4=grave)17. Para ello, se utilizó un protocolo de angiografía predefinido que consistía en la inyección de 20ml de iodixanol (VisipaqueTM) sin diluir, con una velocidad de flujo de 20ml/s, a través de un catéter pigtail de calibre 6 Fr colocado inmediatamente por encima de las valvas bioprotésicas. Se obtuvieron registros de cineangiografía a una velocidad de 30 cuadros/s. Dos evaluadores puntuaron las angiografías de manera independiente. En caso de discrepancia, se alcanzó un consenso mediante la participación de un tercer evaluador. La variabilidad intraevaluador e interevaluadores en la evaluación de la IA después del TAVI según la clasificación de Sellers fue κ=0,70 y κ=0,78 respectivamente. Se estableció una distinción entre los pacientes con grado 0-1 de Sellers y los que presentaban un grado 2-4 de Sellers.
Se realizó una ecocardiografía Doppler transtorácica antes del alta. La gravedad de la IA se definió según la extensión circunferencial de la señal Doppler en la entrada de la estructura de la MCS en el eje corto paraesternal, utilizando los criterios del VARC-2 (Valve Academic Research Consortium-2)18. Se dispuso de una ecocardiografía de calidad suficiente para evaluar la IA en 119 de los 134 pacientes (89%). Se estableció una distinción entre los pacientes sin IA o con IA leve (< 10%) y los que tenían una IA moderada o grave (10-29% y ≥ 30%).
Análisis estadísticoLas variables discretas se presentan en forma de frecuencias y porcentajes, y se comparan mediante la prueba de la χ2 de Pearson. La normalidad de la distribución de las variables continuas se evaluó con la prueba de Kolmogorov-Smirnov y, puesto que todas las variables estudiadas presentaron resultados con una distribución (casi) normal, se presentan en forma de media±desviación estándar y se comparan con la prueba de la t de Student. La variabilidad interobservadores se calculó con la correlación intraclase (). Los análisis estadísticos se llevaron a cabo con el programa SPSS versión 21.0 (IBM SPSS Statistics for Windows, Version 21.0; Armonk, Nueva York, Estados Unidos).
El análisis principal consistió en la comparación de la geometría de MCS y ESV. El análisis secundario consistió en la evaluación de la relación existente entre la geometría de la estructura de ambas válvulas y la IA. Se estableció una distinción entre la IA nula o leve (< 10%) y la IA moderada o grave (10-29% y ≥ 30%) en función de la proyección de eje corto del examen de ecocardiografía Doppler realizada antes del alta (criterios VARC-2)18.
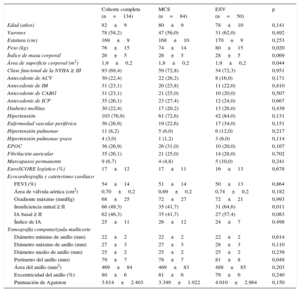
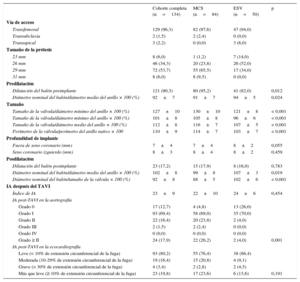
RESULTADOSLos datos clínicos basales y de la intervención de todos los pacientes y de los tratados con MCS o ESV se resumen en las tablas 1 y 2. En el análisis univariable, no hubo diferencias entre los pacientes tratados con MCS y con ESV, excepto por menor peso corporal (74±14 frente a 80±15kg; p=0,02), menor área de superficie corporal (1,8±0,2 frente a 1,9±0,2m2; p=0,044), menor prevalencia basal de insuficiencia mitral ≥ II (41,7 frente a 64,6%; p=0,021) y menor perímetro del anillo (78±7 frente a 81±8mm; p=0,049) en los pacientes tratados con MCS.
Características basales
| Cohorte completa (n=134) | MCS (n=84) | ESV (n=50) | p | |
|---|---|---|---|---|
| Edad (años) | 82±9 | 80±9 | 78±10 | 0,141 |
| Varones | 78 (58,2) | 47 (56,0) | 31 (62,0) | 0,492 |
| Estatura (cm) | 169±9 | 168±10 | 170±9 | 0,253 |
| Peso (kg) | 76±15 | 74±14 | 80±15 | 0,020 |
| Índice de masa corporal | 26±5 | 26±5 | 28±5 | 0,069 |
| Área de superficie corporal (m2) | 1,9±0,2 | 1,8±0,2 | 1,9±0,2 | 0,044 |
| Clase funcional de la NYHA ≥ III | 93 (69,4) | 59 (72,8) | 34 (72,3) | 0,951 |
| Antecedente de ACV | 30 (22,4) | 22 (26,2) | 8 (16,0) | 0,171 |
| Antecedente de IM | 31 (23,1) | 20 (23,8) | 11 (22,0) | 0,810 |
| Antecedente de CABG | 31 (23,1) | 21 (25,0) | 10 (20,0) | 0,507 |
| Antecedente de ICP | 35 (26,1) | 23 (27,4) | 12 (24,0) | 0,667 |
| Diabetes mellitus | 30 (22,4) | 17 (20,2) | 13 (26,0) | 0,439 |
| Hipertensión | 103 (76,9) | 61 (72,6) | 42 (84,0) | 0,131 |
| Enfermedad vascular periférica | 36 (26,9) | 19 (22,6) | 17 (34,0) | 0,151 |
| Hipertensión pulmonar | 11 (8,2) | 5 (6,0) | 6 (12,0) | 0,217 |
| Hipertensión pulmonar grave | 4 (3,0) | 1 (1,2) | 3 (6,0) | 0,114 |
| EPOC | 36 (26,9) | 26 (31,0) | 10 (20,0) | 0,167 |
| Fibrilación auricular | 35 (26,1) | 21 (25,0) | 14 (28,0) | 0,702 |
| Marcapasos permanente | 9 (6,7) | 4 (4,8) | 5 (10,0) | 0,241 |
| EuroSCORE logístico (%) | 17±12 | 17±11 | 16±13 | 0,678 |
| Ecocardiografía y cateterismo cardiaco | ||||
| FEVI (%) | 54±14 | 51±14 | 50±13 | 0,864 |
| Área de válvula aórtica (cm2) | 0,70±0,2 | 0,69±0,2 | 0,74±0,2 | 0,182 |
| Gradiente máximo (mmHg) | 68±25 | 72±27 | 72±21 | 0,993 |
| Insuficiencia mitral ≥ II | 66 (49,3) | 35 (41,7) | 31 (64,6) | 0,011 |
| IA basal ≥ II | 62 (46,3) | 35 (41,7) | 27 (57,4) | 0,083 |
| Índice de IA | 25±11 | 26±12 | 24±7 | 0,498 |
| Tomografía computarizada multicorte | ||||
| Diámetro mínimo de anillo (mm) | 22±2 | 22±2 | 22±2 | 0,614 |
| Diámetro máximo de anillo (mm) | 27±3 | 27±3 | 28±3 | 0,110 |
| Diámetro medio de anillo (mm) | 25±2 | 25±2 | 25±2 | 0,239 |
| Perímetro del anillo (mm) | 79±7 | 78±7 | 81±8 | 0,049 |
| Área del anillo (mm2) | 469±84 | 469±83 | 488±85 | 0,203 |
| Excentricidad del anillo (%) | 80±6 | 81±6 | 79±6 | 0,240 |
| Puntuación de Agatston | 3.614±2.403 | 3.349±1.922 | 4.010±2.964 | 0,150 |
ACV: accidente cerebrovascular; CABG: cirugía de revascularización aortocoronaria; EPOC: enfermedad pulmonar obstructiva crónica; ESV: válvula Edwards SAPIEN®; FEVI: fracción de eyección del ventrículo izquierdo; IA: insuficiencia aórtica; ICP: intervención coronaria percutánea; IM: infarto de miocardio; MCS: sistema Medtronic CoreValve®; NYHA: New York Heart Association.
Los datos expresan n (%) o media±desviación estándar.
Características de la intervención
| Cohorte completa (n=134) | MCS (n=84) | ESV (n=50) | p | |
|---|---|---|---|---|
| Vía de acceso | ||||
| Transfemoral | 129 (96,3) | 82 (97,6) | 47 (94,0) | |
| Transubclavia | 2 (1,5) | 2 (2,4) | 0 (0,0) | |
| Transapical | 3 (2,2) | 0 (0,0) | 3 (6,0) | |
| Tamaño de la prótesis | ||||
| 23 mm | 8 (6,0) | 1 (1,2) | 7 (14,0) | |
| 26 mm | 46 (34,3) | 20 (23,8) | 26 (52,0) | |
| 29 mm | 72 (53,7) | 55 (65,5) | 17 (34,0) | |
| 31 mm | 8 (6,0) | 8 (9,5) | 0 (0,0) | |
| Predilatación | ||||
| Dilatación del balón preimplante | 121 (90,3) | 80 (95,2) | 41 (82,0) | 0,012 |
| Diámetro nominal del balón/diámetro medio del anillo × 100 (%) | 92±7 | 91±7 | 94±5 | 0,024 |
| Tamaño | ||||
| Tamaño de la válvula/diámetro mínimo del anillo × 100 (%) | 127±10 | 130±10 | 121±8 | < 0,001 |
| Tamaño de la válvula/diámetro mínimo del anillo × 100 (%) | 101±8 | 105±8 | 96±6 | < 0,001 |
| Tamaño de la válvula/diámetro medio del anillo × 100 (%) | 112±8 | 116±7 | 107±5 | < 0,001 |
| Perímetro de la válvula/perímetro del anillo nativo × 100 | 110±9 | 114±7 | 103±7 | < 0,001 |
| Profundidad de implante | ||||
| Fuera de seno coronario (mm) | 7±4 | 7±4 | 8±2 | 0,055 |
| Seno coronario izquierdo (mm) | 8±3 | 8±4 | 8±2 | 0,459 |
| Posdilatación | ||||
| Dilatación del balón posimplante | 23 (17,2) | 15 (17,9) | 8 (16,0) | 0,783 |
| Diámetro nominal del balón/diámetro medio del anillo × 100 (%) | 102±8 | 99±8 | 107±3 | 0,019 |
| Diámetro nominal del balón/tamaño de la válvula × 100 (%) | 92±8 | 88±5 | 102±6 | < 0,001 |
| IA después del TAVI | ||||
| Índice de IA | 23±9 | 22±10 | 24±6 | 0,454 |
| IA post-TAVI en la aortografía | ||||
| Grado 0 | 17 (12,7) | 4 (4,8) | 13 (26,0) | |
| Grado I | 93 (69,4) | 58 (69,0) | 35 (70,0) | |
| Grado II | 22 (16,4) | 20 (23,8) | 2 (4,0) | |
| Grado III | 2 (1,5) | 2 (2,4) | 0 (0,0) | |
| Grado IV | 0 (0,0) | 0 (0,0) | 0 (0,0) | |
| Grado ≥ II | 24 (17,9) | 22 (26,2) | 2 (4,0) | 0,001 |
| IA post-TAVI en la ecocardiografía | ||||
| Leve (< 10% de extensión circunferencial de la fuga) | 93 (80,2) | 55 (76,4) | 38 (86,4) | |
| Moderada (10-29% de extensión circunferencial de la fuga) | 19 (16,4) | 15 (20,8) | 4 (9,1) | |
| Grave (> 30% de extensión circunferencial de la fuga) | 4 (3,4) | 2 (2,8) | 2 (4,5) | |
| Más que leve (≥ 10% de extensión circunferencial de la fuga) | 23 (19,8) | 17 (23,6) | 6 (13,6) | 0,191 |
ESV: válvula Edwards SAPIEN®; IA: insuficiencia aórtica; MCS: sistema Medtronic CoreValve®; TAVI: implante percutáneo de válvula aórtica.
Los datos expresan n (%) o media±desviación estándar.
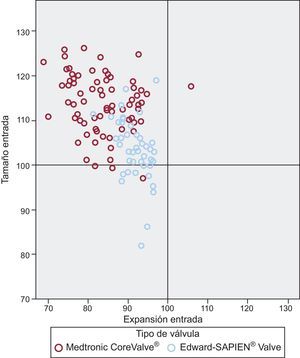
Por lo que respecta a la intervención, en los pacientes tratados con MCS se utilizó la predilatación con balón con mayor frecuencia que en los pacientes tratados con ESV (el 95,2 frente al 82,0%; p=0,012), aunque con un balón más pequeño que la medida del anillo del paciente (media de diámetro del balón/media de diámetro del anillo × 100 para MCS frente a ESV, el 91±7% frente al 94±5%; p=0,024), y además recibieron una válvula más grande respecto a todos los parámetros del anillo obtenidos en la TCMC, en comparación con los pacientes a los que se implantó ESV (MCS frente a ESV: Dmín, 130±10 frente a 121±8mm; p<0,001; Dmáx, 105±8 frente a 96±6mm; p<0,001; Dmedio, 116±7 frente a 107±5mm; p<0,001; perímetro, 114±7 frente a 103±7mm; p<0,001) (figura 3). Después del implante de la válvula, la profundidad de implante fue similar en los dos grupos, al igual que ocurrió con el uso de posdilatación (MCS frente a ESV, el 17,9 frente al 16%; p=0,783), aunque el balón utilizado para la posdilatación en el grupo de MCS fue más pequeño que el diámetro medio del anillo del paciente (99±8 frente a 107±3mm; p=0,019) y el tamaño nominal de la válvula (88±5 frente a 102±6mm; p<0,001).
Gráfico de dispersión de puntos de la relación entre el tamaño (perímetro valvular nominal/perímetro del anillo medido por tomografía computarizada multicorte × 100) y la expansión (perímetro medido de la válvula en la entrada/perímetro valvular nominal a nivel de la entrada × 100).
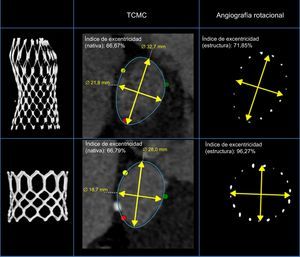
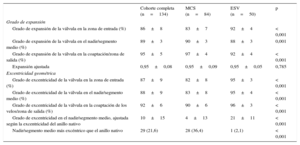
La información de la geometría de la estructura de las dos válvulas se resume en la tabla 3. El grado de expansión de MCS fue inferior en la entrada, en comparación con la ESV (83±7 frente a 92±4; p<0,001). Al relacionar el grado de expansión con el anillo del paciente (expansión ajustada), no se observaron diferencias entre las válvulas en la entrada ni en el nadir/segmento medio (MCS frente a ESV, 0,95±0,09 frente a 0,95±0,05 y 0,91±0,07 frente a 0,91±0,06, respectivamente) (tabla 3). MCS fue más elíptica que ESV en todos los niveles (entrada, 82±8 frente a 95±3; p<0,001; nadir/segmento medio, 83±8 frente a 95±4; p<0,001; coaptación/salida, 90±6 frente a 96±3; p<0,001). Lo mismo ocurrió en el caso de la excentricidad ajustada (MCS frente a ESV, 4±13 frente a 21±11; p<0,001), que fue más prevalente después del implante de MCS que tras ESV (el 36 frente al 2%; p<0,001) (figura 4).
Análisis de geometría mediante angiografía rotacional
| Cohorte completa (n=134) | MCS (n=84) | ESV (n=50) | p | |
|---|---|---|---|---|
| Grado de expansión | ||||
| Grado de expansión de la válvula en la zona de entrada (%) | 86±8 | 83±7 | 92±4 | < 0,001 |
| Grado de expansión de la válvula en el nadir/segmento medio (%) | 89±3 | 90±3 | 88±3 | 0,001 |
| Grado de expansión de la válvula en la coaptación/zona de salida (%) | 95±5 | 97±4 | 92±4 | < 0,001 |
| Expansión ajustada | 0,95±0,08 | 0,95±0,09 | 0,95±0,05 | 0,785 |
| Excentricidad geométrica | ||||
| Grado de excentricidad de la válvula en la zona de entrada (%) | 87±9 | 82±8 | 95±3 | < 0,001 |
| Grado de excentricidad de la válvula en el nadir/segmento medio (%) | 88±9 | 83±8 | 95±4 | < 0,001 |
| Grado de excentricidad de la válvula en la coaptación de los velos/zona de salida (%) | 92±6 | 90±6 | 96±3 | < 0,001 |
| Grado de excentricidad en el nadir/segmento medio, ajustada según la excentricidad del anillo nativo | 10±15 | 4±13 | 21±11 | < 0,001 |
| Nadir/segmento medio más excéntrico que el anillo nativo | 29 (21,6) | 28 (36,4) | 1 (2,1) | < 0,001 |
ESV: válvula Edwards SAPIEN®; MCS: sistema Medtronic CoreValve®.
Los datos expresan n (%) o media±desviación estándar.
Ejemplo de anillo aórtico de 2 pacientes con similares excentricidades del anillo (tomografía computarizada multicorte) tratados con la válvula Medtronic CoreValve® y la válvula Edwards SAPIEN®. Izquierda: imagen tridimensionalizada de la estructura implantada. Derecha: geometría de la estructura a nivel del nadir (Medtronic CoreValve®) y el segmento medio (Edwards SAPIEN®) en la angiografía rotacional después del implante percutáneo de válvula aórtica. Centro: vista transversal e índice de excentricidad de las válvulas Medtronic CoreValve® (arriba) y Edwards SAPIEN® (abajo) después del implante percutáneo de válvula aórtica. TCMC: tomografía computarizada multicorte.
Se realizó un análisis por separado de la ESV-XT y la ESV-S3, que se resume en las . A pesar del menor uso de predilatación con balón y el menor exceso de tamaño, se observó mayor grado de expansión de la S3 que en la XT y similar grado de circularidad, con tendencia a menor posdilatación.
Insuficiencia aórtica posimplante y antes del altaEn la angiografía con contraste, la prevalencia de la IA de grados 0-1 y 2-4 después del implante de MCS fue del 73,8 y el 26,2%, mientras que después del implante de ESV fue del 96 y el 4%. En la ecocardiografía realizada al alta, las prevalencias de IA nula o leve y moderada o grave fueron del 76,4 y el 23,6% después del implante de MCS y del 86,4 y el 13,6% después del implante de ESV (tabla 2). En la tabla 4 se resume la relación entre la geometría de la válvula y la IA después de TAVI (ecocardiografía al alta, VARC-2). La insuficiencia aórtica ≥ 10% se relacionó con el grado de expansión ajustado (cuanto menor la expansión, mayor la IA), así como con la excentricidad y la excentricidad ajustada de la estructura en el nadir (MCS)/segmento medio (ESV) y en la coaptación (MCS)/salida (ESV). Se observó una tendencia similar al analizar por separado a los pacientes a los que se implantó MCS o ESV, pero el tamaño muestral no permite extraer conclusiones firmes.
Relación entre la geometría y la insuficiencia aórtica en la ecocardiografía
| Población completa (n=119) | MCS (n=72) | ESV (n=47) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cohorte completa (n = 119) | < 10% (n = 96) | ≥ 10% (n = 23) | p | Cohorte completa (n = 72) | < 10% (n=55) | ≥ 10% (n=17) | p | Cohorte completa (n=47) | < 10% (n=41) | ≥ 10% (n=6) | p | |
| Grado de expansión | ||||||||||||
| Zona de entrada (%) | 87±7 | 87±7 | 84±9 | 0,113 | 83±7 | 84±7 | 81±8 | 0,260 | 92±4 | 92±4 | 93±4 | 0,480 |
| Nadir/segmento medio (%) | 89±4 | 89±4 | 90±4 | 0,509 | 90±4 | 90±4 | 90±4 | 0,897 | 88±3 | 88±3 | 89±5 | 0,446 |
| Coaptación de los velos/zona de salida (%) | 95±5 | 95±5 | 96±5 | 0,182 | 97±5 | 97±4 | 98±4 | 0,897 | 93±4 | 93±4 | 93±7 | 0,880 |
| Expansión ajustada | 0,95±0,07 | 0,95±0,07 | 0,92±0,08 | 0,049 | 0,95±0,08 | 0,95±0,08 | 0,92±0,08 | 0,131 | 0,94±0,05 | 0,95±0,04 | 0,92±0,09 | 0,181 |
| Grado de excentricidad | ||||||||||||
| Zona de entrada (%) | 87±9 | 87±9 | 84±9 | 0,167 | 81±8 | 81±8 | 81±7 | 0,734 | 95±3 | 96±3 | 95±3 | 0,715 |
| Nadir/segmento medio (%) | 88±9 | 89±9 | 84±9 | 0,015 | 83±8 | 84±8 | 81±9 | 0,220 | 95±4 | 95±3 | 91±6 | 0,019 |
| Coaptación de los velos/zona de salida (%) | 92±6 | 93±6 | 90±7 | 0,024 | 90±7 | 91±6 | 88±7 | 0,206 | 96±3 | 96±3 | 93±5 | 0,114 |
| Excentricidad ajustada | 10±15 | 12±14 | 3±16 | 0,010 | 3±11 | 4±12 | –1±9 | 0,101 | 20±11 | 21±9 | 17±20 | 0,472 |
| Geometría más excéntrica que la del anillo nativo | 25 (22,7) | 15 (16,9) | 10 (47,6) | 0,002 | 24 (36,9) | 15 (30,6) | 9 (56,2) | 0,065 | 1 (2,2) | 0 (0,0) | 1 (20,0) | 0,004 |
ESV: válvula Edwards SAPIEN®; MCS: sistema Medtronic CoreValve®.
Un valor negativo indica que la geometría es más elíptica que la del anillo nativo.
Los valores expresan n (%) o media±desviación estándar.
El principal resultado del presente estudio es que la estructura de la válvula MCS, autoexpandible, se expande menos en la zona de entrada y en general es más excéntrica que la de la ESV expandible con balón. Esto sucedía también cuando se corregía la excentricidad real respecto a la excentricidad del anillo del paciente, que se observó asociada con mayor prevalencia de IA tanto en la angiografía como en la ecocardiografía. Estos datos indican la existencia de una interacción entre dispositivo y huésped que es específica del dispositivo y se asocia a la IA después del TAVI.
Hay que reconocer que estos resultados se basan en un estudio observacional de pequeño tamaño muestral y una distribución desigual de los pacientes con una y otra válvula, además de la ausencia de asignación aleatorizada a una válvula o la otra, lo cual impide realizar una comparación directa de la morfología y la función valvulares. No obstante, no hay diferencias en las características basales, incluida la anatomía de la raíz aórtica, entre los pacientes tratados con MCS y con ESV. Es interesante señalar que la dilatación con balón antes del implante de la válvula se realizó con más frecuencia en los pacientes tratados con MCS (aunque con un balón de tamaño inferior respecto al anillo del paciente), además de un mayor grado de exceso de tamaño (tamaño de la válvula en relación con todas las medidas del anillo del paciente determinadas en la TCMC), en comparación con los pacientes tratados con ESV. Además, se observó mayor incidencia de IA ≥ 2 en la angiografía después del implante de MCS, pero sin diferencias entre las dos válvulas al utilizar la ecocardiografía. Esto puede explicarse por las diferencias intrínsecas existentes entre las dos técnicas en cuanto a la evaluación de la IA, además de su momento de aplicación (la angiografía inmediatamente después del TAVI, la ecocardiografía antes del alta). Además, el cambio puede haber desempeñado un papel, dada la distribución desigual de pacientes en la evaluación de la IA (MCS, 84; ESV, 50).
Los resultados clínicos actuales en pacientes con estenosis aórtica a los que se practica un TAVI se resaltan en el trabajo experimental de Tzamtzis et al19. En un estudio que utilizó un análisis de elementos finitos para investigar la fuerza radial de la MCS y la ESV-XT respecto a diferentes dimensiones y la rigidez del tracto de salida del ventrículo izquierdo, los autores observaron que la ESV tenía una fuerza radial mayor que la MCS para cualquier diámetro del tracto de salida del ventrículo izquierdo, con independencia de la rigidez de este19. Esto no resulta extraño, puesto que esta propiedad biomecánica es imprescindible para el implante seguro de la ESV, que se basa en la deformación del plástico y, por lo tanto, la estructura debe soportar las fuerzas de retracción del tracto de salida del ventrículo izquierdo tras desinflar el balón usado para el implante, con lo que se asegura la geometría y la función de la válvula. La menor fuerza radial de la MCS, autoexpandible, se pone de manifiesto en la observación clínica de que la calcificación de la raíz aórtica tuvo mayor poder de discriminación para predecir la dilatación con balón después del implante de la MCS que las dimensiones del anillo o el cociente prótesis/anillo12. Las diferencias en las propiedades biomecánicas pueden explicar también la diferencia actual y la anteriormente descrita en las excentricidades de MCS y ESV. En una serie de 30 pacientes, la expansión simétrica de MCS se observó tan solo en 5 (17%), mientras que se observó circularidad de la ESV en todos excepto 2 de los 89 pacientes (98%), y ello independientemente de la anatomía del anillo nativo13,14.
El conjunto de estos datos clínicos y experimentales confirma y explica por qué la estructura de la MCS se conforma a la geometría del anillo del paciente, mientras que la ESV dicta la geometría del anillo y su contribución a la aparición de la IA. La menor IA tras el implante de ESV se ha descrito de manera uniforme en diversos estudios observacionales y en un ensayo clínico aleatorizado en el que se comparó directamente la MCS con la ESV8–10. La cuestión es en qué medida interviene la interacción entre dispositivo y huésped en la IA después del TAVI, además de las variables relacionadas con el paciente y con la intervención, como la cantidad y la distribución del calcio, el tamaño y la profundidad del implante. El presente estudio no tuvo la potencia estadística suficiente para analizar la contribución de la IA en comparación con las mencionadas variables del paciente y de la intervención, debido a su tamaño muestral (es decir, la potencia estadística), pero también a causa de la distribución desigual de las características basales y de la intervención en los pacientes tratados con la MCS y la ESV. No obstante, una estructura con una fuerza radial suficiente elimina al menos uno de los componentes de la ecuación, para tratar de reducir la IA después del TAVI, como se observa con la ESV y los dispositivos de nueva generación20,21.
En este estudio, se utilizó la angiografía rotacional con compensación de movimiento para evaluar la geometría de la estructura empleando un prototipo de programa informático desarrollado específicamente para este fin, que se ha validado mediante TCMC15. La ventaja de la angiografía rotacional respecto a la TCMC es que está disponible online en el laboratorio de cateterismo o el quirófano híbrido. Actualmente no se sabe cómo ni cuándo incorporar esta información a la decisión de aplicar otras medidas terapéuticas adicionales, como la dilatación con balón adicional, aunque en unos pocos estudios clínicos se ha puesto de manifiesto esta posible aplicación y el beneficio que aporta22. Su necesidad puede verse cuestionada también por la introducción de nuevas tecnologías de TAVI más avanzadas que permitan una colocación y recolocación precisas, en caso necesario, para reducir e incluso eliminar la IA20–24. No obstante, los datos de este estudio indican la necesidad de incorporar la carga de calcio de la raíz aórtica a la matriz de determinación del tamaño, sobre todo cuando se emplea la MCS, y/o de aplicar una fuerza radial suficiente en el desarrollo de las futuras válvulas de implante percutáneo.
CONCLUSIONESLa angiografía rotacional es un método fácil, exacto y relativamente rápido de determinar la geometría de la estructura en el laboratorio de cateterismo. Después del implante de la MCS, la excentricidad de la estructura a la altura del anillo es frecuente y no se asocia necesariamente a un aumento de la IA, a menos que la excentricidad esté aumentada también respecto a la situación basal. Después del implante de la ESV, la circularidad es la norma y ello descarta una IA importante.
CONFLICTO DE INTERESESR. Rodríguez-Olivares disfruta de una subvención de la Sociedad Española de Cardiología. G. Lauritsch trabaja para Siemens Healthcare GmbH, Forchheim, Alemania.
Este trabajo ha recibido una subvención de la Sociedad Española de Cardiología.
Los conceptos y la información que se presentan en este artículo se basan en la investigación y no están disponibles comercialmente. Los nombres de productos y marcas a los que se hace referencia son propiedad de sus respectivos titulares.