La calcificación grave está presente en más del 50% de las oclusiones coronarias crónicas totales (OCT) tratadas mediante intervención percutánea. Nuestro objetivo fue describir el uso contemporáneo de los dispositivos de modificación de placa (DMP) en este contexto.
MétodosLos pacientes se incluyeron en el Registro Ibérico de OCT de forma prospectiva y consecutiva (32 centros de España y Portugal), de 2015 a 2020. Se compararon en función del uso o no de DMP.
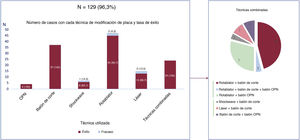
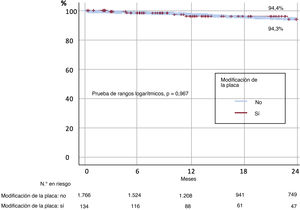
ResultadosSe incluyó a 2.235 pacientes, en 1.900 de los cuales se logró cruzar con éxito la lesión con guía. Se utilizó al menos un DMP en un 7% (134 pacientes) y más de uno en 24 pacientes (1%). Los DMP seleccionados fueron: aterectomía rotacional (35,1%), litotricia (5,2%), láser (11,2%), balones de corte (27,6%), balones OPN (2,9%) o combinaciones de más de uno (18%). Se utilizaron DMP en pacientes más ancianos, con mayor riesgo cardiovascular y puntuaciones Syntax y J-CTO más elevados. Esta mayor complejidad se asoció con procedimientos más prolongados, pero similar longitud total de stent (52 frente a 57mm; p=0,105). Cuando la guía cruzó con éxito la oclusión, la tasa de éxito final del procedimiento fue del 87,2%, pero se incrementó al 96,3% cuando se utilizaron DMP (p=0,001). Por el contrario, los DMP no se asociaron con mayor tasa de complicaciones en el procedimiento (3,7 frente a 3,2%; p=0,615). Pese al peor perfil de riesgo basal, a los 2 años de seguimiento no hubo diferencias en la tasa de supervivencia (94,3% DPM frente a no-DMP: 94,3% no-DPM, respectivamente, p=0,967).
ConclusionesCuando la guía cruzó con éxito una OCT, la tasa de uso de los DMP fue del 7% y se asoció a una tasa de éxito final del procedimiento significativamente mayor. Los resultados a medio plazo fueron comparables cuando se precisaron DMP pese a su mayor riesgo basal, lo que sugiere que un mayor uso adecuado de estas técnicas en este contexto podría conllevar tanto beneficios técnicos como pronósticos.
Palabras clave
Las oclusiones coronarias crónicas totales (OCT) suelen definirse como una oclusión ateroesclerótica completa de un vaso con un flujo TIMI (Thrombolysis in Myocardial Infarction) de grado 0 por más de 3 meses1. Su prevalencia oscila entre el 33 y el 52% de los pacientes con cardiopatía isquémica y su fisiopatología sigue siendo objeto de investigación. Se sabe que los segmentos ocluidos contienen tejido vascular, infiltrado linfocítico, tejido fibroso, ateroma y un grado variable de calcificación. De hecho, la ateroesclerosis calcificada es la culminación de distintos procesos patológicos que se superponen y probablemente sean causa y consecuencia de la enfermedad cardiovascular, lo que explica que se la considere un factor de riesgo cardiovascular independiente2,3. Además, el análisis de las pruebas de diagnóstico por imagen ha demostrado que las fases tardías de las OCT se relacionan con mayor calcificación focal y realce dentro de la oclusión4, con fragmentos de calcio más grandes que se depositan en láminas gruesas (> 3mm)5. Por lo tanto, en estas oclusiones crónicas tan calcificadas, puede ser útil recurrir a los dispositivos de modificación de placa (DMP). Hay pocas pruebas que respalden su uso o expliquen los riesgos concretos de los DMP en las intervenciones de OCT. Además, en los últimos años han aparecido nuevos DMP6.
Así pues, el objetivo es describir en un estudio a gran escala el actual empleo de dispositivos especializados en las OCT muy calcificadas y comparar los resultados a corto y largo plazo de los pacientes que requirieron estas técnicas con los que no.
MÉTODOSPoblación del estudioSe incluyó en el Registro Ibérico de OCT de manera prospectiva a los pacientes consecutivos sometidos a angioplastia por una OCT. Un total de 32 centros de España y Portugal participaron en este registro entre 2015 y 2020, pero se incluyeron en el estudio solo los centros que registraron información sobre las técnicas de modificación de placa (n=17) (). Como resultado, se incluyó a un total de 2.235 pacientes; el análisis se centró en las lesiones que la guía cruzó con éxito (n=1.900) según se utilizaran DMP (n=134, 7%) o no (n=1.766, 93%). Un operador experto, definido como una experiencia ≥ 50 intervenciones de OCT y con formación específica en intervenciones de OCT, fue el primer operador en todos los pacientes. Se consideró que la intervención era satisfactoria con un flujo TIMI final de grado 3 con menos del 30% de estenosis residual y sin complicaciones de riesgo vital. Los resultados hospitalarios y del seguimiento se cumplimentaron en la base de datos en línea según criterios predefinidos () y se cumplieron los requisitos de la Ley sobre protección de datos; la base es accesible a los operadores participantes y los coordinadores del registro. En la base de datos, se definió calcificación grave como radiopacidades fijas observadas durante el ciclo cardiaco antes de inyectar el contraste y calcificación moderada, como radiopacidades observadas solo durante el ciclo cardiaco, aunque esta definición variaba si la cantidad de calcio observada en la ecografía intravascular era mayor que la observada mediante angiografía3. Después de cada intervención coronaria percutánea (ICP), se llevó a cabo la seriación de los biomarcadores electrocardiográficos y cardiacos. La evaluación clínica se hizo tras 1, 6 y 12 meses, y anualmente a partir de entonces o hasta el final del seguimiento. Solo se hizo seguimiento angiográfico de los pacientes con nuevos síntomas, empeoramiento de la función ventricular o nueva isquemia en las pruebas no invasivas. El registro cuenta con el respaldo de la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología. Todos los comités de ética locales aprobaron el estudio y los pacientes facilitaron el consentimiento informado.
DispositivosLos DMP pueden clasificarse en técnicas con balón (A) y sin balón (B)7. Los DMP con balón son: balones de muy alta presión no distensibles (OPN), balones de corte (Wolverine, Boston Scientific, Estados Unidos), balones de incisión (AngioSculpt, Cardiva, España; Scoreflex, OrbusNeich, Estados Unidos; NSE Alpha, Braun, Alemania) y balones de litotricia intracoronaria (Shockwave Medical Lithoplasty System, Shockwave Medical, Estados Unidos). Las técnicas sin balón (técnicas de reducción de volumen de placa o debulking) son: aterectomía rotacional (Rotablator, rotaPro, Boston Scientific, Estados Unidos), aterectomía orbital (Diamondback 360, OrbusNeich) y aterectomía con láser excimer (CVX-300, Philips, Reino Unido)8. Se consideró éxito del dispositivo que se pudiera cruzar la OCT y colocar un stent con un flujo TIMI 3 y una estenosis residual <30%. En la se resumen los principales dispositivos9–21.
Análisis estadísticoLas variables categóricas se expresan en frecuencias y las comparaciones entre grupos se hicieron con la prueba de la χ2 o la prueba exacta de Fisher. Las variables continuas se expresan en media±desviación estándar o mediana [intervalo intercuartílico] y se analizaron con la prueba de la t de Student o la prueba de la U de Mann-Whitney. Se hizo un análisis de regresión de Cox multivariable y estratificado por hospitales para determinar las variables independientes de la mortalidad a los 2 años en el conjunto de la población del estudio. Para evitar el sobreajuste, en el modelo solo se introdujo 1 variable cada 10 eventos del objetivo. Se verificaron los supuestos de riesgos proporcionales con la prueba de residuos de Schoenfeld y se comprobaron con gráficos de supervivencia logarítmica. Aunque la variable modificación de la placa no fue significativa, se incluyó en el modelo final para proporcionar datos ajustados por múltiples variables sobre el efecto o la ausencia de efecto de los DMP en la mortalidad. Para el modelo final, se calcularon los cocientes de riesgos instantáneos (hazard ratio [HR]) ajustados para cada una de las variables incluidas, junto con su intervalo de confianza del 95% (IC95%). Se utilizó el estimador robusto de Huber/White/Sandwich para calcular los errores estándar. Se determinó la bondad de ajuste del modelo final con la prueba de Gronnesby y Borgan, la puntuación de Brier y el índice C. Todas las pruebas fueron de 2 colas y con un nivel de significación de 0,05. Se estimaron las curvas de supervivencia. Se hizo el análisis estadístico con el programa estadístico de IBM SPSS Statistics, versión 25 (IBM, Estados Unidos) y el paquete estadístico R (2019, R Foundation for Statistical Computing, Austria).
RESULTADOSSe incluyó a un total de 2.235 pacientes consecutivos del Registro Ibérico de OCT. Se consiguió cruzar la guía en 1.900 pacientes; se utilizó 1 DMP en 134 pacientes (7%) y más de 1 en 24 (1%).
Características basales según los dispositivos de modificación de placa utilizadosEn la tabla 1 se resumen las principales características basales. La mayoría de los pacientes en quienes el cruce de la guía fue satisfactorio eran varones (83,8%) y la media de edad, 65,2 años. Se observó angina de pecho grave en el 40,2% de los pacientes y disnea (clase III o IV) en el 49,1%. La mayoría de los pacientes sufrían enfermedad coronaria previa (57,2%) tratada mediante intervención percutánea (48,3%) o quirúrgica (5,9%). Además, al 11,8% de ellos ya se les había practicado un intento de revascularización de la OCT.
Principales características basales
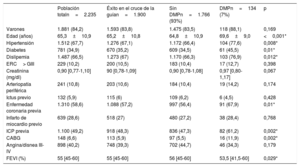
| Población totaln=2.235 | Éxito en el cruce de la guían=1.900 | Sin DMPn=1.766 (93%) | DMPn=134 (7%) | p | |
|---|---|---|---|---|---|
| Varones | 1.881 (84,2) | 1.593 (83,8) | 1.475 (83,5) | 118 (88,1) | 0,169 |
| Edad (años) | 65,3±10,9 | 65,2±10,8 | 64,8±10,9 | 69,6±9,0 | <0,001* |
| Hipertensión | 1.512 (67,7) | 1.276 (67,1) | 1.172 (66,4) | 104 (77,6) | 0,008* |
| Diabetes | 781 (34,9) | 670 (35,2) | 609 (34,5) | 61 (45,5) | 0,01* |
| Dislipemia | 1.487 (66,5) | 1.273 (67) | 1.170 (66,3) | 103 (76,9) | 0,012* |
| ERC> GIII | 229 (10,2) | 200 (10,5) | 183 (10,4) | 17 (12,7) | 0,398 |
| Creatinina (mg/dl) | 0,90 [0,77-1,10] | 90 [0,78-1,09] | 0,90 [0,78-1,08] | 0,97 [0,80-1,17] | 0,067 |
| Arteriopatía periférica | 241 (10,8) | 203 (10,6) | 184 (10,4) | 19 (14,2) | 0,174 |
| Ictus previo | 132 (5,9) | 115 (6) | 109 (6,2) | 6 (4,5) | 0,428 |
| Enfermedad coronaria previa | 1.310 (58,6) | 1.088 (57,2) | 997 (56,4) | 91 (67,9) | 0,01* |
| Infarto de miocardio previo | 639 (28,6) | 518 (27) | 480 (27,2) | 38 (28,4) | 0,768 |
| ICP previa | 1.100 (49,2) | 918 (48,3) | 836 (47,3) | 82 (61,2) | 0,002* |
| CABG | 148 (6,6) | 113 (5,9) | 97 (5,5) | 16 (11,9) | 0,002* |
| Angina/disnea III-IV | 898 (40,2) | 748 (39,3) | 702 (44,7) | 46 (34,3) | 0,179 |
| FEVI (%) | 55 [45-60] | 55 [45-60] | 56 [45-60] | 53,5 [41,5-60] | 0,029* |
CABG: cirugía de revascularización coronaria; DMP: dispositivos de modificación de la placa; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Cuando se comparó a los pacientes según las técnicas de modificación de placa utilizadas, se observó que los dispositivos especializados se usaban más en pacientes mayores (69,6±9,0 frente a 64,8±10,9 años; p <0,001) y con mayor tasa de factores de riesgo cardiovascular. Además, era más frecuente que hubieran sufrido enfermedad coronaria (el 67,9 frente al 56,4%; p=0,010), tanto por vía quirúrgica (el 11,9 frente al 5,5%; p=0,020) como percutánea (el 61,2 frente al 47,3%; p=0,002). En particular, la enfermedad del tronco coronario izquierdo fue más frecuente en el grupo tratado con DMP (el 10,4 frente al 5,1%; p=0,009) y su complejidad se reflejó con una mayor puntuación Syntax (el 23 frente al 18%; p=0,001) (tabla 2). Por último, el grupo tratado con DMP mostró peor fracción de eyección del ventrículo izquierdo (el 56 frente al 53,5%; p=0,029).
Características angiográficas y de la intervención
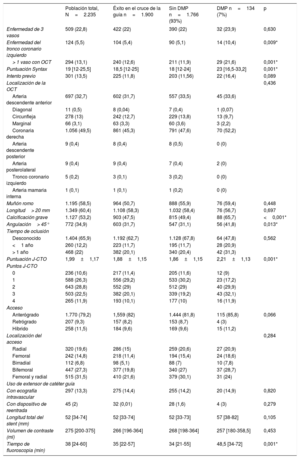
| Población total, N=2.235 | Éxito en el cruce de la guía n=1.900 | Sin DMP n=1.766 (93%) | DMP n=134 (7%) | p | |
|---|---|---|---|---|---|
| Enfermedad de 3 vasos | 509 (22,8) | 422 (22) | 390 (22) | 32 (23,9) | 0,630 |
| Enfermedad del tronco coronario izquierdo | 124 (5,5) | 104 (5,4) | 90 (5,1) | 14 (10,4) | 0,009* |
| > 1 vaso con OCT | 294 (13,1) | 240 (12,6) | 211 (11,9) | 29 (21,6) | 0,001* |
| Puntuación Syntax | 19 [12-25,5] | 18,5 [12-25] | 18 [12-24] | 23 [16,5-33,2] | 0,001* |
| Intento previo | 301 (13,5) | 225 (11,8) | 203 (11,56) | 22 (16,4) | 0,089 |
| Localización de la OCT | 0,436 | ||||
| Arteria descendente anterior | 697 (32,7) | 602 (31,7) | 557 (33,5) | 45 (33,6) | |
| Diagonal | 11 (0,5) | 8 (0,04) | 7 (0,4) | 1 (0,07) | |
| Circunfleja | 278 (13) | 242 (12,7) | 229 (13,8) | 13 (9,7) | |
| Marginal | 66 (3,1) | 63 (3,3) | 60 (3,6) | 3 (2,2) | |
| Coronaria derecha | 1.056 (49,5) | 861 (45,3) | 791 (47,6) | 70 (52,2) | |
| Arteria descendente posterior | 9 (0,4) | 8 (0,4) | 8 (0,5) | 0 (0) | |
| Arteria posterolateral | 9 (0,4) | 9 (0,4) | 7 (0,4) | 2 (0) | |
| Tronco coronario izquierdo | 5 (0,2) | 3 (0,1) | 3 (0,2) | 0 (0) | |
| Arteria mamaria interna | 1 (0,1) | 1 (0,1) | 1 (0,2) | 0 (0) | |
| Muñón romo | 1.195 (58,5) | 964 (50,7) | 888 (55,9) | 76 (59,4) | 0,448 |
| Longitud> 20 mm | 1.349 (60,4) | 1.108 (58,3) | 1.032 (58,4) | 76 (56,7) | 0,697 |
| Calcificación grave | 1.127 (53,2) | 903 (47,5) | 815 (49,4) | 88 (65,7) | <0,001* |
| Angulación> 45° | 772 (34,9) | 603 (31,7) | 547 (31,1) | 56 (41,8) | 0,013* |
| Tiempo de oclusión | |||||
| Desconocido | 1.404 (65,9) | 1.192 (62,7) | 1.128 (67,8) | 64 (47,8) | 0,562 |
| <1 año | 260 (12,2) | 223 (11,7) | 195 (11,7) | 28 (20,9) | |
| > 1 año | 468 (22) | 382 (20,1) | 340 (20,4) | 42 (31,3) | |
| Puntuación J-CTO | 1,99±1,17 | 1,88±1,15 | 1,86±1,15 | 2,21±1,13 | 0,001* |
| Puntos J-CTO | |||||
| 0 | 236 (10,6) | 217 (11,4) | 205 (11,6) | 12 (9) | |
| 1 | 588 (26,3) | 556 (29,2) | 533 (30,2) | 23 (17,2) | |
| 2 | 643 (28,8) | 552 (29) | 512 (29) | 40 (29,9) | |
| 3 | 503 (22,5) | 382 (20,1) | 339 (19,2) | 43 (32,1) | |
| 4 | 265 (11,9) | 193 (10,1) | 177 (10) | 16 (11,9) | |
| Acceso | |||||
| Anterógrado | 1.770 (79,2) | 1,559 (82) | 1.444 (81,8) | 115 (85,8) | 0,066 |
| Retrógrado | 207 (9,3) | 157 (8,2) | 153 (8,7) | 4 (3) | |
| Híbrido | 258 (11,5) | 184 (9,6) | 169 (9,6) | 15 (11,2) | |
| Localización del acceso | 0,284 | ||||
| Radial | 320 (19,6) | 286 (15) | 259 (20,6) | 27 (20,9) | |
| Femoral | 242 (14,8) | 218 (11,4) | 194 (15,4) | 24 (18,6) | |
| Birradial | 112 (6,8) | 98 (5,1) | 88 (7) | 10 (7,8) | |
| Bifemoral | 447 (27,3) | 377 (19,8) | 340 (27) | 37 (28,7) | |
| Femoral y radial | 515 (31,5) | 410 (21,6) | 379 (30,1) | 31 (24) | |
| Uso de extensor de catéter guía | |||||
| Con ecografía intravascular | 297 (13,3) | 275 (14,4) | 255 (14,2) | 20 (14,9) | 0,820 |
| Con dispositivo de reentrada | 45 (2) | 32 (0,01) | 28 (1,6) | 4 (3) | 0,279 |
| Longitud total del stent (mm) | 52 [34-74] | 52 [33-74] | 52 [33-73] | 57 [38-82] | 0,105 |
| Volumen de contraste (ml) | 275 [200-375] | 266 [196-364] | 268 [198-364] | 257 [180-358,5] | 0,453 |
| Tiempo de fluoroscopia (min) | 38 [24-60] | 35 [22-57] | 34 [21-55] | 48,5 [34-72] | 0,001* |
DMP: dispositivos de modificación de placa; OCT: oclusión crónica total.
Forma roma de la entrada: segmento ocluido que no termina en forma de embudo. Calcificación grave: radiopacidades alrededor de la oclusión observadas sin movimiento cardiaco antes de inyectar el contraste.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
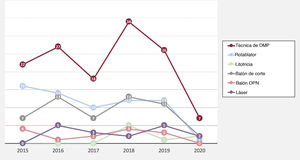
En la tabla 2 se muestran las principales observaciones del procedimiento inicial del conjunto de la población en estudio según se utilizaran DMP. En general, a los pacientes en quienes la guía cruzó con éxito se los trató más a menudo mediante acceso simultáneo femoral y radial (21,6%) y por acceso anterógrado (82%), lo que fue mucho más frecuente cuando se utilizaron DMP. La arteria coronaria derecha fue el vaso tratado con mayor frecuencia (49,3%), seguida de la arteria descendente anterior izquierda (31,7%) y la arteria circunfleja (12,7%), sin ninguna diferencia entre los grupos con y sin DMP. La puntuación J-CTO fue mayor cuando se requirieron DMP (2,21 frente a 1,86; p=0,001), principalmente por el mayor grado de calcificación, la mayor tasa de intentos previos y la antigüedad de la OCT, pero también se observó una tendencia a mayor tortuosidad del vaso afectado en el grupo tratado con DMP. Esta mayor complejidad se relacionó con más tiempo de radioscopia (34 frente a 48,5min; p=0,001), aunque no tuvo un impacto significativo en la cantidad de contraste (268 frente a 257 ml; p=0,453) o la longitud total del stent (57 frente a 52mm; p=0,105). Los DMP seleccionados fueron los siguientes: aterectomía rotacional (35,1%), litotricia (5,2%), láser (11,2%), balones de corte (27,6%), balones OPN (2,9%) o una combinación de DMP (18%). Hay que tener en cuenta que los resultados se comunican por paciente, pero en algunos de ellos se utilizó cada técnica en más de una lesión. La tendencia temporal a una mayor práctica de la aterectomía rotacional persistió durante el periodo del estudio a pesar de la aparición de nuevas alternativas, tal como se representa en la figura 1. En esta misma figura también se observa en 2020 una disminución sustancial del número de intervenciones realizadas durante la pandemia de la COVID-19. Cabe destacar que la aterectomía rotacional se utilizó como estrategia de rescate de lesiones no dilatables en el 75,4% de las lesiones, mientras que en el resto de los casos se seleccionó como primera estrategia. Por el contrario, la litotricia y el láser se eligieron como estrategia de rescate en todos los casos. Las estrategias de reducción del volumen de placa o debulking —como la aterectomía rotacional y el láser— se utilizaron mucho menos en los centros con menor volumen de pacientes ().
Tal como se muestra en la tabla 3, la tasa de éxito de la intervención fue del 75% de la población general y el 87,2% de los pacientes en quienes la guía cruzó con éxito, aunque aumentó hasta el 96,3% cuando se utilizó un DMP (frente al 86,6% alcanzado cuando no se utilizó; p=0,001). En particular, como se muestra en la figura 2, los balones OPN y los balones de corte se relacionaron con una tasa de éxito del 100%, mientras que en el caso de la litotricia la tasa de éxito fue menor que con otras alternativas de modificación de la placa (el 85,7 frente al 95,7% con todos los demás dispositivos; p=0,999). La tasa de éxito de la rotablación fue del 95,7% y la del láser, del 86,7%. Cualquier combinación de DMP (rotablación y otro DMP en el 79,2%) se relacionó con una tasa de éxito técnico del 100%. El empleo de DMP no se relacionó con una mayor tasa de complicaciones en el procedimiento (el 3,7 frente al 3,2%; p=0,615), como perforación coronaria/taponamiento, muerte o ictus periprocedimiento.
Resultados quirúrgicos hospitalarios y a largo plazo
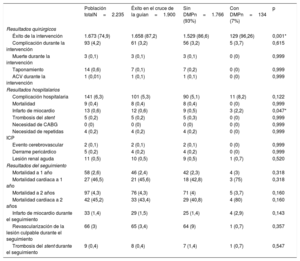
| Población totalN=2.235 | Éxito en el cruce de la guían=1.900 | Sin DMPn=1.766 (93%) | Con DMPn=134 (7%) | p | |
|---|---|---|---|---|---|
| Resultados quirúrgicos | |||||
| Éxito de la intervención | 1.673 (74,9) | 1.658 (87,2) | 1.529 (86,6) | 129 (96,26) | 0,001* |
| Complicación durante la intervención | 93 (4,2) | 61 (3,2) | 56 (3,2) | 5 (3,7) | 0,615 |
| Muerte durante la intervención | 3 (0,1) | 3 (0,1) | 3 (0,1) | 0 (0) | 0,999 |
| Taponamiento | 14 (0,6) | 7 (0,1) | 7 (0,2) | 0 (0) | 0,999 |
| ACV durante la intervención | 1 (0,01) | 1 (0,1) | 1 (0,1) | 0 (0) | 0,999 |
| Resultados hospitalarios | |||||
| Complicación hospitalaria | 141 (6,3) | 101 (5,3) | 90 (5,1) | 11 (8,2) | 0,122 |
| Mortalidad | 9 (0,4) | 8 (0,4) | 8 (0,4) | 0 (0) | 0,999 |
| Infarto de miocardio | 13 (0,6) | 12 (0,6) | 9 (0,5) | 3 (2,2) | 0,047* |
| Trombosis del stent | 5 (0,2) | 5 (0,2) | 5 (0,3) | 0 (0) | 0,999 |
| Necesidad de CABG | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0,999 |
| Necesidad de repetidas ICP | 4 (0,2) | 4 (0,2) | 4 (0,2) | 0 (0) | 0,999 |
| Evento cerebrovascular | 2 (0,1) | 2 (0,1) | 2 (0,1) | 0 (0) | 0,999 |
| Derrame pericárdico | 5 (0,2) | 4 (0,2) | 4 (0,2) | 0 (0) | 0,999 |
| Lesión renal aguda | 11 (0,5) | 10 (0,5) | 9 (0,5) | 1 (0,7) | 0,520 |
| Resultados del seguimiento | |||||
| Mortalidad a 1 año | 58 (2,6) | 46 (2,4) | 42 (2,3) | 4 (3) | 0,318 |
| Mortalidad cardiaca a 1 año | 27 (46,5) | 21 (45,6) | 18 (42,8) | 3 (75) | 0,318 |
| Mortalidad a 2 años | 97 (4,3) | 76 (4,3) | 71 (4) | 5 (3,7) | 0,160 |
| Mortalidad cardiaca a 2 años | 42 (45,2) | 33 (43,4) | 29 (40,8) | 4 (80) | 0,160 |
| Infarto de miocardio durante el seguimiento | 33 (1,4) | 29 (1,5) | 25 (1,4) | 4 (2,9) | 0,143 |
| Revascularización de la lesión culpable durante el seguimiento | 66 (3) | 65 (3,4) | 64 (9) | 1 (0,7) | 0,357 |
| Trombosis del stent durante el seguimiento | 9 (0,4) | 8 (0,4) | 7 (1,4) | 1 (0,7) | 0,547 |
ACV: accidente cerebrovascular; CABG: cirugía de revascularización coronaria; DMP: dispositivos de modificación de la placa; ICP: intervención coronaria percutánea.
Los valores expresan n (%).
En la tabla 3 se muestran las complicaciones y la mortalidad. La complicaciones hospitalarias fueron comparables independientemente de que se utilizaran DMP, incluida la necesidad de cirugía de revascularización coronaria (0%) o una nueva ICP del vaso afectado (0.2%), los accidentes cerebrovasculares (0,1%), el taponamiento cardiaco (0,6%), la nefropatía inducida por el contraste (0,5%) o la mortalidad hospitalaria (0,4%). Solo el infarto de miocardio periintervención fue más probable tras utilizar un DMP (el 2,2 frente al 0,5%; p=0,047), pero no se relacionó con ninguna diferencia en la tasa de trombosis aguda del stent (el 0 frente al 0,3%; p=0,999).
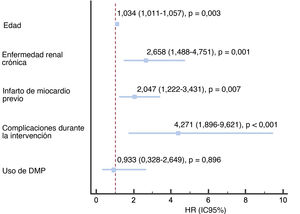
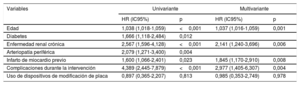
A los 2 años de seguimiento no se observaron diferencias en la supervivencia según se utilizaran DMP o no (el 96,3 frente al 96%; p=0,160) (figura 3), y la mortalidad total fue del 4,3%, principalmente por causas no cardiovasculares (56,6%). En la tabla 4 se resumen los principales factores relacionados con una mayor mortalidad total y en la figura 4 y la tabla 5 se representan las variables independientes de la mortalidad, incluidas la edad, la enfermedad renal crónica, la existencia previa de infarto de miocardio y las complicaciones del procedimiento, pero no el uso de cualquiera de los DMP incluidos en este estudio o el centro donde se realizó. Además, pese al peor perfil inicial de los pacientes que requieren DMP, la mortalidad fue comparable.
Predictores de la mortalidad a 2 años
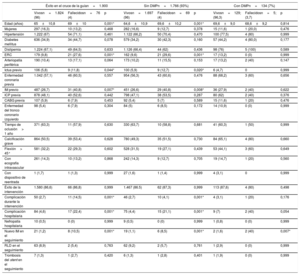
| Éxito en el cruce de la guían=1.900 | Sin DMPn=1.766 (93%) | Con DMPn=134 (7%) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Vivosn=1.824 (96) | Fallecidosn=76 (4) | p | Vivosn=1.697 (96) | Fallecidosn=69 (4) | p | Vivosn=129; (96,3) | Fallecidosn=5; (3,7) | p | |
| Edad (años) | 65±10,8 | 69±10 | 0,001* | 64,6±10,9 | 69,6±10,2 | 0,001* | 69,6±9,0 | 68,6±9,2 | 0,814 |
| Mujeres | 297 (16,3) | 10 (13,2) | 0,468 | 282 (16,6) | 9 (12,7) | 0,378 | 15 (11,6) | 1 (20,0) | 0,476 |
| Hipertensión | 1.222 (67) | 54 (71,1) | 0,461 | 1.122 (66,2) | 50 (70,4) | 0,470 | 100 (77,5) | 4 (80) | 0,999 |
| Diabetes mellitus | 636 (34,9) | 34 (44,7) | 0,078 | 579 (34,2) | 30 (42,3) | 0,160 | 57 (44,2) | 4 (80,0) | 0,177 |
| Dislipemia | 1.224 (67,1) | 49 (64,5) | 0,633 | 1.126 (66,4) | 44 (62) | 0,436 | 98 (76) | 5 (100) | 0,589 |
| ERC | 179 (9,8) | 21 (27,6) | 0,001* | 162 (9,6) | 21 (29,6) | 0,001* | 17 (13,2) | 0 (0) | 0,999 |
| Arteriopatía periférica | 190 (10,4) | 13 (17,1) | 0,064 | 173 (10,2) | 11 (15,5) | 0,153 | 17 (13,2) | 2 (40) | 0,147 |
| Ictus previo | 106 (5,8) | 9 (11,8) | 0,044* | 100 (5,9) | 9 (12,7) | 0,020* | 6 (4,7) | 0 | 0,999 |
| Enfermedad coronaria previa | 1.042 (57,1) | 46 (60,5) | 0,557 | 954 (56,3) | 43 (60,6) | 0,476 | 88 (68,2) | 3 (60) | 0,656 |
| IM previo | 487 (26,7) | 31 (40,8) | 0,007* | 451 (26,6) | 29 (40,8) | 0,008* | 36 (27,9) | 2 (40) | 0,622 |
| ICP previa | 878 (48,1) | 40 (52,6) | 0,442 | 798 (47,1) | 38 (53,5) | 0,287 | 80 (62) | 2 (40) | 0,376 |
| CABG previa | 107 (5,9) | 6 (7,9) | 0,453 | 92 (5,4) | 5 (7) | 0,589 | 15 (11,6) | 1 (20) | 0,476 |
| Enfermedad del tronco coronario izquierdo | 98 (5,4) | 6 (7,9) | 0,304 | 84 (5) | 6 (8,5) | 0,172 | 14 (10,9) | 0 (0) | 0,999 |
| Tiempo de oclusión> 1 año | 371 (63,3) | 11 (57,9) | 0,630 | 330 (63,7) | 10 (58,8) | 0,681 | 41 (60,3) | 1 (50) | 0,999 |
| Calcificación grave | 864 (50,5) | 39 (53,4) | 0,628 | 780 (49,3) | 35 (51,5) | 0,730 | 84 (65,1) | 4 (80) | 0,660 |
| Flexión> 45° | 581 (32,2) | 22 (29,3) | 0,602 | 528 (31,5) | 19 (27,1) | 0,439 | 53 (44,1) | 3 (60) | 0,649 |
| Con ecografía intravascular | 261 (14,3) | 10 (13,2) | 0,868 | 242 (14,3) | 9 (12,7) | 0,705 | 19 (14,7) | 1 (20) | 0,560 |
| Con dispositivo de reentrada | 1 (1,7) | 1 (1,3) | 0,999 | 27 (1,6) | 1 (1,4) | 0,999 | 4 (3,1) | 0 | 0,999 |
| Éxito de la intervención | 1.580 (86,6) | 66 (86,8) | 0,999 | 1.467 (86.5) | 62 (87,3) | 0,999 | 113 (87,6) | 4 (80) | 0,498 |
| Complicación durante la intervención | 50 (2,7) | 11 (14,5) | 0,001* | 46 (2,7) | 10 (4,1) | 0,001* | 4 (3,1) | 1 (20) | 0,176 |
| Complicación hospitalaria | 84 (4,6) | 17 (22,4) | 0,001* | 75 (4,4) | 15 (21,1) | 0,001* | 9 (7) | 2 (40) | 0,054 |
| Nefropatía hospitalaria | 10 (0,5) | 0 (0) | 0,999 | 9 (0,5) | 0 (0) | 0,999 | 1 (0,8) | 0 (0) | 0,999 |
| Nuevo IM en el seguimiento | 21 (1,2) | 8 (10,5) | 0,001* | 19 (1,1) | 6 (8,5) | 0,001* | 2 (1,6) | 2 (40) | 0,007* |
| RLD en el seguimiento | 63 (8,9) | 2 (5,4) | 0,763 | 62 (9,2) | 2 (5,7) | 0,761 | 1 (2,9) | 0 (0) | 0,999 |
| Trombosis del stent en el seguimiento | 7 (1,3) | 1 (2,7) | 0,420 | 6 (1,3) | 1 (2,8) | 0,401 | 1 (1,9) | 0 (0) | 0,999 |
CABG: cirugía de revascularización coronaria; DMP: dispositivos de modificación de la placa; ERC: enfermedad renal crónica; ICP: intervención coronaria percutánea; IM: infarto de miocardio; RLD: revascularización de la lesión diana.
Los valores expresan n.
Predictores de la mortalidad independientes en el conjunto de la población del estudio. En el 3,2% de los pacientes se constató ausencia de datos en al menos 1 de las variables incluidas en este modelo de Cox. DMP: dispositivos de modificación de la placa; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Predictores de la mortalidad independientes con éxito en el cruce de la OCT con la guía
| Variables | Univariante | Multivariante | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad | 1,038 (1,018-1,059) | <0,001 | 1,037 (1,016-1,059) | 0,001 |
| Diabetes | 1,666 (1,118-2,484) | 0,012 | ||
| Enfermedad renal crónica | 2,567 (1,596-4,128) | <0,001 | 2,141 (1,240-3,696) | 0,006 |
| Arteriopatía periférica | 2,079 (1,271-3,400) | 0,004 | ||
| Infarto de miocardio previo | 1,600 (1,066-2,401) | 0,023 | 1,845 (1,170-2,910) | 0,008 |
| Complicaciones durante la intervención | 4,389 (2,445-7,879) | <0,001 | 2,977 (1,405-6,307) | 0,004 |
| Uso de dispositivos de modificación de placa | 0,897 (0,365-2,207) | 0,813 | 0,985 (0,353-2,749) | 0,978 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Prueba de Groennesby y Borgan, p=0,168. Índice C = 0,672 (0,612-0,732). Puntuación de Brier, 0,028 (0,027-0,029).
El tratamiento percutáneo de las OCT es técnicamente difícil y la tasa de éxito sigue siendo mejorable en todo el mundo. La calcificación de la placa es un buen predictor de fallo técnico22,23, en buena medida porque se trata de lesiones no dilatables (hasta un 12%) o que la guía no cruza (6%)24,25, pero también por una mayor tasa de complicaciones (∼8%) —principalmente perforaciones— que pueden requerir que se interrumpa la intervención. Esto es importante, puesto que la calcificación moderada-grave de las OCT afecta al 58% de las personas consideradas candidatas a una ICP26. En este subanálisis del Registro Ibérico de OCT, se hizo una descripción exhaustiva de las principales herramientas actuales especializadas específicamente en el tratamiento de la calcificación grave, y los principales resultados son: a) la técnica más utilizada es la aterectomía rotacional, a pesar de la variedad creciente de alternativas, y la tasa de éxito tras los DMP alcanzó el 95% cuando solo se utilizó 1 dispositivo y el 100% cuando se utilizaron 2, lo que indica un comportamiento sinérgico de estas técnicas; b) los pacientes que requirieron técnicas de modificación de la placa tenían un riesgo cardiovascular considerablemente mayor, mayor calcificación del segmento ocluido y mayor puntuación J-CTO, y c) a pesar de ello, la tasa de complicaciones y la mortalidad en los procedimientos complejos fueron muy bajas y no se observaron diferencias en la supervivencia a 2 años entre los grupos tratados con dispositivos de modificación de placa y sin ellos, lo que indica que estas técnicas pueden ser útiles para amortiguar la mayor carga ateroesclerótica de este subgrupo de pacientes.
Riesgo basal y éxito técnico en los pacientes tratados con DMPSe sabe que los DMP a menudo se utilizan en pacientes ancianos con mayor riesgo cardiovascular y, por consiguiente, con una enfermedad coronaria más compleja2,3. No obstante, el impacto pronóstico a medio plazo de estas técnicas está menos claro. Las pruebas más sólidas disponibles son de la técnica más utilizada, la aterectomía rotacional27. Aunque, en estos últimos años, el uso de la litotricia y la angioplastia coronaria con láser excimer como nuevas alternativas ha aumentado progresivamente en la práctica clínica, que se utilicen menos en el contexto de las OCT se explica por la escasez de pruebas a favor, pero también por su escasa disponibilidad en algunos centros12,19. No obstante, según los resultados del presente estudio, dichas nuevas técnicas son seguras y efectivas, en particular si se utilizan combinadas, lo que indica un comportamiento parecido al observado en otro tipo de lesiones (no oclusivas) como las del estudio DISRUPT CAD II o los ensayos STRATAS y LEONARDO, todos los cuales comunican tasas de éxito superiores al 90%13,21,28.
Es importante destacar que en nuestro estudio se compararon los resultados inmediatos y a medio plazo después de descartar a los pacientes en quienes la guía no cruzó la OCT y, aun así, se observó una tasa de éxito significativamente mayor (el 96,3 frente al 86,6%) en la cohorte tratada con DMP; no obstante, la aterectomía rotacional y el láser se reservan a menudo para las lesiones no dilatables con el balón20,29, mientras que los otros DMP a menudo se utilizan para mejorar los resultados angiográficos en lesiones que pueden cruzarse y dilatarse con balones estándar y stents. En este último contexto, el análisis aleatorio podría arrojar algo de luz sobre cuál es la mejor estrategia; por el contrario, en el caso de las lesiones no dilatables, es poco probable que se hagan estudios en los que se aleatorice a con o sin DMP.
Resultados a largo plazo en pacientes con OCT calcificadas tratadas con DMPA más largo plazo, es razonable preguntarse si el tratamiento de las OCT muy calcificadas se relaciona con una mayor tasa de ineficacia en el vaso afectado, tal como señalan algunos autores22. Sin embargo, en el presente estudio, los resultados al cabo de 2 años fueron favorables respecto a los pacientes con una enfermedad menos compleja, lo que indica que utilizar más estas tecnologías podría ser útil para garantizar la permeabilidad a largo plazo de las OCT tratadas por vía percutánea cuando la calcificación es moderada o grave. Se pudo analizar las imágenes intravasculares del 37% de la población del estudio; se confirmó una calcificación moderada-grave en más del 50% de las OCT y se detectó con relativa frecuencia subexpansión del stent (∼3%), lo que no hace la angiografía30. El efecto complementario de las imágenes intravasculares y los DMP es crucial para la mejora de los resultados a largo plazo en los pacientes con OCT que se someten a recanalización percutánea; del subgrupo tratado con DMP, se utilizó ecografía intravascular en el 56% de los pacientes durante el procedimiento inicial (p=0,001 frente a los pacientes sin estrategias de modificación de placa), lo que resalta la complejidad de los pacientes que requieren DMP, pero también podría tener una influencia en los resultados adecuados a medio plazo que se comunican en este estudio. Aunque la potencia estadística del estudio es insuficiente para comparar los distintos DMP, está claro que hay técnicas de menor y mayor reducción de volumen de placa o debulking, y en este último grupo se incluirían la aterectomía orbital, la aterectomía rotacional y el láser. La hipótesis según la cual las estrategias de mayor debulking podrían ofrecer mejores resultados a largo plazo sigue sin probarse, pero el hecho de que estas estrategias se utilizaran considerablemente menos en los centros con menor volumen de pacientes () indica que el grado de destreza del operador necesaria para utilizarlos podría ser mayor para evitar un exceso de complicaciones que, de otro modo, neutralizarían las posibles ventajas en términos de durabilidad de la recanalización. En realidad, entre las variables independientes de la mortalidad y frente a los factores de riesgo no modificables (edad, enfermedad renal crónica y arteriopatía periférica), las complicaciones que tienen lugar durante la intervención son un factor potencial que puede mejorarse para reducir la mortalidad31,32.
LimitacionesLas principales limitaciones de este estudio, inherentes a la naturaleza retrospectiva de los estudios basados en registros, son la heterogeneidad de las técnicas con DMP (número de operadores, criterios basados en la experiencia de los operadores con los DMP y disponibilidad en el laboratorio de hemodinámica de cada uno de los DMP), cierto sesgo debido a la falta de un análisis independiente del laboratorio central para evaluar los episodios angiográficos y clínicos y la pequeña cohorte tratada con modificación de placa. A pesar de esta heterogeneidad de las técnicas incluidas, para el análisis del impacto clínico no se tuvo en cuenta cada técnica específicamente sino, sobre todo, el efecto general en la enfermedad subyacente más allá de aspectos específicamente técnicos, y por ello se analizaron minuciosamente los resultados en el seguimiento a largo plazo.
CONCLUSIONESSe utilizaron DMP en el 6% de los pacientes con OCT gravemente calcificadas con una tasa de éxito óptima, en particular cuando se combinaron varias de estas técnicas. Los resultados a medio plazo fueron comparables a pesar del peor perfil basal, lo que indica que el mayor empleo de los DMP en este contexto podría tener potencial beneficio técnico y ventajas pronósticas.
- –
Se constata calcificación grave en más del 50% de las OCT que se someten a intervención percutánea.
- –
En los últimos años han aparecido varios DMP nuevos, además de los que ya existían, y se han difundido rápidamente.
- –
No obstante, se sabe poco sobre su tasa de utilización y sus resultados en el contexto de las OCT gravemente calcificadas.
- –
Se utilizaron DMP en el 7% de los pacientes con OCT gravemente calcificadas con una tasa de éxito óptima, en particular cuando se combinaron varias de estas técnicas.
- –
Pese al mayor riesgo basal, los resultados a medio plazo fueron similares a los de los pacientes cuya placa no fue necesario modificar, lo que indica que el mayor empleo de DMP en este contexto podría tener potencial beneficio técnico y ventajas pronósticas.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESI.J. Amat-Santos y J.A. Fernández-Díaz coordinaron el registro. J.R. Delgado-Arana y I.J. Amat-Santos concibieron el proyecto y se encargaron de redactar el artículo y presentarlo. J.R. Rumoroso, A. Regueiro, J. Martín-Moreiras, G. Miñana, M. Mohandes, M. Pan, P. Salinas, J. Caballero-Borrego, J.A. Fernández-Díaz, A. Jurado, J. Lacunza, B. Vaquerizo, F. Rivero, J. Abellán, J. Rondán, A. Gómez Menchero, S. Santos-Martínez, A. Subinas, V. Arévalos, A. Diego Nieto, J. Sanchis, S. Rojas, S. Ojeda, N. Gonzalo, M. López-Pérez, J. Goicolea, M. Sádaba, M. Sabaté y J.C. Núñez García realizaron las intervenciones, recogieron la información de manera prospectiva, llevaron a cabo el seguimiento y revisaron y aprobaron la versión final del artículo. I. Gómez-Salvador hizo el análisis estadístico y la revisión y aprobación completa del artículo.
CONFLICTO DE INTERESESA. Regueiro es asesor de Boston Scientific; iVascular; Terumo. A. Jurado es proctor para Spectranetics. M. Sabaté es asesor de Abbott Vascular y de iVascular fuera del trabajo presentado. J.R. Rumoroso e I.J. Amat-Santos son proctors para Boston Scientific.