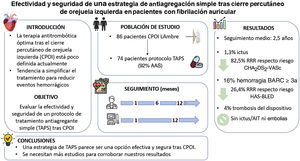
Se desconoce cuál es la terapia antitrombótica óptima tras el cierre percutáneo de la orejuela izquierda (CPOI) en pacientes con fibrilación auricular no valvular. El objetivo de este estudio es analizar la efectividad y la seguridad de un régimen de tratamiento antiagregante plaquetario simple (TAPS) tras el CPOI en una población con alto riesgo isquémico y hemorrágico.
MétodosEstudio observacional prospectivo que incluyó una cohorte consecutiva de pacientes a los que se realizó CPOI con dispositivo LAmbre (Lifetech Scientific, China) y que recibieron TAPS al alta. El evento primario fue un combinado de ictus, embolia sistémica y trombosis del dispositivo. Los eventos secundarios fueron mortalidad cardiovascular y hemorragia mayor (BARC ≥ 3a). Se realizó seguimiento clínico al mes y a los 6 y 12 meses y cada año después. Se realizó ecocardiograma transesofágico al mes y a los 12 meses.
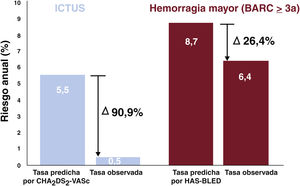
ResultadosSe incluyó a 74 pacientes (el 43% mujeres) con una mediana de edad de 77 [intervalo intercuartílico, 72-83] años, que presentaban gran comorbilidad y factores de riesgo cardiovascular. Los valores de CHA2DS2-VASc y HAS-BLED fueron una mediana de 4 [3-6] y 4 [4-5] respectivamente. Durante el seguimiento (mediana, 2,5 años), 3 pacientes (4%) presentaron trombosis del dispositivo. Uno sufrió ictus isquémico (1,3%, 0,5%/año), lo que supone, según la incidencia esperada por CHA2DS2-VASc, una reducción del riesgo relativo del 90,9%. Sufrieron eventos hemorrágicos 12 pacientes (16%; 6,4%/año), una tasa el 26,4% menor que el riesgo HAS-BLED predicho. Se produjo la muerte cardiovascular de 2 pacientes (2,7%).
ConclusionesUna estrategia de TAPS tras el CPOI parece ser una opción efectiva y segura para los pacientes con altos riesgos isquémico y hemorrágico. Se necesitan más estudios que corroboren nuestros resultados.
Palabras clave
El cierre percutáneo de la orejuela izquierda (CPOI) ha emergido en los últimos años como una alternativa terapéutica eficaz para la prevención de eventos tromboembólicos en pacientes con fibrilación auricular (FA) no valvular y contraindicación para el tratamiento con anticoagulantes orales (ACO) o con muy alto riesgo hemorrágico (indicación IIb B)1. Desde 2001, se han desarrollado múltiples dispositivos, lo que ha mejorado progresivamente tanto los resultados del procedimiento como la prevención de eventos embólicos a largo plazo2–5.
Actualmente se desconoce cuál es el régimen antitrombótico óptimo tras el CPOI para evitar la trombosis relacionada con el dispositivo (TRD), cuya presencia se ha relacionado con un aumento de la incidencia de ictus en el seguimiento de estos pacientes6,7. Desde un punto de vista teórico, dicho tratamiento debería ser lo suficientemente potente para evitar la TRD y, a la vez, lo más simple y breve posible para evitar complicaciones hemorrágicas en este grupo de pacientes con alto riesgo de hemorragia.
Los regímenes propuestos tras el CPOI han sido diferentes con el paso del tiempo y en función del tipo de dispositivo utilizado. Estos esquemas de tratamiento han ido evolucionando desde regímenes más agresivos iniciales con el dispositivo WATCHMAN (Boston Scientific, Estados Unidos) en pacientes sin contraindicación previa a los ACO (6 semanas de tratamiento con ACO+ácido acetilsalicílico [AAS], seguido de tratamiento antiagregante plaquetario doble [TAPD] durante 6 meses y después AAS indefinidamente)5 hasta los esquemas más simplificados actuales para pacientes con contraindicación a los ACO, que recomiendan generalmente un mínimo de 3 meses de TAPD seguidos de tratamiento antiagregante plaquetario simple (TAPS) indefinidamente8–11.
A pesar de los esquemas recomendados, algunos estudios en práctica clínica real han puesto en evidencia la necesidad de simplificar y acortar aún más dichos tratamientos, ya que, por un lado, el perfil del paciente que se somete a CPOI tiene mayor riesgo hemorrágico que los incluidos en los estudios fundamentales de dichos dispositivos12-14 y, por otro, los esquemas antitrombóticos más simples no parecen estar relacionados con más eventos tromboembólicos durante el seguimiento15. El objetivo de este estudio es evaluar la eficacia y la seguridad de un régimen de TAPS tras el CPOI con un dispositivo de última generación para la prevención de eventos tromboembólicos y hemorrágicos durante el seguimiento.
MÉTODOSDiseño del estudioEste trabajo es un estudio unicéntrico, observacional, prospectivo y no aleatorizado que incluyó una cohorte consecutiva de pacientes a los que se realizó CPOI con el dispositivo LAmbre (Lifetech Scientific Co., China) y se dio de alta con TAPS.
Selección de pacientes y procedimientoLos criterios de inclusión fueron edad ≥ 18 años, diagnóstico de FA no valvular con indicación de ACO indefinidamente e indicación para el CPOI por contraindicación absoluta o relativa para mantener a dosis adecuadas un tratamiento prolongado con anticoagulantes (aprobado por un comité experto con base en los antecedentes del paciente y las guías de práctica clínica actuales). Se incluyó a todos los pacientes consecutivos entre mayo de 2017 y marzo de 2021. Los criterios de exclusión fueron implante subóptimo del dispositivo, necesidad de TAPD o ACO por otras razones médicas (como revascularización percutánea coronaria o vascular en los últimos 12 meses). A todos los pacientes se les realizó CPOI con el dispositivo LAmbre durante el periodo de inclusión en el estudio. En el periodo de inclusión de los pacientes no se utilizaron otros dispositivos para el CPOI. La figura 1 describe la población incluida en el estudio.
Diagrama de flujo de los pacientes incluidos en el estudio. AAS: ácido acetilsalicílico; ACO(D): anticoagulantes orales de acción directa; ACTP: angioplastia coronaria transluminal percutánea; CPOI: cierre percutáneo de la orejuela izquierda; p: pacientes; TAPD: tratamiento antiagregante plaquetario doble; TAPS: tratamiento antiagregante plaquetario simple.
Cardiólogos intervencionistas expertos en CPOI realizaron los procedimientos con apoyo de equipo de anestesia e imagen cardiaca. Se obtuvo ecocardiograma transesofágico (ETE) o ecografía intracardiaca (8%) de todos los pacientes para descartar la existencia previa de trombo en la orejuela izquierda y guiar el procedimiento. A las 24 h del procedimiento se realizó un ecocardiograma transtorácico para asegurar la correcta permanencia del dispositivo y descartar un derrame pericárdico. En ausencia de complicaciones, se dio de alta a los pacientes a las 24 h con TAPS (AAS, clopidogrel o triflusal).
Ética en investigaciónEl Comité de Ética de Investigaciones Médicas de la institución (CEIm-PSMAR) aprobó el protocolo de estudio. Todos los pacientes firmaron el consentimiento informado antes del procedimiento. Todos los procedimientos del estudio se realizaron de acuerdo con los principios de la Declaración de Helsinki y la norma ISO14155.
Evaluación basalSe recogieron los datos clínicos basales (sociobiográficos, antecedentes patológicos y riesgos isquémico y hemorrágico según escalas CHA2DS2-VASc16 y HAS-BLED17), analíticos (función renal y hemograma) y ecocardiográficos (mediciones de la orejuela izquierda y la función ventricular y determinación de valvulopatías). Durante el procedimiento de CPOI, se recogieron datos técnicos (tamaño del dispositivo empleado, tiempo del procedimiento, tamaño de la orejuela izquierda por fluoroscopia y éxito del procedimiento) y clínicos (estancia hospitalaria y complicaciones locales y durante el ingreso).
Seguimiento y definición de eventosSe realizó un seguimiento clínico presencial a los 3 y los 12 meses tras el CPOI. Se trató a todos los pacientes con TAPS durante como mínimo 1 mes tras el procedimiento. La suspensión del TAPS fue a discreción del cardiólogo tratante según antecedentes clínicos relevantes (cardiopatía isquémica, vasculopatía periférica…), el riesgo hemorrágico del paciente (por eventos previos y su gravedad, así como valoración de HAS-BLED) y los datos del ETE de seguimiento (presencia de fugas residuales).
Se realizó seguimiento del dispositivo por imagen mediante ETE al mes y a los 12 meses del CPOI. Se recogieron la presencia de fugas periprotésicas y su tamaño, así como imágenes que indicaran TRD. Las TRD se confirmaron mediante tomografía computarizada (TC) cardiaca sincronizada. En caso de hallarse trombosis, se comunicó directamente al equipo para valoración y tratamiento precoces.
Se definieron como eventos primarios el combinado de eventos isquémicos durante el seguimiento: ictus, accidente isquémico transitorio, embolia sistémica o TRD. Se recogieron también la mortalidad cardiovascular y por cualquier causa.
Se definió como evento secundario la presencia de eventos hemorrágicos durante el seguimiento. Los eventos hemorrágicos se clasificaron según la escala de la Bleeding Research Academy Consortium (BARC)18, y se consideró hemorragia mayor todo evento catalogado como BARC ≥ 3a (3a: hemorragia con caída de hemoglobina> 3 g/dl o cualquier necesidad de transfusión con hemorragia evidente; 3b: hemorragia con caída de hemoglobina> 5g/dl o necesidad de cirugía/fármacos vasopresores; 3c: hemorragia intraocular o intracraneal; 5: hemorragia mortal).
Análisis estadísticoEl análisis estadístico se realizó con el programa IBM SPSS Statistics versión 25. Las variables continuas se expresan como media± desviación estándar o mediana [intervalo intercuartílico] en función de su distribución normal. Las variables categóricas se expresan como frecuencias y porcentajes. Los eventos durante el seguimiento se expresan como porcentaje del total y como tasa de eventos cada 100 pacientes-año. Se calculó la tasa predicha de ictus isquémico de la puntuación CHA2DS2-VASc según la proporción ajustada por uso de AAS19. Se calculó la tasa predicha de hemorragia mayor según la cohorte global de la escala de riesgo HAS-BLED17. La reducción de riesgo relativa se calculó como (tasa anual estimada % – tasa anual observada %) / tasa anual estimada %.
RESULTADOSPoblación del estudioEn total, 86 pacientes se sometieron a CPOI con dispositivo LAmbre entre mayo de 2017 y marzo de 2021; de ellos, 74 entraron en el protocolo de estudio. Se excluyó a 12 pacientes por razones que se resumen en la figura 1.
Características basalesLos datos basales y los antecedentes de los participantes incluidos en el estudio se resumen en la tabla 1. Se trata de una población con una mediana de edad de 77 [72-83] años y un gran volumen de comorbilidades (hipertensión arterial, 92%; diabetes mellitus tipo 2, 49%; enfermedad renal crónica, 72%), riesgos isquémico y hemorrágico muy altos (CHA2DS2-VASc 4 [3-6] y HAS-BLED 4 [4-5]). El 81% de los pacientes ya habían sufrido antes al menos 1 evento hemorrágico mayor, cuyo origen más frecuente fue el gastrointestinal (66,7%), seguido del ictus hemorrágico (20%). El 31% de los pacientes ya habían sufrido antes 1 evento isquémico cerebral (ictus/accidente isquémico transitorio). Tres pacientes (4%) presentaron una complicación aguda durante el procedimiento: 2 presentaron hematoma femoral (que no requirió intervención quirúrgica) y 1, taponamiento cardiaco que requirió una pericardiocentesis emergente que la resolvió. Tras el procedimiento se dio de alta a todos los pacientes con TAPS (el 92% con AAS).
Características basales de los participantes del estudio (N=74)
| Variables | |
|---|---|
| Edad (años) | 77 [72-83] |
| Mujeres | 32 (43,2) |
| Hipertensión arterial | 68 (92,0) |
| Diabetes | 36 (48,6) |
| FA tipo | |
| Paroxística | 34 (45,9) |
| Persistente | 5 (6,8) |
| Permanente | 35 (47,3) |
| CHA2DS2-VASc | 4 [3-6] |
| HAS-BLED | 4 [4-5] |
| Enfermedad coronaria | 22 (30,0) |
| IAM | 10 (13,5) |
| Enfermedad vascular periférica | 24 (32,4) |
| Ictus/AIT | 23 (31,0) |
| Hemorragia mayor previa | 60 (81,0) |
| Gastrointestinal | 40 (66,7) |
| Ictus hemorrágico | 12 (20,0) |
| Intracraneal | 4 (6,7) |
| Abdominal/retroperitoneal | 1 (1,7) |
| Otros | 3 (5,0) |
| Insuficiencia renal (TFG <60 ml/min/m2) | 53 (71,6) |
| Estadio 3a (TFG <60 ml/min/m2) | 17 (32) |
| Estadio 3b (TFG <45 ml/min/m2) | 12 (22,6) |
| Estadio 4 (TFG <30 ml/min/m2) | 11 (20,7) |
| Estadio 5 (TFG <15 ml/min/m2) | 13 (24,5) |
| Hemodiálisis | 10 (13,5) |
| Diámetro de la AI | 45 [41-48] |
| Indicación para CPOI | |
| Antecedente de hemorragia mayor en tratamiento con ACO | 60 (81) |
| Enfermedad renal terminal y alto riesgo hemorrágico | 13 (17,6) |
| Enfermedad hepática grave | 1 (1,4) |
ACO: anticoagulantes orales; AI: aurícula izquierda; AIT: accidente isquémico transitorio; CPOI: cierre percutáneo de la orejuela izquierda; FA: fibrilación auricular; IAM: infarto agudo de miocardio; TFG: tasa de filtrado glomerular.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
El seguimiento por imagen mediante ETE se resume en la tabla 2. Se obtuvo el ETE al mes de seguimiento tras el CPOI del 90,5% de los pacientes. Todos los pacientes presentaron un resultado técnicamente óptimo del cierre, con un 0% de fugas periprotésicas significativas (≥ 5 mm). De 1 paciente (1,5%) se obtuvo una imagen sospechosa de TRD, que se confirmó con la TC cardiaca. En dicho paciente no se produjeron eventos isquémicos embólicos durante el seguimiento.
Resultados del seguimiento mediante imagen al mes y al año (n=74)
| Variables | |
|---|---|
| ETE a 1 mes | 67 (90,5) |
| Trombosis del dispositivo* | 1 (1,5) |
| Fuga peridispositivo | 14 (21,0) |
| Tamaño de la fuga peridispositivo | 2,8±0,8 |
| <3 mm | 6 (9) |
| 3-4 mm | 8 (12) |
| ≥ 5 mm | 0 |
| Ubicación de la fuga peridispositivo | |
| Marshall | 13 (93,0) |
| Mitral | 1 (7,0) |
| ETE a los 12 meses | 52 (70,2) |
| Trombosis del dispositivo* | 2 (3,85) |
| Fuga peridispositivo | 11 (21,1) |
| Tamaño de la fuga peridispositivo | 2,45±0,82 |
| <3 mm | 6 (11,5) |
| 3-4 mm | 5 (9,6) |
| ≥ 5 mm | 0 (0) |
| Ubicación de la fuga peridispositivo | |
| Marshall | 10 (91) |
| Mitral | 1 (9,0) |
ETE: ecocardiograma transesofágico.
Se realizó el ETE de control a los 12 meses al 70,2% de los pacientes; ningún paciente presentó fuga periprotésica significativa y en 2 (3,85%) se observó una imagen compatible con TRD. Ninguno de estos pacientes sufrió eventos isquémicos/embólicos antes ni después del diagnóstico. A los pacientes con TRD se los trató con ACO a dosis bajas (apixabán 2,5mg/12 h) hasta comprobar la resolución de este mediante TC cardiaca.
Seguimiento clínicoEl 100% de los pacientes completaron el seguimiento clínico (tabla 3). La mediana de seguimiento fue de 2,5 [1,65-3,38] años, con un total de 188 pacientes-año. La duración del TAPS fue una mediana de 6 [3-30] meses. En 1 paciente (1,3%) sufrió un ictus isquémico durante el seguimiento, lo que correspondería a una incidencia anual del 0,5%: dicho evento se produjo a los 2 años de seguimiento tras el CPOI. Si se tiene en cuenta que la incidencia esperada de ictus según la puntuación CHA2DS2-VASc en nuestra cohorte sería del 5,5%/año19, lo cual supone una reducción del riesgo relativo del 87,5% (figura 2).
Eventos clínicos durante el seguimiento (n=74)
| Variables | n (%) |
|---|---|
| Ictus/AIT | 1 (1,3) |
| Mortalidad | 21 (28,4) |
| Cardiovascular | 2 (9,5) |
| No cardiovascular | 17 (80,9) |
| Desconocida | 2 (9,5) |
| Hemorragia mayor (BARC ≥ 3a) | 12 (16,2) |
| BARC 3a | 8 (67,0) |
| BARC 3b | 3 (25,0) |
| BARC 3c | 1 (8,0) |
AIT: accidente isquémico transitorio; BARC: Bleeding Academy Research Consortium.
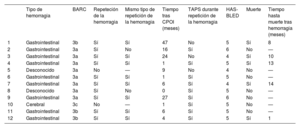
Respecto a los eventos secundarios, 12 pacientes (16,2%; incidencia anual del 6,4%) presentaron hemorragias mayores durante el seguimiento (BARC ≥ 3a). La incidencia de hemorragia teórica según la mediana de la clasificación HAS-BLED sería del 8,7%/año, lo que supone una reducción del riesgo relativo del 26,4% respecto la incidencia de hemorragias reales (figura 2). No hubo ninguna hemorragia fatal o que requiriese intervención quirúrgica/endoscópica urgente. Cabe destacar que 10 de esos 12 pacientes (83%) tenían antecedentes de hemorragia y en el 80% se produjo recurrencia de hemorragias del mismo origen (gastrointestinal). Asimismo, las hemorragias se relacionaron con una alta mortalidad durante el seguimiento (41,6%), con una media de 9 meses hasta el fallecimiento tras el evento hemorrágico. Los eventos hemorrágicos se describen con mayor detalle en la tabla 4. Dos pacientes (2,7%) fallecieron por causa cardiovascular, en ningún caso relacionada con el dispositivo; 19 (25,7%) fallecieron por otras causas durante el seguimiento, una mediana de 2 [1-2,6] años tras el CPOI. Las muertes no cardiovasculares se analizan con detalle en la (figura 3).
Características de los eventos hemorrágicos mayores (BARC ≥ 3a) ocurridos durante el seguimiento
| Tipo de hemorragia | BARC | Repeteción de la hemorragia | Mismo tipo de repetición de la hemorragia | Tiempo tras CPOI (meses) | TAPS durante repetición de la hemorragia | HAS-BLED | Muerte | Tiempo hasta muerte tras hemorragia (meses) | |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Gastrointestinal | 3b | Sí | Sí | 47 | No | 5 | Sí | 8 |
| 2 | Gastrointestinal | 3a | Sí | No | 16 | Sí | 6 | No | — |
| 3 | Gastrointestinal | 3a | Sí | Sí | 24 | No | 4 | Sí | 10 |
| 4 | Gastrointestinal | 3a | Sí | Sí | 1 | Sí | 5 | Sí | 13 |
| 5 | Desconocido | 3a | No | — | 9 | No | 4 | No | — |
| 6 | Gastrointestinal | 3a | Sí | Sí | 1 | Sí | 5 | No | — |
| 7 | Gastrointestinal | 3a | Sí | Sí | 6 | Sí | 4 | Sí | 14 |
| 8 | Desconocido | 3a | Sí | No | 0 | Sí | 5 | No | — |
| 9 | Gastrointestinal | 3a | Sí | Sí | 27 | Sí | 6 | No | — |
| 10 | Cerebral | 3c | No | — | 1 | Sí | 5 | No | — |
| 11 | Gastrointestinal | 3b | Sí | Sí | 6 | Sí | 5 | No | — |
| 12 | Gastrointestinal | 3b | Sí | Sí | 4 | Sí | 5 | Sí | 1 |
BARC: Bleeding Academic Research Consortium; CPOI: cierre percutáneo de la orejuela izquierda; TAPS: tratamiento antiagregante plaquetario simple.
Los resultados de este estudio, que evalúa la seguridad y la efectividad de una estrategia de TAPS tras el CPOI, se resumen en 3 puntos clave:
- 1.
Estos pacientes presentaron una muy baja tasa de eventos isquémicos embólicos tras una mediana de 2,5 años de seguimiento.
- 2.
La incidencia de TRD con el uso de TAPS es similar a la de otros estudios y no tuvo implicación clínica embólica.
- 3.
Los eventos hemorrágicos se redujeron en un 2,3% en términos absolutos y en un 26% respecto al riesgo de hemorragia teórico.
El tratamiento antitrombótico tras el CPOI se prescribe con el objetivo de evitar la TRD y, por consiguiente, la aparición de nuevos eventos embólicos sistémicos. Sin embargo, el proceso biológico de endotelización de dispositivos intracardiacos no se conoce por completo y se desconoce cuánto tiempo es necesario para completar dicho proceso20,21.
Tanto la incidencia como las consecuencias clínicas (embólicas) de la TRD tras el CPOI son muy variables según las series publicadas. Se describe una incidencia anual de un 0,9-7,2% en los estudios más recientes21. En el registro europeo más amplio, publicado por los investigadores de EWOLUTION con dispositivo WATCHMAN12, se describe una incidencia de TRD (identificada por ETE o TC) del 4,1% (34/835 pacientes), que en el 91% se detectaron antes de los 90 días tras el implante (mediana, 54 días). Ninguno de los casos de TRD sufrió eventos tromboembólicos como ictus/accidente isquémico transitorio o embolia periférica durante un seguimiento de 21 meses. De modo similar, en el estudio retrospectivo multicéntrico del Amplatzer Cardiac Plug22, la incidencia de TRD (diagnosticada por ETE) fue del 3,2% y no se asoció con eventos tromboembólicos.
Esto contrasta con el estudio publicado por Dukkipati et al.23, en el cual se analizó en retrospectiva a los pacientes de los estudios piloto PROTECT-AF, PREVAIL, CAP y CAP2. Todos los casos de TRD se diagnosticaron mediante ETE con una alta adherencia al protocolo (90,9-98,7%). De un total de 1.739 pacientes, en 65 (3,74%) se halló TRD. La proporción de embolia sistémica fue superior en el grupo de TRD: 6,28 frente a 1,65/100 pacientes-año (p <0,001). En el análisis multivariado se encontraron como factores predictores de TRD la el antecedente de ictus/accidente isquémico transitorio, la FA permanente, el diámetro de la orejuela izquierda y la fracción de eyección del ventrículo izquierdo. En esta misma línea apuntan los resultados del estudio de Simard et al.24 sobre factores predictores de TRD. Ese estudio realizó un análisis de casos emparejados con y sin TRD en proporción 1:2 con varios dispositivos de CPOI. Se observó que la TRD se asocia con una incidencia superior de eventos cardiovasculares mayores durante el seguimiento (el 29,5 frente al 14,4%; p <0,001) a expensas sobre todo de ictus isquémico (el 16,9 frente al 3,6%; p=0,01). Cabe destacar que no se encontraron diferencias de esquema de tratamiento antiagregante prescrito tras el CPOI (TAPS frente a TAPD) en la aparición de TRD. Se identificaron 2 factores principales predictores de TRD (la hipercoagulabilidad y la presencia de derrame pericárdico) y 3 factores menores: insuficiencia renal, profundidad del implante> 10mm de las venas pulmonares y FA no paroxística. La presencia de 1 factor de riesgo mayor o 2 menores confería un riesgo aumentado 2,1 veces de TRD en el seguimiento.
Por lo que respecta al dispositivo LAmbre, se han descritos tasas muy bajas de TRD en el seguimiento, un 0-1,3% a los 12 meses de seguimiento con TAPD estándar (durante al menos 3 meses)10,25,26. Este es el primer estudio que muestra datos de TRD en este tipo de dispositivo con el uso de TAPS.
En nuestro estudio, la incidencia de TRD fue del 1,5% a los 30 días del CPOI y del 3,85% a los 12 meses, lo que supone un 4% de la cohorte total y un 2,5% por ETE realizado. Si bien esta incidencia de TRD es superior a la descrita previamente con el dispositivo LAmbre, cabe destacar que dichos estudios se realizaron en poblaciones muy pequeñas (n=11-24)26,27, con descripción de TRD solo a 3 meses de seguimiento10 o con bajas tasas de seguimiento ecocardiográfico a los 12 meses de seguimiento (60%)25.
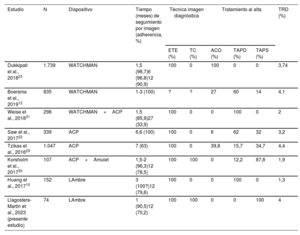
En general, creemos que este resultado es prometedor, teniendo en cuenta que todos los estudios de TRD antes mencionados se realizaron con ACO o TAPD en su mayoría. La baja incidencia de TRD en nuestro estudio se podría explicar por azar en el contexto de una cohorte relativamente pequeña; sin embargo, creemos que el propio diseño y el material del dispositivo LAmbre, junto con la técnica de implante, facilitaron un cierre completo del orificio y que esto pudo facilitar la rápida endotelización del dispositivo25,28. En la tabla 5 se resumen los principales datos sobre TRD de los estudios antes mencionados.
Comparación de la incidencia de TRD según el dispositivo, el método diagnóstico y el tratamiento antitrombótico
| Estudio | N | Dispositivo | Tiempo (meses) de seguimiento por imagen (adherencia, %) | Técnica imagen diagnóstica | Tratamiento al alta | TRD (%) | |||
|---|---|---|---|---|---|---|---|---|---|
| ETE (%) | TC (%) | ACO (%) | TAPD (%) | TAPS (%) | |||||
| Dukkipati et al., 201823 | 1.739 | WATCHMAN | 1,5 (98,7)6 (96,8)12 (90,9) | 100 | 0 | 100 | 0 | 0 | 3,74 |
| Boersma et al., 201912 | 835 | WATCHMAN | 1-3 (100) | ? | ? | 27 | 60 | 14 | 4,1 |
| Weise et al., 201831 | 298 | WATCHMAN+ACP | 1,5 (85,9)27 (33,9) | 100 | 0 | 0 | 100 | 0 | 2 |
| Saw et al., 201722 | 339 | ACP | 6,6 (100) | 100 | 0 | 6 | 62 | 32 | 3,2 |
| Tzikas et al., 201629 | 1.047 | ACP | 7 (63) | 100 | 0 | 39,8 | 15,7 | 34,7 | 4,4 |
| Korsholm et al., 201730 | 107 | ACP+Amulet | 1,5-2 (96,3)12 (78,5) | 100 | 100 | 0 | 12,2 | 87,8 | 1,9 |
| Huang et al., 201710 | 152 | LAmbre | 3 (100?)12 (79,6) | 100 | 0 | 0 | 100 | 0 | 1,3 |
| Llagostera-Martín et al., 2023 (presente estudio) | 74 | LAmbre | 1 (90,5)12 (70,2) | 100 | 100 | 0 | 0 | 100 | 4 |
ACP: Amplatzer Cardiac Plug; ETE: ecocardiograma transesofágico; TC: tomografía computarizada; TAPD: tratamiento antiagregante plaquetario doble; TAPS: tratamiento antiagregante plaquetario simple; TRD: trombosis relacionada con el dispositivo.
En nuestro estudio la tasa observada de ictus resulta del 0,5%/año, lo que supone una reducción relativa del riesgo del 91% respecto a la tasa esperada de eventos según CHA2DS2-VASc. Este resultado es muy destacable, ya que, por un lado, muestra que la tasa de eventos isquémicos cerebrales en pacientes con TAPS tras el CPOI es extremadamente baja y, además, es comparable con los resultados de otros estudios que usaron regímenes más agresivos de tratamiento antitrombótico tras el CPOI. En el estudio EWOLUTION12 (que incluyó a 1.020 pacientes con CPOI con dispositivo WATCHMAN y seguimiento a 2 años), el 60% de los pacientes recibieron TAPD tras el CPOI y un 27%, ACO durante al menos 2 meses. En el seguimiento se observó una tasa anual de ictus isquémico del 1,3%, con una reducción del riesgo del 83%. Por otro lado, el registro Europeo de Amplatzer29 incluyó a 1.047 pacientes seguidos una media de 13 meses. Se dio de alta con ACO o TAPD tras el CPOI (duración media, 3,8 meses) al 59% de los pacientes. En este caso se comunica una tasa del 2,3% anual de ictus/accidente isquémico transitorio, con una reducción del riesgo relativo del 59%. Finalmente, si se compara con el estudio descriptivo del dispositivo LAmbre referente en Europa, Park et al.25 describieron una tasa de evento isquémico cerebral del 2%/año con un TAPD durante 3 meses.
Hasta donde sabemos, solo se ha publicado un estudio que evalúa el uso de TAPS tras el CPOI con los dispositivos ACP y Amulet en una población con alto riesgo hemorrágico30. En este estudio no aleatorizado, Korsholm et al. incluyeron a 107 pacientes a los que se prescribió AAS en monoterapia tras el procedimiento. Tanto la población de estudio como sus resultados son comparables con los de nuestra cohorte. La cohorte presentaba un CHA2DS2-VASc medio de 4,4±1,6 y un HAS-BLED de 4,1±1,1. Se describe una incidencia de ictus del 2,3%/año durante el seguimiento, con una reducción del riesgo relativo del 61%.
Eventos hemorrágicosPesar a reducirse el tratamiento antitrombótico tras el CPOI, se sigue observando una alta tasa de hemorragias mayores en el seguimiento (12 pacientes, 16,2%; 6,4%/año). No tomaban TAPS en el momento del evento 3 pacientes (el 25% de las hemorragias), por lo que no le serían atribuibles. Esto refuerza la idea de que se trata de una población con muy alto riesgo hemorrágico y propensión a las hemorragias incluso sin tratamiento antitrombótico alguno. Sin embargo, si se comparan los eventos hemorrágicos de nuestra población con el riesgo de hemorragia teórico según la escala HAS-BLED, se observan unas tasas claramente menores en nuestro estudio. La incidencia de hemorragia teórica según HAS-BLED sería del 8,7%/año, lo que supone una reducción del riesgo relativa del 26,4% respecto la incidencia de hemorragias reales.
Nuestros resultados concuerdan con los de otros estudios que han analizado la presencia de hemorragias en la práctica real y con estrategias acortadas de TAPD tras el CPOI. En el antes mencionado subanálisis a 2 años del estudio EWOLUTION12 se describe un 2,7%/año de eventos hemorrágicos en la cohorte total de 1.020 pacientes, con una reducción del riesgo relativo respecto al sangrado esperado por HAS-BLED del 46%. Si se analiza únicamente el subgrupo de pacientes con antecedentes de hemorragia, la incidencia de eventos aumenta al 4,5%/año y la reducción del riesgo relativo resulta del 30%.
Comparando con el único estudio que ha evaluado la estrategia de TAPS, Korsholm et al.30 reportan una tasa de hemorragias mayores del 3,8%/año, con una reducción del riesgo relativo del 57% respecto a lo esperado por HAS-BLED. Si bien la población de este estudio es equiparable a la nuestra en cuanto a riesgo hemorrágico por HAS-BLED (valor medio, 4,1), no lo es respecto a otras comorbilidades como la insuficiencia renal crónica (el 13 frente al 72% en nuestro registro), que se relaciona directamente con la disfunción plaquetaria y la alteración de la hemostasia32. Esto podría explicar nuestra más discreta reducción observada de hemorragias mayores en comparación con la de Korsholm et al.30.
LimitacionesLas principales limitaciones de este estudio derivan de su carácter observacional y no aleatorizado. Los resultados se ven limitados por la falta de un grupo de control o con tratamiento alternativo que permitiera validarlos. Se han usado las estimaciones de predicción de eventos mediante las escalas CHA2DS2-VASc y HAS-BLED solo como aproximación en ausencia de un grupo de control. Asimismo, en nuestro estudio, los médicos tratantes establecieron la duración del TAPS; son necesarios estudios que permitan establecer su duración óptima. Por otro lado, el tamaño muestral y la tasa de seguimiento por ETE limitan la interpretación de los resultados. El estudio se realizó con un único dispositivo. Por último, el tamaño muestral es relativamente pequeño y de un único centro. Son necesarias series más grandes y estudios experimentales aleatorizados que permitan confirmar estos hallazgos prometedores.
CONCLUSIONESUna estrategia de TAPS tras el CPOI con el dispositivo LAmbre parece ser una opción efectiva y segura en pacientes con muy altos riesgos tromboembólico y hemorrágico. Si bien aún se debe establecer su duración óptima, la simplificación del tratamiento antiagregante plaquetario tras el CPOI evaluada en nuestro estudio supone un cambio en el paradigma actual y resulta una opción atractiva desde el punto de vista clínico. Son necesarios más estudios que corroboren nuestros hallazgos.
FINANCIACIÓNNo hay fondos de financiación en este estudio.
CONTRIBUCIÓN DE LOS AUTORESM. Llagostera-Martín: diseño del estudio, inclusión de pacientes, adquisición de datos, análisis estadístico, interpretación de datos, redacción del manuscrito, revisión del manuscrito, aprobación final del manuscrito. M. Cainzos, H. Tizón-Marcos y A. Calvo-Fernández: interpretación de datos, redacción del manuscrito, revisión del manuscrito, aprobación final del manuscrito. N. Salvatella y H. Cubero-Gallego: inclusión de pacientes, revisión del manuscrito, aprobación final del manuscrito. A. Mas-Stachurska, A. Sánchez-Carpintero y L. Molina: adquisición de datos, revisión del manuscrito, aprobación final del manuscrito. B. Vaquerizo: diseño del estudio, interpretación de datos, redacción del manuscrito, revisión del manuscrito, aprobación final del manuscrito.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses relacionado con el contenido de este manuscrito.
- –
La mayoría de los pacientes sometidos a CPOI tienen un muy alto riesgo hemorrágico que limita el tratamiento antitrombótico posterior. Las guías de práctica clínica actuales recomiendan el TAPD de duración variable, aunque la evidencia en la que se basan estas recomendaciones es escasa. La trombosis del dispositivo es un evento poco frecuente en el seguimiento de estos pacientes.
- –
Un régimen de TAPS tras el CPOI con el dispositivo LAmbre parece ser seguro y eficaz, con bajas tasas de trombosis del dispositivo y eventos embólicos en el seguimiento de una cohorte con gran carga de comorbilidad y riesgos isquémico y hemorrágico altos.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.06.005