La enfermedad tromboembólica crónica se define como la trombosis crónica de la vasculatura pulmonar y disnea, sin hipertensión pulmonar (HP) en reposo tras una embolia de pulmón. El estudio evaluó la hemodinámica al esfuerzo en estos pacientes y su relación con la ergoespirometría.
MétodosSe incluyó a pacientes sintomáticos con trombosis pulmonar crónica tras una embolia de pulmón. Se excluyó a los pacientes con cardiopatía izquierda o HP significativa en reposo (presión arterial pulmonar media [PAPm] >25mmHg, resistencia vascular pulmonar >3 UW y presión capilar pulmonar [PCP] >15mmHg). Se realizó una ergoespirometría y un cateterismo derecho de ejercicio. La HP precapilar al ejercicio se definió como las pendientes PAPm/gasto cardiaco >3 y PCP/gasto cardiaco <2mmHg/l/min. Se comparó la respuesta hemodinámica y ergoespirométrica entre pacientes con y sin HP precapilar al ejercicio.
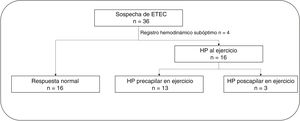
ResultadosSe estudió a 36 pacientes, excluyéndose 4 por calidad subóptima en el registro hemodinámico. Tres pacientes presentaron una elevación patológica de la PCP. De los 29 restantes (edad, 49,4±13,7 años; el 34,5% mujeres), en 13 se halló HP precapilar al ejercicio. La PAPm basal fue mayor en aquellos con HP al ejercicio (23,3±5,4 frente a 19,0±3,8mmHg; p=0,012), con similar gasto cardiaco. Aquellos con HP al ejercicio exhibieron valores reducidos de la presión de CO2 exahalada en el umbral anaeróbico (32,8±3,0 frente a 36,2±3,3mmHg; p=0,021) y mayor pendiente Ve/VCO2 (34,2±4,8 frente a 30,7±5,0; p=0,049).
ConclusionesLa HP precapilar al ejercicio se asocia con limitación funcional e ineficiencia ventilatoria en un subgrupo de pacientes con trombosis arterial pulmonar crónica y disnea persistente.
Palabras clave
La enfermedad tromboembólica crónica (ETEC) se define como la trombosis persistente en el lecho vascular pulmonar tras uno o varios episodios de embolia pulmonar (EP) sintomática pese a una correcta anticoagulación durante al menos 3 meses y sin hipertensión pulmonar (HP) en reposo. Se especula que la limitación funcional podría explicarse por la existencia de microvasculopatía que condiciona el desarrollo de HP en durante el ejercicio y se expresa como disnea de esfuerzo1,2. Se desconocen su incidencia y la posible historia natural de esta entidad3.
El síndrome posembólico engloba a todo paciente con persistencia de la disnea tras uno o varios episodios de EP. Se estima una prevalencia del 60% en las series en seguimiento tras una EP4,5. La resolución incompleta de trombos se ha objetivado en un 23-50% de las series, y son en su mayoría un hallazgo casual y asintomático, y no se lo considera per se ETEC6. Por el contrario, la incidencia de hipertensión pulmonar tromboembólica crónica (HPTEC) es del 2-3% tras una EP sintomática a los 2 años de seguimiento5. Este hecho no justifica el cribado de esta entidad en todos los pacientes que han padecido EP. El seguimiento estructurado de estos pacientes ha ayudado a caracterizar y seleccionar a aquellos que pudieran tener riesgo por la aparición de HPTEC o definir nuevas entidades como la ETEC, que pueden tener implicaciones pronósticas5,7. En este escenario la hemodinámica de ejercicio ha tenido especial interés, dado que la aparición de HP de ejercicio podría ser reflejo de una vasculopatía incipiente o estar causada por la oclusión crónica del lecho pulmonar8. La vigente guía de la ESC/ERS establece el criterio que define la HP de ejercicio cuando la relación presión arterial pulmonar media (PAPm)/gasto cardiaco (GC) obtenida durante el esfuerzo es >3mmHg/l/min9.
La prueba de esfuerzo cardiopulmonar (PECP) ha tomado un papel relevante en el estudio de los pacientes en seguimiento tras una EP10,11. La ineficiencia ventilatoria, entendida como la necesidad progresiva de incrementar la ventilación para conseguir un intercambio gaseoso eficaz, se muestra como el hallazgo más característico en los pacientes que padecen HPTEC, a diferencia de los pacientes con HP de otros grupos, y es signo de alarma en el seguimiento tras una EP6,12.
La hipótesis principal que sustenta nuestro estudio se basa en que existe un subgrupo de pacientes con trombosis persistente cuya limitación funcional después de una EP se explica por una respuesta hemodinámica patológica durante el ejercicio, identificable mediante cateterismo cardiaco derecho (CCD) de ejercicio y cuyo diagnóstico de sospecha podría establecerse mediante técnicas no invasivas como la PECP. Para ello, el presente estudio analiza el comportamiento hemodinámico al esfuerzo de una cohorte de pacientes con disnea y trombosis persistente tras una EP y su relación con los valores alcanzados en la ergoespirometría.
MÉTODOSPacientesEstudio observacional formado por una cohorte de pacientes mayores de 18 años en seguimiento tras una EP remitidos a la unidad de HP con diagnóstico de sospecha de HPTEC. Los criterios de inclusión fueron: a) presencia de síntomas (clase funcional ≥ II); b) defectos de perfusión persistentes en gammagrafía ventilación/perfusión e imágenes de trombosis crónica en el lecho pulmonar tras 3 meses de correcta anticoagulación; c) estudio hemodinámico basal con ausencia de HP significativa incluyendo aquellos con PAPm <25mmHg, resistencia vascular pulmonar (RVP) <3 UW y presión capilar pulmonar (PCP) ≤ 15mmHg; d) ausencia de cardiopatía izquierda; e) ausencia de enfermedad pulmonar (tabla 1 del material adicional), y f) consentimiento informado para participar en el estudio. El protocolo del estudio fue aprobado por el comité de ética de nuestro centro.
Diseño del estudioTras una evaluación clínica inicial, se incluía al paciente en el protocolo de estudio. La gammagrafía de ventilación/perfusión y la angiografía arterial pulmonar mediante tomografía computarizada se realizó siguiendo protocolos habituales en nuestro centro13. En todos los pacientes se descartó cardiopatía izquierda mediante estudio clínico y ecocardiográfico (EPIQ CVx, Philips Healthcare, Estados Unidos).
La PECP se realizó en un cicloergómetro con análisis continuo de gases y monitorización cardiaca (Blue Cherry Ergoline, Sanro, España). Al inicio de la prueba se realizaron pruebas de función respiratoria para descartar enfermedad obstructiva o restrictiva. Se utilizó un protocolo incremental secuencial de 5 W cada 30 s con carga basal de 20 W. Los parámetros medidos fueron la ventilación (Ve), el consumo de O2 y la producción de CO2. Las variables extraídas para el análisis comprendían: consumo pico de O2 (VO2), equivalentes de CO2 y O2, pendiente Ve/VCO2, presiones parciales al final de la espiración de CO2 (PetCO2) y O2 (PetO2) en reposo, umbral anaeróbico (UA) y pico, OUES y cociente de intercambio gaseoso (RER). Se registraron la frecuencia cardiaca (FC), la presión arterial sistémica (PA), el registro electrocardiográfico continuo y la saturación no invasiva de O2 periférica de todos los pacientes.
En las siguientes 24 h, se realizó CCD de ejercicio en decúbito supino en un cicloergómetro del laboratorio de hemodinámica, utilizando el mismo protocolo de la PECP. A través de acceso venoso periférico con introductor de 7 Fr y catéter con balón de Swan-Ganz (Edwards Lifesciences, Estados Unidos), se realizó estudio hemodinámico basal con medición de presiones en avance. Durante el protocolo de ejercicio se realizó una monitorización continua de la presión pulmonar. La estimación del GC basal se realizó mediante termodilución, usando la media de al menos 3 valores. En ejercicio, por cada estadio al menos se recogió un valor de GC, PCP y saturación venosa mixta. En reposo se obtuvo el dato de la PCP al final de la espiración y en ejercicio, la media digital en un trazado de 10 s. Las variables hemodinámicas calculadas fueron: RVP (PAPm – PCP) / GC y la complianza (volumen sistólico/presión del pulso). Se requirieron al menos 3 mediciones de PAPm, PCP y GC durante el ejercicio para considerar válido el estudio. Se consideró respuesta hemodinámica patológica cuando la pendiente PAPm/GC superó 3mmHg/l/min. Una relación PCP/GC >2mmHg/l/min fue el criterio empleado para desenmascarar la insuficiencia cardiaca con fracción de eyección conservada (IC-FEc)9,14. Se realizó un subanálisis de la respuesta hemodinámica de los pacientes según la presencia o ausencia de HP en reposo con base al nuevo criterio hemodinámico de las vigentes guías de HP (PAPm >20mmHg y RVP >2 UW)9.
Análisis estadísticoSe realizó análisis estadístico mediante Stata v 17.0 (Stata Corp., Estados Unidos). Las variables continuas se compararon mediante la prueba de la t de Student o la de Wilcoxon según la normalidad de datos y la prueba de la χ2 en el caso de datos categóricos. Se estimó la relación de presión-volumen individualmente mediante regresión lineal de los puntos obtenidos durante el ejercicio (PAPm/GC y PCP/GC). La asociación entre variables continuas se estableció con los coeficientes de correlación de Pearson. Mediante curvas ROC, se analizaron la sensibilidad y la especificidad óptimas y el área bajo la curva (AUC) de cada parámetro de la PECP para la discriminación de respuesta hemodinámica patológica al ejercicio. Se consideró significación estadística en caso de p <0,05.
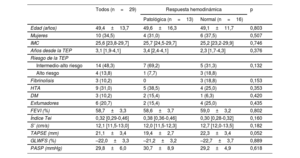
RESULTADOSCaracterísticas basales de la poblaciónEntre los 36 pacientes inicialmente seleccionados, se excluyó a 4 por calidad subóptima en el registro hemodinámico de esfuerzo y se validaron 32 estudios (88,8%) para el análisis. De ellos, 16 pacientes (50%) mostraron HP al ejercicio: en 3 de ellos la HP al ejercicio era de origen poscapilar y desenmascaró una IC-FEc (figura 1). El estudio se centró en los 29 pacientes restantes para comparar a los que presentaron HP precapilar de ejercicio (ETEC) con los que mostraron respuesta hemodinámica normal al esfuerzo. No hubo complicaciones en ningún estudio. Las características basales de los 29 pacientes se resumen en la tabla 1. No se observó diferencia en el perfil de riesgo cardiovascular, la edad ni el sexo según la respuesta hemodinámica al ejercicio. El tiempo transcurrido entre la EP y el estudio hemodinámico fue similar en ambos grupos (mediana, 3,4 [2,4-4,1] frente a 2,3 [1,7-4,3] años; p=0,376). El total de nuestros pacientes estaban en clase funcional II de la New York Heart Association (NYHA). Ningún paciente estaba recibiendo tratamiento con vasodilatadores pulmonares. No se objetivaron datos ecocardiográficos que indicaran disfunción diastólica de ventrículo izquierdo en el estudio basal independientemente de la respuesta hemodinámica al esfuerzo de los pacientes analizados (tabla 2 del material adicional).
Características basales de la población total incluida en el estudio y estratificada según la respuesta hemodinámica al ejercicio
| Todos (n=29) | Respuesta hemodinámica | p | ||
|---|---|---|---|---|
| Patológica (n=13) | Normal (n=16) | |||
| Edad (años) | 49,4±13,7 | 49,6±16,3 | 49,1±11,7 | 0,803 |
| Mujeres | 10 (34,5) | 4 (31,0) | 6 (37,5) | 0,507 |
| IMC | 25,6 [23,8-29,7] | 25,7 [24,5-29,7] | 25,2 [23,2-29,9] | 0,746 |
| Años desde la TEP | 3,1 [1,9-4,1] | 3,4 [2,4-4,1] | 2,3 [1,7-4,3] | 0,376 |
| Riesgo de la TEP | ||||
| Intermedio-alto riesgo | 14 (48,3) | 7 (69,2) | 5 (31,3) | 0,132 |
| Alto riesgo | 4 (13,8) | 1 (7,7) | 3 (18,8) | |
| Fibrinolisis | 3 (10,2) | 0 | 3 (18,8) | 0,153 |
| HTA | 9 (31,0) | 5 (38,5) | 4 (25,0) | 0,353 |
| DM | 3 (10,2) | 2 (15,4) | 1 (6,3) | 0,420 |
| Exfumadores | 6 (20,7) | 2 (15,4) | 4 (25,0) | 0,435 |
| FEVI (%) | 58,7±3,3 | 58,6±3,7 | 59,0±3,2 | 0,802 |
| Índice Tei | 0,32 [0,29-0,46] | 0,38 [0,36-0,46] | 0,30 [0,28-0,32] | 0,160 |
| S’ (cm/s) | 12,1 [11,5-13,0] | 12,0 [11,5-12,3] | 12,7 [12,0-13,5] | 0,182 |
| TAPSE (mm) | 21,1±3,4 | 19,4±2,7 | 22,3±3,4 | 0,052 |
| GLWFS (%) | –22,0±3,3 | –21,2±3,2 | –22,7±3,7 | 0,889 |
| PASP (mmHg) | 29,8±6,0 | 30,7±8,9 | 29,2±4,9 | 0,618 |
DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; GLWFS: strain de la pared libre del ventrículo derecho; HTA: hipertensión arterial; IMC: índice de masa corporal; PASP: presión de la arteria pulmonar estimada; TEP: tromboembolia pulmonar.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
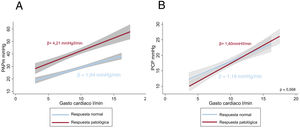
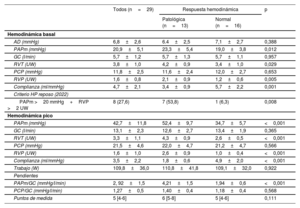
De la cohorte analizada, 13 pacientes mostraron una respuesta hemodinámica patológica en el ejercicio (4,21±1,5 frente a 1,94±0,6mmHg/l/min) (figura 2A). Los valores hemodinámicos basales y en esfuerzo máximo se muestran en la tabla 2. Aquellos con respuesta patológica muestran mayor PAPm (23,3±5,4 frente a 19,0±3,8mmHg; p=0,012), mayor RVP en reposo (2,1±0,9 frente a 1,2±0,6 UW; p=0,005), con similar gasto cardiaco (5,7±1,3 frente a 5,7±1,1 l/min; p=0,957) y valores medios de PCP similares (11,6±2,5 frente a 12,0±2,7mmHg; p=0,653). La PAPm en pico de esfuerzo fue significativamente mayor en los pacientes con respuesta patológica (52,4±9,7 frente a 34,7±5,7mmHg; p<0,001), el GC pico medio fue similar en ambos grupos (12,6±2,7 frente a 13,4±1,9 l/min; p=0,365), sin diferencias en la PCP media en el pico de ejercicio (22,0±4,7 frente a 21,2±4,7mmHg; p=0,566). La relación PCP/GC no mostró diferencias significativas en la cohorte analizada según la aparición de HP al ejercicio (1,40±0,4 frente a 1,18±0,4mmHg/l/min; p=0,568) (figura 2B).
Patrones de respuesta hemodinámica al esfuerzo en la cohorte de pacientes con enfermedad tromboembólica crónica. A: pendiente PAPm/GC medio según la respuesta hemodinámica. B: pendiente PCP/GC según respuesta hemodinámica. GC: gasto cardiaco; PAPm: presión arterial pulmonar media; PCP: presión capilar pulmonar.
Resultados hemodinámicos basales y en pico de esfuerzo máximo de ejercicio estratificados según la respuesta hemodinámica
| Todos (n=29) | Respuesta hemodinámica | p | ||
|---|---|---|---|---|
| Patológica (n=13) | Normal (n=16) | |||
| Hemodinámica basal | ||||
| AD (mmHg) | 6,8±2,6 | 6.4±2,5 | 7,1±2,7 | 0,388 |
| PAPm (mmHg) | 20,9±5,1 | 23,3±5,4 | 19,0±3,8 | 0,012 |
| GC (l/min) | 5,7±1,2 | 5,7±1,3 | 5,7±1,1 | 0,957 |
| RVT (UW) | 3,8±1,0 | 4,2±0,9 | 3,4±1,0 | 0,029 |
| PCP (mmHg) | 11,8±2,5 | 11,6±2,4 | 12,0±2,7 | 0,653 |
| RVP (UW) | 1,6±0,8 | 2,1±0,9 | 1,2±0,6 | 0,005 |
| Complianza (ml/mmHg) | 4,7±2,1 | 3,4±0,9 | 5,7±2,2 | 0,001 |
| Criterio HP reposo (2022) | ||||
| PAPm >20 mmHg+RVP >2 UW | 8 (27,6) | 7 (53,8) | 1 (6,3) | 0,008 |
| Hemodinámica pico | ||||
| PAPm (mmHg) | 42,7±11,8 | 52,4±9,7 | 34,7±5,7 | <0,001 |
| GC (l/min) | 13,1±2,3 | 12,6±2,7 | 13,4±1,9 | 0,365 |
| RVT (UW) | 3,3±1,1 | 4,3±0,9 | 2,6±0,5 | <0,001 |
| PCP (mmHg) | 21,5±4,6 | 22,0±4,7 | 21,2±4,7 | 0,566 |
| RVP (UW) | 1,6±1,0 | 2,6±0,9 | 1,0±0,4 | <0,001 |
| Complianza (ml/mmHg) | 3,5±2,2 | 1,8±0,6 | 4,9±2,0 | <0,001 |
| Trabajo (W) | 109,8±36,0 | 110,8±41,8 | 109,1±32,0 | 0,922 |
| Pendientes | ||||
| PAPm/GC (mmHg/l/min) | 2, 92±1,5 | 4,21±1,5 | 1,94±0,6 | <0,001 |
| PCP/GC (mmHg/l/min) | 1,27±0,5 | 1,40±0,4 | 1,18±0,4 | 0,568 |
| Puntos de medida | 5 [4-6] | 6 [5-8] | 5 [4-6] | 0,111 |
AD: aurícula derecha; GC: gasto cardiaco; HP: hipertensión pulmonar; PAPm: presión arterial pulmonar media; PCP: presión capilar pulmonar; RVP: resistencia vascular pulmonar; RVT: resistencia vascular total.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo inercuartílico].
La RVP y la complianza vascular en reposo mostraron asociación con la pendiente PAPm/GC (r=0,654, p=0,001 y r=–0,529, p=0,008 respectivamente). Por su parte, la PAPm basal no presentó asociación con la pendiente PAPm/GC (r=0,333, p=0,083).
De la cohorte analizada, 8 pacientes (27,6%) cumplían el actual criterio hemodinámico de HP en reposo (PAPm >20mmHg y RVP >2 UW). De estos, 7 pacientes (88%) mostraron HP al ejercicio.
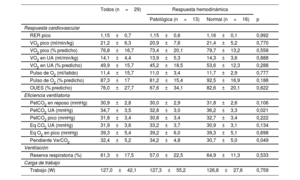
Prueba de esfuerzo cardiopulmonar y respuesta hemodinámica al ejercicioLos parámetros derivados de la PECP en la cohorte analizada se muestran en la tabla 3. Ambos grupos alcanzaron una carga de trabajo similar (127,3±55,2 frente a 126,8±27,6 W; p=0,759) e hicieron una prueba máxima con un RER pico medio parecido (1,15±0,6 frente a 1,16±0,1; p=0,992). No hubo diferencias en la respuesta tensional, la frecuencia cardiaca ni la saturación periférica según la respuesta hemodinámica al ejercicio (tabla 3 del material adicional). El VO2 pico no mostró diferencias significativas entre ambos grupos, con disminución ligera en valores predichos en ambos grupos (73,4±20,1 frente a 79,7±13,2%; p=0,558).
Variables en la prueba de esfuerzo de la cohorte analizada
| Todos (n=29) | Respuesta hemodinámica | |||
|---|---|---|---|---|
| Patológica (n=13) | Normal (n=16) | p | ||
| Respuesta cardiovascular | ||||
| RER pico | 1,15±0,7 | 1,15±0,6 | 1,16±0,1 | 0,992 |
| VO2 pico (ml/min/kg) | 21,2±6,3 | 20,9±7,6 | 21,4±5,2 | 0,770 |
| VO2 pico (% predicho) | 76,8±16,7 | 73,4±20,1 | 79,7±13,2 | 0,558 |
| VO2 en UA (ml/min/kg) | 14,1±4,4 | 13,9±5,3 | 14,3±3,6 | 0,888 |
| VO2 en UA (% predicho) | 49,9±15,7 | 45,2±18,5 | 53,6±12,3 | 0,288 |
| Pulso de O2 (ml/latido) | 11,4±15,7 | 11,0±3,4 | 11,7±2,9 | 0,777 |
| Pulso de O2 (% predicho) | 87,3±17 | 81,2±15,4 | 92,5±16,9 | 0,188 |
| OUES (% predicho) | 76,0±27,7 | 67,6±34,1 | 82,6±20,1 | 0,622 |
| Eficiencia ventilatoria | ||||
| PetCO2 en reposo (mmHg) | 30,9±2,8 | 30,0±2,9 | 31,8±2,6 | 0,106 |
| PetCO2 UA (mmHg) | 34,7±3,5 | 32,8±3,0 | 36,2±3,3 | 0,021 |
| PetCO2 pico (mmHg) | 31,8±3,4 | 30,8±3,4 | 32,7±3,4 | 0,222 |
| Eq CO2 UA (mmHg) | 31,9±3,6 | 33,2±3,7 | 30,9±3,1 | 0,134 |
| Eq O2 en pico (mmHg) | 39,3±5,4 | 39,2±6,0 | 39,3±5,1 | 0,698 |
| Pendiente Ve/CO2 | 32,4±5,2 | 34,2±4,8 | 30,7±5,0 | 0,049 |
| Ventilación | ||||
| Reserva respiratoria (%) | 61,3±17,5 | 57,0±22,5 | 64,9±11,3 | 0,533 |
| Carga de trabajo | ||||
| Trabajo (W) | 127,0±42,1 | 127,3±55,2 | 126,8±27,6 | 0,759 |
EqCO2: equivalentes de CO2; PetCO2: presión al final de la espiración de CO2; RER: cociente respiratorio; UA: umbral anaeróbico; Ve: ventilación pulmonar; EqO2: equivalentes de O2; VO2: consumo de O2.
Los valores expresan n (%) o media±desviación estándar.
En las variables de eficiencia ventilatoria, se objetivó un valor significativamente inferior en la PetCO2 en el UA en aquellos pacientes con HP al ejercicio (32,8±3,0 frente a 36,2±3,3mmHg; p=0,021) y una pendiente Ve/CO2 más pronunciada en este grupo de pacientes (34,2±4,8 frente a 30,7±5,0; p=0,049)
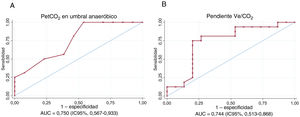
Las PetCO2 en el UA y la pendiente Ve/CO2 mostraron una correlación moderada con la pendiente PAPm/GC (r=-0,544, p=0,002; r=0,594, p<0,001 respectivamente). La capacidad de discriminación para el diagnóstico de HP de ejercicio de los parámetros de eficiencia ventilatoria fue: PetCO2 en el UA (AUC=0,750; intervalo de confianza del 95% [IC95%], 0,567-0,933) y de la pendiente Ve/VCO2 (AUC=0,744; IC95, 0,513-0,868) (figura 3). En la cohorte analizada, un valor de PetCO2 <33mmHg en el UA mostró una sensibilidad y una especificidad del 100 y el 46,5% para la detección de HP de ejercicio con un valor predictivo negativo del 100%. Por su parte, la pendiente Ve/VCO2 media >31,5 alcanzo sensibilidad y especificidad del 80,4 y el 50,0%, con un valor predictivo negativo del 80,0%.
Análisis de sensibilidad y especificad de variables relacionadas con la eficiencia ventilatoria obtenidas en la prueba de esfuerzo cardiopulmonar y la respuesta hemodinámica al ejercicio. UC: área bajo la curva; IC95%: intervalo de confianza del 95%; PetCO2: presiones al final de la espiración de CO2.
El estudio muestra una de las cohortes más grandes publicadas con uso de CCD de ejercicio en la evaluación diagnostica de la ETEC. Los hallazgos principales son: a) el 40,6% de pacientes con sospecha ETEC sin HP en reposo presentan una respuesta hemodinámica patológica durante el ejercicio con perfil de vasculopatía pulmonar; b) el 88% de los pacientes con PAPm entre 20-25mmHg y RVP entre 2 y 3 UW presentaron HP al ejercicio; c) el CCD de ejercicio es un medio útil para desenmascarar IC-FEc como causa de la disnea, y d) la ineficiencia ventilatoria en la PECP se relaciona con la presencia de HP al ejercicio.
La EP supone la tercera causa de ingreso por un síndrome de origen cardiovascular con una incidencia de entre 48 y 115 casos/100.000 habitantes, por detrás del infarto agudo de miocardio y el ictus15. El síndrome posembólico surge tras el seguimiento estructurado de estos pacientes y engloba desde la trombosis pulmonar persistente asintomática hasta la HPTEC4. La alta proporción de pacientes que presentan limitación funcional o disnea persistente contrasta con la baja incidencia en las cohortes prospectivas que finalmente contraen HPTEC5. En esta última, existe una vasculopatía asociada con el componente obstructivo cuya mortalidad sin tratamiento se asemeja a la de los pacientes con HP del grupo 1 no tratados16. La preocupación de las distintas sociedades científicas por la dimensión del problema queda patente en el diseño de algoritmos de seguimiento tras una EP, vigentes en la actual guía de la ESC/ERS17, en la que se intenta dar una respuesta a través del manejo multidisciplinar de estos pacientes. El desacondicionamiento muscular y las comorbilidades cardiovasculares parecen tener un peso importante en relación con la disnea persistente tras la EP; sin embargo, no explica el conjunto de pacientes, fundamentalmente adultos jóvenes con limitación funcional sin otras comorbilidades. Nuestra cohorte es un ejemplo de esta población: pacientes en edades medias de la vida (49,4±13,7 años), deterioro de la clase funcional o aparición de disnea de novo tras una EP que presentan trombosis persistente de arterias pulmonares sin HP en reposo y sin otras causas de disnea. La ETEC surge como entidad en la que se especula que el material trombótico residual conlleva una disfunción vascular al esfuerzo puesta de manifiesto por una respuesta hemodinámica patológica, y aún se desconoce si es un paso previo al desarrollo de HPTEC1,2,9.
El CCD de ejercicio realizado en estos pacientes resulta en 3 tipos de respuesta hemodinámica: a) HP al ejercicio precapilar en 13 pacientes; b) HP poscapilar al ejercicio en 3 pacientes, y c) respuesta hemodinámica normal en 16 pacientes. Una respuesta patológica precapilar implica vasculopatía presente o repercusión del material trombótico y, por lo tanto, el diagnóstico de ETEC. Este subgrupo de pacientes parte de una PAPm superior, y muestra un incremento desproporcionado de la PAPm durante el ejercicio a similar incremento de GC en comparación con los que tienen una respuesta normal. Delcroix et al.18 realizaron una valoración cardiopulmonar exhaustiva de pacientes con ETEC e HPTEC y valoraron los cambios en los volúmenes del ventrículo derecho mediante resonancia magnética cardiaca de ejercicio, con medición invasiva de presiones simultánea. Los 14 pacientes con ETEC estudiados tenían características similares a las de nuestro estudio y mostraban una respuesta al ejercicio caracterizada por un aumento desproporcionado de la poscarga, reflejada en la pendiente PAPm/GC media de 3,5 (2,2-4,4) mmHg/l/min. Esta respuesta se asoció a su vez con una insuficiente reducción del volumen telesistólico del ventrículo derecho esperado cuando se comparaba con un grupo de 13 adultos sanos, lo que implica una reducción en la fracción de eyección del ventrículo derecho. Estos hallazgos presentan a la ETEC como un fenotipo intermedio comparado con la HPTEC, en la que existe una dilatación del ventrículo derecho en reposo y ausencia de reserva contráctil que impide aumentar el gasto en esfuerzo.
La intervención sobre el material obstructivo en pacientes con síntomas pero sin HP en reposo ha demostrado beneficio clínico y hemodinámico. Taboada et al.19 comunicaron la primera serie de tromboendarterectomía en 42 pacientes con diagnóstico de ETEC, con mejoría de la clase funcional en el 95% de la cohorte, sin mortalidad hospitalaria, pero con un 40% de complicaciones. En la misma línea, nuestro grupo presentó un análisis de los pacientes intervenidos quirúrgicamente sin HP en reposo, con resultados similares20. Por su parte, el grupo de Guth et al.21 demostró, en una cohorte de 12 pacientes con ETEC sometidos a tromboendarterectomía pulmonar, la normalización de la respuesta hemodinámica al ejercicio (cambio de la relación media PAPm/GC de 3,6±1,0mmHg/l/min antes de la intervención a 2,3±0,8mmHg/l/min después; p=0,002). Estas series tienen en común la inclusión de pacientes con una media de edad de 35-55 años, sin comorbilidad y material trombótico crónico bilateral proximal accesible quirúrgicamente, con una PAPm en reposo de 20-25mmHg y RVP de 1,8-3 UW. En la era de la angioplastia pulmonar, la ETEC ha sido objeto de interés por su baja tasa de complicaciones, con resultados clínicos superponibles a los de las series quirúrgicas22,23. La evidencia de estas series sirve para otorgar una recomendación IIa con nivel de evidencia C a la intervención sobre el material trombótico de pacientes seleccionados con diagnóstico de ETEC en quienes se ha excluido otras causas de disnea9.
La hemodinámica en ejercicio en todos los grupos de HP ha tenido interés en estos últimos años, si bien la limitación de su utilidad radicaba en establecer el límite patológico, dada la heterogeneidad en edad, sexo y comorbilidades de los pacientes incluidos en los estudios publicados14. La reciente guía de la ESC/ERS para el diagnóstico y el tratamiento de la HP definen el criterio de HP al ejercicio y reducen los puntos de corte de la definición de HP precapilar en reposo (PAPm >20mmHg, RVP >2 UW y PCP ≤ 15mmHg)9. La modificación de la definición no implica el tratamiento de los pacientes en estos valores hemodinámicos. En los pacientes con sospecha de ETEC, se recomienda evaluar detalladamente si la disnea no tiene otra posible explicación, valorando la respuesta patológica al ejercicio (HP al ejercicio) y descartando otras causas como la IC-FEc. En este sentido, nuestro estudio aporta conocimiento sobre pacientes antes considerados en zona gris y refuerza el cambio de criterio hemodinámico, ya que, de los pacientes estudiados, 8 cumplieron el nuevo criterio hemodinámico vigente de HP en reposo. Todos excepto 1 paciente de este subgrupo mostraron HP al ejercicio. Por otro lado, de los 21 pacientes con hemodinámica normal en reposo (PAPm <20mmHg y RVP <2 UW), en 6 se halló HP precapilar al ejercicio. De esta forma, en nuestra experiencia, el criterio hemodinámico actual identifica a la mayoría de los pacientes que sufren HP al ejercicio. Sin embargo, sigue existiendo un grupo de pacientes en los que la normalidad de la PAPm en reposo durante el estudio de la ETEC no implica una respuesta normal al ejercicio.
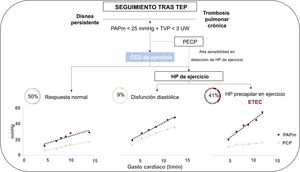
En nuestra opinión, el estudio mediante CCD de ejercicio en estos pacientes puede ser una medida decisiva en la selección de aquellos que se podrían beneficiar de tratamiento intervencionista sobre el componente obstructivo. Se trata de una técnica diagnóstica segura, con un tasa de complicaciones similares a la descritas en la realización de CCD basales14. A este respecto, en nuestra serie no se produjo ninguna complicación. Además, el CCD de ejercicio permitió desenmascarar IC-FEc como origen de la disnea de esfuerzo en 3 pacientes, lo que motivó que se reconsiderara la causa subyacente por el hallazgo de una relación PCP/GC en ejercicio >2mmHg/l/min, lo cual además añade valor diagnóstico y pronóstico24. Este aspecto otorga mayor valor al CCD de esfuerzo en el estudio de pacientes sintomáticos con sospecha de ETEC sin HP en reposo, ya que, pese a no tener datos indirectos ecocardiográficos ni en el CCD basal de elevación de presiones de llenado izquierdas, en nuestra cohorte un 9% de pacientes mostraron HP en esfuerzo de origen poscapilar (figura 4).
Figura central. Resultados hemodinámicos obtenidos en el CCD de ejercicio en una cohorte de pacientes con sospecha de ETEC. CCD: cateterismo derecho; ETEC: enfermedad tromboembólica crónica; HP: hipertensión pulmonar; PAPm: presión arterial pulmonar media; PCP: presión de enclavamiento pulmonar; PECP: prueba de esfuerzo cardiopulmonar; RVP: resistencia vascular pulmonar; TEP: tromoembolia pulmonar.
Por su parte, la PECP es una prueba no invasiva de gran utilidad para la caracterización de la disnea en multitud de afecciones. En nuestra cohorte, ambos grupos presentaron valores de VO2 pico levemente reducidos, un hallazgo previamente descrito en el seguimiento de pacientes tras una EP25. No obstante, aquellos que presentaron HP de ejercicio mostraron alteraciones en el comportamiento de las variables de eficiencia ventilatoria (PetCO2, VCO2, pendiente Ve/VCO2), especialmente en su valoración del UA. El grado de ineficiencia ventilatoria parece estar en relación con la situación hemodinámica de los pacientes con HPTEC y la ETEC se muestra como un fenotipo intermedio entre pacientes sanos y aquellos con HPTEC en reposo18. Es llamativo que nuestra serie mostrara valores medios de la pendiente Ve/CO2 y la PetCO2 menos alteradas que en otras series publicadas en el contexto de la ETEC26. Una posible explicación podría ser la menor media de edad de nuestra cohorte y la eliminación del análisis de los pacientes que en ejercicio presentaron datos compatibles con IC-FEc. En nuestros pacientes, pese al pequeño tamaño muestral, el uso de la cinética de las PetCO2, en especial su valor en el UA, así como la relación Ve/VCO2 extraída de la PECP muestran una capacidad aceptable de discriminar a los pacientes que después sufren HP de ejercicio. Dados los resultados obtenidos en nuestra cohorte, que requieren una validación externa con mayor número de pacientes, se puede considerar que una PECP normal excluye el desarrollo de HP en ejercicio en pacientes en seguimiento tras una EP. De esta manera, se propone la PECP como un instrumento de cribado en el estudio de la disnea previo a la realización de estudios invasivos como el CCD de ejercicio.
LimitacionesSe trata de un estudio unicéntrico y transversal con un tamaño muestral pequeño que muestra la asociación entre la HP al ejercicio y la ineficiencia ventilatoria en la PCEP, sin embargo, no puede afirmarse que la presencia de ineficiencia ventilatoria o HP al ejercicio sea la causa de la disnea persistente, ya que no se ha realizado seguimiento clínico de la población del estudio.
Los pacientes estudiados no representan al total de la población incluida dentro del síndrome posembólico, dado el bajo perfil de riesgo cardiovascular y la ausencia de comorbilidades. Es una población seleccionada por sospecha de HPTEC remitida a la unidad de HP de nuestro centro para valoración de opciones terapéuticas ante la persistencia de los síntomas, por lo cual podría explicar una mayor prevalencia de HP al ejercicio.
La nueva definición de HP en reposo aceptada durante el desarrollo del proyecto afecta a los criterios de inclusión; sin embargo, dado que no hay evidencia ni recomendación de tratamiento para los pacientes con HP leve según los criterios hemodinámicos actuales, se ha mantenido como población de estudio a los pacientes con PAPm entre 20 y 24mmHg y RVP entre 2 y 3 UW, realizándose un subanálisis siguiendo este criterio.
CONCLUSIONESEn una población con disnea persistente tras una EP y trombosis crónica del lecho pulmonar sin otras causas que expliquen los síntomas, la HP precapilar al ejercicio se asocia con limitación funcional. En este contexto, el CCD de ejercicio es una técnica útil en el estudio de la disnea persistente de causa desconocida, ya que diferencia la HP al ejercicio precapilar, expresión de una posible microvasculopatía pulmonar subyacente, de la HP al ejercicio poscapilar típica de la IC-FEc. Por su parte, la PECP es un medio no invasivo que permite discriminar la presencia de HP al ejercicio.
- –
La respuesta hemodinámica al ejercicio tiene interés en el estudio de la disnea de esfuerzo sin HP.
- –
La limitación funcional tras una EP es un problema frecuente con causas diversas y necesidad de tratamiento multidisciplinario.
- –
La enfermedad tromboembólica crónica sin hipertensión pulmonar se diagnostica con mayor frecuencia por la estructuración en el seguimiento tras una embolia pulmonar.
- –
Se halla HP al ejercicio, diagnosticada mediante CCD de ejercicio, en un subgrupo de pacientes con limitación funcional tras una embolia de pulmón.
- –
La identificación de estos pacientes podría tener implicaciones pronósticas, dado que podrían beneficiarse de tratamiento invasivo o farmacológico precoz que pudiera modificar su pronóstico y su calidad de vida.
- –
La ineficiencia ventilatoria en la PECP tiene valor para el diagnóstico no invasivo en pacientes que sufren HP de ejercicio.
El presente proyecto se enmarca en las becas de ayuda a la investigación concedida por la Sociedad Española de Cardiología en 2019. Alejandro Cruz-Utrilla ha recibido la beca Río Hortega del Instituto de Salud Carlos III del Ministerio de Ciencia e Innovación de España (CM20/00164).
CONTRIBUCIÓN DE LOS AUTORESS. Huertas, M. Velázquez y P. Escribano idearon y diseñaron el proyecto. S. Huertas, M. Velazquez, F. Sarnago, N. Maneiro, C. Jiménez y T. Segura de la Cal han contribuido en la selección de pacientes, realización de pruebas invasivas y análisis de datos.
A. Flox, T.A. Cruz, R. Aguilar, M.J. López, C. Andrés, Y. Revilla, S. Alonso, C. Gómez y F. Arribas han contribuido en la selección y el seguimiento de pacientes incluidos. Todos los autores han contribuido en la redacción y la lectura crítica del manuscrito. Todos los autores han aprobado la versión final del artículo y son responsables del contenido publicado.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.