Se evaluaron los resultados ecocardiográficos al mes en 22 pacientes con estenosis aórtica valvular tratados con prótesis CoreValve, con especial interés en la valoración de fugas valvulares y el grosor de paredes ventriculares izquierdas. Realizamos ecocardiograma previo al implante, al alta y al mes. La media de edad fue de 77±4 años. Al alta 16 pacientes (76%) tenían regurgitación aórtica: 8 de grado I y 8 de grado II. Al mes sólo 13 (62%) la presentaban: 10 en grado I y 3 en grado II, y se redujo al menos un grado en 8 pacientes (38%) (p<0,005). Se redujo el grosor septal (14,2±2 mm basal frente a 11±2,4 mm al mes; p<0,001) y de pared posterior (10,9±2,4 mm basal frente a 8,3±1,2 mm al mes; p<0,001).
En nuestra serie, la frecuencia y el grado de regurgitación aórtica residual tras el implante de la prótesis CoreValve disminuyeron al mes, y además se observó un remodelado ventricular favorable.
Palabras clave
El implante de prótesis aórticas percutáneas está demostrando ser una buena alternativa en pacientes con estenosis aórtica severa y elevado riesgo quirúrgico, con tasas de éxito inicial del 75-88%1,2,3,4.
Sin embargo, hay menos datos acerca de su durabilidad, así como de su repercusión en la función ventricular5. Estudios con prótesis de Edwards han demostrado una reducción de los gradientes transvalvulares3,6, y parámetros como la fracción de eyección e hipertrofia ventricular izquierda también tienen un papel indudable en la evolución y el pronóstico de estos pacientes. Por último, la evolución de las fugas valvulares tras el implante determinarán el resultado a largo plazo de estas prótesis. Hasta la fecha, existen escasos estudios respecto al remodelado precoz del ventrículo izquierdo, así como de la evolución de las fugas protésicas tras la implantación de la prótesis CoreValve1,5.
Nuestro objetivo es evaluar, en nuestra serie inicial de pacientes, los resultados ecocardiográficos precoces, centrándonos fundamentalmente en el grado de regurgitación de la prótesis y en la hipertrofia ventricular izquierda.
MétodosDiseño y definicionesEl estudio diseñado corresponde a una serie de casos. Como variable principal se analizó la existencia y el grado de regurgitación protésica, cuantificándolo de I, leve, a IV, severa. Como variables secundarias se valoraron: el grado de estenosis aórtica, el área valvular aórtica efectiva y la hipertrofia ventricular izquierda mediante la medición de septo interventricular y pared posterior.
PacientesDesde el 24 de abril al 12 de diciembre de 2008 se han implantado 22 bioprótesis aórticas percutáneas CoreValve en pacientes con estenosis aórtica severa sintomática. De todos los pacientes se obtuvo consentimiento informado, y un comité de implantación de prótesis CoreValve los supervisó.
Criterios de inclusiónSe incluyó en el estudio a todos los pacientes a los que se implantó una prótesis CoreValve y tuvieran un seguimiento de al menos 1 mes.
Mediciones con ecocardiograma transtorácicoSe realizó con el mismo ecocardiógrafo (Philips iE33), en todos los estudios. Se valoró la función ventricular por Teicholz. El grado de regurgitación prótesica se determinó cuantificando la profundidad y anchura del jet, según lo recomendado por otros autores y las guías de ecocardiografía7,8, y se recogió también la localización (paravalvular, transvalvular) y el número de chorros. Se midieron los gradientes aórticos máximo y medio y el área aórtica con ecuación de continuidad. Las mediciones de los diámetros ventriculares y el grosor septal y de pared posterior de ventrículo izquierdo se hicieron en modo M en telediástole, y se promediaron tres ciclos cardiacos si había ritmo sinusal y cinco en caso de fibrilación auricular).
SeguimientoA todos los pacientes supervivientes al procedimiento, se les realizó ecocardiograma transtorácico al alta hospitalaria y al mes tras el implante, en los que se valoraron los mismos parámetros que antes del preprocedimiento.
Análisis estadísticoLos datos cuantitativos se presentan como media±desviación estándar. Los datos cualitativos se expresan en porcentajes. Se estudió el ajuste a la distribución normal de las variables cuantitativas mediante el test de Komogorov-Smirnoff. Para la comparación de la evolución de las variables cuantitativas en el seguimiento se utilizó la prueba de la t de Student para datos apareados o el test de Wilcoxon, según los datos se ajustaran o no a la distribución normal. En el caso de las variables cualitativas se utilizó el test de los rangos de Wilcoxon.
Se consideró resultado estadísticamente significativo con un valor de p<0,05.
ResultadosLos pacientes tenían una media de edad de 77 (69-82) años y el 50% eran varones. En la Tabla 1 se resumen las características clínicas basales más relevantes.
Tabla 1. Características basales de los pacientes incluidos
| Clase funcional >II | 8 (36,4) |
| Disnea | 20 (86) |
| Angina | 10 (45) |
| Síncopes | 5 (23) |
| HTA | 13 (59) |
| DM | 4 (18,2) |
| Dislipemia | 10 (45,5) |
| Enfermedad pulmonar crónica | 4 (18,2) |
| Arteriopatía periférica | 1 (4,5) |
| Cirugía cardiaca previa | 2 (9,5) |
| Creatinina (mg/dl) | 0,97±0,28 |
| PSAP (mmHg) | 42,73±12,12 |
| PCP (mmHg) | 20±6,2 |
DM: diabetes mellitus; HTA: hipertensión arterial; PCP: presión capilar pulmonar; PSAP: presión sistólica en arteria pulmonar.
Los datos expresan n (%) o media±desviación estándar.
Tras el implante en los 22 pacientes, uno falleció por taponamiento pericárdico secundario a rotura ventricular izquierda. En el resto fueron exitosos, aunque con bloqueo auriculoventricular completo en 7 pacientes: transitorio en 4 (19%) y persistente en 3, que precisaron marcapasos definitivo (14%).
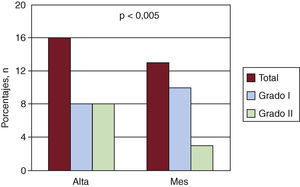
Al alta, había fugas paravalvulares en 16 de 21 pacientes (el 76% de la población de seguimiento) (Figura 1). De ellos, 8 pacientes (50%) presentaban fuga de grado I y 8 pacientes (50%) de grado II. En 5 de los 16 casos (31%), la regurgitación tenía dos chorros de diferente localización, y un único chorro en los 11 restantes. Esto supone 21 chorros en total al alta. Al mes de seguimiento sólo se observó fuga paravalvular en 13 pacientes (62%), grado I en 10 pacientes (77%) y grado II en 3 (23%). En cuanto al número de chorros regurgitantes, quedaron dos chorros diferentes en sólo 3 de los 13 pacientes (23%), y un único chorro en los 10 restantes, lo cual supone un total de 16 chorros de regurgitación al mes de seguimiento. Hubo una reducción significativa en la regurgitación, de al menos un grado, en 8 pacientes (38%) (p<0,005) (Figura 1, Figura 2), así como una reducción en el número absoluto de chorros de 21 a 16. Ningún paciente presentó regurgitaciones mayores que grado II ni transvalvulares.
Figura 1. Evolución al alta hospitalaria y al mes de las fugas perivalvulares en pacientes con prótesis CoreValve.
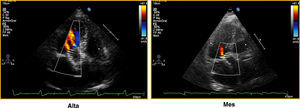
Figura 2. Valoración de grado de regurgitación protésica previo al alta y al mes de seguimiento de un paciente con prótesis CoreValve. Alta: fuga perivalvular grado II; Mes: fuga perivalvular grado I.
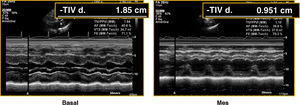
Se observó una reducción significativa al mes de los grosores de ventrículo izquierdo, y el septo pasó de 14,2±2 a 11±2,4 mm y la pared posterior, de 10,9±2,4 a 8,3±1,2 mm, respectivamente (p<0,001) (Tabla 2; Figura 3).
Tabla 2. Parámetros ecocardiográficos previos al procedimiento, al alta hospitalaria y al mes de seguimiento en pacientes con prótesis CoreValve
| Basal | Alta | p | 1 mes | p | |
| FEVI (%) | 71±9 | 71,6±7,6 | NS | 71,9±5,8 | NS |
| SIV (mm) | 14,2±2 | 13,6±3 | NS | 11±2,4 | <0,001 |
| PP (mm) | 10,9±2,4 | 10,8±1,9 | NS | 8,3±1,2 | <0,001 |
| GTAo máximo (mmHg) | 93±17 | 11±5 | <0,001 | 7,4±4 | <0,01 |
| GTAo medio (mmHg) | 60±12 | 6±2,5 | <0,001 | 7,4±4 | <0,01 |
| AVAo (cm2) | 0,6±0,2 | 2,4±0,7 | <0,001 | 2,3±0,9 | <0,001 |
| IM grado I, % de pacientes | 37 | 38 | NS | 36 | NS |
| IM grado II, % de pacientes | 21 | 14 | NS | 19 | NS |
AVAo: área valvular aórtica; FEVI: fracción de eyección del ventrículo izquierdo; GTAo: gradiente transaórtico; IM: insuficiencia mitral; PP: pared posterior; SIV: septo interventricular.
Todas las comparaciones estadísticas se realizaron respecto a los datos basales.
Figura 3. Valoración de hipertrofia ventricular izquierda en ecocardiograma basal y previo al alta de un paciente con prótesis CoreValve. TIVd: grosor de septo interventricular.
DiscusiónLa regurgitación valvular, tras el implante de una prótesis percutánea, es una posible complicación de técnica del procedimiento. En nuestro estudio, no tuvimos ningún caso de regurgitación paravalvular moderada/severa (superior al grado II) tras el implante, a diferencia de otras series2,5. Además, hemos encontrado una reducción precoz en el grado de regurgitación paravalvular tras el implante de la prótesis CoreValve, que se evidenciaba ya al mes de seguimiento, probablemente en relación con la buena adaptabilidad y autoexpansibilidad de la prótesis de nitinol. También es de destacar que durante el seguimiento se apreció una disminución en el número absoluto de chorros, lo que implica que algunos de ellos desaparecieron totalmente a pesar de tratarse de los primeros casos realizados por nuestro grupo, lo que incluiría la curva de aprendizaje inicial.
En estudios previos, la mayoría con prótesis de Edwards, se han observado fugas paravalvulares leves o moderadas tras el procedimiento, con escasos cambios en el seguimiento en su grado de severidad. Así, en la series de Webb et al3 y Cribier et al2 con prótesis de Edward, el grado de regurgitación protésica total permanece sin cambios significativos tras seguimiento de 1 y 2 años respectivamente. Con la prótesis CoreValve, tampoco en la serie de Grube et al1 se observaron diferencias en el grado de regurgitación protésica, en el seguimiento a corto plazo. En cambio, en el estudio de Moss et al4, sí parece que hubo reducción del grado de las fugas en el seguimiento precoz, y la tendencia se mantuvo hasta los 12 meses. No obstante, esta reducción solamente resultó significativa para las regurgitaciones transvalvulares, y no es comparable con nuestros resultados.
Sin embargo, en ningún estudio de los publicados hasta el momento se ha valorado la evolución de la hipertrofia ventricular izquierda. De nuestro análisis se puede deducir que la hipertrofia, como mecanismo compensatorio a la obstrucción del flujo de salida del ventrículo izquierdo, es reversible a corto plazo, lo que hace pensar en el excelente perfil hemodinámico de la prótesis. En otras series se ha observado una mejoría de la función sistólica del ventrículo izquierdo, más llamativa en pacientes con disfunción basal2,3,5, no así en nuestro estudio, probablemente porque no se incluyó a pacientes con disfunción ventricular.
Una limitación en nuestro estudio es la valoración de las fugas en válvulas prótesicas, pues se han seguido las recomendaciones realizadas por Kapur et al8. Otra limitación es el diseño «serie de casos» del estudio, con un reducido número de pacientes y corto periodo de seguimiento. Estudios con un diseño adecuado, mayor número de pacientes y seguimiento más largo establecerán el papel definitivo de esta alternativa terapéutica.
Podemos concluir que, en nuestra serie de pacientes con prótesis aórtica percutánea CoreValve, las fugas paravalvulares en ningún caso han sido severas y su grado y su número se han reducido precozmente de forma significativa.
Al mes tars la implantación ya se observó un remodelado favorable del ventrículo izquierdo, y se apreció reducción de la hipertrofia ventricular, verosímilmente por el excelente perfil hemodinámico de la prótesis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Recibido 9 Julio 2009
Aceptado 9 Febrero 2010
Autor para correspondencia. Servicio de Cardiología, Hospital Universitario Reina Sofía, Avda. Menéndez Pidal, s/n. 14004 Córdoba, España. mamenl@hotmail.com