La tromboembolia pulmonar (TEP) aguda es la tercera causa de mortalidad cardiovascular y su incidencia en España es de 154/100.000 habitantes1. La TEP masiva (presencia de shock, presión arterial sistólica<90mmHg e hipoperfusión orgánica) tiene una mortalidad de hasta el 60%. La terapia con catéter es alternativa a la fibrinolisis sistémica cuando hay alto riesgo de hemorragia y en los casos refractarios.
Recientemente se ha mostrado su eficacia hasta en el 80% de las TEP de alto riesgo con menos del 5% de complicaciones2. La reanimación cardiopulmonar (RCP) extracorpórea consiste en el uso del oxigenador extracorpóreo de membrana con acceso venoarterial (ECMO-VA) de despliegue rápido para proporcionar asistencia circulatoria cuando la RCP convencional no consigue retorno de la circulación espontánea sostenida. Según las guías, debe considerarse como terapia de rescate para pacientes seleccionados. En pacientes con TEP masiva que desarrollan shock refractario o parada cardiorrespiratoria (PCR), el uso de ECMO-VA puede mantener la hemodinámica y la perfusión orgánica como puente a estabilización o a terapias de reperfusión.
A continuación se describe la experiencia inicial con trombectomía mecánica percutánea con ECMO-VA. La canulación la realizaron en la unidad de hemodinámica un hemodinamista y un intensivista experto en ECMO, con cánulas de retorno arterial (17-19 Fr) y de drenaje venoso (21-25 Fr) Bio-Medicus NextGen (Medtronic, Estados Unidos). La máquina de ECMO Novalung (Fresenius, Estados Unidos) estaba cebada. El acceso vascular fue percutáneo ecodirigido con control fluoroscópico, femorofemoral unilateral o bilateral. En todos los pacientes se colocó una cánula de perfusión distal de 6 Fr en la arteria femoral superficial. Se estableció un flujo sanguíneo entre 3-4 lpm y se efectuó la trombectomía durante el mismo procedimiento, tras entrar en ECMO-VA, con acceso por la vena femoral contralateral a la cánula de drenaje venoso. Se utilizó un introductor de 24 Fr Gore DrySeal Flex (Gore Medical, Estados Unidos) y el dispositivo FlowTriever system 24 Curve (Inari Medical, Estados Unidos) para maximizar las aspiraciones. Solo se interrumpió el soporte con ECMO momentáneamente durante la extracción de la vaina del introductor de 24 Fr para evitar la entrada de aire en el sistema ECMO: aunque el oxigenador puede eliminar la entrada de aire, una entrada masiva podría interrumpir el flujo en la bomba centrífuga y el soporte circulatorio. El cierre venoso se realizó con compresión y «sutura en ocho». Tras la trombectomía, se trasladó a los pacientes a la unidad coronaria.
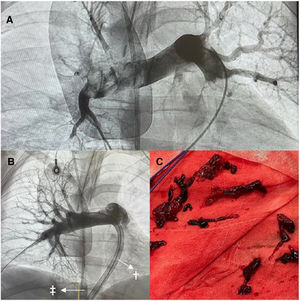
Durante el año 2023 se realizaron 4 procedimientos: 2 en PCR y 2 en shock refractario con fibrinolisis ineficaz. El diagnóstico se realizó con ecocardiografía transtorácica, y la confirmación se efectuó mediante angiografía tras la entrada en ECMO. En todos los pacientes se inició el soporte de forma temprana, durante las primeras 4h desde el diagnóstico. Todos recibieron tratamiento con noradrenalina a una dosis superior a 1μg/kg/min. La edad media fue de 51 años (tabla 1). La mediana de tiempo en ECMO fue de 44h. En todos los casos se realizó trombectomía, por lo que tras el procedimiento se recuperó la perfusión en las arterias pulmonares principales (figura 1A,B). El procedimiento se realizó sin bajar el flujo de ECMO en las aspiraciones, teniendo en cuenta la dependencia del soporte de los pacientes y que la cánula venosa estaba alojada en la entrada de la vena cava (figura 1B, flecha, doble daga) y el dispositivo de aspiración en las arterias pulmonares (figura 1B, flecha, daga), sin que disminuyera la eficacia de la trombectomía (figura 1B,C) ni se produjera paso de aire al sistema ECMO. De todos los pacientes, 3 pudieron ser destetados del ECMO-VA. Una paciente presentó problemas de flujo durante el soporte por pérdida de pulsatilidad y desarrolló isquemia intestinal, por lo que falleció durante el ECMO. El desenlace neurológico favorable (clase 1-2 de la escala Cerebral Performance Category) se produjo en 2 pacientes (n=2). La supervivencia hospitalaria fue del 50%. La complicación más frecuente fue la hemorragia por zonas de punción, por lo que todos los pacientes precisaron trasfusión de hemoderivados y 1 hemorragia se consideró grave. La decanulación la realizó cirugía vascular.
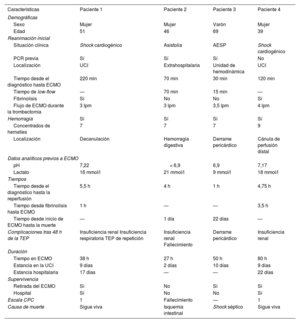
Características de los pacientes y resultados clínicos
| Características | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 |
|---|---|---|---|---|
| Demográficas | ||||
| Sexo | Mujer | Mujer | Varón | Mujer |
| Edad | 51 | 46 | 69 | 39 |
| Reanimación inicial | ||||
| Situación clínica | Shock cardiogénico | Asistolia | AESP | Shock cardiogénico |
| PCR previa | Sí | Sí | Sí | No |
| Localización | UCI | Extrahospitalaria | Unidad de hemodinámica | UCI |
| Tiempo desde el diagnóstico hasta ECMO | 220 min | 70 min | 30 min | 120 min |
| Tiempo de low-flow | — | 70 min | 15 min | — |
| Fibrinolisis | Sí | No | No | Sí |
| Flujo de ECMO durante la trombectomía | 3 lpm | 3 lpm | 3,5 lpm | 4 lpm |
| Hemorragia | Sí | Sí | Sí | Sí |
| Concentrados de hematíes | 7 | 7 | 7 | 9 |
| Localización | Decanulación | Hemorragia digestiva | Derrame pericárdico | Cánula de perfusión distal |
| Datos analíticos previos a ECMO | ||||
| pH | 7,22 | < 6,9 | 6,9 | 7,17 |
| Lactato | 16 mmol/l | 21 mmol/l | 9 mmol/l | 18 mmol/l |
| Tiempos | ||||
| Tiempo desde el diagnóstico hasta la reperfusión | 5,5 h | 4 h | 1 h | 4,75 h |
| Tiempo desde fibrinolisis hasta ECMO | 1 h | — | — | 3,5 h |
| Tiempo desde inicio de ECMO hasta la muerte | — | 1 día | 22 días | — |
| Complicaciones tras 48 h de la TEP | Insuficiencia renal Insuficiencia respiratoria TEP de repetición | Insuficiencia renal Fallecimiento | Derrame pericárdico | Insuficiencia renal |
| Duración | ||||
| Tiempo en ECMO | 38 h | 27 h | 50 h | 80 h |
| Estancia en la UCI | 9 días | 2 días | 10 días | 9 días |
| Estancia hospitalaria | 17 días | — | — | 22 días |
| Supervivencia | ||||
| Retirada del ECMO | Sí | No | Sí | Sí |
| Hospital | Sí | No | No | Sí |
| Escala CPC | 1 | Fallecimiento | — | 1 |
| Causa de muerte | Sigue viva | Isquemia intestinal | Shock séptico | Sigue viva |
AESP: actividad eléctrica sin pulso; CPC: Cerebral Performance Category; ECMO: oxigenador extracorpóreo de membrana; PCR: parada cardiorrespiratoria; TEP: tromboembolia pulmonar; UCI: unidad de cuidados intensivos.
Imágenes de procedimiento de trombectomía mecánica en paciente con dispositivo FlowTriever System 24 curve (Inari Medical, Estados Unidos). A: angiografía pulmonar inicial. B: resultado tras aspiración. C: material trombótico aspirado. †Cánula de dispositivo FlowTriever. ‡Cánula venosa para oxigenador extracorpóreo de membrana de 25 Fr.
En una reciente revisión de la ELSO (Extracorporeal Life Support Organization) —en la que se incluyó a 821 pacientes con TEP y ECMO (el 88% con soporte venoarterial y el 28% con RCP extracorpórea)—, la RCP extracorpórea fue un predictor independiente de mortalidad hospitalaria (OR=3,67; IC95%, 1,46-9,23)3. El uso de terapias de reperfusión se ha asociado con disminución del tiempo en ECMO y aumento de la probabilidad de destete del soporte. La American Heart Association recomienda el uso temprano de ECMO-VA en pacientes con TEP masiva y shock refractario cuando la fibrinolisis sea ineficaz, por el alto riesgo de PCR antes o durante la trombectomía4. En esta serie todos desarrollaron disfunción biventricular grave y pérdidas intermitentes de pulsatibilidad durante la trombectomía, por lo que el ECMO-VA fue indispensable para impedir una PCR que sería difícilmente reversible5. Hobohm et al.6 evidenciaron recientemente la baja utilización de embolectomía con ECMO en TEP, asociándose su uso a una menor mortalidad hospitalaria (OR=0,5; IC95%, 0,41-0,61).
En conclusión, el soporte con ECMO-VA temprano en pacientes con TEP masiva en shock refractario (o PCR) que se someten a trombectomía mecánica es una estrategia posible y eficaz para mantener la hemodinámica de los pacientes, y la tromboaspiración mecánica se considera una herramienta eficaz y segura en este contexto.
FINANCIACIÓNNinguna.
CONSIDERACIONES ÉTICASEl presente trabajo se ha elaborado respetando las recomendaciones internacionales sobre investigación clínica (Declaración de Helsinki de la Asociación Médica Mundial). Al tratarse de un procedimiento emergente, no era necesario obtener el consentimiento informado. En cambio, se obtuvo el consentimiento verbal de los familiares. En la elaboración de este artículo se han tenido en cuenta los posibles sesgos de sexo y género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALPara este artículo no se ha utilizado inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han tenido acceso a los datos y han participado en la preparación de este artículo. R. García del Moral redactó el artículo y J. Caballero-Borrego corrigió el manuscrito. Todos los autores han contribuido a la conceptualización del estudio, la conservación de los datos, el análisis formal, la investigación, la metodología, la validación y la revisión.
CONFLICTO DE INTERESESNinguno.