«Nada es más blando ni más flexible que el agua, pero nada puede resistirla»
— Lao Tzu
La hidratación intravenosa periintervención y la reducción al mínimo del volumen de medio de contraste (MC) son las medidas de atención estándares para prevenir la lesión renal aguda por contraste1. La finalidad de la hidratación es ampliar el volumen intravascular con objeto de incrementar la perfusión renal, facilitar la transición del MC hidrosoluble por las nefronas para reducir su repercusión citotóxica y garantizar una diuresis suficiente antes, durante y después de la administración del MC. Aunque la guía de la Sociedad Europea de Cardiología y la European Association for Cardio-Thoracic Surgery recomienda la hidratación con suero fisiológico normal administrado a 1ml/kg/h (0,5ml/kg/h si la fracción de eyección del ventrículo izquierdo es ≤ 35% o si la clase funcional de la New York Heart Association [NYHA] es > 2) desde 12 h antes hasta 24 h después de la exposición al MC, a lo largo de los años se han propuesto varios protocolos de hidratación (tabla 1)2,3. Muy recientemente se ha propuesto el concepto de pautas de hidratación individualizadas, a fin de mejorar la seguridad y la eficacia de las estrategias de prevención de la lesión renal aguda por contraste. Concretamente, se han presentado varias pautas de hidratación personalizadas, en función de: a) la diuresis4–8; b) la presión telediastólica del ventrículo izquierdo (PTDVI)9; c) la presión venosa central10, y d) la bioimpedancia11.
Protocolos de hidratación recomendados actualmente con suero fisiológico normal para la prevención de la lesión renal aguda por contraste
| Fuente | Volumen | Duración* |
|---|---|---|
| American College of Radiology1 | 100 ml/h | De 12 h antes a 24 h después |
| Guía de la Sociedad Europea de Cardiología/Asociación Europea de Cirugía Cardiotorácica2 | 1 ml/kg/h(0,5 ml/kg/h si FEVI ≤ 35% o NYHA > 2) | De 12 h antes a 24 h después |
| Gupta et al.3 | 3 ml/h | De 1 h antes a h después |
FEVI: fracción de eyección del ventrículo izquierdo; NYHA: clase funcional de la New York Heart Association.
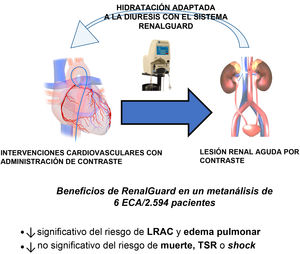
La premisa fundamental de estos estudios es que una diuresis elevada puede reducir la incidencia de lesión renal aguda por contraste a través de varios efectos. Es de destacar que los datos del estudio Prevention of Radiocontrast Induced Nephropathy Clinical Evaluation (PRINCE) indican que un aumento de la diuresis (≥ 150ml/h) reduce el efecto tóxico de los MC12. El sistema RenalGuard (PLC Medical System, Estados Unidos) se diseñó para facilitar un tratamiento de hidratación óptimo (figura 1)13. Este dispositivo permite alcanzar una diuresis elevada, a la vez que se establece un equilibrio entre la diuresis y la infusión de líquidos intravenosos con objeto de prevenir la hipovolemia. Varios ensayos aleatorizados han puesto de manifiesto la efectividad de este sistema para reducir de manera significativa la incidencia de la lesión renal aguda por contraste en comparación con la hidratación estándar en los pacientes en alto riesgo4–8. De entre ellos, el ensayo REMEDIAL III, en el que se incluyó a 702 pacientes con un riesgo alto de lesión renal aguda por contraste, ha puesto claramente de manifiesto que la hidratación guiada por la diuresis llevada a cabo con el sistema RenalGuard es superior a la hidratación guiada por la PTDVI para prevenir el objetivo combinado de lesión renal aguda por contraste o edema pulmonar agudo (riesgo relativo [RR], 0,56; intervalo de confianza del 95%, 0,39-0,79; p = 0,036)14.
En un artículo reciente publicado en Revista Española de Cardiología, Occhipinti et al. presentan un metanálisis bayesiano para respaldar nuevamente la utilidad clínica de RenalGuard, y muestran que su uso se asocia con menos riesgo de lesión renal aguda por contraste y edema pulmonar agudo, sin que haya diferencias en la mortalidad por cualquier causa, el shock cardiogénico o la insuficiencia renal aguda con necesidad de tratamiento de sustitución renal en comparación con la hidratación intravenosa periintervención estándar15. Empleando un enfoque bayesiano, Occhipinti et al. pudieron mostrar una probabilidad del 95% de que el sistema RenalGuard fuera superior al grupo de control para reducir el riesgo de lesión renal aguda por contraste. Es importante señalar que este resultado se obtuvo a la vez que se limitaban o incluso se reducían las posibles consecuencias de las estrategias de hidratación no controladas (es decir, la sobrecarga de volumen y el edema pulmonar agudo). Además, el efecto del tratamiento fue incluso superior al excluir del análisis los ensayos que se centraron en el implante percutáneo de válvula aórtica, en el que hay factores distintos del MC (como la situación hemodinámica) que pueden desempeñar un papel importante en la fisiopatología de la lesión renal aguda por contraste.
Este metanálisis es oportuno y tiene importancia clínica. En primer lugar, este trabajo resalta el concepto de que no hay un protocolo de hidratación estándar, como se muestra en la tabla 2, que detalla los diferentes protocolos de hidratación empleados en los grupos de control de los ensayos agrupados para el metanálisis. En segundo lugar, como señalan Occhipinti et al., el sistema RenalGuard se ha evaluado tan solo en ensayos aleatorizados de pequeño tamaño, con una potencia estadística baja para detectar diferencias en criterios de valoración clínicos y con una alta variabilidad en las características de los pacientes y las intervenciones utilizadas. Es posible que esto sea lo que suceda en el reciente ensayo STRENGTH18. En este ensayo prospectivo, aleatorizado, multicéntrico, internacional, abierto y de poscomercialización supervisado por el Cardiovascular European Research Center de Massy (Francia), se incluyó a 250 participantes con enfermedad renal crónica de moderada a grave (tasa de filtrado glomerular estimada, 15-40ml/min/m2) que necesitaron una intervención coronaria, estructural o periférica compleja, en la que se preveía una inyección de contraste de como mínimo 3 veces la tasa de filtrado glomerular estimada, aleatorizados a hidratación con diuresis forzada equilibrada proporcionada por el sistema RenalGuard o hidratación convencional con suero fisiológico intravenoso según lo recomendado por la guía actual. El objetivo principal, la lesión renal aguda por contraste, se produjo con una frecuencia similar en los 2 grupos (el 15,9% en el grupo de RenalGuard frente al 13,9% en el grupo control; p=0,6). Los resultados de este estudio difieren de los de publicaciones previas sobre el mismo tema, en las que se observó que el dispositivo RenalGuard aportaba un beneficio en cuanto a la protección contra la lesión renal aguda por contraste. Una posible explicación es que este estudio tuviera una potencia estadística insuficiente. La potencia fue de 0,9, con alfa=0,05, y eran necesarios 133 pacientes en cada grupo para demostrar una reducción de la lesión renal aguda por contraste del 25 al 10% con el dispositivo RenalGuard. Sin embargo, solo el 60,3% (n = 73) de los pacientes del grupo experimental y el 50,8% (n = 62) de los del grupo de control cumplían los criterios de inclusión. Empleando el mismo valor de alfa y los porcentajes de reducción de la lesión renal aguda por contraste antes mencionados, esto corresponde a una potencia estadística del estudio de 0,55, es decir, significativamente insuficiente. Otra advertencia importante es que algunos pacientes en muy alto riesgo, como los que no alcanzan una diuresis suficiente (por ejemplo, > 150ml/h) durante el tratamiento con el dispositivo RenalGuard, no pueden obtener un beneficio con esta intervención.
Protocolos de hidratación con suero fisiológico normal para la prevención de la lesión renal aguda por contraste en los grupos de control de los ensayos incluidos en el metanálisis de Occhipinti et al.15
| Estudio | Volumen | Duración* |
|---|---|---|
| CINEMA16 | 1-1,5 ml/kg/h | De 12 h antes a 12 h después |
| MYTHOS7 | 1 ml/kg/h | De 12 h antes a 12 h después |
| PROTECT TAVI6 | 1 ml/kg/h(0,5 ml/kg/h si FEVI < 30%) | De 12 h antes a 6 h después |
| REDUCE-AKI17 | 0,5-1 ml/kg/h | De intraintervención a 6 h después |
| REMEDIAL III14 | 5 ml/h con PTDVI < 13 mmHg3 ml/h con PTDVI 13-18 mmHg1,5 ml/h con PTDVI > 18 mmHg | De 1 h antes a 6 h después |
| STRENGTH18 | 1 ml/kg/h(0,5 ml/kg/h si FEVI ≤ 35% o NYHA > 2) | De 12 h antes a 24 h después |
FEVI: fracción de eyección del ventrículo izquierdo; NYHA: clase funcional de la New York Heart Association; PTDVI: presión telediastólica del ventrículo izquierdo.
En conclusión, y a la vista de la evidencia disponible hasta la fecha sobre el sistema RenalGuard, incluido el metanálisis oportuno y detallado de Occhipinti et al.15, son necesarios nuevos estudios controlados y aleatorizados de gran tamaño para esclarecer si el tratamiento con el sistema RenalGuard debe recomendarse para todos los pacientes en riesgo o solo para aquellos que tienen un riesgo alto19 según las puntuaciones de riesgo de lesión renal aguda por contraste propuestas20,21. Otra cuestión importante es si el sistema RenalGuard tiene una relación de coste-efectividad favorable en todos los casos o solo en los pacientes con un riesgo inicial alto3,17.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESG. Biondi-Zoccai ha sido consultor de Amarin, Balmed, Cardionovum, Crannmedical, Endocore Lab, Eukon, Innovheart, Guidotti, Meditrial, Microport, Opsens Medical, Replycare, Teleflex, Terumo y Translumina. Los demás autores no declaran ningún conflicto de intereses.
VÉASE CONTENIDO RELACIONADO: https://doi.org/10.1016/j.recesp.2023.02.004.