La enfermedad coronaria (EC) se encuentra en el 30-50% de los pacientes con estenosis aórtica (EA) grave que reciben tratamiento intervencionista. Todavía no está claro cuál es el mejor tratamiento de la EAC en pacientes con EA sometidos a implante percutáneo de válvula aórtica (TAVI). El objetivo del estudio fue analizar el impacto clínico del miocardio en riesgo en pacientes con EAC y EA grave tratados con TAVI.
MétodosSe incluyó a pacientes consecutivos sometidos a TAVI en nuestro hospital. En presencia de EAC, el miocardio en riesgo antes del procedimiento se clasificó utilizando la puntuación de riesgo (JS) de la British Cardiovascular Intervention Society (BCIS). La población de estudio se dividió en 3 grupos: pacientes sin EAC concomitante (grupo No-EAC), pacientes con EAC y BCIS-JS ≤ 4 (grupo EAC BCIS-JS ≤ 4) y pacientes con EAC concomitante y BCIS-JS> 4 (grupo EAD BCIS -JS> 4). El objetivo primario del estudio fueron los eventos cardiovasculares y cerebrovasculares adversos mayores (MACCE).
ResultadosSe incluyó a un total de 403 pacientes: 223 No-EAD, 94 EAC BCIS-JS ≤ 4 y 86 EAC BCIS-JS> 4. Con 3 meses de seguimiento [rango 104 – 3.296 días], los pacientes sin EAC y los pacientes con EAC con BCIS-JS ≤ 4 tuvieron una mejor supervivencia libre de MACCE en comparación con aquellos con revascularización menos extensa (BCIS-JS> 4) (p=0,049). Este resultado se debió en parte a una reducción significativa de la mortalidad (p=0,031). En el análisis multivariado, el BCIS-JS residual ≤ 4 y la clase III-IV de la NYHA predijeron MACCE de forma independiente.
ConclusionesEn pacientes con EAC y EA grave, la extensión del miocardio en riesgo antes del TAVI influye en los resultados clínicos.
Palabras clave
La enfermedad coronaria (EC) es un hallazgo frecuente en pacientes con estenosis degenerativa de la válvula aórtica (EA)1. Por lo tanto, se ha notificado EC en más del 50% de los pacientes con EA en tratamiento quirúrgico2 o con implante percutáneo de válvula aórtica (TAVI)3–5. Por lo general, cuando se encuentra EC en pacientes con EA programados para cirugía, se trata mediante cirugía de revascularización coronaria realizada en el momento del recambio quirúrgico de la válvula aórtica6. A pesar de la alta prevalencia de EC en pacientes tratados con TAVI, la estrategia de tratamiento de la EC concomitante en estos pacientes continúa siendo un área de considerable incertidumbre. La EC grave se asocia con un aumento de la mortalidad después del TAVI7,8, pero las intervenciones coronarias percutáneas (ICP) en pacientes con TAVI pueden ser complicadas. La vigente guía de práctica clínica, basándose en algunos estudios observacionales9, recomienda la ICP antes o en el momento del TAVI para pacientes con estenosis de la arteria coronaria > 70% del diámetro en segmentos proximales. En este estudio observacional retrospectivo, se analizó el impacto clínico del grado del miocardio en riesgo en pacientes con EC concomitante y EA grave tratados con TAVI.
MÉTODOSSelección de la población de estudioSe trata de un estudio observacional retrospectivo que incluyó a pacientes consecutivos intervenidos para TAVI en nuestro centro en un periodo de 9 años (de octubre de 2010 a diciembre de 2019).
De acuerdo con la práctica estándar de nuestro centro, se derivó a todos los pacientes para TAVI sobre la base de una discusión formal y multidisciplinaria del equipo cardiológico. Los datos clínicos y los detalles de la intervención se introdujeron de forma prospectiva en la sección especializada en TAVI de una base de datos electrónica, lo que permitió la evaluación previa del impacto de EuroSCORE en las intervenciones coronarias10 y de la seguridad de las intervenciones transradiales11.
El riesgo quirúrgico de los pacientes se clasificó de acuerdo con el EuroSCORE logístico y la Society of Thoracic Surgeons (STS) predijo la mortalidad quirúrgica en el momento de la consulta del equipo cardiológico. El riesgo del TAVI se clasificó según el STS/American College of Cardiology Transcatheter Valve Therapy mediante la calculadora de riesgo de mortalidad hospitalaria por TAVI en línea12.
Antes de someterse a la intervención programada, todos los pacientes firmaron un formulario de consentimiento informado específico que incluye la autorización para la inclusión en la base de datos y la evaluación del seguimiento clínico.
En el presente estudio, se examinó retrospectivamente a todos los pacientes tratados mediante TAVI en nuestra institución entre octubre de 2010 y diciembre de 2019.
Evaluación de la enfermedad coronariaTodos los pacientes se sometieron a una evaluación coronaria antes del TAVI. Se estudió por coronariografía a la gran mayoría (no solo en el caso de arterias coronarias no obstruidas en la coronariografía por tomografía computarizada, 80 pacientes). Se clasificó a los pacientes con EC si cumplían 1 de las siguientes condiciones: estenosis coronaria > 70% al menos en 1 arteria coronaria epicárdica mayor o revascularización coronaria previa mediante ICP o cirugía. El miocardio en riesgo de cada paciente con EC concomitante antes del TAVI se clasificó utilizando la puntuación de riesgo de la British Cardiovascular Intervention Society (BCIS-JS)13. El grado de revascularización coronaria y el uso de la reserva fraccional de flujo para guiar la revascularización se dejaron a criterio del cirujano.
Seguimiento clínico y objetivo principalSe evaluaron cuidadosamente las historias clínicas de todos los pacientes inscritos y se realizó el seguimiento clínico (como visitas presenciales, entrevistas telefónicas e historias clínicas de cualquier ingreso hospitalario o visitas ambulatorias). El infarto de miocardio (IM) no mortal durante el seguimiento se definió como el aumento y el descenso de enzimas cardiacas (generalmente troponina I sérica de alta sensibilidad) en presencia de signos o síntomas electrocardiográficos compatibles con isquemia miocárdica, como se describe en la cuarta definición universal del IM14, auque la inclusión se inició antes de la publicación de la cuarta definición universal. El ictus se definió como cualquier déficit neurológico nuevo, permanente, global o focal determinado por un examen neurológico estándar y que durase más de 24h o menos si se obtuvo evidencia de infarto cerebral mediante imágenes. La revascularización coronaria se definió como cualquier revascularización coronaria (mediante ICP o cirugía) realizada después del TAVI, independientemente de que estuviera relacionada con un segmento ya tratado o no.
El objetivo principal del estudio fueron los eventos adversos cardiovasculares y cerebrovasculares mayores (MACCE), definidos como el objetivo compuesto de mortalidad, IM no mortal, ictus no mortal y revascularización coronaria. Los componentes individuales del objetivo principal constituyeron los objetivos secundarios.
Análisis estadísticosLas variables continuas se presentan como media± desviación estándar y las variables cualitativas, como números y porcentajes. Las comparaciones de variables continuas entre diferentes grupos se realizaron con pruebas de la t de Student o ANOVA (según corresponda). Las variables cualitativas se evaluaron mediante pruebas de la χ2 o exacta de Fisher, según corresponda. Se realizó un análisis de regresión de Cox para identificar los predictores independientes del objetivo principal entre las principales características basales (edad, sexo, factores de riesgo cardiovascular, insuficiencia renal, IM previo, ICP previa, cirugía cardiaca previa, gradiente aórtico medio, área de la válvula aórtica, fracción de eyección, clase III-IV de la NYHA, mortalidad según STS, puntuación del TAVI, anatomía coronaria y BCIS-JS). Se calcularon las hazard ratio (HR) ajustadas con su intervalo de confianza del 95% (IC95%) de los predictores del objetivo principal significativos y se determinaron las correspondientes curvas de supervivencia ajustadas. Las subdistribuciones de un riesgo competitivo se calcularon con la prueba de Fine-Gray para los eventos de riesgo competitivo incluidos en los objetivos secundarios15. Se estableció un valor de p bilateral <0,05 como el umbral de significación estadística. Todos los análisis estadísticos se hicieron con el software SPSS v22.0 (IBM Corporation, Estados Unidos) y SAS 9 (SAS Institute, Estados Unidos).
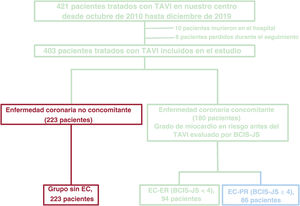
RESULTADOSPoblación de pacientesDe los 421 pacientes sometidos a TAVI en nuestro hospital entre octubre de 2010 y diciembre de 2019, se excluyó a 18 (10 murieron en el hospital y 8 se perdieron en el seguimiento). Por lo tanto, se incluyó en el estudio a 403 pacientes (180 con EC concomitante). La mediana de BCIS-JS antes del TAVI fue 4,0 [intervalo intercuartílico, 0,7]. Por lo tanto, la población del estudio se dividió en 3 grupos: pacientes sin EC concomitante (SinEC), pacientes con EC y BCIS-JS antes del TAVI ≤ 4 (EC BCIS-JS ≤ 4) y pacientes con EC concomitante y BCIS-JS antes del TAVI > 4 (EC BCIS-JS > 4). Al combinar la presencia o ausencia de EC y BCI-JS antes del TAVI (≤ 4 o > 4), la población de estudio se dividió en los siguientes 3 grupos: 223 pacientes sin EC, 94 con EC extensamente revascularizada (EC-ER) y 86 con EC parcialmente revascularizada (EC-PR) (figura 1).
Diagrama del estudio. BCIS-JS: puntuación de riesgo de la British Cardiovascular Intervention Society; EC: enfermedad coronaria; EC-ER: enfermedad coronaria extensamente revascularizada; EC-PR: enfermedad coronaria parcialmente revascularizada; TAVI: implante percutáneo de la válvula aórtica.
Las características basales de los pacientes se enumeran en la tabla 1, donde se muestran marcadas diferencias entre los 3 subgrupos del estudio. Entre estas, en el gripo EC BCIS-JS > 4 el sexo masculino fue menos prevalente (el 29 frente al 48 y el 70%; p <0,0001) y la incidencia de enfermedad arterial periférica fue mayor (el 35 frente al 22 y el 23%; p=0,004) que los de EC BCIS-JS ≤ 4 y SinEC. Como se esperaba, la incidencia de todos los factores de riesgo cardiovascular fue más frecuente en los grupos EC BCIS-JS > 4 y EC BCIS-JS ≤ 4 en comparación con el grupo SinEC (diabetes, el 41 frente al 39 y el 23%; p <0,0001; dislipemia, el 77 frente al 61 y el 45%; p <0,0001; tabaquismo en activo, el 7 frente al 0,7 y el 2%; p=0,042; hipertensión, el 93 frente al 91 y el 87%; p=0,003; antecedentes familiares, el 30 frente al 27 y el 15%; p=0,001). La incidencia de fibrilación auricular fue mayor en los grupos de EC BCIS-JS > 4 y EC BCIS-JS ≤ 4 que en el grupo SinEC (el 38 frente al 37 y el 16%; p <0,0001). Del mismo modo, la puntuación de mortalidad de la STS fue mayor en los pacientes con EC concomitante (EC BCIS-JS > 4 y EC BCIS-JS ≤ 4) que en pacientes sin EC (6,8 ± 3,1 frente a 6,2 ± 3,6 y 5,8 ± 3,5; p=0,004). En cambio, la puntuación del TAVI no difirió entre los 3 subgrupos del estudio. Cabe destacar que entre los pacientes con EC concomitante no hubo diferencias en la distribución de la EC. Las características de la ecocardiografía se presentan en la tabla 2. En pacientes sin EC, el gradiente aórtico medio fue mayor (54 ± 15 frente a 50 ± 15 y 47 ± 17; p=0,003) y el área de la válvula aórtica fue menor (0,6 ± 0,2 frente a 0,7 ± 0,2 y 0,7 ± 0,2; p=0,006) que en pacientes con EC concomitante (tanto EC BCIS-JS > 4 como EC BCIS-JS ≤ 4).
Características basales de la población del estudio
| Características | Sin EC(n=223) | EC BCIS-JS ≤ 4(n=94) | EC BCIS-JS > 4(n=86) | p |
|---|---|---|---|---|
| Edad (años) | 81,1±7,3 | 79,4±7,5 | 79,6±6,8 | 0,55 |
| Varones | 157 (70) | 45 (48) | 25 (29) | 0,0001 |
| IMC | 26,6±5,4 | 25,9±4,5 | 27,0±4,0 | 0,72 |
| Factores de riesgo cardiovascular | ||||
| Diabetes | 52 (23) | 37 (39) | 35 (41) | 0,0001 |
| Dislipemia | 101 (45) | 57 (61) | 66 (77) | 0,0001 |
| Tabaquismo activo | 5 (2) | 7 (0,7) | 6 (7) | 0,042 |
| Hipertensión | 195 (87) | 86 (91) | 80 (93) | 0,003 |
| Antecedentes familiares | 34 (15) | 25 (27) | 26 (30) | 0,001 |
| Antecedentes clínicos | ||||
| IM previo | 1 (0,4) | 27 (29) | 26 (30) | <0,0001 |
| ICP anterior | — | 83 (88) | 61 (71) | <0,0001 |
| Cirugía de revascularización coronaria previa | — | 13 (14) | 45 (52) | <0,0001 |
| Fibrilación auricular | 35 (16) | 35 (37) | 33 (38) | <0,0001 |
| EAP | 51 (23) | 21 (22) | 30 (35) | 0,004 |
| EPOC | 68 (30) | 22 (23) | 30 (35) | 0,147 |
| TFG <60 | 141 (63) | 58 (62) | 51 (59) | 0,709 |
| Diálisis | 4 (1,7) | 2 (0,2) | 1 (1) | 0,454 |
| Mortalidad de la STS | 5,8±3,5 | 6,2±3,6 | 6,8±3,1 | 0,004 |
| Puntuación del TAVI | 4,7±2,9 | 4,5±2,8 | 5,1±3,8 | 0,64 |
| Enfermedad coronaria | ||||
| 1 vaso | — | 48 (51) | 42 (49) | 0,35 |
| 2 vasos | — | 28 (30) | 25 (29) | |
| 3 vasos | — | 17 (18) | 21 (24) | |
| Principal izquierda | — | 8 (0,8) | 6 (7) | 0,428 |
EC: enfermedad coronaria; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de la válvula aórtica; TFG: tasa de filtrado glomerular.
Los valores expresan n (%) o media ± desviación estándar.
La población con EC se estratificó según la carga miocárdica evaluada por la puntuación de riesgo de la British Cardiovascular Intervention Society (BCIS-JS) antes del TAVI.
Características ecocardiográficas de la población del estudio
| Características | Sin EC(n=223) | EC BCIS-JS ≤ 4(n=94) | EC BCIS-JS > 4(n=86) | p |
|---|---|---|---|---|
| Fracción de eyección (%) | 56±11 | 55±11 | 52±14 | 0,09 |
| Gradiente medio | 54±15 | 50±15 | 47±17 | 0,003 |
| AVA | 0,6±0,2 | 0,7±0,2 | 0,7±0,2 | 0,006 |
| Relación IVT | 0,17±0,04 | 0,19±0,05 | 0,21±0,13 | 0,27 |
| Insuficiencia valvular prevalente | 9 (4) | 4 (4) | 3 (3) | 0,87 |
| Cardiopatía reumática | 14 (6) | 3 (3) | 3 (3) | 0,70 |
| Válvula bicúspide | 10 (4) | 0 | 2 (2) | 0,17 |
| Enfermedad de la prótesis | 9 (4) | 2 (2) | 2 (2) | 0,83 |
| Hipertensión pulmonar grave (PAP > 60 mmHg) | 44 (20) | 12 (13) | 20 (23) | 0,18 |
AVA: área de la válvula aórtica; EC: enfermedad coronaria; IVT: integral velocidad-tiempo; PAP: presión arterial pulmonar; TAVI: implante percutáneo de la válvula aórtica.
Los valores expresan n (%) o media ± desviación estándar.
La población con EC se estratificó según la carga miocárdica evaluada por la puntuación de riesgo de la British Cardiovascular Intervention Society (BCIS-JS) antes del TAVI.
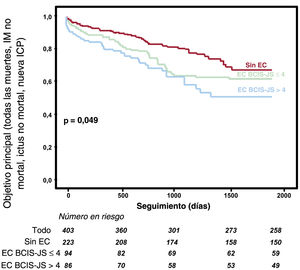
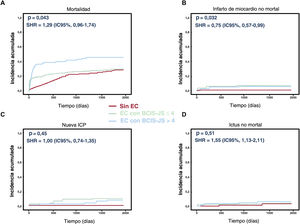
A todos los pacientes se les dio un seguimiento > 3 meses (intervalo, 104-3.296 días) y la duración media del seguimiento fue de ∼5 años. La figura 2 presenta las curvas de supervivencia (tabla 3) de los 3 grupos de estudio, que muestran que el de EC BCIS-JS ≤ 4 tuvo tasas de eventos comparables a las del grupo SinEC y considerablemente mejores que el de EC BCIS-JS > 4 (p=0,049). Como se muestra en la figura 3, este resultado fue impulsado por una incidencia de muerte significativamente mayor, desde el punto de vista estadístico, en pacientes con EC BCIS-JS > 4 que en aquellos con EC BCIS-JS ≤ 4 y sin EC (subhazard ratio [SHR] = 1,29; IC95%, 0,96-1,74; p=0,043). Cabe destacar que la incidencia de IM no mortal fue mayor en pacientes con EC concomitante, independientemente del grado de miocardio en riesgo alcanzado antes del TAVI que en los pacientes sin EC (SHR = 1,74; IC95%, 1,28-2,50; p=0,032). El análisis de regresión de Cox identificó BJS <4 (HR = 0,43; IC95%, 0,21-0,90; p=0,02) y clase III-IV de NYHA (HR = 0,31; IC95%, 0,12-0,78; p=0,03) como predictores independientes del objetivo principal entre las principales características basales (tabla 3). En el análisis multivariante (tabla 4) que incluye todas las principales características basales, BCIS-JS ≤ 4 (HR = 0,53; IC95%, 0,19-0,87; p=0,02) y clase III-IV de la NYHA (HR = 0,19; IC95%, 0,04-0,60; p=0,04) fueron los predictores independientes del objetivo principal.
Objetivo principal según el grado del miocardio en riesgo antes del TAVI. La figura muestra las curvas de supervivencia sin eventos en la población del estudio. La población con EC se estratificó según la carga miocárdica evaluada por la BCIS-JS antes del TAVI. BCIS-JS: puntuación de riesgo de la British Cardiovascular Intervention Society; EC: enfermedad coronaria; ICP: intervención coronaria percutánea; IM: infarto de miocardio; TAVI: implante percutáneo de la válvula aórtica.
Análisis de regresión de Cox de predictores independientes del objetivo principal
| Características | p | HR ajustada (IC95%) |
|---|---|---|
| Edad (años) | 0,99 | 0,99 (0,95-1,39) |
| Sexo masculino | 0,47 | 1,15 (0,98-1,35) |
| Diabetes | 0,62 | 0,86 (0,47-1,58) |
| Dislipemia | 0,95 | 0,88 (0,41-1,89) |
| Tabaquismo activo | 0,81 | 1,13 (0,38-3,37) |
| Hipertensión | 0,12 | 1,01 (0,13-1,25) |
| Antecedentes familiares | 0,95 | 0,97 (0,43-2,17) |
| IM previo | 0,28 | 1,28 (0,66-2,30) |
| ICP previa | 0,18 | 2,27 (0,69-7,39) |
| CABG previa | 0,68 | 0,97 (0,86-1,10) |
| Fibrilación auricular | 0,85 | 0,98 (0,52-1,87) |
| EAP | 0,45 | 2,95 (1,45-5,97) |
| EPOC | 0,50 | 0,96 (0,15-6,23) |
| TFG <60 | 0,44 | 1,53 (0,10-2,77) |
| Mortalidad de la STS | 0,69 | 1,07 (0,87-1,10) |
| Puntuación del TAVI | 0,86 | 1,04 (0,13-1,25) |
| Enfermedad coronaria (3 vasos) | 0,47 | 1,01 (0,98-3,43) |
| Fracción de eyección | 0,73 | 1,01 (0,97-1,04) |
| Gradiente medio | 0,29 | 1,98 (0,96-2,01) |
| AVA | 0,14 | 0,17 (0,02-1,75) |
| BCIS-JS <4 | 0,02 | 0,43 (0,21-0,90) |
| NYHA III-IV | 0,03 | 0,31 (0,12-0,78) |
AVA: área de la válvula aórtica; BCIS-JS, puntuación de riesgo de la British Cardiovascular Intervention Society; CABG: cirugía de revascularización coronaria; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; NYHA: clsa funcional de la New York Heart Association; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de la válvula aórtica; TFG: tasa de filtrado glomerular.
Componente único del objetivo principal según el grado del miocardio en riesgo antes del TAVI. La figura muestra la curva de función de incidencia acumulada utilizando el modelo de riesgo competitivo de Fine-Grey de los componentes individuales del objetivo principal en la población del estudio. A: mortalidad. B: infarto de miocardio no mortal. C: nuevas intervenciones coronarias percutáneas. D: ictus no mortal. La población con EC se estratificó según la carga miocárdica evaluada por la puntuación de riesgo de la British Cardiovascular Intervention Society (BCIS-JS) antes del TAVI. EC: enfermedad coronaria; ICP: intervención coronaria percutánea; TAVI: implante percutáneo de la válvula aórtica.
Predictores del objetivo principal y objetivos secundarios en los análisis univariante y multivariante
| Univariante,p | Multivariante,p | HR ajustada (IC95%) | |
|---|---|---|---|
| Objetivo principal | |||
| Edad | 0,04 | 0,23 | 1,00 (1,00-1,20) |
| Sexo masculino | 0,05 | 0,79 | 1,23 (0,65-1,41) |
| TFG <60 | 0,02 | 0,40 | 1,62 (1,03-2,52) |
| IM previo | 0,03 | 0,50 | 1,54 (0,21-1,90) |
| Fracción de eyección | 0,05 | 0,12 | 1,00 (1,00-1,64) |
| Mortalidad de la STS | 0,04 | 0,30 | 1,10 (0,73-1,21) |
| NYHA III-IV | 0,02 | 0,04 | 0,19 (0,04-0,60) |
| IR BCIS-JS <4 | 0,01 | 0,02 | 0,53 (0,19-0,87) |
| Mortalidad | |||
| Edad | 0,03 | 0,39 | 1,34 (1,01-1,63) |
| Sexo masculino | 0,05 | 0,67 | 1,00 (1,50-1,75) |
| TFG <60 | 0,04 | 0,37 | 1,21 (1,04-2,02) |
| IM previo | 0,05 | 0,46 | 1,61 (0,64-1,82) |
| Fracción de eyección | 0,04 | 0,24 | 0,81 (1,10-1,91) |
| Mortalidad de la STS | 0,05 | 0,27 | 1,21 (0,90-1,71) |
| NYHA III-IV | 0,03 | 0,06 | 0,9 (0,4-1,0) |
| IR BCIS-JS <4 | 0,04 | 0,05 | 0,71 (0,41-0,93) |
| IM no mortal | |||
| Edad | 0,05 | 0,16 | 0,33 (0,12-1,61) |
| Sexo masculino | 0,05 | 0,80 | 1,30 (0,14-1,51) |
| TFG <60 | 0,04 | 0,24 | 2,01 (0,60-3,02) |
| IM previo | 0,04 | 0,80 | 1,90 (0,41-2,01) |
| Fracción de eyección | 0,05 | 0,35 | 1,03 (0,91-1,03) |
| Mortalidad de la STS | 0,03 | 0,25 | 2,01 (0,60-2,61) |
| NYHA III-IV | 0,04 | 0,07 | 0,73 (1,01-1,51) |
| IR BCIS-JS <4 | 0,03 | 0,06 | 0,50 (0,91-1,82) |
| Ictus no mortal | |||
| Edad | 0,05 | 0,20 | 1,00 (1,00-1,91) |
| Sexo masculino | 0,04 | 0,26 | 1,23 (0,84-1,90) |
| TFG <60 | 0,09 | 0,97 | 1,41 (1,11-2,54) |
| IM previo | 0,08 | - | - |
| Fracción de eyección | 0,05 | 0,05 | 1,73 (1,10-2,31) |
| Mortalidad de la STS | 0,05 | 0,54 | 1,13 (0,91-2,01) |
| NYHA III-IV | 0,04 | 0,08 | 0,75 (0,51-1,81) |
| IR BCIS-JS <4 | 0,04 | 0,08 | 1,20 (1,04-4,33) |
| ICP nueva | |||
| Edad | 0,05 | 0,32 | 1,51 (1,04-2,12) |
| Sexo masculino | 0,09 | - | - |
| TFG <60 | 0,08 | - | - |
| IM previo | 0,07 | - | - |
| Fracción de eyección | 0,05 | 0,93 | 1,54 (0,92-1,91) |
| Mortalidad de la STS | 0,05 | 0,79 | 1,00 (0,91-2,12) |
| NYHA III-IV | 0,04 | 0,32 | 0,91 (0,42-1,94) |
| IR BCIS-JS <4 | 0,04 | 0,18 | 1,53 (1,01-3,43) |
BCIS-JS: puntuación de riesgo de la British Cardiovascular Intervention Society; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IR: índice de revascularización; NYHA: clase funcional de la New York Heart Association; TFG: tasa de filtrado glomerular; STS: Society of Thoracic Surgeons.
De 180 pacientes con EC concomitante, 88 se sometieron a ICP antes del TAVI y 92, a revascularización coronaria antes de la indicación del TAVI, teniendo en cuenta todas las revascularizaciones coronarias previas. A ningún paciente se le realizó ICP en etapas después del TAVI. En estos pacientes, el grado de revascularización del miocardio se clasificó utilizando el índice de revascularización (IR) BCIS-JS (0-1) según la siguiente fórmula: (BCIS-JS pre – BCIS-JS post) / BCIS-JS pre13. La mediana del IR de BCIS-JS fue 0,67 [0,7]. Por tanto, la población de estudio se dividió en 3 grupos: 223 pacientes sin EC, 99 con revascularización extensa (IR > 0,67, EC-RE) y 81 con revascularización menos extensa (IR ≥ 0,67, EC-RME). Las características basales de los pacientes se enumeran en la y en la . Los pacientes sin EC y los pacientes con una revascularización más completa (EC-ER, IR > 0,67-1,0) tuvieron una supervivencia libre de MACCE mejor que aquellos con revascularización menos extensa (EC-MER, IR ≤ 0,67; p=0,042) (). Este resultado fue impulsado por una reducción significativa de la mortalidad (SHR = 1,31; IC95%, 0,97-1,54; p=0,041) (). Cabe destacar que la incidencia de IM no mortal fue mayor en pacientes con EC concomitante, independientemente del grado de revascularización alcanzado antes del TAVI, que en pacientes sin EC (SHR = 1,74; IC95%, 1,28-2,50; p=0,046) (). En el análisis multivariante, BCIS-JS IR ≤ 0,67 (HR = 2,10; IC95%, 1,35-5,83; p=0,002), BCIS-JS post (HR = 0,17; IC95%, 0,24-1,34; p=0,024) y clase III-IV de la NYHA (HR = 1,19; IC95%, 1,02-1,39; p=0,018) fueron predictores independientes de MACCE.
DISCUSIÓNLa estrategia óptima para tratar la EC concomitante en pacientes con EA que son candidatos a TAVI todavía es objeto de debate3–7. En el presente estudio se encuentra que una elevada carga de miocardio residual, evaluada por BCIS-JS, se asoció con un peor resultado clínico, principalmente impulsado por una mayor mortalidad. Además, los resultados de los pacientes con un pequeño grado de miocardio en riesgo antes del TAVI fueron similares a los de los pacientes sin EC. Por lo tanto, estos hallazgos indican que se debe lograr antes del TAVI una revascularización más extensa en pacientes con EC. Cuando se reconocen lesiones coronarias en pacientes con EA sometidos a TAVI, se desconoce la seguridad de la intervención sin revascularización previa. Esto se debe a que los principales ensayos que permitieron la aprobación del TAVI requirieron la revascularización de la estenosis coronaria significativa en los vasos epicárdicos de la rama principal en los 30 días posteriores al TAVI16–18. En cambio, la ICP en pacientes con EA supone un reto, ya que el riesgo de la ICP en este entorno se percibe como alto19. Los recientes estudios que evalúan los desenlaces clínicos de la ICP en EA han demostrado que los resultados pueden ser favorables con una cuidadosa selección de los pacientes20–24.
Cabe destacar que no solo las consideraciones clínicas, sino también la cantidad de miocardio en riesgo y la selección de la lesión diana, pueden modular la eficacia de la ICP. En el presente estudio, que analiza el impacto clínico del grado de miocardio en riesgo antes del TAVI, se encontró que una gran cantidad de miocardio en riesgo antes del TAVI (BCIS-JS > 4) influyó en el impacto clínico después del TAVI (figura 4). En cambio, un BCI-JS ≤ 4 se asoció con un resultado clínico comparable al de los pacientes sin EC (figura 4). Un registro prospectivo previo de un solo centro que incluía a 191 pacientes consecutivos con EA grave derivados para TAVI demostró que la mortalidad a los 30 días no fue muy diferente entre los pacientes con EC tratados con ICP y aquellos sin EC21. En este estudio, la ICP se realizó solo para la estenosis que afectaba a los segmentos proximal o medio de las arterias coronarias principales, pero no se evaluó el riesgo miocárdico residual antes del TAVI. En consecuencia, el registro POL-TAVI mostró que la revascularización del miocardio previa al TAVI mejoró la supervivencia a los 30 días a cifras comparables con las de los pacientes sin EC obstructiva al inicio del estudio25. Sorprendentemente, ni los valores basales ni los valores residuales de la puntuación Syntax afectaron al resultado25. En un metanálisis reciente, D’Ascenzo F et al.26 evaluaron el impacto de la gravedad de la EC (valorada como puntuación Syntax [SS]) y de la revascularización incompleta residual (evaluada como SS residual [rSS]) en la mortalidad después del TAVI. Una SS > 22 se asoció con un aumento de la mortalidad a 1 año y una rSS < 8 se asoció con un menor riesgo de muerte a 1 año. En cambio, los datos de ACTIVATION (Percutaneous Coronary Intervention Prior to Transcatheter Aortic Valve Implantation) han mostrado tasas similares de mortalidad y rehospitalización a 1 año entre ICP y sin ICP antes de TAVI; sin embargo, no se alcanzó el margen de no inferioridad y no se hizo ningún subanálisis según el miocardio en riesgo27.
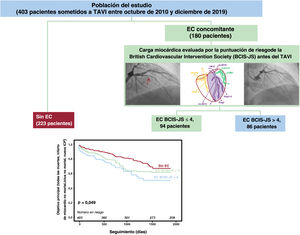
Ilustración central. Diseño del estudio y principales resultados. Se incluyó en el estudio a 403 pacientes con estenosis aórtica grave y EC concomitante tratados con TAVI. La carga miocárdica fue evaluada por BCIS-JS antes del TAVI. Los pacientes con menor carga miocárdica antes del TAVI (BCIS-JS <4) tuvieron una supervivencia sin MACCE mejor que aquellos con un miocardio en riesgo más extenso (BCIS-JS ≥ 4; p=0,049). BCIS-JS: puntuación de riesgo de la British Cardiovascular Intervention Society; EC: enfermedad coronaria; IM: infarto de miocardio; ICP: intervención coronaria percutánea; TAVI: implante percutáneo de la válvula aórtica.
En el presente estudio, se evaluó el grado de miocardio en riesgo por BCIS-JS. La elección se basó en que, a diferencia de otros sistemas de puntuación angiográfica centrados en características específicas de la lesión (como el SS), el BCIS-JS es una clasificación del grado de la EC según el territorio miocárdico en riesgo fácil de aplicar13. Al parecer, esta puntuación y su IR derivado son los más adecuados para el estudio de los pacientes críticos13,28. Cabe destacar que un BCIS-JS ≤ 4 antes del TAVI se asoció con mejores resultados. Este hallazgo indica que no todas las lesiones tienen que ser revascularizadas para lograr la ventaja clínica. Por el contrario, esto respalda la noción de que, si se planifica el TAVI, un plan de revascularización minimalista no es suficiente. En este sentido, también se observó que la mejora respecto a MACCE asociada con una revascularización más extensa antes del TAVI se debió principalmente a la reducción de la mortalidad. De hecho, en nuestro estudio, como también se notificó en un registro previo21, la incidencia de IM continuó siendo mayor en pacientes con EC concomitante que en aquellos sin EC. Aunque la incidencia de IM es mayor en pacientes con EC intervenidos con TAVI, independientemente del grado de revascularización coronaria, esto no parece que tenga impacto alguno en los objetivos clínicos duros como la mortalidad.
Se espera que en un futuro próximo se obtenga más información de importantes ensayos diseñados específicamente. El ensayo NOTION-3 en curso (ClinicalTrials.gov. Identificador: NCT03058627) planea aleatorizar a 452 pacientes con EA grave y EC a una revascularización completa guiada por la reserva fraccional de flujo antes del TAVI en un enfoque por etapas o a TAVI solo. El ensayo COMPLETE TAVI (ClinicalTrials.gov. Identificador: NCT04634240) aleatorizará a 4.000 pacientes derivados a TAVI, ICP guiada por angiografía después del TAVI o tratamiento médico.
Otro aspecto importante en este contexto es el momento de la revascularización. Hace poco, Kumar A et al.29 no encontraron diferencias en la mortalidad por cualquier causa o ictus en pacientes tratados con ICP durante o después del TAVI en comparación con los pacientes sometidos a ICP antes del TAVI.
LimitacionesEn primer lugar, aunque se trata de un gran registro unicéntrico sobre el tema del impacto de la EC en el resultado del TAVI con evaluación simultánea de su complejidad y su tratamiento, la muestra fue demasiado pequeña para abordar y evaluar integralmente el impacto clínico. En segundo lugar, la revascularización coronaria se llevó a cabo sin protocolo y el grado de la revascularización coronaria y el uso de la reserva fraccional de flujo para guiar la revascularización se dejaron a criterio del cirujano. Por último, la seguridad y la eficacia de la ICP antes del TAVI en comparación con solo TAVI pueden probarse mejor solamente en ensayos aleatorizados.
CONCLUSIONESSe ha demostrado que los factores de riesgo de EA son similares a la ateroesclerosis. Por consiguiente, la EC a menudo se encuentra simultáneamente en pacientes que presentan EA grave. El papel pronóstico de la EC en pacientes con EA grave es controvertido. Puede considerarse un factor perjudicial o, en su defecto, un marcador de alto riesgo de «testigos inocentes». Sin embargo, en la era del TAVI, importantes cuestiones sin resolver son cómo y cuándo tratar la EC concomitante. Actualmente se recomienda la ICP (IIa) para pacientes con estenosis de la arteria coronaria > 70% del diámetro en segmentos proximales9. Nuestros resultados muestran que un pequeño grado de miocardio en riesgo antes del TAVI (BCIS-JS ≤ 4) mejora el pronóstico después del TAVI. La reducción de la carga de EC (evaluada por BCIS-JS) antes del TAVI en pacientes con EC más grave podría mejorar el pronóstico.
Estos resultados podrían aplicarse no solo a los pacientes en alto riesgo, sino sobre todo a la mayoría de los pacientes en riesgo bajo e intermedio, que son los destinatarios de las nuevas indicaciones del TAVI.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESC. Aurigemma y M.B. Giannico son los coinvestigadores principales y deben ser considerados coautores. C. Trani, F. Burzotta y C. Aurigemma analizaron e interpretaron los datos y redactaron y revisaron la versión final del original. M.B. Giannico, S. Cangemi y F. Burzotta realizaron la evaluación de BCIS-JS. El resto de los autores (P. Bruno, A.M. Leone, F. Bianchini y E. Romagnoli) recopilaron los datos clínicos e interpretaron los datos. C. Trani, G. Gaspardone y F. Crea ayudaron a interpretar los datos e hicieron una revisión crítica del original.
CONFLICTO DE INTERESESF. Burzotta, C. Trani y C. Aurigemma recibieron honorarios como conferenciantes de Abbott, Medtronic y Abiomed. A.M. Leone recibió honorarios como conferenciante de St. Jude Medical/Abbott, Medtronic, Abiomed y Bracco Imaging. P. Bruno recibió honorarios como conferenciante de Abbott. A. Gaspardone recibió honorarios como experto de Hearstich e Lifetech. El resto de los autores no tiene conflictos de intereses.
- –
El TAVI ha revolucionado el tratamiento de la EA grave y la indicación de TAVI se extiende a grupos de pacientes cada vez más jóvenes y con menor riesgo.
- –
Sin embargo, importantes cuestiones sin resolver son cómo y cuándo debe tratarse la EC concomitante.
- –
Actualmente se recomienda la ICP (IIa) para pacientes con estenosis de la arteria coronaria > 70% del diámetro en segmentos proximales.
- –
Cabe destacar que se encontró que una pequeña carga de EC antes del TAVI (BCIS-JS ≤ 4) se asoció con mejores resultados.
- –
Nuestros resultados respaldan la noción de que dejar áreas extensas de miocardio sin revascularizar se asocia con un resultado adverso en pacientes con EA y EC tratados con TAVI.