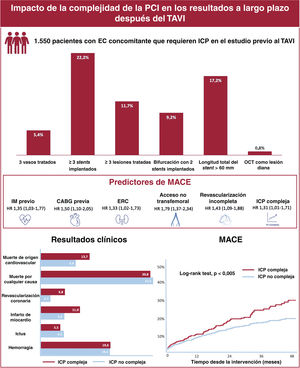
Se desconoce el impacto pronóstico asociado con la complejidad de la revascularización coronaria de pacientes que se someten a una intervención coronaria percutánea (ICP) durante el estudio previo al implante percutáneo de válvula aórtica (TAVI). El objetivo de este estudio es evaluar el impacto pronóstico de una ICP compleja realizada durante el estudio pre-TAVI.
MethodsEstudio multicéntrico que incluye a pacientes consecutivos sometidos a TAVI a quienes se había realizado una angioplastia en los 3 meses previos al procedimiento. La ICP se clasificó como compleja cuando cumplía al menos 1 de los siguientes criterios: ≥ 3 vasos tratados, ≥ 3 stents implantados, ≥ 3 lesiones tratadas, bifurcación tratada con 2 stents, más de 60 mm de stent implantados u oclusión crónica total. Se evaluó la tasa de eventos adversos cardiacos mayores (MACE): mortalidad cardiovascular, infarto y necesidad de nueva revascularización coronaria.
ResultadosSe incluyó a 1.550 pacientes sometidos a ICP; 454 (29,3%) de ellas eran ICP complejas. A los 2 años, la incidencia de MACE fue de 9,6 eventos cada 100 pacientes-año. La ICP compleja se asoció con mayor riesgo de muerte cardiovascular (HR=1,44; IC95%, 1,01-2,07), infarto de miocardio no relacionado con el procedimiento (HR=1,52; IC95%, 1,04-2,21) y revascularización coronaria (HR=2,46; IC9%, 1,44-4,20). Asimismo, la ICP compleja se asoció con mayor riesgo de MACE tras el TAVI (HR=1,31; IC95%, 1,01-1,71; p=.042).
ConclusionesEn candidatos a TAVI con enfermedad coronaria significativa, una revascularización compleja se asoció con mayor riesgo de eventos adversos.
Palabras clave
La prevalencia de enfermedad coronaria (EC) en la población con implante percutáneo de válvula aórtica (TAVI) es bastante alta, e incluso al 25% de los candidatos a TAVI se les realiza una intervención coronaria percutánea (ICP) como parte del estudio previo a la intervención o en el momento del TAVI1. La necesidad de revascularización coronaria en pacientes con TAVI continúa siendo controvertida en esos casos por la falta de uniformidad de la evidencia disponible, principalmente basada en datos no aleatorizados2.
Debido a la fisiopatología compartida de estenosis aórtica (EA) y EC, los candidatos a TAVI con frecuencia presentan enfermedad multivaso y lesiones coronarias complejas3. Aunque la existencia de EC compleja concomitante ha sido un criterio de exclusión frecuente en la mayoría de los ensayos aleatorizados en que se compara TAVI con recambio valvular quirúrgico, la evidencia de los estudios observacionales indica que la complejidad anatómica de la EC y la exhaustividad de la revascularización coronaria podrían tener un impacto en los resultados clínicos posteriores al TAVI4,5.
La EC avanzada y un subconjunto de lesiones difíciles generalmente se traducen en estrategias de revascularización más complejas. En el entorno del TAVI, una anatomía coronaria compleja (puntuación SYNTAX >22) se ha asociado con mayor riesgo de mortalidad por cualquier causa y de mortalidad cardiovascular a los 5 años de seguimiento6. Sin embargo, el impacto de la complejidad de la revascularización percutánea en esta población continúa siendo, en gran parte, desconocido. Por tanto, el objetivo del presente estudio es evaluar, en una gran cohorte de pacientes sometidos a ICP durante el estudio previo a TAVI, el impacto de la complejidad de la ICP en los resultados a largo plazo tras el TAVI.
MÉTODOSEste estudio multicéntrico incluyó a pacientes consecutivos con EA grave y EC concomitante sometidos a ICP como parte de su estudio diagnóstico previo al TAVI entre 2007 y 2022. Los datos se obtuvieron de 15 centros de Canadá, Europa y Brasil. El estudio fue aprobado por el comité de ética de cada centro participante y todos los pacientes dieron el consentimiento informado para las intervenciones.
La ICP se realizó en los 3 meses anteriores al TAVI o durante el TAVI. El tratamiento de la EC, incluida la estrategia de la ICP, el uso de pruebas funcionales invasivas para la isquemia miocárdica y la ecografía intravascular y la duración del tratamiento antiagregante plaquetario se dejaron a criterio del médico responsable de la intervención. La EC se evaluó mediante coronariografía (≥ 70% de estenosis en un vaso coronario epicárdico o ≥ 50% de estenosis del tronco coronario izquierdo) o reserva fraccional de flujo (≤ 0,80). La revascularización se consideró completa cuando todas las lesiones importantes en vasos >2mm de diámetro se habían tratado con éxito. Las indicaciones del TAVI, el tipo de dispositivo y el enfoque de la intervención fueron valorados por cada equipo cardiovascular tras una exhaustiva evaluación clínica y anatómica preoperatoria. El abordaje transfemoral fue la opción predeterminada y el acceso alternativo se reservó para pacientes con anatomía iliofemoral poco favorable.
Recopilación de datos y definiciones del estudioLos datos basales, de las intervenciones y de seguimiento se recopilaron prospectivamente en una base de datos específica. El seguimiento clínico se llevó a cabo en cada centro participante 1 mes y 12 meses después del TAVI y anualmente a partir de entonces, ya fuera mediante una visita médica o por teléfono. En cada contacto médico se actualizó si el paciente seguía con vida y se registró la fecha del último contacto con cada paciente.
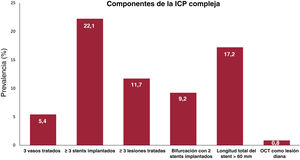
La ICP compleja incluyó intervenciones con al menos 1 de las siguientes características: tratamiento de 3 vasos, implante de al menos 3 stents, tratamiento de al menos 3 lesiones, bifurcación con implante de 2 stents, longitud total del stent >60mm u oclusión total crónica como lesión diana7. La información sobre la ICP se obtuvo a partir de informes de intervenciones que fueron revisados por 2 cardiólogos intervencionistas.
Estudios clínicosEl objetivo principal fue un combinado de eventos adversos cardiovasculares mayores (MACE), como muerte cardiaca, infarto de miocardio no relacionado con cirugía y necesidad de una nueva revascularización coronaria en el seguimiento. Los objetivos secundarios incluyeron los elementos que conformaban el objetivo principal combinado, muerte por cualquier causa, trombosis o reestenosis del stent manifiesta o probable, ictus y hemorragia. Todos los eventos adversos se recopilaron y se validaron según los criterios del Valve Academic Research Consortium-2 y las guías de práctica clínica del síndrome coronario agudo8,9.
Análisis estadísticoLas variables cualitativas se expresaron en porcentajes y los datos continuos, en media±desviación estándar o mediana [intervalo intercuartílico], en función de su distribución. Las variables continuas se compararon utilizando la prueba (bilateral) de la t de Student o la prueba del orden de la U de Mann-Whitney, según correspondiera. Las variables cualitativas se compararon con la prueba de la χ2 o la prueba exacta de Fisher. Las curvas de supervivencia se resumieron utilizando estimaciones de Kaplan-Meier y se utilizaron pruebas del orden logarítmico para comparar los grupos. Se realizó un análisis de regresión multivariante de Cox para identificar los predictores independientes de MACE y mortalidad cardiovascular y por cualquier causa en toda la cohorte de ICP-TAVI. Las variables con interés clínico y con valor de p<0,10 en el análisis univariante se introdujeron en un análisis multivariante. El análisis multivariante se realizó mediante regresión de Cox escalonada retrógrada. Para todos los análisis se empleó un método jerárquico para tener en cuenta la variabilidad entre centros. Se adoptó un nivel alfa bilateral de 0,05 en todas las pruebas estadísticas. Todos los análisis estadísticos se realizaron utilizando SAS versión 9.4 (SAS Institute, Estados Unidos).
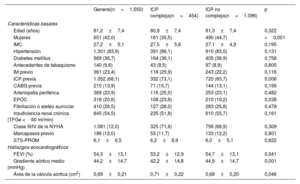
RESULTADOSSe incluyó a 1.550 pacientes tratados con ICP en el estudio diagnóstico previo al TAVI. Entre ellos, 454 (29,3%) tenían al menos 1 de los criterios de ICP compleja. Las características clínicas basales según la complejidad de la intervención se presentan en la tabla 1. La media de edad de los pacientes era 81,2±7 años, el 42,0% eran mujeres y la puntuación media de la Society of Thoracic Surgeons Predicted Risk of Mortality fue del 6,1% [3,1-6,9%]. Los pacientes sometidos a ICP compleja fueron más frecuentemente varones y presentaron cifras más altas de ICP previa y enfermedad pulmonar obstructiva crónica.
Características basales según la complejidad de la ICP
| General(n=1.550) | ICP compleja(n=454) | ICP no compleja(n=1.096) | p | |
|---|---|---|---|---|
| Características basales | ||||
| Edad (años) | 81,2±7,4 | 80,9±7,4 | 81,3±7,4 | 0,322 |
| Mujeres | 651 (42,0) | 161 (35,5) | 490 (44,7) | <0,001 |
| IMC | 27,2±5,1 | 27,5±5,6 | 27,1±4,9 | 0,195 |
| Hipertensión | 1.301 (83,9) | 391 (86,1) | 910 (83,0) | 0,131 |
| Diabetes mellitus | 569 (36,7) | 164 (36,1) | 405 (36,9) | 0,758 |
| Antecedentes de tabaquismo | 140 (9,6) | 43 (9,5) | 97 (8,9) | 0,805 |
| IM previo | 361 (23,4) | 118 (25,9) | 243 (22,2) | 0,116 |
| ICP previa | 1.052 (68,1) | 332 (73,1) | 720 (65,7) | 0,006 |
| CABG previa | 215 (13,9) | 71 (15,7) | 144 (13,1) | 0,199 |
| Arteriopatía periférica | 369 (23,9) | 116 (25,5) | 253 (23,1) | 0,482 |
| EPOC | 318 (20,6) | 108 (23,8) | 210 (19,2) | 0,038 |
| Fibrilación o aleteo auricular | 410 (26,5) | 127 (28,0) | 283 (25,8) | 0,478 |
| Insuficiencia renal crónica (TFGe <60 ml/min) | 845 (54,5) | 235 (51,8) | 610 (55,7) | 0,161 |
| Clase III/IV de la NYHA | 1.081 (12,0) | 325 (71,6) | 756 (68,9) | 0,309 |
| Marcapasos previo | 186 (12,0) | 53 (11,7) | 133 (12,2) | 0,801 |
| STS-PROM | 6,1±6,5 | 6,2±8,9 | 6,0±5,1 | 0,622 |
| Hallazgos ecocardiográficos | ||||
| FEVI (%) | 54,3±13,1 | 53,2±12,9 | 54,7±13,1 | 0,041 |
| Gradiente aórtico medio (mmHg) | 44,2±14,7 | 42,2±14,8 | 44,9±14,7 | 0,001 |
| Área de la válvula aórtica (cm2) | 0,69±0,21 | 0,71±0,22 | 0,68±0,20 | 0,046 |
CABG: cirugía de revascularización aortocoronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; STS-PROM: Society of Thoracic Surgeons Predicted Risk of Mortality; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan media ± desviación estándar o n (%).
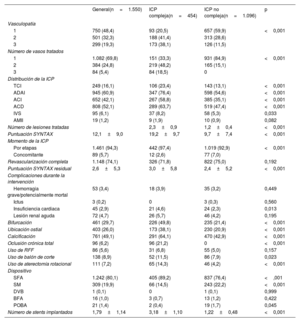
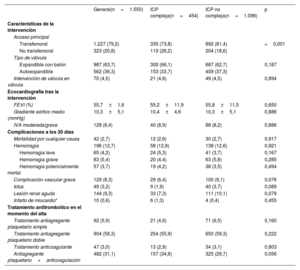
Las características de las intervenciones (ICP y TAVI) y los resultados hospitalarios de la población del estudio estratificados por complejidad de la ICP se muestran en la tabla 2 y la tabla 3. El tiempo medio entre ICP y TAVI fue 31 [8-68] días. La mayoría (94,3%) de las ICP se realizaron antes del TAVI y una minoría (5,7%), simultáneamente al TAVI. La revascularización completa se logró en 1.148 pacientes (74,1%). Las características de la ICP fueron diferentes entre los grupos de ICP compleja e ICP no compleja. Los pacientes de ICP compleja tenían una EC más avanzada, como lo demuestra un mayor número de vasos enfermos y tratados, una mayor puntuación SYNTAX media inicial y residual y mayores prevalencias de oclusión total crónica, calcificación coronaria, lesiones coronarias ostiales y lesiones de bifurcación. La frecuencia de los elementos de la ICP compleja en la población se muestra en la figura 1. Las cifras de complicaciones durante las ICP no mostraron ninguna diferencia entre ICP compleja e ICP no compleja, a no ser por una mayor incidencia de insuficiencia cardiaca en el grupo de ICP compleja (el 4,6 frente al 2,3%; p=0,013).
Características angiográficas de las coronariografías y la ICP previa al TAVI según la complejidad de la ICP
| General(n=1.550) | ICP compleja(n=454) | ICP no compleja(n=1.096) | p | |
|---|---|---|---|---|
| Vasculopatía | ||||
| 1 | 750 (48,4) | 93 (20,5) | 657 (59,9) | <0,001 |
| 2 | 501 (32,3) | 188 (41,4) | 313 (28,6) | |
| 3 | 299 (19,3) | 173 (38,1) | 126 (11,5) | |
| Número de vasos tratados | ||||
| 1 | 1.082 (69,8) | 151 (33,3) | 931 (84,9) | <0,001 |
| 2 | 384 (24,8) | 219 (48,2) | 165 (15,1) | |
| 3 | 84 (5,4) | 84 (18,5) | 0 | |
| Distribución de la ICP | ||||
| TCI | 249 (16,1) | 106 (23,4) | 143 (13,1) | <0,001 |
| ADAI | 945 (60,9) | 347 (76,4) | 598 (54,6) | <0,001 |
| ACI | 652 (42,1) | 267 (58,8) | 385 (35,1) | <0,001 |
| ACD | 808 (52,1) | 289 (63,7) | 519 (47,4) | <0,001 |
| IVS | 95 (6,1) | 37 (8,2) | 58 (5,3) | 0,033 |
| AMII | 19 (1,2) | 9 (1,9) | 10 (0,9) | 0,082 |
| Número de lesiones tratadas | 2,3±0,9 | 1,2±0,4 | <0,001 | |
| Puntuación SYNTAX | 12,1±9,0 | 19,2±9,7 | 9,7±7,4 | <0,001 |
| Momento de la ICP | ||||
| Por etapas | 1.461 (94,3) | 442 (97,4) | 1.019 (92,9) | <0,001 |
| Concomitante | 89 (5,7) | 12 (2,6) | 77 (7,0) | |
| Revascularización completa | 1.148 (74,1) | 326 (71,8) | 822 (75,0) | 0,192 |
| Puntuación SYNTAX residual | 2,6±5,3 | 3,0±5,8 | 2,4±5,2 | <0,001 |
| Complicaciones durante la intervención | ||||
| Hemorragia grave/potencialmente mortal | 53 (3,4) | 18 (3,9) | 35 (3,2) | 0,449 |
| Ictus | 3 (0,2) | 0 | 3 (0,3) | 0,560 |
| Insuficiencia cardiaca | 45 (2,9) | 21 (4,6) | 24 (2,3) | 0,013 |
| Lesión renal aguda | 72 (4,7) | 26 (5,7) | 46 (4,2) | 0,195 |
| Bifurcación | 461 (29,7) | 226 (49,8) | 235 (21,4) | <0,001 |
| Ubicación ostial | 403 (26,0) | 173 (38,1) | 230 (20,9) | <0,001 |
| Calcificación | 761 (49,1) | 291 (64,1) | 470 (42,9) | <0,001 |
| Oclusión crónica total | 96 (6,2) | 96 (21,2) | 0 | <0,001 |
| Uso de RFF | 86 (5,6) | 31 (6,8) | 55 (5,0) | 0,157 |
| Uso de balón de corte | 138 (8,9) | 52 (11,5) | 86 (7,9) | 0,023 |
| Uso de aterectomía rotacional | 111 (7,2) | 65 (14,3) | 46 (4,2) | <0,001 |
| Dispositivo | ||||
| SFA | 1.242 (80,1) | 405 (89,2) | 837 (76,4) | <,001 |
| SM | 309 (19,9) | 66 (14,5) | 243 (22,2) | <0,001 |
| DVB | 1 (0,1) | 0 | 1 (0,1) | 0,999 |
| BFA | 16 (1,0) | 3 (0,7) | 13 (1,2) | 0,422 |
| POBA | 21 (1,4) | 2 (0,4) | 19 (1,7) | 0,045 |
| Número de stents implantados | 1,79±1,14 | 3,18±1,10 | 1,22±0,48 | <0,001 |
ACD: arteria coronaria derecha; ACI: arteria circunfleja izquierda; ADAI: arteria descendente anterior izquierda; AMII: arteria mamaria interna izquierda; BFA: balón farmacoactivo; DVB: dispositivo vascular bioabsorbible; ICP: intervención coronaria percutánea; IVS: injerto de vena safena; POBA: angioplastia tradicional con balón simple; RFF: reserva fraccional de flujo; SFA: stent farmacoactivo; SM: stent metálico; SYNTAX: SYNergy between PCI with TAXUS and Cardiac Surgery; TAVI: implante percutáneo de válvula aórtica; TCI: tronco coronario izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
Características del TAVI y resultados tempranos según la complejidad de la ICP
| General(n=1.550) | ICP compleja(n=454) | ICP no compleja(n=1.096) | p | |
|---|---|---|---|---|
| Características de la intervención | ||||
| Acceso principal | ||||
| Transfemoral | 1.227 (79,2) | 335 (73,8) | 892 (81,4) | <0,001 |
| No transfemoral | 323 (20,8) | 119 (26,2) | 204 (18,6) | |
| Tipo de válvula | ||||
| Expandible con balón | 987 (63,7) | 300 (66,1) | 687 (62,7) | 0,187 |
| Autoexpandible | 562 (36,3) | 153 (33,7) | 409 (37,3) | |
| Intervención de válvula en válvula | 70 (4,5) | 21 (4,6) | 49 (4,5) | 0,894 |
| Ecocardiografía tras la intervención | ||||
| FEVI (%) | 55,7±1,6 | 55,2±11,9 | 55,8±11,5 | 0,650 |
| Gradiente aórtico medio (mmHg) | 10,3±5,1 | 10,4±4,6 | 10,3±5,1 | 0,886 |
| IVA moderada/grave | 128 (8,4) | 40 (8,9) | 88 (8,2) | 0,686 |
| Complicaciones a los 30 días | ||||
| Mortalidad por cualquier causa | 42 (2,7) | 12 (2,6) | 30 (2,7) | 0,917 |
| Hemorragia | 196 (12,7) | 58 (12,8) | 138 (12,6) | 0,921 |
| Hemorragia leve | 65 (4,2) | 24 (5,3) | 41 (3,7) | 0,167 |
| Hemorragia grave | 83 (5,4) | 20 (4,4) | 63 (5,8) | 0,285 |
| Hemorragia potencialmente mortal | 57 (3,7) | 19 (4,2) | 38 (3,5) | 0,494 |
| Complicación vascular grave | 129 (8,3) | 29 (6,4) | 100 (9,1) | 0,076 |
| Ictus | 49 (3,2) | 9 (1,9) | 40 (3,7) | 0,089 |
| Lesión renal aguda | 144 (9,3) | 33 (7,3) | 111 (10,1) | 0,079 |
| Infarto de miocardio* | 10 (0,6) | 6 (1,3) | 4 (0,4) | 0,455 |
| Tratamiento antitrombótico en el momento del alta | ||||
| Tratamiento antiagregante plaquetario simple | 92 (5,9) | 21 (4,6) | 71 (6,5) | 0,160 |
| Tratamiento antiagregante plaquetario doble | 904 (58,3) | 254 (55,9) | 650 (59,3) | 0,222 |
| Tratamiento anticoagulante | 47 (3,0) | 13 (2,9) | 34 (3,1) | 0,803 |
| Antiagregante plaquetario+anticoagulación | 482 (31,1) | 157 (34,6) | 325 (29,7) | 0,056 |
ICP: intervención coronaria percutánea; IVA: insuficiencia valvular aórtica; FEVI: fracción de eyección del ventrículo izquierdo; TAVI: implante percutáneo de válvula aórtica.
Los valores expresan n (%) o media ± desviación estándar.
En las intervenciones de TAVI, el acceso transfemoral fue de elección en la mayoría de los pacientes (79,2%). La adopción del acceso no transfemoral fue más frecuente en el grupo de ICP compleja (el 26,2 frente al 18,6%; p<0,001). Se utilizaron válvulas expandibles con balón y autoexpandibles en 987 (63,7%) y 562 (36,3%) pacientes. No se observaron diferencias entre los 2 grupos con respecto a las complicaciones posteriores al TAVI. En el momento del alta hospitalaria, el 58,3% de los pacientes recibían tratamiento antiagregante plaquetario doble; el 34,1%, un anticoagulante oral (monoterapia, el 3,0%; combinado con tratamiento antiagregante plaquetario, el 31,1%), y el 5,9%, solo tratamiento antiagregante plaquetario, sin diferencias entre los grupos de ICP compleja e ICP no compleja.
Resultados a largo plazo según la complejidad de la ICPLa duración media del seguimiento de la población del estudio fue de 2 [1-3] años. Durante el seguimiento se perdió a 82 pacientes (5,3%); murieron 486 (31,4%); de ellos, 169 (11,1%) por causas cardiovasculares.
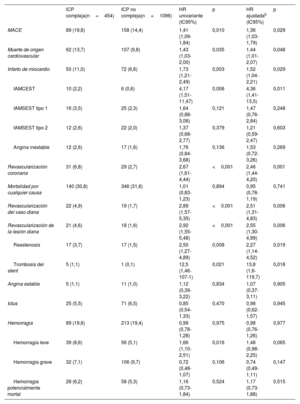
Los resultados a largo plazo después del TAVI estratificados según la complejidad de la ICP se resumen en la tabla 4. La incidencia de MACE (objetivo principal) fue de 9,6 eventos cada 100 pacientes-año (ICP compleja, hazard ratio [HR] = 1,31; intervalo de confianza del 95% [IC95%], 1,01-1,71; p=0,042). La supervivencia sin eventos estimada fue de 79,8 meses en el grupo de ICP compleja y 87,4 meses en el de ICP no compleja (p<0,01). Los pacientes en el grupo de ICP compleja mostraron cifras más altas de muerte cardiaca, infarto de miocardio, revascularización coronaria, revascularización de vasos diana, revascularización de lesiones diana, reestenosis y trombosis del stent. La ICP compleja no se asoció con un mayor riesgo de mortalidad por cualquier causa, ictus y eventos hemorrágicos en los análisis adaptados.
Resultados a largo plazo de la población del estudio según la complejidad de la ICPa
| ICP compleja(n=454) | ICP no compleja(n=1096) | HR univariante (IC95%) | p | HR ajustadab (IC95%) | p | |
|---|---|---|---|---|---|---|
| MACE | 89 (19,6) | 158 (14,4) | 1,41 (1,09-1,84) | 0,010 | 1,36 (1,03-1,79) | 0,029 |
| Muerte de origen cardiovascular | 62 (13,7) | 107 (9,8) | 1,43 (1,03-2,00) | 0,035 | 1,44 (1,01-2,07) | 0,048 |
| Infarto de miocardio | 50 (11,0) | 72 (6,6) | 1,73 (1,21-2,49) | 0,003 | 1,52 (1,04-2,21) | 0,029 |
| IAMCEST | 10 (2,2) | 6 (0,6) | 4,17 (1,51-11,47) | 0,006 | 4,36 (1,41-13,5) | 0,011 |
| IAMSEST tipo 1 | 16 (3,5) | 25 (2,3) | 1,64 (0,88-3,08) | 0,121 | 1,47 (0,76-2,84) | 0,248 |
| IAMSEST tipo 2 | 12 (2,6) | 22 (2,0) | 1,37 (0,68-2,77) | 0,379 | 1,21 (0,59-2,47) | 0,603 |
| Angina inestable | 12 (2,6) | 17 (1,6) | 1,76 (0,84-3,68) | 0,136 | 1,53 (0,72-3,26) | 0,269 |
| Revascularización coronaria | 31 (6,8) | 29 (2,7) | 2,67 (1,61-4,44) | <0,001 | 2,46 (1,44-4,20) | 0,001 |
| Mortalidad por cualquier causa | 140 (30,8) | 346 (31,6) | 1,01 (0,83-1,23) | 0,894 | 0,95 (0,78-1,19) | 0,741 |
| Revascularización del vaso diana | 22 (4,9) | 19 (1,7) | 2,89 (1,57-5,35) | <0,001 | 2,51 (1,31-4,83) | 0,006 |
| Revascularización de la lesión diana | 21 (4,6) | 18 (1,6) | 2,92 (1,55-5,48) | <0,001 | 2,55 (1,30-4,99) | 0,006 |
| Reestenosis | 17 (3,7) | 17 (1,5) | 2,50 (1,27-4,89) | 0,008 | 2,27 (1,14-4,52) | 0,019 |
| Trombosis del stent | 5 (1,1) | 1 (0,1) | 12,5 (1,46-107-1) | 0,021 | 13,8 (1,6-119,7) | 0,018 |
| Angina estable | 5 (1,1) | 11 (1,0) | 1,12 (0,39-3,22) | 0,834 | 1,07 (0,37-3,11) | 0,905 |
| Ictus | 25 (5,5) | 71 (6,5) | 0,85 (0,54-1,33) | 0,470 | 0,98 (0,62-1,57) | 0,945 |
| Hemorragia | 89 (19,6) | 213 (19,4) | 0,99 (0,78-1,28) | 0,975 | 0,98 (0,76-1,26) | 0,977 |
| Hemorragia leve | 39 (8,6) | 56 (5,1) | 1,66 (1,10-2,51) | 0,016 | 1,48 (0,98-2,25) | 0,065 |
| Hemorragia grave | 32 (7,1) | 106 (9,7) | 0,72 (0,48-1,07) | 0,106 | 0,74 (0,49-1,11) | 0,147 |
| Hemorragia potencialmente mortal | 28 (6,2) | 58 (5,3) | 1,16 (0,73-1,84) | 0,524 | 1,17 (0,73-1,88) | 0,515 |
HR: hazard ratio; IAMCEST: infarto de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; MACE: eventos adversos cardiovasculares mayores.
Salvo otra indicación, los valores expresan n (%).
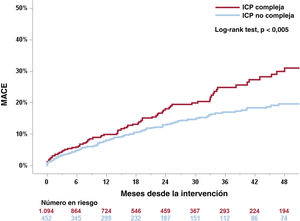
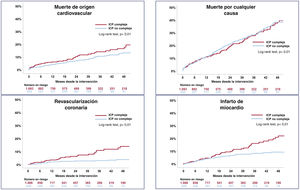
Las estimaciones de Kaplan-Meier de MACE a los 4 años de seguimiento tras el TAVI se muestran en la figura 2. Las tasas de MACE en el seguimiento a 4 años fueron del 31,1 y el 19,6% en los grupos de ICP compleja y no compleja (log-rank test, p<0,005). La ICP compleja aumentó significativamente el riesgo de muerte cardiaca, infarto de miocardio y revascularización coronaria a los 4 años de seguimiento (log-rank test, p<0,001). La complejidad de la ICP no afectó a las cifras de mortalidad por cualquier causa (figura 3). Se observaron cifras similares de eventos hemorrágicos, independientemente de la complejidad de la ICP.
Curvas de Kaplan-Meier de MACE según la complejidad de la ICP. Las estimaciones de Kaplan-Meier muestran cifras más altas de MACE (muerte de origen cardiovascular, infarto de miocardio no quirúrgico y necesidad de nueva revascularización coronaria) en el grupo de ICP compleja (línea roja) que en el de ICP no compleja (línea azul) a los 4 años de seguimiento. ICP: intervención coronaria percutánea; MACE: eventos adversos cardiovasculares mayores.
Efecto de la complejidad de la intervención en los resultados isquémicos y hemorrágicos. Curvas de riesgo acumulado de muerte de origen cardiovascular, muerte por cualquier causa, revascularización coronaria e infarto de miocardio, estratificadas según la complejidad de la ICP. ICP: intervención coronaria percutánea.
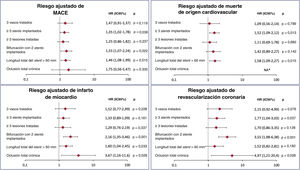
Los riesgos adaptados de los objetivos isquémicos cardiacos (MACE y sus componentes por separado) según el tipo de características de las intervenciones de alto riesgo se muestran en la figura 4. La ICP con implante de 3 o más stents y las bifurcaciones con la estrategia de 2 stents fueron los subconjuntos angiográficos más claramente asociados con un mayor riesgo isquémico.
Efecto de los subconjuntos de intervenciones de alto riesgo en los resultados isquémicos. Riesgo ajustado de MACE, muerte de origen cardiovascular, infarto de miocardio y revascularización coronaria entre los subconjuntos de intervenciones de alto riesgo. No se produjo muerte de origen cardiovascular en el grupo de oclusión crónica total. HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores; NA: no aplicable.
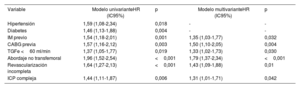
El riesgo de MACE después del TAVI fue del 8,6, el 19,4 y el 29,7% a los 1, 3 y 5 años de seguimiento. Los análisis univariante y multivariante de los factores asociados con la aparición de MACE después del TAVI se muestran en la tabla 5. En el modelo multivariante, el infarto de miocardio previo, la cirugía de revascularización aortocoronaria (CABG) previa, la insuficiencia renal crónica, el acceso no transfemoral, la revascularización incompleta y la ICP compleja se asociaron de manera independiente con un mayor riesgo de MACE.
Predictores independientes de eventos adversos cardiovasculares mayores después del implante percutáneo de válvula aórtica
| Variable | Modelo univarianteHR (IC95%) | p | Modelo multivarianteHR (IC95%) | p |
|---|---|---|---|---|
| Hipertensión | 1,59 (1,08-2,34) | 0,018 | - | - |
| Diabetes | 1,46 (1,13-1,88) | 0,004 | - | - |
| IM previo | 1,54 (1,18-2,01) | 0,001 | 1,35 (1,03-1,77) | 0,032 |
| CABG previa | 1,57 (1,16-2,12) | 0,003 | 1,50 (1,10-2,05) | 0,004 |
| TGFe <60 ml/min | 1,37 (1,05-1,77) | 0,019 | 1,33 (1,02-1,73) | 0,030 |
| Abordaje no transfemoral | 1,96 (1,52-2,54) | <0,001 | 1,79 (1,37-2,34) | <0,001 |
| Revascularización incompleta | 1,64 (1,27-2,13) | <0,001 | 1,43 (1,09-1,88) | 0,01 |
| ICP compleja | 1,44 (1,11-1,87) | 0,006 | 1,31 (1,01-1,71) | 0,042 |
CABG: cirugía de revascularización aortocoronaria; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; TFGe: tasa de filtrado glomerular estimada.
Las principales conclusiones de este estudio se pueden resumir en: a) entre los pacientes remitidos para ICP en el estudio diagnóstico previo al TAVI, aproximadamente 1 de cada 3 se sometió a evascularización coronaria compleja; b) la ICP compleja se asoció con cifras más altas de MACE tras una media de seguimiento de 2 años; 3) los pacientes sometidos a ICP compleja tuvieron mayores riesgos de muerte cardiaca, revascularización coronaria, infarto de miocardio y eventos trombóticos coronarios, con cifras similares de mortalidad por cualquier causa, y d) en el análisis multivariante, la complejidad de la ICP fue un predictor independiente de MACE después del TAVI, junto con revascularización incompleta, infarto de miocardio previo, CABG previa, acceso no transfemoral e insuficiencia renal crónica (figura 5).
Resultados a largo plazo de la ICP compleja en la población con TAVI. Tasa de elementos de la ICP compleja en la población ICP-TAVI (arriba). Predictores de MACE después de TAVI (centro). Los resultados clínicos de la población del estudio se estratificaron según la complejidad de la ICP (abajo, izquierda) y la curva de Kaplan-Meier de MACE hasta 4 años después del TAVI (abajo, derecha). CABG: cirugía de revascularización aortocoronaria; EC: enfermedad coronaria; HR: hazard ratio; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IRC: insuficiencia renal crónica; MACE: eventos adversos cardiovasculares mayores; OCT: oclusión crónica total; TAVI: implante percutáneo de válvula aórtica.
El tratamiento de la EC concomitante en candidatos a TAVI continúa siendo en gran medida un problema sin resolver. Aunque la revascularización coronaria en el estudio diagnóstico previo a la intervención es una práctica habitual en la mayoría de los centros en que se realizan TAVI, no hay evidencia de su idoneidad, debido a la falta de uniformidad de los datos sobre el impacto en los resultados de la EC, su complejidad y la exhaustividad de la revascularización.
Fuera de la población con TAVI, varios ensayos aleatorizados no mostraron ningún beneficio en el pronóstico de la ICP en pacientes con cardiopatía isquémica estable10. En el campo del TAVI, la única evidencia de estudios aleatorizados proviene del ensayo ACTIVATION, que muestra que la ICP guiada por angiografía previa al TAVI no confirió ningún beneficio por lo que respecta a mortalidad y rehospitalización al año en comparación con el tratamiento conservador y, en cambio, aumentó el riesgo de hemorragia11. No obstante, el estudio se interrumpió de forma prematura debido al lento reclutamiento y no cumplió con el margen formal de ausencia de inferioridad, lo que impidió extraer conclusiones definitivas sobre este tema. Además, la mayoría de los pacientes incluidos en ese ensayo tenían lesiones únicas y se les realizaron ICP sencillas de. Un reciente estudio analizó el impacto de la EC obstructiva crónica no tratada en los resultados después del TAVI y presentó cifras relativamente bajas de revascularización coronaria no planificada y síndrome coronario agudo al año (el 0,7 y el 0,5% respectivamente)12, con un incremento de la incidencia según aumentaba la gravedad de la EC. Por lo tanto, podría ser una opción segura el TAVI primero en pacientes con imortante EC concomitante y la ICP podría considerarse tras TAVI en pacientes con síntomas residuales a pesar del tratamiento médico óptimo.
La presencia de EC grave es un factor importante que puede influir en el proceso de toma de decisiones clínicas en pacientes con EA. Los pacientes con EC compleja fueron excluidos de los ensayos aleatorizados que comparaban TAVI y recambio valvular quirúrgico, lo que afectó a las posibilidades de generalización de los resultados a la población general con EA13,14. En un estudio con emparejamiento por puntuación de propensión, Alperi et al.4 mostraron que en pacientes con EC compleja (puntuación SYNTAX >22 o enfermedad del tronco coronario izquierdo en ausencia de derivación coronaria funcionante), el abordaje percutáneo (ICP+TAVI) se asoció con un riesgo similar de MACE (mortalidad por cualquier causa, infarto de miocardio, revascularización coronaria e ictus) en comparación con una intervención quirúrgica combinada (recambio quirúrgico de válvula aórtica+CABG) después de una mediana de seguimiento de 3 años. Sin embargo, se observó un mayor riesgo de nueva revascularización coronaria en los receptores de TAVI+ICP.
Hasta la fecha, pocos estudios han analizado el impacto de la complejidad de la lesión coronaria en los resultados posteriores al TAVI. En un estudio con 604 pacientes, la complejidad anatómica de la EC coexistente se asoció con un riesgo 2 veces mayor de mortalidad cardiovascular después del TAVI (puntuación SYNTAX >22; HR=1,84; p=0,041)6. La EC compleja fue un predictor independiente de muerte de origen cardiovascular, lo que indica que no es simplemente un marcador de carga ateroesclerótica, sino más bien un factor de riesgo isquémico crítico en pacientes con EA. Sin embargo, el estudio estuvo limitado por su pequeño tamaño muestral y la experiencia de un solo centro.
Hasta donde se sabe, el presente estudio es el primero en mostrar el impacto de la complejidad de la revascularización coronaria en los resultados a largo plazo en una gran cohorte multicéntrica de pacientes con TAVI sometidos a ICP durante el estudio diagnóstico previo a la intervención. Esto es digno de mención por 2 motivos: en primer lugar, la complejidad de la ICP suele reflejar la de la EC y, en segundo lugar, ofrece una visión práctica del efecto de las técnicas de revascularización en los resultados clínicos. En esta cohorte, la complejidad de la ICP se asoció de manera significativa con peores resultados a largo plazo. Tener al menos 1 de los criterios de ICP compleja confirió un mayor riesgo de muerte de origen cardiovascular, infarto de miocardio, revascularización coronaria, trombosis del stent y reestenosis después del TAVI. La mortalidad total no fue diferente entre pacientes con ICP compleja e ICP no compleja. Sin embargo, el perfil de riesgo basal y la carga de comorbilidad, que afecta principalmente al pronóstico en pacientes con TAVI, fueron similares entre los 2 grupos, lo que podría explicar los resultados comparables por lo que respecta a la mortalidad por cualquier causa. En cambio, las diferencias fueron marcadas en cuanto a la complejidad de la EC y las características de las intervenciones. Aproximadamente la mitad de los pacientes presentaban enfermedad multivaso y las lesiones coronarias con frecuencia eran complejas (tipo B2/C, calcificadas, con una ubicación ostial), lo que probablemente explicaría el riesgo excesivo de mortalidad de origen cardiovascular relacionado con la ICP compleja. Además, la asociación entre la complejidad de la ICP y el riesgo isquémico probablemente sea multifactorial. Los pacientes sometidos a intervenciones más complejas suelen tener una EC más avanzada, lo que implica un mayor riesgo de aterotrombosis debida a la progresión natural de la EC15. El tratamiento de lesiones más complejas (es decir, bifurcaciones, lesiones calcificadas) puede aumentar el riesgo de aposición incompleta del stent y retraso de la endotelización, lo que puede actuar como desencadenante de la activación plaquetaria y la posterior trombosis intracoronaria16,17.
Estas conclusiones están en consonancia con las presentadas anteriormente en estudios de ICP, que muestran el impacto desfavorable de la complejidad de la intervención7,18,19. Giustino et al.7 mostraron que la ICP compleja se asoció con un mayor riesgo de eventos isquémicos, pero no hemorrágicos, lo que indica también el papel protector del tratamiento antiagregante plaquetario doble prolongado (≥ 1 año) en la reducción del riesgo en comparación con un tratamiento antiagregante plaquetario doble más corto. En un metanálisis reciente, la complejidad de la ICP aumentó el riesgo de eventos isquémicos y hemorrágicos19. Curiosamente, en nuestro estudio, la frecuencia de ICP compleja (frente a ICP sencilla) fue mayor que en cohortes de ICP previas (el 29,3 frente al 18%), así como el número de eventos coronarios durante el seguimiento, lo que pone de relieve el perfil de alto riesgo de la población con TAVI que requiere ICP7. Con todo, hay que señalar que las tasas de trombosis del stent y de reestenosis tras un seguimiento medio de 2 años fueron tan bajas como el 1,2 y el 5,2%, lo que aporta evidencia tranquilizadora en relación con los resultados a largo plazo de la ICP previa al TAVI.
El infarto de miocardio previo, la CABG previa, la insuficiencia renal crónica y el acceso no transfemoral se identificaron como predictores independientes de MACE después del TAVI y estos resultados se ajustan a la evidencia previa que presentaba el efecto adverso de las comorbilidades del paciente después de la ICP y del TAVI20. Cabe destacar que la ICP compleja y la revascularización incompleta también se asociaron con un mayor riesgo de MACE en el modelo multivariante. El impacto clínico de la exhaustividad de la revascularización continúa siendo un tema controvertido. Si bien algunos estudios no presentaron un beneficio clínico claro21,22, la revascularización parcial y la puntuación SYNTAX residual se han asociado con peores resultados después del TAVI, lo que favorece una estrategia de revascularización completa en el estudio diagnóstico previo a este3,5. Se necesitan ensayos aleatorizados para establecer la estrategia (enfoque conservador o revascularización completa) que se traduce en los resultados más favorables después del TAVI. Del mismo modo, se debe explicar el papel potencial de la evaluación fisiológica (reserva fraccional de flujo, índice sin ondas instantáneo) en los candidatos a TAVI. Aunque la ICP guiada por fisiología se ha asociado con mejores resultados que la ICP guiada por angiografía23, los datos sobre la aplicabilidad de las pruebas funcionales invasivas en el entorno de la EA son escasos y justifican una mayor validación de los valores umbral óptimos.
Los tratamientos intervencionistas ofrecen la oportunidad de retrasar el tratamiento de la EC o la EA, equilibrando la secuencia en función del estado clínico del paciente y la práctica de los centros. Con todo, teniendo en cuenta el impacto desfavorable de los factores angiográficos (número de vasos enfermos) y los factores de la intervención (número de stents, longitud del stent, bifurcación con una estrategia de 2 stents), la estrategia de revascularización debe planificarse y personalizarse. La decisión de revascularizar o no debe ser equilibrada según la gravedad y la ubicación de la estenosis coronaria, la esperanza de vida del paciente y el riesgo de perjudicar un nuevo acceso coronario después del TAVI. La forma de revascularizar continúa siendo una decisión más difícil debido al estrecho equilibrio entre evitar la complejidad de la intervención y lograr una revascularización completa.
Las conclusiones de este estudio destacan el papel fundamental de las características coronariográficas y la complejidad de la ICP como un importante factor de riesgo de eventos adversos mayores que el equipo cardiovascular debe tener en cuenta al elegir la estrategia de tratamiento (respecto a la EA y la EC) en pacientes con EC extensa. Se esperan más estudios aleatorizados que ofrezcan una evidencia definitiva sobre el posible beneficio o falta de beneficios de la revascularización sistemática de los pacientes con TAVI y cardiopatía isquémica estable y el significado en el pronóstico del grado de revascularización miocárdica.
LimitacionesEste estudio presenta algunas limitaciones. En primer lugar, el diseño del estudio es observacional y, aunque los datos se recopilaron de forma prospectiva, el presente análisis no se especificó previamente y es retrospectivo. A pesar de que el riesgo de MACE se adaptó en las covariables importantes, podría haber habido factores de confusión residuales debido a factores no medidos. La decisión de realizar la ICP y la estrategia de revascularización se dejaron a criterio del cardiólogo responsable de la intervención en cada centro participante, sin criterios de selección predefinidos. Aunque los datos sobre la pauta farmacológica se recopilaron prospectivamente, no se pudo hacer un subanálisis que evaluara el impacto de varias estrategias antitrombóticas en los resultados isquémicos y hemorrágicos, principalmente debido al número relativamente pequeño de eventos en el seguimiento. Además, casi una tercera parte de esta población necesitó tratamiento anticoagulante oral concomitante, lo que definió muchas combinaciones terapéuticas posibles. Por último, aunque los eventos clínicos se clasificaron de acuerdo con definiciones estandarizadas, no fueron adjudicados por un comité de validación de eventos independiente.
CONCLUSIONESEntre los pacientes con EC e ICP en el estudio diagnóstico previo al TAVI, aquellos con características de ICP compleja presentaron peores resultados a largo plazo, como un riesgo mucho mayor de muerte de origen cardiovascular, infarto de miocardio y trombosis del stent hasta los 4 años de seguimiento. Además, la complejidad de la ICP fue un indicador independiente de MACE después del TAVI. Este estudio amplía las conclusiones previas sobre la ICP compleja en población con TAVI y defiende la hipótesis de que la complejidad de la intervención debe tenerse en cuenta como un indicador de la estratificación del riesgo durante el estudio diagnóstico previo al TAVI, lo que podría afectar a la estrategia de tratamiento. Se justifican más estudios para definir mejor el tratamiento óptimo de la EC en pacientes con EA grave, principalmente en relación con la necesidad de revascularización sistemática, el alcance de su exhaustividad y el tipo y la duración del tratamiento antitrombótico.
FINANCIACIÓNJ. Rodés-Cabau ostenta la Cátedra de Investigación Fondation Famille Jacques Larivière sobre el desarrollo de intervenciones en cardiopatías estructurales (Laval University).
CONSIDERACIONES ÉTICASEste estudio se realizó de conformidad con el comité de ética de cada centro participante y todos los pacientes dieron el consentimiento informado por escrito para las intervenciones. Este estudio se realizó según las directrices SAGER (Sex and Gender Equity in Research).
DECLARACIÓN SOBRE EL USO DE LA INTELIGENCIA ARTIFICIALNo se utilizaron herramientas de inteligencia artificial en la preparación de este estudio.
CONTRIBUCIÓN DE LOS AUTORESM. Avvedimento y J. Rodès-Cabau concibieron y diseñaron el estudio. M. Avvedimento y J. Nuche fusionaron bases de datos locales de todos los centros participantes y fueron los responsables del control de calidad de los datos. M. Côté realizó el análisis estadístico. M. Avvedimento escribió el primer borrador del artículo. Todos los autores participaron en el diseño y la cumplimentación de las bases de datos locales. Todos los autores aprobaron la versión final del artículo y aseguraron la exactitud y la integridad del trabajo. Todos los autores tuvieron acceso a todos los datos del estudio y son responsables finales de la decisión de enviar el artículo para su publicación. J. Rodès-Cabau es responsable del contenido general del estudio en su calidad de garante.
CONFLICTO DE INTERESESJ. Rodès-Cabau ha recibido subvenciones institucionales para investigación y honorarios como ponente/asesor de Edwards Lifesciences y Medtronic. Los demás autores no declaran ningún conflicto en relación con el contenido de este artículo.
- –
La prevalencia de EC en la población con TAVI es bastante alta, y al menos el 25% de los candidatos a TAVI se sometieron a ICP como parte del estudio diagnóstico previo a la intervención o en el momento del TAVI.
- –
Los pacientes tratados con TAVI con frecuencia tienen enfermedad multivaso y lesiones coronarias complejas.
- –
La evidencia previa indica que la complejidad anatómica de la EC y la exhaustividad de la revascularización coronaria podrían tener un impacto en los resultados clínicos después del TAVI.
- –
El grado de complejidad de la intervención es un importante factor determinante del pronóstico en la población de ICP-TAVI.
- –
Los pacientes sometidos a ICP compleja presentan peores resultados a largo plazo, como un mayor riesgo de muerte de origen cardiovascular, infarto de miocardio y revascularización coronaria.
- –
En pacientes con EC que requieren revascularización coronaria en el estudio diagnóstico previo al TAVI, al elegir la estrategia de tratamiento el equipo cardiovascular debe tener en cuenta la complejidad de la ICP como un indicador de la estratificación del riesgo.