Determinar la incidencia de complicaciones vasculares entre los pacientes con insuficiencia renal crónica tratados con angioplastia primaria por vía femoral, así como evaluar la seguridad y la eficacia del uso de dispositivos de cierre vascular en este contexto.
MétodosRegistro de 527 pacientes sometidos a angioplastia primaria por vía femoral entre enero de 2003 y diciembre de 2008. Se definió insuficiencia renal crónica como aclaramiento de creatinina<60mL/min. El objetivo primario fue la presencia de complicaciones vasculares mayores.
ResultadosUn total de 166 (31,5%) pacientes sufrían insuficiencia renal crónica. El grupo de pacientes con insuficiencia renal crónica tuvo mayor incidencia de complicaciones vasculares mayores que los pacientes sin deterioro de la función renal (el 8,4 frente al 4,2%; p=0,045), especialmente de las que precisaron trasfusión (el 6,6 frente al 1,9%; p=0,006). Entre los pacientes con insuficiencia renal crónica, 129 (77,7%) recibieron un dispositivo de cierre vascular, mientras que en 37 pacientes (22,3%) se aplicó compresión manual. El riesgo de complicaciones vasculares mayores fue significativamente menor con el uso de dispositivos de cierre vascular que con la compresión manual (el 4,7 frente al 21,6%; p=0,003). En el análisis multivariable, el uso de dispositivos de cierre vascular entre los pacientes con insuficiencia renal crónica tratados con angioplastia primaria se asoció de forma independiente con menor riesgo de complicaciones vasculares mayores (odds ratio=0,11; intervalo de confianza del 95%, 0,03-0,41; p=0,001).
ConclusionesLos pacientes con insuficiencia renal crónica tratados con angioplastia primaria por vía femoral tienen mayor riesgo de sufrir complicaciones vasculares mayores. El uso de dispositivos de cierre vascular en este grupo de pacientes es seguro y se asocia a reducción del riesgo de complicaciones vasculares mayores, en comparación con la compresión manual.
Palabras clave
La presencia de insuficiencia renal crónica (IRC) se asocia de forma independiente con un incremento de la morbimortalidad cardiovascular, lo que incluye mayor riesgo de infarto agudo de miocardio1. No es de extrañar, debido al aumento de la prevalencia de IRC en el mundo occidental, que los pacientes con deterioro de la función renal constituyan un grupo de importancia creciente entre los pacientes remitidos de urgencia a los laboratorios de hemodinámica para la realización de una angioplastia primaria (AP) como tratamiento de un síndrome coronario agudo con elevación del segmento ST (SCACEST). El deterioro de la función renal se ha relacionado con un mayor riesgo de sangrado y complicaciones en relación con el acceso vascular tras el intervencionismo coronario percutáneo (ICP)2. Sin embargo en el contexto concreto de la AP, donde el riesgo es especialmente elevado por la necesidad de anticoagulación y antiagregación intensivas, se desconoce la incidencia real de complicaciones en relación con el acceso vascular en el grupo de pacientes con IRC.
Con el fin de reducir las complicaciones hemorrágicas tras el ICP, se han desarrollado diferentes estrategias, como la utilización de nuevos anticoagulantes como la bivalirudina o el uso preferente del acceso radial3, 4. El uso de dispositivos de cierre vascular (DCV) para este propósito continúa siendo controvertido5. Más aún, sobre los pacientes de elevado riesgo hemorrágico como son los pacientes con IRC o los sometidos a una AP, hay escasa información en cuanto a la seguridad de dichos dispositivos, pues estos pacientes han sido excluidos de la mayor parte de los estudios que han evaluado el uso de DCV6. En el caso concreto de los pacientes con IRC, trabajos recientes han comunicado un riesgo elevado de complicaciones vasculares con el uso de DCV7.
El objetivo de nuestro estudio es analizar la incidencia de complicaciones vasculares entre los pacientes con IRC tratados con AP por vía femoral en comparación con los pacientes sin deterioro de la función renal, así como determinar la seguridad y la eficacia del uso de los DCV en los pacientes con IRC tratados con AP.
MÉTODOSContexto y población en estudioEl Servicio Galego de Saúde (SERGAS) ha puesto en marcha un programa denominado PROGALIAM para garantizar el acceso a la AP a la mayor parte de la población gallega. Los detalles de dicho programa han sido descritos previamente8, 9. De forma breve, los pacientes con SCACEST que llegan a los hospitales intervencionistas y son candidatos a tratamiento mediante reperfusión según lo establecido en las guías de práctica clínica son tratados mediante ICP urgente. Los pacientes que llegan en primer lugar a un hospital no intervencionista son trasladados rápidamente al centro con laboratorio de hemodinámica a través del servicio de ambulancias medicalizadas del 061 para recibir el mismo tratamiento. Todos los pacientes que se presentaron con dolor anginoso típico de más de 30 min de duración con una elevación del ST ≥ 1 mm en dos o más derivaciones contiguas (o depresión recíproca ≥ 1 mm en las derivaciones V1 o V2) o bloqueo de rama izquierda del haz de His y dentro de las primeras 12 h tras el inicio de los síntomas eran candidatos a AP y se los incluyó en el estudio si el procedimiento se realizó mediante abordaje femoral. Se excluyó del estudio a los pacientes que fallecieron durante el procedimiento y los que precisaron el implante de un balón intraaórtico de contrapulsación por la misma vía por la que se realizó el procedimiento. La información respecto a características clínicas, factores de riesgo cardiovascular y tratamientos previos se recogieron directamente del paciente o, en caso necesario, de las historias clínicas.
Protocolo de angioplastia primariaCardiólogos intervencionistas con experiencia acreditada realizaron todas las AP siguiendo las guías de práctica clínica. La canulación de la arteria femoral se realizó mediante técnica de Seldinger tras identificación de los puntos anatómicos de referencia. Se utilizaron habitualmente introductores de 6 Fr, y sólo en los casos en que la complejidad de la intervención precisase mayor calibre se usaron introductores de 7 Fr. Todos los pacientes recibieron 250 mg de ácido acetilsalicílico en el momento del diagnóstico. Se administró una dosis de carga de 300 mg de clopidogrel en el servicio de urgencias o durante el traslado en ambulancia. En caso de no haber recibido dicha dosis de carga, esta se administró tras la realización de la angioplastia y antes de abandonar el laboratorio de hemodinámica. La utilización del antagonista de la glucoproteína IIb/IIIa abciximab (ReoPro®; dosis de carga, 0,25mg/kg, seguida de una perfusión de 0,125μg/kg/min durante 12 h) estaba altamente recomendada en el protocolo, aunque su uso quedó a criterio del médico que atendió inicialmente al paciente. Durante el cateterismo se administró una dosis intravenosa de heparina no fraccionada de 60 UI/kg con abciximab o 100 UI/kg sin abciximab. Tras el procedimiento se recomendó una dosis de mantenimiento de clopidogrel de 75mg/día durante 1 mes en el caso de implante de un stent convencional y durante 12 meses si se trataba de un stent liberador de fármacos.
Protocolo de hemostasiaEn cada caso, el intervencionista eligió el método de cierre de la arteria femoral. Por sistema, en los casos en que se consideraba utilizar un DCV, se realizó una angiografía femoral previamente al implante. Por norma general, no se empleó el dispositivo si la punción no se localizaba en la arteria femoral común, si esta era de escaso calibre (menos de 5 mm) o si había enfermedad arterial periférica severa. La elección del tipo de dispositivo quedó también a elección del operador entre los tres disponibles: Angio-Seal® (St. Jude Medical; St. Paul, Minnesota, Estados Unidos), StarClose® (Abbott Laboratories; Abbott Park, Illinois, Estados Unidos) y Perclose A-T® (Abbott Laboratories; Abbott Park, Illinois, Estados Unidos). El implante del dispositivo se realizó en el laboratorio de hemodinámica inmediatamente tras finalizar el procedimiento y siguiendo las instrucciones del fabricante. En los casos en que se realizó compresión manual, el introductor se retiraba en la sala de hemodinámica al finalizar el procedimiento y se aplicaba presión manual en el lugar de punción durante 15-20 min. En caso de ser necesario, se utilizaba un dispositivo mecánico de compresión hasta la obtención de hemostasia completa. Posteriormente se aplicaba un vendaje compresivo inguinal durante 8 h. Por protocolo y de acuerdo con las guías de práctica clínica, no se permitió la deambulación a los pacientes de ambos grupos hasta pasadas 12-24 h de la AP.
Definiciones y eventosSe definió IRC como un aclaramiento de creatinina<60ml/min calculado según la fórmula de Cockcroft-Gault: (140 – edad)×(peso) (× 0,85 si sexo femenino) / (72×creatinina en suero) en la determinación analítica basal al ingreso. Esta fórmula ha sido adecuadamente validada y predice con exactitud la tasa de filtrado glomerular10. Con el fin de describir el espectro de afección renal de nuestra población y su impacto en las complicaciones vasculares mayores (CVM), también se dividió a los pacientes con IRC en dos grupos según presentasen un aclaramiento de creatinina estimado de 30-60 o < 30ml/min (IRC grave). Todos los pacientes fueron examinados durante el ingreso para evaluar la presencia de complicaciones en relación con el acceso vascular. Se obtuvieron sistemáticamente determinaciones analíticas completas tanto al ingreso como de 24 a 72 h tras el procedimiento. Se definió CVM como el evento combinado compuesto por toda complicación en relación con el acceso vascular que fuese tanto mortal como que precisase reparación quirúrgica o endovascular, precisase trasfusión o se asociase con una caída de hemoglobina ≥ 3g/dl. Esta definición está basada en la definición de sangrado mayor OASIS11(Organization to Assess Strategies in acute Ischemic Syndromes). Se evaluó también la presencia de complicaciones vasculares menores, entre las que se incluyeron hematoma, fístula arteriovenosa, seudoaneurisma y sangrado que no cumpliesen criterios de CVM, así como infección en la zona de acceso vascular. Se definió fracaso del DCV como suspensión del implante o implante ineficaz por hemostasia inadecuada que precisara compresión manual o mecánica. El análisis se realizó por intención de tratar; por lo tanto, en caso de fracaso del dispositivo, el paciente fue incluido en el grupo de DCV. Finalmente, se evaluó también la mortalidad a 30 días.
Análisis estadísticoLos resultados se presentan como media±1 desviación estándar para las variables continuas distribuidas normalmente, como medianas [intervalo intercuartílico] para las variables continuas de distribución no gaussiana y como porcentajes para las variables categóricas. Las variables categóricas se compararon utilizando el test de la χ2 o la prueba exacta de Fisher. Las variables cuantitativas se analizaron mediante la prueba de la t de Student o la de la U de Mann-Whitney, en función de que la distribución fuera normal o no. Con el fin de valorar el efecto independiente de la IRC en la incidencia de CVM, se construyó un modelo de regresión logística incluyendo las variables asociadas de modo independiente con la presencia de CVM en nuestra muestra (sexo y uso de DCV) y otras variables que, en virtud de la literatura previa, la experiencia clínica y/o su distribución asimétrica entre los grupos, se consideraron potenciales factores de confusión (edad, área de superficie corporal, diabetes mellitus, enfermedad vascular periférica, shock y uso de abciximab). Las variables en el modelo fueron introducidas en bloque. De igual modo, se construyó un modelo de regresión logística incluyendo las mismas variables para determinar el efecto independiente del uso de DCV en las CVM del grupo de pacientes con IRC. El nivel de significación se fijó en p < 0,05. Todos los análisis estadísticos se realizaron con el paquete estadístico SPSS 15.0 para Windows (SPSS, Chicago, Illinois, Estados Unidos).
RESULTADOSEn el periodo comprendido entre el 1 de enero de 2003 y el 31 de diciembre de 2008, en nuestro centro se trató con AP por vía femoral a 527 pacientes que cumplían los criterios de inclusión en el estudio (el 32% del total de las AP realizadas durante ese periodo). Del total de pacientes incluidos, 166 (31,5%) tenían IRC y, de estos, 23 (13,9%) presentaban un aclaramiento de creatinina<30ml/min. Del grupo de pacientes con IRC, 129 (77,7%) recibieron un DCV y en 37 (22,3%) se aplicó compresión manual. De los pacientes con IRC que recibieron un DCV, en 86 (66,7%) se utilizó el dispositivo Angio-Seal®, en 25 (19,4%) se usó Perclose A-T® y en 18 (13,9%), StarClose®.
Complicaciones vasculares en los pacientes con insuficiencia renal crónica tratados mediante angioplastia primaria por vía femoralEn comparación con el grupo de pacientes sin deterioro de la función renal, los pacientes con IRC basal eran significativamente de mayor edad, presentaban mayor prevalencia de diabetes mellitus, hipertensión arterial y enfermedad arterial periférica y recibieron con menor frecuencia tratamiento con abciximab. Con respecto al procedimiento, cabe destacar que en el grupo de pacientes con IRC se utilizaron DCV con menor frecuencia. Las características clínicas y del procedimiento de la población total del estudio se recogen en la Tabla 1.
Tabla 1. Características basales y del procedimiento del global de la población
| Insuficiencia renal (n=166) | Grupo control (n=361) | p | |
| Edad (años) | 72,3±9,9 | 60,2±11,7 | < 0,001 |
| Varones | 121 (72,9) | 285 (78,9) | 0,125 |
| Superficie corporal (m2) | 1,8±0,2 | 1,8±0,3 | 0,708 |
| Hipertensión | 59 (35,5) | 78 (21,6) | 0,001 |
| Dislipemia | 27 (16,3) | 66 (18,3) | 0,573 |
| Fumadores | 12 (7,2) | 64 (17,7) | 0,001 |
| Diabetes mellitus | 31 (18,7) | 33 (9,1) | 0,002 |
| Enfermedad arterial periférica | 16 (9,6) | 13 (3,6) | 0,005 |
| Antecedentes de IAM | 5 (3) | 12 (3,3) | 0,851 |
| Antecedentes de cirugía coronaria | 2 (0,6) | 2 (1,2) | 0,594 |
| Infarto anterior | 71 (43) | 163 (45,2) | 0,650 |
| Shock cardiogénico | 14 (8,4) | 9 (2,5) | 0,002 |
| Aclaramiento de creatinina (ml/min) | 43,7±11,1 | 91,6±28,3 | < 0,001 |
| Características del procedimiento | |||
| Abciximab | 96 (57,8) | 258 (71,5) | 0,002 |
| Clopidogrel | 154 (94,5) | 344 (96,1) | 0,407 |
| Retraso síntomas-reperfusión (min) | 237 [177-378] | 220 [160-322] | 0,114 |
| Retraso contacto-balón (min) | 122 [86-173] | 111 [80-150] | 0,031 |
| Éxito angiográfico | 160 (97) | 355 (98,3) | 0,333 |
| Introductor de 7 Fr | 5 (3) | 10 (2,8) | 0,877 |
| Dispositivos de cierre vascular | 129 (77,7) | 307 (85) | 0,039 |
IAM: infarto agudo de miocardio.
Los datos expresan media±desviación estándar para las variables distribuidas normalmente, medianas [intervalo intercuartílico] para las variables con distribución no gaussiana y n (%) para las variables categóricas.
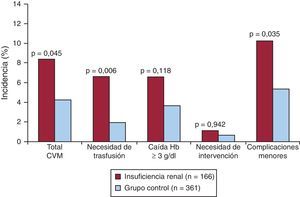
Los pacientes con IRC presentaron mayor incidencia de CVM que los pacientes sin deterioro de la función renal (el 8,4 frente al 4,2%; p=0,045). Entre las CVM, destaca la mayor incidencia de hemorragias femorales que precisaron trasfusión entre los pacientes con IRC (el 6,6 frente al 1,9%; p=0,006). Asimismo, los pacientes con IRC presentaron mayor incidencia de complicaciones vasculares menores (el 10,2 frente al 5,3%; p=0,035). Por otro lado, en nuestra población el nivel de deterioro de la función renal se relacionó también con mayor incidencia de CVM (el 4,2% en pacientes sin IRC frente al 7% en pacientes con aclaramiento de creatinina en 30-60ml/min frente al 17,4% en pacientes con IRC grave; p=0,017). En cuanto a la mortalidad a 30 días, fue significativamente mayor entre los pacientes con IRC que entre los pacientes sin deterioro de la función renal (el 11,4 frente al 1,7%; p<0,001). En la Tabla 2 y la Figura 1 se detallan los eventos en el total de la población.
Tabla 2. Resumen de los eventos en el total de la población
| Insuficiencia renal crónica (n=166) | Grupo control (n=361) | p | |
| CVM | 14 (8,4) | 15 (4,2) | 0,045 |
| Trasfusión | 11 (6,6) | 7 (1,9) | 0,006 |
| Caída de hemoglobina ≥ 3 g/dL | 11 (6,6) | 13 (3,6) | 0,118 |
| Necesidad de intervención | 4 (1,1) | 1 (0,6) | 0,942 |
| Hematoma retroperitoneal | 2 (1,2) | 4 (1,1) | 0,923 |
| Complicaciones vasculares menores | 17 (10,2) | 19 (5,3) | 0,035 |
| Seudoaneurisma | 1 (0,6) | 1 (0,3) | 0,531 |
| Fístula arteriovenosa | 2 (1,2) | 2 (0,6) | 0,594 |
| Sangrado/hematoma menor | 13 (7,8) | 16 (4,4) | 0,112 |
| Infección | 1 (0,6) | 0 (0) | 0,315 |
| Muerte a 30 días | |||
| Total | 19 (11,4) | 6 (1,7) | < 0,001 |
| Vascular | 1 (0,6) | 1 (0,3) | 0,531 |
CVM: complicaciones vasculares mayores.
Los datos expresan n (%).
Figura 1. Gráfico de barras que muestra la incidencia de complicaciones vasculares en el total de la población según la presencia de insuficiencia renal crónica. CVM: complicaciones vasculares mayores; Hb: hemoglobina.
En el modelo de regresión ajustado por potenciales variables de confusión, la IRC se asoció con mayor riesgo de CVM, aunque este resultado no resultó estadísticamente significativo (odds ratio [OR]=2; intervalo de confianza del 95% [IC95%], 0,92-4,43; p=0,081). Si hubo asociación independiente entre IRC grave y CVM (OR=3,4; IC95%, 1,1-11,7; p=0,043). En este modelo, además de la IRC grave, el sexo femenino (OR=3,8; IC95%, 1,7-8,3; p=0,001) y el uso de DCV (OR=0,4; IC95%, 0,2-0,9; p=0,029) se asociaron de forma independiente con la presencia de CVM.
Seguridad y eficacia del uso de dispositivos de cierre vascular en los pacientes con insuficiencia renal crónica tratados con angioplastia primariaEn el grupo de pacientes con IRC, no hubo diferencias significativas en cuanto a las características basales y del procedimiento entre los pacientes que recibieron un DCV y aquellos a los que se aplicó compresión manual (Tabla 3).
Tabla 3. Características basales y del procedimiento de los pacientes con insuficiencia renal crónica
| Dispositivos de cierre vascular (n=129) | Compresión manual (n=37) | p | |
| Edad (años) | 72,8±9,6 | 70,9±10,7 | 0,322 |
| Varones | 95 (73,6) | 26 (70,3) | 0,684 |
| Superficie corporal (m2) | 1,8±0,3 | 1,8±0,1 | 0,953 |
| Hipertensión | 44 (34,1) | 15 (40,5) | 0,471 |
| Dislipemia | 22 (17,1) | 5 (13,5) | 0,607 |
| Fumadores | 12 (9,3) | 0 | 0,070 |
| Diabetes mellitus | 22 (17,1) | 9 (24,3) | 0,317 |
| Enfermedad arterial periférica | 11 (8,5) | 5 (13,5) | 0,355 |
| Antecedentes de IAM | 3 (2,3) | 2 (5,4) | 0,312 |
| Antecedentes de cirugía coronaria | 2 (1,6) | 0 | 0,987 |
| Infarto anterior | 57 (44,5) | 14 (37,8) | 0,469 |
| Shock cardiogénico | 9 (7) | 5 (13,5) | 0,310 |
| Aclaramiento de creatinina (ml/min) | 42,7±13,7 | 47±10,3 | 0,085 |
| Características del procedimiento | |||
| Abciximab | 74 (57,4) | 22 (59,5) | 0,820 |
| Clopidogrel | 121 (96) | 33 (89,2) | 0,119 |
| Retraso síntomas-reperfusión (min) | 254 [190-389] | 212 [153-294] | 0,131 |
| Retraso contacto-balón (min) | 126 [87-189] | 120 [78-157] | 0,248 |
| Introductor de 7 Fr | 4 (3,1) | 1 (2,7) | 0,899 |
| Éxito angiográfico | 126 (98,4) | 34 (91,9) | 0,075 |
IAM: infarto agudo de miocardio.
Los datos expresan media±desviación estándar para las variables distribuidas normalmente, medianas [intervalo intercuartílico] para las variables con distribución no gaussiana y n (%) para las variables categóricas.
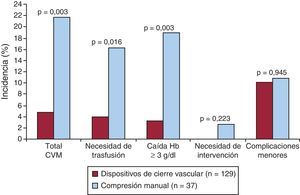
Entre los pacientes con IRC tratados mediante AP por vía femoral, el uso de DCV se asoció con menor incidencia de CVM que con la compresión manual (el 4,7 frente al 21,6%; p=0,003). El uso de DCV en el grupo de pacientes con IRC se asoció a menor necesidad de trasfusión (el 3,9 frente al 16,2%; p=0,016) y menor incidencia de sangrado asociado a caída de hemoglobina ≥ 3g/dl (el 3,1 frente al 18,9%; p=0,003). En cuanto a las complicaciones vasculares menores, no hubo diferencias entre ambos grupos en el combinado ni en ninguno de sus componentes individuales. Tampoco hubo diferencias entre los grupos en lo que se refiere a mortalidad a 30 días. Con respecto al fracaso del DCV en los pacientes con IRC, este ocurrió en 8 (6,2%) pacientes. Entre los pacientes con IRC a los que se implantó un DCV, el fracaso del dispositivo se asoció con mayor incidencia de CVM que cuando el implante se realizó con éxito (el 25 frente al 3,3%; p=0,036). En la Tabla 4 y la Figura 2 se detallan los eventos en el grupo de pacientes con IRC.
Tabla 4. Resumen de los eventos en el grupo de pacientes con insuficiencia renal crónica
| Dispositivos de cierre vascular (n=129) | Compresión manual (n=37) | p | |
| CVM | 6 (4,7) | 8 (21,6) | 0,003 |
| Trasfusión | 5 (3,9) | 6 (16,2) | 0,016 |
| Caída de hemoglobina ≥ 3 g/dl | 4 (3,1) | 7 (18,9) | 0,003 |
| Necesidad de intervención | 0 | 1 (2,7) | 0,223 |
| Hematoma retroperitoneal | 1 (0,8) | 1 (2,7) | 0,397 |
| Complicaciones vasculares menores | 13 (10,1) | 4 (10,8) | 0,945 |
| Seudoaneurisma | 0 | 1 (2,7) | 0,223 |
| Fístula arteriovenosa | 2 (1,6) | 0 | 0,603 |
| Sangrado/hematoma menor | 10 (7,8) | 3 (8,1) | 0,944 |
| Infección | 1 (0,8) | 0 | 0,777 |
| Muerte a 30 días | |||
| Total | 13 (10,1) | 6 (16,2) | 0,378 |
| Vascular | 0 | 1 (2,7) | 0,223 |
CVM: complicaciones vasculares mayores.
Los datos expresan n (%).
Figura 2. Gráfico de barras que muestra la incidencia de complicaciones vasculares en el grupo de pacientes con insuficiencia renal crónica según el uso de dispositivos de cierre vascular. CVM: complicaciones vasculares mayores; Hb: hemoglobina.
En el análisis de regresión logística ajustado por potenciales variables de confusión, el uso de DCV entre los pacientes con IRC tratados con AP se asoció de forma independiente con menor riesgo de CVM (OR=0,11; IC95%, 0,03-0,41; p=0,001). Además del uso de DCV, sólo la superficie corporal se asoció de forma independiente con la presencia de CVM entre los pacientes con IRC (OR=0,02; IC95%, 0,01-0,7; p=0,033).
DISCUSIÓNEste estudio evalúa por primera vez la incidencia de complicaciones en relación con el acceso vascular en pacientes con IRC tratados con AP por vía femoral en el seno de un SCACEST, así como la seguridad y la eficacia del uso de DCV en este mismo grupo de pacientes.
Complicaciones vasculares en el grupo de pacientes con insuficiencia renal crónica tratados con angioplastia primaria por vía femoralVarios estudios han demostrado una fuerte asociación entre el deterioro de la función renal y la presencia de complicaciones hemorrágicas tras el ICP, así como en el contexto específico de la AP12, 13. Sin embargo, no se había publicado previamente la incidencia concreta de complicaciones hemorrágicas en relación con el acceso vascular entre los pacientes con IRC tratados mediante AP por vía femoral. Nuestros resultados muestran mayor incidencia de complicaciones vasculares femorales en el grupo de pacientes con IRC que en los pacientes sin deterioro de la función renal, y además el riesgo de sufrir una CVM es más elevado a mayor deterioro de la función renal. Es de destacar, entre los pacientes con IRC, especialmente un mayor riesgo de hemorragias femorales que precisaron trasfusión sanguínea.
Varios mecanismos parecen explicar el exceso de complicaciones hemorrágicas entre los pacientes con IRC tras el ICP. En primer lugar, se trata de una población de pacientes con una elevada prevalencia de comorbilidades asociadas, que justifican al menos en parte el mayor riesgo de sangrado13. En segundo lugar, se ha postulado también un efecto directo del propio deterioro de la función renal en el riesgo hemorrágico, mediado por la disfunción endotelial y plaquetaria que se produce en una situación de uremia14. En este sentido, en el presente estudio los pacientes con IRC supusieron un grupo de mayor edad y con mayor prevalencia de diabetes mellitus y enfermedad arterial periférica, y tras un análisis ajustado, sólo la IRC grave se asoció de forma independiente con la presencia de CVM.
En nuestra población, y en concordancia con lo comunicado en trabajos previos, la presencia de IRC se asoció con mayor mortalidad tras la AP13. Queda por determinar qué parte de este exceso de mortalidad se explica por la mayor incidencia de complicaciones hemorrágicas sufridas por los pacientes con IRC.
Impacto del uso de dispositivos de cierre vascular en el grupo de pacientes con insuficiencia renal crónica tratados mediante angioplastia primariaEl uso de DCV para la prevención de complicaciones hemorrágicas tras el ICP continúa siendo controvertido15. Hasta el momento, varios estudios han mostrado una reducción de las complicaciones vasculares con el uso de DCV16; por contra, otros trabajos han señalado un exceso de complicaciones locales con el uso de DCV en comparación con la compresión manual17 y, por último, la mayoría de los estudios aleatorizados realizados han mostrado un efecto neutro6. Un reciente metaanálisis5, que evaluó 31 ensayos clínicos en los que se incluyó a 7.528 pacientes sometidos a intervencionismo coronario diagnóstico y terapéutico, mostró que, a pesar de que el uso de DCV se asocia con menor tiempo de hemostasia, esto no conlleva una reducción significativa de las complicaciones hemorrágicas locales en comparación con la compresión manual.
Sin embargo, a la hora de interpretar estos resultados, debemos tener en cuenta algunos aspectos. En primer lugar, la información disponible con respecto al uso de DCV entre los pacientes de mayor riesgo hemorrágico, como son los sometidos a un procedimiento urgente o aquellos con deterioro severo de la función renal, es muy escasa, puesto que habitualmente se ha excluido a estos pacientes de los estudios que han evaluado el uso de DCV. En este sentido, el estudio ACUITY18 mostró que, en pacientes con síndrome coronario agudo sin elevación del ST sometidos a ICP precoz, el uso de DCV se asoció a una disminución significativa de las complicaciones hemorrágicas mayores. En el contexto del SCACEST tratado con AP por vía femoral, los resultados en el total de nuestra población mostraron que el uso de DCV se asoció de forma independiente con menor incidencia de CVM en comparación con la compresión manual19.
En cuanto a la seguridad y la eficacia del uso de DCV en pacientes con IRC, hay incluso menos información. Aziz et al7, en un reciente estudio, señalan un elevado riesgo de complicaciones vasculares con el uso de DCV en pacientes con IRC sometidos a ICP. Sin embargo, las conclusiones que se puede extraer de este estudio están limitadas por carecer de grupo control de compresión manual. El presente estudio evalúa por primera vez específicamente el uso de DCV entre los pacientes con IRC y lo hace en un contexto de especial riesgo hemorrágico como es el de la AP. Nuestros resultados muestran que el uso de DCV en esta población es seguro y se asocia a una baja incidencia de complicaciones vasculares, menor que en el grupo de compresión manual y muy similar a la de los pacientes sin IRC. Estos resultados están en línea con lo ya publicado para el total de nuestra población19.
El segundo aspecto que tener en cuenta es que los resultados de los ensayos clínicos no parecen reflejar la realidad de la práctica clínica habitual, donde no siempre pueden establecerse protocolos de hemostasia tan estrictos. Así, en línea con nuestros resultados, varios registros publicados en los últimos años en los que se ha evaluado el uso de DCV en la práctica clínica han mostrado resultados favorables en cuanto a la prevención de complicaciones hemorrágicas3, 16, 20, 21. Marso et al3, en un registro de más de 1,5 millones de pacientes sometidos a ICP, encontraron que el uso de DCV se asoció con menor incidencia de complicaciones hemorrágicas mayores, especialmente entre los pacientes de mayor riesgo hemorrágico, entre los que se incluía, además de otros, a los pacientes sometidos a procedimientos urgentes o aquellos con IRC. Paradójicamente, en ese registro los pacientes de mayor riesgo hemorrágico eran los menos propicios para recibir un DCV. De igual forma, en nuestra población, el uso de DCV fue menor entre los pacientes con IRC en comparación con los pacientes sin deterioro de la función renal.
Para finalizar, Dauerman et al22, en una reciente revisión sobre estrategias para la prevención de complicaciones hemorrágicas tras el ICP, concluyen que actualmente hay evidencia suficiente para considerar apropiado el uso de DCV con este propósito. Esta afirmación parece especialmente acertada, sobre todo para los pacientes de mayor riesgo hemorrágico. En esta línea, los resultados de nuestro estudio tienen el valor de ser directamente aplicables a la práctica clínica habitual en un contexto en que la realización de ensayos aleatorizados resulta complicado, por lo que parece razonable considerar el uso de DCV en los pacientes con IRC tratados con AP por vía femoral.
LimitacionesEste estudio presenta varias limitaciones que se deben tener en cuenta al interpretar los resultados. En primer lugar, el diseño observacional y no aleatorizado del estudio hace posible la existencia de sesgos de selección no controlables durante la fase de análisis. En relación con este punto, en el grupo de pacientes con IRC hay una desproporción importante entre los que recibieron un DCV y aquellos a quienes se aplicó compresión manual, debido a que el método de cierre de la arteria femoral quedó a criterio del hemodinamista. Es posible, por lo tanto, que los pacientes seleccionados para compresión manual fuesen un grupo de mayor riesgo hemorrágico, con peores condiciones anatómicas o con punciones femorales más desfavorables. En segundo lugar, en nuestro laboratorio no se mide sistemáticamente el tiempo activado de coagulación, por lo que no se ha podido evaluar una posible relación entre el grado de anticoagulación y la aparición de complicaciones hemorrágicas.
CONCLUSIONESLos pacientes con IRC tratados con AP por vía femoral en el contexto de un SCACEST presentan mayor riesgo de sufrir CVM que los pacientes sin deterioro de la función renal. El uso de DCV en los pacientes con IRC sometidos a AP es seguro y se asocia a reducción de las CVM en comparación con la compresión manual.
AGRADECIMIENTOSEl Dr. Rodrigo Estévez-Loureiro ha recibido la beca de investigación «Río Hortega», Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III.
FINANCIACIÓNEste trabajo ha sido financiado en parte por la Red Cardiovascular RECAVA, Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III.
CONFLICTO DE INTERESESNinguno.
Recibido 16 Septiembre 2011
Aceptado 28 Octubre 2011
Autor para correspondencia: Servicio de Cardiología, Complejo Hospitalario Universitario de A Coruña, As Xubias 84, 15006 A Coruña, España. Oscar.Prada.Delgado@sergas.es