La insuficiencia del ventrículo derecho tras la cirugía cardiaca sigue siendo un problema clínico significativo, especialmente en determinados contextos quirúrgicos: cardiopatías congénitas, enfermedad valvular mitral con hipertensión pulmonar, enfermedad coronaria de alto riesgo, trasplante cardiaco, tromboendarterectomía pulmonar e inserción de un dispositivo de asistencia ventricular izquierda. Durante los últimos años, varios estudios han demostrado el valor pronóstico de la función del ventrículo derecho en cirugía cardiaca y, por lo tanto, la utilidad de una adecuada estratificación del riesgo. La tasa de supervivencia a la insuficiencia del ventrículo derecho aguda y refractaria tras la cirugía cardiaca puede situarse en cifras tan bajas como un 20-25%. Grados menos graves se asocian también a un aumento de la morbimortalidad postoperatoria y tienen un notable impacto en la estancia hospitalaria. Esto destaca la relevancia de conocer su particular fisiopatología, espectro clínico, diagnóstico precoz y estrategias de prevención, aspectos todos ellos tratados en este artículo de revisión.
Palabras clave
Tanto en el ámbito de la cardiología clínica como en el contexto de la cirugía cardiaca, el reconocimiento de la importancia del ventrículo derecho (VD) es un hecho reciente. Durante los últimos años, la investigación de su particular fisiología y la determinación de su influencia en la evolución de diferentes enfermedades han despertado un creciente interés. Por ello, la importancia del VD en cirugía cardiaca se sustenta en una evidencia todavía escasa, basada en estudios retrospectivos o breves estudios prospectivos, en contraste con la sólida evidencia sobre la función del ventrículo izquierdo (VI).
La importancia de la hipertensión pulmonar (HP) prequirúrgica es un hecho más consolidado. En las escalas de riesgo ampliamente utilizadas en cirugía cardiaca, como los EuroSCORE I1 y II2 y el Parsonnet Score3, la HP es un factor de riesgo independiente de incremento de la mortalidad posquirúrgica4.
Sin embargo, hay cada vez más evidencia de que la morbimortalidad asociada a la HP depende más de la adaptación del VD a la enfermedad vascular pulmonar que de una cifra absoluta de presión arterial pulmonar5. Ello contrasta con la ausencia de parámetros de función ventricular derecha en los actuales modelos de estratificación del riesgo a gran escala. Por lo tanto, su valor incremental todavía no se ha establecido adecuadamente, lo que puede explicarse en parte por las tradicionales dificultades para la evaluación del VD, debido a la complejidad de su morfología y su disposición espacial. Probablemente esto se pueda subsanar en un futuro mediante la inclusión de alguno de los índices ecocardiográficos de función ventricular derecha, ampliamente utilizados en la práctica cardiológica actual y con demostrado valor pronóstico para pacientes con HP y afección del VD.
Datos recientes indican que la valoración prequirúrgica del VD puede mejorar la estratificación del riesgo, especialmente en los contextos clínicos más vulnerables a la aparición de insuficiencia ventricular derecha (IVD) tras la cirugía cardiaca: cirugía de las cardiopatías congénitas, cirugía valvular y coronaria de alto riesgo, trasplante cardiaco, tromboendarterectomía pulmonar y después del implante de un dispositivo de asistencia ventricular izquierda (DAVI) (tabla)6.
Valor pronóstico de la función del ventrículo derecho en cirugía cardiaca.
| Estudio | Población | Diseño del estudio | Disfunción del VD | Resultados |
| Maslow et al7 | EAC con FEVI < 25% sometidos a bypass quirúrgico | Retrospectivo, n=41 | FACVD < 35%, n=50 | Disfunción del VD se asoció con descenso de la supervivencia tardía |
| Pinzani et al8 | Cirugía mitral y combinada mitroaórtica | Retrospectivo, n=382 | Definición clínica | La IVD postoperatoria fue el predictor más fuerte de mortalidad hospitalaria |
| Haddad et al9 | Cirugía valvular de alto riesgo | Prospectivo, n=50 | FACVD < 32% o ICMVD | Disfunción del VD preoperatoria se asoció con una alta incidencia de insuficiencia circulatoria postoperatoria |
| Denault et al48 | Pacientes sometidos a cirugía cardiaca con BCP | Retrospectivo y prospectivo, n=800 | Obstrucción dinámica del TSVD (gradiente > 25mmHg) | Incidencia, 4%; se asoció con mayor dificultad para desconexión del BCP |
| Reichert et al43 | Pacientes inestables en el postoperatorio | Prospectivo, n=60 | FACVD < 35% | Disfunción del VD se asoció con aumento de la mortalidad |
| Therrien et al13 | Tetralogía de Fallot | Prospectivo, n=41 | Remodelado del VD | Gran dilatación del VD (VDFVD > 170ml/m2 o FSFVD > 85ml/m2) se asoció con remodelado incompleto del VD |
| Cullen et al14 | Tetralogía de Fallot | Prospectivo, n=35 | Fisiología del VD restrictiva | Estancia prolongada en cuidados intensivos y bajo gasto postoperatorio |
| Webb et al12 | Comunicación interauricular | Series retrospectivas | Remodelado del VD | Mayor edad y relajación anormal del VD se asociaron con incompleto remodelado del VD |
| Ochiai et al15 | DAVI | Retrospectivo, n=245 | IVD que requiere DAVD | 23 pacientes (9%) precisaron DAVD. La necesidad de soporte inotrópico, el sexo femenino y la etiología no isquémica fueron predictores de necesidad de DAVD |
| Kormos et al16 | DAVI e IVD | Retrospectivo, n=31 | FEVD media, 11,8% | Factores clínicos como fiebre, edema pulmonar, transfusiones intraoperatorias y etiología no isquémica, predictores de necesidad de DAVD |
| Hosenpud et al17 | Trasplante cardiaco | Retrospectivo; base de datos de la ISHLT | IVD asociada a insuficiencia circulatoria | La IVD causó el 20% de las muertes tempranas |
BCP: bypass cardiopulmonar; DAVD: dispositivo de asistencia ventricular derecha; DAVI: dispositivo de asistencia ventricular izquierda; EAC: enfermedad arterial coronaria; FACVD: fracción de acortamiento del ventrículo derecho; FEVD: fracción de eyección del ventrículo derecho; ICMVD: índice de comportamiento miocárdico del ventrículo derecho; ISHLT: Internacional Society of Heart and Lung Transplantation; IVD: insuficiencia ventricular derecha; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho; VDFVD: volumen diastólico final del ventrículo derecho; VSFVD: volumen sistólico final del ventrículo derecho.
Basado en Haddad et al6.
En pacientes con miocardiopatía isquémica y disfunción grave del VI sometidos a cirugía de revascularización coronaria no urgente, Maslow et al7 demostraron en un estudio retrospectivo que la presencia de disfunción significativa del VD estaba asociada a un incremento de la morbimortalidad perioperatoria y tardía.
En pacientes sometidos a cirugía cardiaca valvular, varios estudios retrospectivos y pequeñas series prospectivas pusieron también de manifiesto el valor pronóstico de la función del VD. Así, Pinzani et al8, en un estudio retrospectivo, demostraron que la IVD preoperatoria es un fuerte predictor de mortalidad perioperatoria. En ese mismo estudio, la IVD postoperatoria es el más importante predictor independiente de supervivencia a largo plazo.
En pacientes sometidos a cirugía valvular mitral con HP, Haddad et al9 observaron, en una serie prospectiva de 50 pacientes, que la disfunción del VD es mejor predictor de insuficiencia circulatoria postoperatoria que la presión arterial pulmonar.
Cardiopatías congénitasEstudios recientes han demostrado que la función del VD es uno de los más importantes predictores de resultados y supervivencia después de la cirugía de las cardiopatías congénitas10,11. Webb et al12, en una serie retrospectiva de pacientes operados de comunicación interauricular aislada y presiones pulmonares normales o HP ligera, hallaron que los enfermos de edad más avanzada y con alteración de la relajación del VD presentaban durante el seguimiento un remodelado incompleto.
En pacientes con tetralogía de Fallot corregida, la causa más frecuente de dilatación progresiva e IVD es la insuficiencia pulmonar, que aparece asociada a intolerancia al ejercicio, arritmias auriculares y ventriculares, y muerte súbita10. En estos casos se debe considerar el reemplazo valvular pulmonar, lo que generalmente resulta en una disminución del volumen del VD. En un ensayo prospectivo de 17 pacientes, Therrien et al13 observaron que el remodelado incompleto del VD con persistencia de la dilatación es más frecuente en pacientes con dilatación preoperatoria grave.
Algunos pacientes con tetralogía de Fallot presentan en la valoración ecocardiográfica una «fisiología restrictiva del VD». En ellos, Cullen et al14 vieron que, después de la cirugía de reparación, presentaban mayor frecuencia de bajo gasto cardiaco postoperatorio y estancia en la unidad de cuidados intensivos más prolongada.
Inserción de dispositivo de asistencia ventricular izquierdaLa IVD aguda después de la inserción de un DAVI ocurre en aproximadamente un 10-30% de los pacientes y tiene alta mortalidad. Reconocer los factores predictores de IVD sigue siendo un desafío en este contexto, aunque algunos estudios recientes han aportado mayor información. Ochiai et al15 revisaron los datos preoperatorios de 245 pacientes y hallaron que los predictores más significativos para considerar la implantación de un dispositivo de asistencia ventricular derecha (DAVD) después del implante de un DAVI son: requerimiento de soporte inotrópico antes de la inserción del DAVI, sexo femenino y etiología no isquémica. En un breve y muy ilustrativo estudio, Kormos et al16 demostraron que los factores clínicos preoperatorios, como fiebre, edema pulmonar y transfusiones intraoperatorias, son mejores predictores de requerimiento de DAVD que la función del VD o las variables hemodinámicas.
Trasplante cardiacoLa importancia de la HP y la función del VD previas al trasplante está ampliamente descrita y justificada en la literatura. Sin embargo, según varios informes17,18, a pesar de los avances en el manejo perioperatorio, la IVD todavía es causa del 50% de las complicaciones y hasta el 20% de la mortalidad en este periodo. No hay consenso generalizado en la literatura, pero habitualmente se acepta que unas resistencias vasculares pulmonares (RVP) previas al trasplante ≥ 6 UW y un gradiente transpulmonar medio (GTPm) > 15mmHg se asocian a mayor incidencia de IVD y mortalidad perioperatoria6. Otros factores implicados son: tiempo de isquemia prolongado, discordancia significativa entre donante y receptor con un corazón donante de tamaño mucho menor (mismatch > 20%), obstrucción mecánica de la anastomosis de la arteria pulmonar y rechazo agudo.
Un estudio más reciente ha demostrado que la HP reversible previa al trasplante confirmada mediante test con vasodilatadores no influyó en la supervivencia precoz ni tardía, a diferencia de la HP fija previa al trasplante20.
Fisiopatología de la insuficiencia del ventrículo derecho tras cirugía cardiacaEn la IVD tras cirugía cardiaca subyace una fisiopatología compleja, en la que isquemia y depresión miocárdica suelen ser los factores precipitantes y, según los contextos clínicos, predominan uno o más de los siguientes mecanismos:
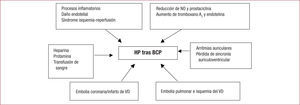
Hipertensión pulmonar aguda tras bypass cardiopulmonarLa vasoconstricción pulmonar y el incremento de las resistencias vasculares pulmonares que ocurren al final de la cirugía cardiaca son resultado tanto de procesos inflamatorios y de daño endotelial como del síndrome de isquemia/reperfusión debido al inadecuado flujo a través de las arterias bronquiales durante el bypass cardiopulmonar (BCP).
Fisiopatológicamente, estos procesos están mediados por una reducción del óxido nítrico y prostaciclina y un aumento en la producción de radicales libres, tromboxano A2 y endotelina, lo que acaba produciendo un desequilibrio entre vasodilatadores y vasoconstrictores pulmonares21.
Se ha señalado que los principales desencadenantes, dentro de la respuesta inflamatoria sistémica, son la liberación de citocinas a través de la producción de endotoxinas, la activación del complemento y la lesión añadida por el mecanismo de isquemia/reperfusión22.
Otros factores que se asocian a la HP durante o inmediatamente después del BCP son: administración de heparina, o de protamina, fenómenos microembólicos pulmonares, isquemia del VD, hipoxia, hipercapnia, acidosis e hipotermia, así como transfusión excesiva de sangre.
Un escenario menos frecuente es la crisis hipertensiva pulmonar inmediatamente después de la desconexión del BCP, caracterizada por vasoconstricción pulmonar masiva, dilatación del VD, descenso de la presión en aurícula izquierda e hipotensión arterial23.
La administración de protamina puede inducir vasoconstricción pulmonar catastrófica hasta en el 1,8% de los pacientes24 y merece especial atención por su utilización sistemática al finalizar el BCP. Se han descrito tres tipos de respuestas: hipotensión sistémica transitoria, reacción anafilactoide (mecanismo inmunitario a través de la activación del complemento) e HP grave seguida de colapso circulatorio. Habitualmente se ha afirmado que la gravedad del cuadro clínico es independiente de dosis y vía de administración, aunque recientemente algunos autores25 han apuntado que la administración lenta y por una vía periférica puede disminuir la gravedad y la intensidad de los efectos adversos (fig. 1).
Hipertensión pulmonar preexistenteLa HP aguda y la disfunción ventricular derecha precipitadas por la isquemia y la depresión miocárdica tras BCP son habitualmente leves y transitorias y no ocasionan insuficiencia circulatoria, excepto en pacientes con HP preexistente.
La disfunción sistólica o diastólica del VI y la enfermedad valvular mitral o multivalvular son las causas más frecuentes de HP en cirugía cardiaca26.
La discordancia (mismatch) entre prótesis y paciente es otro factor descrito recientemente como causa de HP persistente después de la cirugía cardiaca. Magne et al27 vieron que una discordancia importante se asocia a HP residual y una mortalidad postoperatoria 3 veces mayor, tras ajustar por otros factores de riesgo.
Asimismo, tanto en el trasplante cardiaco como en la tromboendarterectomía pulmonar, el mecanismo fisiopatológico que predomina es la HP prequirúrgica.
En pacientes sometidos a tromboendarterectomía pulmonar por HP troboembólica crónica, la IVD preoperatoria manifestada por aumento de la presión de la aurícula derecha (PAD) es un reconocido factor de riesgo de muerte perioperatoria28. Sin embargo, estudios recientes han enfatizado que la causa más común de IVD grave postoperatoria es la persistencia de la HP. Esto ocurre en aproximadamente el 10% de los pacientes y se asocia a un incremento sustancial del riesgo de muerte perioperatoria29. Esto se debe a que la enfermedad tromboembólica es más distal y, por lo tanto, quirúrgicamente inaccesible o, incluso más frecuentemente, a arteriopatía de pequeño vaso30.
La insuficiencia tricuspídea, que con frecuencia se halla presente en las enfermedades que cursan con HP, puede exacerbarse como consecuencia de la dilatación posquirúrgica del VD y agravar la situación hemodinámica. Asimismo, la IVD grave puede conducir a hipoxemia grave debido a la presencia de shunt derecha-izquierda a través del foramen oval permeable por aumento de la presión en la AD. Otras causas de hipoxia son el desajuste en la relación ventilación/perfusión asociado a bajo gasto cardiaco y, en algunos casos, a la hipoxia relacionada con la enfermedad de base6.
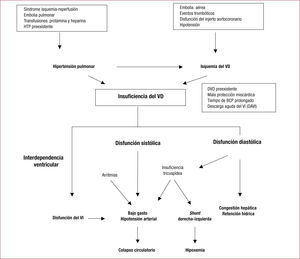
Interdependencia ventricularLa contribución del septo interventricular a la función ventricular derecha está ampliamente demostrada tanto en modelos animales como humanos; la literatura quirúrgica apunta a que una parte importante de la función global del VD deriva del septo intraventricular31.
Cuando se analiza el rendimiento del VD en condiciones de aumento de la poscarga, se demuestra que al menos la mitad de la función global del VD depende del septo interventricular y que la fuerza de contracción del VI es el principal determinante de la máxima contribución septal a la función global del VD, incluso más que la presión de perfusión en la coronaria derecha32.
Por lo tanto, cuando se produce la IVD, la estabilidad hemodinámica depende de la contracción del VI, especialmente del septo, además de la contracción auricular, de la sincronía auriculoventricular y de la perfusión del VD33. Estos principios fisiopatológicos tienen implicaciones importantes en el manejo clínico de la IVD tras cirugía cardiaca.
La interdependencia ventricular tiene un papel especialmente importante en la IVD que ocurre después de la inserción de un DAVI, ya que se produce un desplazamiento del septo debido a la descarga aguda del VI. Esto altera la contractilidad y la geometría del VD, y además puede empeorar la regurgitación tricuspídea. En este contexto, el desplazamiento septal determina una menor contribución a la contracción del VD y puede ocasionar disfunción aguda, circunstancia especialmente importante en presencia de disfunción basal del VD. Tales pacientes pueden incluso requerir un DAVD para solventar la insuficiencia circulatoria34,35.
Por otro lado, la interdependencia ventricular afecta también a la función del VI, puesto que la dilatación del VD produce un desplazamiento septal hacia la izquierda, lo que disminuye tanto la distensibilidad como la contractilidad del VI y contribuye a reducir el gasto cardiaco.
Otros factores que pueden contribuir o agravar la IVD postoperatoria mediante alguno de los mecanismos citados son: protección miocárdica subóptima durante la cirugía, tiempo de BCP prolongado, infarto del VD por obstrucción del injerto aortocoronario, presencia de arritmias auriculares y pérdida de la sincronía auriculoventricular6 (fig. 2).
Insuficiencia ventricular derecha tras cirugía cardiaca: espectro clínico y diagnósticoLa IVD tras cirugía cardiaca puede definirse como un síndrome clínico caracterizado por la incapacidad del corazón derecho para aportar un flujo de sangre adecuado a la circulación pulmonar, que se produce inmediatamente después del BCP o durante el postoperatorio36.
Presenta un espectro clínico amplio, con diferencias importantes en cuanto a incidencia y mortalidad. Si bien algunas de las manifestaciones de la IVD tras cirugía cardiaca permanecen poco claras en la literatura, se puede distinguir al menos tres escenarios clínicos.
Insuficiencia ventricular derecha aguda y refractaria tras cardiotomíaEs el cuadro mejor definido, muy infrecuente pero asociado a una elevada mortalidad. Se estima que ocurre solo entre el 0,04 y el 0,1% de los postoperados, pero esta incidencia aumenta a un 2-3% de los pacientes sometidos a trasplante cardiaco y hasta un 20-30% de aquellos a los que se implanta un DAVI. La mortalidad hospitalaria puede alcanzar hasta un 70-75%27.
Se manifiesta por una situación de inestabilidad hemodinámica grave que dificulta o impide la desconexión del BCP y requiere soporte farmacológico prolongado o soporte mecánico. Debido a los particulares mecanismos fisiopatológicos implicados, la IVD aguda y refractaria tras cirugía cardiaca puede presentarse en ausencia de disfunción del VD prequirúrgica.
Síndrome de bajo gasto cardiaco postoperatorio con insuficiencia biventricular de predominio derechoEl síndrome de bajo gasto cardiaco (SBGC) es un escenario de presentación más frecuente. Es un cuadro heterogéneo en cuanto a definición y etiología, y en general comprende: hipotensión arterial persistente, presiones de llenado ventricular elevadas, bajo gasto y necesidad de intervención farmacológica y eventualmente mecánica38.
El SBGC postoperatorio tiene una incidencia que, según diferentes estudios, varía del 3 al 45% y se asocia a incremento de la morbimortalidad, prolongación de la estancia hospitalaria y aumento en el consumo de recursos39–41. La causa más frecuente del SBGC postoperatorio es la insuficiencia del VI. La contribución del VD todavía es poco conocida. En un trabajo prospectivo, Dávila-Román et al42 evaluaron mediante ecocardiografía transesofágica (ETE) la contribución de ambos ventrículos y confirmaron que tenían IVD sistólica el 48% de los pacientes, bien aislada o asociada a disfunción del VI. La mortalidad hospitalaria de los pacientes con IVD era del 44%.
Asimismo, Reichert et al43 (tabla) mostraron que, en pacientes hipotensos durante el postoperatorio que requirieron soporte inotrópico, la IVD se asoció a una elevada mortalidad. En este estudio, los pacientes con fracaso biventricular sufrieron una mortalidad de hasta el 86%, que contrasta con la mortalidad de un 30-40% entre los pacientes con insuficiencia del VI predominante y de solo el 15% de aquellos con función normal de ambos ventrículos.
Disfunción ventricular derecha «de grado menor»Situada en el otro extremo del espectro clínico, puede definirse como una alteración de la contracción o del llenado del VD que no conduce invariablemente a IVD36 y carece de repercusión clínica significativa.
Es la manifestación clínica más frecuente; probablemente está presente en mayor o menor grado en la práctica totalidad de los pacientes sometidos a cirugía cardiaca con circulación extracorpórea. No incrementa la mortalidad, pero puede tener un impacto relevante en la morbilidad y la estancia hospitalaria.
La etiología de la IVD tras cirugía cardiaca puede determinar estos escenarios clínicos. Por ejemplo, en el trasplante cardiaco, la disfunción ventricular derecha leve postoperatoria es muy frecuente, hasta en el 70% en algunas series, dependiendo de los criterios diagnósticos19. En las formas graves, se asocia a una mortalidad temprana que alcanza el 20%, como se apuntó anteriormente. Cualquiera de las causas implicadas se expresa como IVD aislada, sin disfunción del VI asociada, al menos inicialmente.
Asimismo, la IVD después de la tromboendarterectomía pulmonar suele presentarse de forma aislada o como predominante44. Por otra parte, en la cirugía valvular de alto riesgo (principalmente mitral con HP o multivalvular), la IVD suele acompañarse de insuficiencia del VI y, en ocasiones, conduce a SBGC.
En cuanto al diagnóstico, la ecocardiografía y el cateterismo cardiaco derecho son los pilares de la valoración intraoperatoria y postoperatoria. Ambas técnicas proporcionan una información útil y complementaria para la toma de decisiones y evaluación del manejo terapéutico. La ecocardiografía es actualmente la técnica de imagen más empleada para evaluar la estructura y la función del VD, por su disponibilidad, su carácter poco invasivo y su reproducibilidad.
Debido a las dificultades para obtener una medida precisa de la fracción de eyección del VD, durante los últimos años se han desarrollado índices de contractilidad que han demostrado buena correlación con la fracción de eyección. Los más utilizados para el diagnóstico de IVD son45: TAPSE (Tricuspid Annulus Plane Systolic Excursion), que refleja el acortamiento longitudinal del VD (desplazamiento del anillo tricuspídeo hacia el ápex); índice de Tei o índice de comportamiento miocárdico global, que representa el cociente entre la suma de los tiempos de contracción y relajación isovolumétrica y el tiempo de eyección; determinación mediante Doppler tisular de la velocidad máxima del anillo tricuspídeo durante la sístole; valoración subjetiva de la presencia de dilatación del VD, y fracción de acortamiento, a pesar de sus limitaciones como parámetro equivalente a la fracción de eyección.
El cateterismo cardiaco derecho es esencial para el manejo intraoperatorio y postoperatorio de estos pacientes. Se debe insertar siempre un catéter de arteria pulmonar, lo que permite realizar tanto el diagnóstico como la valoración continua de la situación hemodinámica, para el adecuado ajuste del tratamiento. Hay acuerdo en que, particularmente en este complejo contexto hemodinámico, el riesgo potencial de la inserción de un catéter de Swan-Ganz es claramente inferior a sus notables ventajas46.
Hemodinámicamente, la IVD se reconoce por la presencia de una PAD elevada, una presión capilar pulmonar Wedge normal o baja, que indica mal llenado de la aurícula izquierda, y un índice cardiaco bajo. La obstrucción significativa del tracto de salida del VD (TSVD), fija o dinámica, debe sospecharse cuando haya un gradiente > 25mmHg entre la presión del VD y la arteria pulmonar. La obstrucción dinámica del TSVD se ha descrito recientemente como una posible causa de inestabilidad hemodinámica en el perioperatorio de cirugía cardiaca (tabla).
El diagnóstico de la IVD aguda y refractaria se basa en una suma de criterios clínicos, hemodinámicos y ecocardiográficos, idealmente asumidos por consenso entre cirujanos, anestesistas y cardiólogos. Con frecuencia, la sospecha diagnóstica se realiza en el propio quirófano por visualización directa del corazón derecho y debe ser confirmada con ecocardiografía y monitorización hemodinámica invasiva47.
Criterios clínicos. Dificultad para la desconexión del BCP o SBGC grave postoperatorio, no relacionado con la función del VI ni con presencia de hipovolemia.
Criterios hemodinámicos. PAD ≥ 18mmHg o relación PAD/presión capilar pulmonar Wedge ≥ 1. Índice cardiaco ≤ 2l/m/m2. Presión arterial media < 60mmHg37.
Criterios ecocardiográficos. Los más utilizados, aunque todavía no bien evaluados en este contexto, son: dilatación del VD mediante valoración cualitativa subjetiva (> 2/3 del VI en su diámetro transversal); fracción de acortamiento < 25% o una reducción del 20% respecto a la valoración pre-BCP; TAPSE ≤ 16mm y velocidad sistólica del Doppler tisular del anillo tricuspídeo < 10cm/s49.
Prevención de la insuficiencia del ventrículo derecho tras cirugía cardiacaEl conocimiento de los mecanismos fisiopatológicos de la IVD postoperatoria y los avances terapéuticos, especialmente en el campo de los vasodilatadores pulmonares, han mejorado notablemente en los últimos años, lo que posibilita el desarrollo de estrategias para la prevención y el manejo precoz de estos enfermos.
La prevención debe empezar con la identificación de los pacientes de alto riesgo y una adecuada valoración prequirúrgica, intraoperatoria y postoperatoria del VD.
Algunas de las estrategias que pueden minimizar el riesgo de IVD grave postoperatoria son: a) seleccionar el momento adecuado para la cirugía; en las valvulopatías y en las cardiopatías congénitas, por ejemplo, antes de que se produzca HP; b) optimizar la protección miocárdica; c) utilizar vasodilatadores selectivos en el periodo perioperatorio; d) limitar las transfusiones de hemoderivados50; e) evitar hipotensiones graves; f) optimizar la precarga del VD, y g) realizar un ajuste cuidadoso de la ventilación mecánica, evitando hipoxemias e hipercapnias31.
ConclusionesEn una era en la que el conocimiento y el desarrollo tecnológico permiten el acceso a la cirugía cardiaca de pacientes cada vez más complejos, la IVD puede seguir siendo una causa de importante morbimortalidad.
La adecuada estratificación del riesgo antes de la cirugía, con el fin de que un equipo experimentado pueda adoptar estrategias de prevención y planificar la actuación tanto quirúrgica como perioperatoria, puede contribuir a la disminución de la incidencia de IVD refractaria.
Conflicto de interesesNinguno.