La ivabradina es un inhibidor de la corriente If, principal determinante de la función marcapasos del nódulo sinusal, aprobado como antianginoso y para tratar la insuficiencia cardiaca. Existen indicios sobre su capacidad para inhibir la conducción a través del nódulo auriculoventricular (NAV). Sobre esta base, el proyecto BRAKE-AF plantea el uso de ivabradina como agente cronotrópico negativo en fibrilación auricular (FA).
MétodosSe realizará un ensayo clínico multicéntrico de fase III, aleatorizado, abierto, en paralelo, con diseño de no inferioridad, para comparar la ivabradina frente a la digoxina en 232 pacientes con FA permanente no controlada con bloqueadores beta o antagonistas del calcio; el objetivo primario es la reducción de la frecuencia cardiaca media diurna en un Holter de 24 h a los 3 meses. El ensayo se apoyará en un estudio electrofisiológico que analizará el efecto de la ivabradina en el potencial de acción del NAV humano, utilizando un modelo experimental en células de ovario de hámster chino transfectadas con el ADN que codifica la expresión de los distintos canales que componen dicho potencial de acción, registrando las corrientes iónicas mediante la técnica del parche de membrana.
ResultadosSe obtendrá información tanto del efecto de la ivabradina en las corrientes iónicas y el potencial de acción del NAV como de su eficacia y su seguridad en pacientes con FA permanente.
ConclusionesLos resultados del proyecto BRAKE-AF podrían permitir que la ivabradina se incluyera en el limitado arsenal de fármacos disponibles actualmente para el control de frecuencia en la FA.
Ensayo registrado en ClinicalTrials.gov (Identificador: NCT03718273).
Palabras clave
La fibrilación auricular (FA) es la arritmia sostenida más frecuente, con una prevalencia en aumento debido al envejecimiento de la población1. Entre las estrategias disponibles para tratar los síntomas, el control de la frecuencia cardiaca (FC) es esencial, y es la única posible para los pacientes con FA permanente. Para ello se emplean fármacos que modulan las distintas corrientes que generan el potencial de acción del nódulo auriculoventricular (NAV)2.
Actualmente son 3 los grupos de fármacos disponibles para el control de la FC: bloqueadores beta, antagonistas del calcio no dihidropiridínicos y digoxina; todos ellos actualmente tienen el mismo grado de recomendación (I) y nivel de evidencia (B) en la última guía europea de FA3. En la misma guía se puntualiza que es necesario profundizar en la investigación en fármacos y estrategias centradas en el control de la FC en la FA. Habitualmente los bloqueadores beta o antagonistas del calcio no dihidropiridínicos (diltiazem, verapamilo) constituyen el primer escalón terapéutico debido a un perfil de eficacia y seguridad más favorable que el de la digoxina. Entre los diversos problemas asociados con el uso de digoxina, destacan un mal control de la FC durante el esfuerzo4-6, su estrecho rango terapéutico, múltiples interacciones farmacológicas y un posible incremento de la mortalidad a largo plazo7,8. Actualmente no existen alternativas farmacológicas a la digoxina para el control de la FC en FA que los bloqueadores beta o los antagonistas del calcio, lo que conlleva la necesidad de implantar un marcapasos y realizar una ablación del NAV para poder controlar los síntomas en ciertos casos y, en consecuencia, dejar al paciente dependiente de la estimulación.
La ivabradina es un antiarrítmico inhibidor de la corriente despolarizante If, una corriente mixta de entrada de sodio-potasio que fue descrita inicialmente en las células marcapasos del nódulo sinusal9, donde es el principal determinante de su automatismo. Este fármaco ha tenido un importante desarrollo y uso clínico por su efecto bradicardizante en el nódulo sinusal debido a que, a diferencia de lo que sucede con los bloqueadores beta y los antagonistas del calcio no dihidropiridínicos, no modifica la presión arterial, la contractilidad cardiaca, los periodos refractarios o la velocidad de conducción intracardiaca. La seguridad del fármaco y su beneficio clínico han podido constatarse en 3 grandes ensayos clínicos: los estudios BEAUTIFUL y SIGNIFY en pacientes con enfermedad coronaria, donde se demostró que reducía las hospitalizaciones por infarto de miocardio10 y mejoraba de los síntomas de angina respectivamente11, y el estudio SHIFT en pacientes con fracción de eyección reducida, donde la ivabradina redujo el objetivo primario de mortalidad y hospitalización por insuficiencia cardiaca12.
La utilidad de la ivabradina como fármaco cronotrópico negativo en pacientes en FA permanente no se ha establecido en la práctica clínica. El proyecto BRAKE-AF investigará el posible papel de la ivabradina dentro de la estrategia farmacológica para el control de FC en FA.
MÉTODOSEl proyecto traslacional BRAKE-AF incluye 2 estudios de investigación paralelos: a) un estudio de investigación básica sobre el efecto de la ivabradina en las distintas corrientes que participan en la génesis del potencial de acción del NAV en un modelo celular, y b) un ensayo clínico de fase III, aleatorizado, controlado, abierto, en 2 grupos paralelos y con un diseño de no inferioridad utilizando ivabradina frente a digoxina en pacientes con FA permanente con respuesta ventricular rápida.
El proyecto BRAKE-AF se lleva a cabo en 10 centros españoles (9 hospitales y la Facultad de Medicina de la Universidad Complutense de Madrid) y está financiado por el Instituto de Investigación Carlos III a través de una ayuda AES (PI17/01272). El ensayo clínico ha sido aprobado por el Comité de Ética de Investigación con medicamentos y por la Agencia Española de Medicamentos y Productos Sanitarios. Está registrado en clinicaltrials.gov con el identificador NCT03718273 y en EUDRACT con el n.° 2018-001936-23.
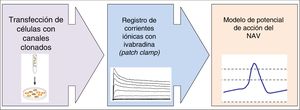
Estudio de investigación básicaEl diseño del estudio de investigación básica se representa de forma esquemática en la figura 1.
- •
Determinar los efectos de la ivabradina en la amplitud de las corrientes generadas por los canales humanos en el NAV: las corrientes de entrada de Ca2+ a través de los canales tipo L (ICaL) y T (ICaT) y diversas corrientes de salida de K+: la transitoria (Ito), los componentes ultrarrápido (IKur), rápido (IKr) y lento (IKs) de la corriente rectificadora tardía y la corriente IK1 que presenta rectificación interna.
- •
Determinar los efectos de la ivabradina dependientes de tiempo y voltaje de los procesos de activación, inactivación y reactivación de dichas corrientes.
- •
Integrar estos datos en un modelo de potencial de acción generado en el NAV para conocer cómo la ivabradina podría modificarlos.
Se utilizarán células de ovario de hámster chino que serán transfectadas con el ADN que codifica para la expresión de las subunidades alfa y beta de los canales iónicos clonados de tejido miocárdico humano implicados en el potencial de acción del NAV, y cotransfectadas con el vector EBO-pcD leu 2 (0,5 ug), que codifica para la expresión del antígeno de superficie CD8, lo que permitirá identificarlas para su posterior recolección y utilización en registros electrofisiológicos. Se realizarán los experimentos en soluciones externas de control y en soluciones con ivabradina a diferentes concentraciones.
Recogida y análisis de datosLas corrientes iónicas se registrarán utilizando la configuración de célula entera de la técnica del parche de membrana según el protocolo previamente descrito13,14. Las soluciones externas y de las micropipetas serán específicas para cada una de las corrientes iónicas que se van a registrar. Los artefactos de corriente capacitiva generados tras la aplicación de pulsos desde –80 a –70mV se registraran a 50kHz (filtrados a 10kHz) para calcular la capacitancia de la célula, la resistencia de acceso y la impedancia de entrada. La capacitancia y las resistencias en serie se compensarán en todos los experimentos hasta en un 80%. La adquisición de los datos, su análisis y los protocolos de pulsos serán controlados mediante el programa PCLAMP (Molecular Devices). Durante los experimentos, el potencial de membrana y las corrientes iónicas serán monitorizadas continuamente en un osciloscopio digital (mod. 5020 A, Kikusui Electronics Co).
Las curvas de activación e inactivación de las distintas corrientes se ajustarán mediante una ecuación de Boltzmann, lo que permitirá determinar los posibles efectos de las mutaciones en la dependencia de voltaje de la activación o de la inactivación. La cinética de activación, inactivación y reactivación se estudiarán mediante un análisis exponencial de los trazos de corriente.
Se analizará cómo las alteraciones electrofisiológicas observadas modifican las características de los potenciales de acción nodales. El modelo será implementado con MATLAB6.5 (MAThematical LABoratory, Mathworks Inc.; Natick, Massachusetts, Estados Unidos) utilizando un algoritmo de integración ode15s en condiciones basales (control) y a distintas frecuencias de estimulación (0,5-3,0 Hz) durante al menos 200 ciclos para asegurar que todos los parámetros alcanzan un estado estable. De los potenciales de acción simulados se medirán los siguientes parámetros: potencial de reposo (mV), amplitud (mV) y duración (ms), medida al 20% (DPA20), al 50% (DPA50) y al 90% (DPA90) de la repolarización, lo que permitirá predecir los efectos de la ivabradina en el potencial de acción nodular.
Análisis estadísticoLos resultados se expresarán como media±desviación estándar. Los datos obtenidos de cada grupo se compararán con los de sus respectivos controles utilizando la prueba de la t de Student. Para realizar comparaciones entre distintos grupos, se utilizará un ANOVA (análisis de la varianza), seguido de un test de Newman-Keuls.
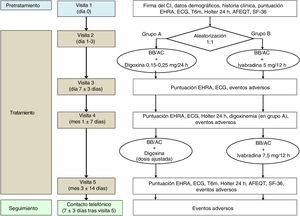
Ensayo clínicoSe trata de un ensayo clínico multicéntrico en fase III, aleatorizado, controlado, abierto, en 2 grupos paralelos y con un diseño de no inferioridad. Se representa de forma esquemática en la figura 2.
Esquema resumen de las visitas y procedimientos del ensayo clínico BRAKE-AF. AC: antagonistas del calcio (no dihidropiridínicos); AFEQT: cuestionario de calidad de vida Atrial Fibrillation Effect On Quality-Of-Life; BB: bloqueadores beta; CI: consentimiento informado; ECG: electrocardiograma; EHRA: European Heart Rhythm Association; SF-36: cuestionario de calidad de vida The Medical Outcomes Study 36-item Short-Form Health Survey; T6m: test de 6min de marcha.
El ensayo evaluará si la administración de ivabradina como tratamiento añadido a bloqueadores beta o antagonistas del calcio no dihidropiridínicos es una alternativa no inferior a digoxina para la reducción de la FC en pacientes con FA permanente. Para ello se definen los siguientes objetivos:
- •
Objetivo primario de eficacia: reducción de la FC media diurna en Holter-electrocardiograma (ECG) a 3 meses.
- •
Objetivo primario de seguridad: Compuesto de:
- -
Síncope.
- -
Bradicardia grave: FC mantenida <40 lpm (durante al menos 10 s) o de asistolia> 4 s que condicione síncope o síntomas requieran medidas farmacológicas (agentes cronotrópicos intravenosos) o estimulación (transcutánea o mediante un marcapasos transitorio).
- -
Reacción adversa grave que condicione hospitalización o visita a urgencias o produzca la muerte del paciente.
- -
- •
Objetivos secundarios de eficacia
- -
Síntomas acordes con la puntuación EHRA evaluados a 1 y 3 meses.
- -
Distancia recorrida en el test de 6 minutos a los 3 meses del tratamiento.
- -
Parámetros de calidad de vida analizados en los cuestionarios SF-3615 y AFEQT16 a 1 y 3 meses.
- -
FC media diurna medida con un Holter-ECG a 1 y 3 meses.
- -
FC en reposo medida con un ECG a 1 y 3 meses.
- -
FC máxima medida con un Holter-ECG a 1 y 3 meses.
- -
FC media en 24 h medida con un Holter-ECG a 1 y 3 meses.
- -
Delta de FC (diferencia entre FC máxima y FC media) medida con un Holter-ECG a 1 y 3 meses.
- -
FC en ejercicio moderado medida con un Holter-ECG durante la realización del test de 6 minutos a los 3 meses de tratamiento.
- -
- •
Objetivos secundarios de seguridad. Compuestos de:
- -
Bradicardia no grave: FC mantenida <40 lpm (durante al menos 10 s) o de asistolia> 4 s sin repercusión clínica o que condicione síntomas leves (no sincopales) que no requieran medidas farmacológicas o estimulación.
- -
Cualquier reacción adversa grave a los fármacos del estudio.
- -
Abandono voluntario del fármaco por parte del paciente.
- -
Hospitalizaciones, visitas a urgencias y mortalidad por un evento cardiovascular durante el tratamiento con los fármacos del estudio.
- -
Se seleccionará a los pacientes con FA permanente que presenten mal control de FC en ausencia de factores secundarios que la motiven, a pesar de tratamiento con bloqueadores beta o con antagonistas del calcio no dihidropiridínicos. Los criterios de selección se resumen en la tabla 1.
Población del ensayo clínico BRAKE-AF. Criterios de selección
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| Edad ≥ 18 años | Tratamiento previoa o pacientes con contraindicación conocida a la ivabradina o digoxina o a cualquier excipiente de ambos fármacos |
| FA permanente en el momento de la aleatorización, sin perspectiva de cardioversión, tratamiento antiarrítmico con fármacos del grupo I o III o ablación de venas pulmonares | Bloqueo AV completo paroxístico o intermitente en pacientes no portadores de marcapasos |
| Síntomas atribuibles a FA asociados con la presencia de al menos uno de los siguientes criterios de control inadecuado de la FC: FC en reposo> 110 lpm o FC en reposo entre 80 y 110 lpm y al menos uno de los siguientes criterios:• FC en ejercicio de intensidad moderadab> 130 lpm (ergometría o Holter-ECG)• FC media diurnac ≥ 80 lpm (Holter-ECG) | Insuficiencia cardiaca descompensada, que requiera inotrópicos o diuréticos intravenosos en la semana previa a la aleatorización o en clase funcional IV de la NYHA o en lista de espera de trasplante cardiaco |
| Tratamiento con bloqueadores beta o antagonistas del calcio no dihidropiridínicos a la dosis máxima recomendada o tolerada por el paciente | Pericarditis aguda, miocarditis aguda, pericarditis constrictiva, miocardiopatía hipertrófica obstructiva |
| Analítica de sangre realizada en los 6 meses previos a la inclusión que incluya hemograma, hormonas tiroideas y creatinina, para descartar causas secundarias de un mal control de la FC | Hipotensión grave (< 90/50 mmHg) |
| Ecocardiograma transtorácico para descartar valvulopatías graves, miocardiopatía hipertrófica, etc. Se considerará aceptable el realizado en el año previo a la inclusión en el estudio siempre que la situación clínica del paciente haya sido estable en ese intervalo de tiempo | Insuficiencia renal (ClCr <30 ml/kg/min) o paciente en programa de hemodiálisis |
| Insuficiencia hepática grave | |
| Cirugía mayor (incluida la cardiaca) en el mes previo a la aleatorización | |
| Enfermedad valvular que requiera corrección quirúrgica o percutánea | |
| Tratamiento concomitante con inhibidores potentes del citocromo P450 3A4d | |
| Enfermedad concomitante grave que suponga una expectativa de vida <1 año | |
| Infarto agudo de miocardio, angina inestable (durante su fase aguda) o ictus reciente (últimas 4 semanas) | |
| Síndrome de QT largo congénito o pacientes tratados con medicamentos que prolonguen dicho intervalo | |
| Mujer en edad fértil (< 50 años, salvo que presenten un informe ginecológico que acredite menopausia) y mujeres en periodo de lactancia | |
| Imposibilidad de realizar las visitas programadas en el protocolo | |
| Participación en un ensayo clínico en los 6 meses previos | |
| Ser capaz de otorgar voluntariamente su consentimiento informado | Causas médicas que justifiquen un mal control de la FC: fiebre, anemia, hipertiroidismo, feocromocitoma, etc. |
AV: auriculoventricular; ClCr: aclaramiento de creatinina; ECG: electrocardiograma; FA: fibrilación auricular; FC: frecuencia cardiaca; NYHA: New York Heart Association.
Se entiende como tratamiento previo con digoxina al tratamiento con dicho fármaco a través de la misma vía de administración que el fármaco experimental comparador (digoxina oral) de manera continua, de modo que permita adquirir una concentración del fármaco capaz de proporcionar el efecto terapéutico deseado (control de la FC).
Corresponde a una carga de trabajo aproximada entre 3 y 6 METS (equivalentes metabólicos) equivalente a la realizada durante las primeras 2 etapas del protocolo de Bruce de una ergometría. Algunos ejemplos de este tipo de ejercicio son: caminar a paso ligero, realizar tareas del hogar, bailar, llevar a cabo actividades de jardinería, desplazar cargas de menos de 20kg, actividad sexual, lavar un coche, etc.
Se aleatorizará a los pacientes del ensayo en 2 grupos en una proporción 1:1. En el grupo de digoxina, la dosis inicial se pautará en función de la presencia de 3 factores: edad ≥ 80 años, peso ≤ 60kg y aclaramiento de creatinina <60 ml/min como se detalla a continuación: 0,25 mg/24 h (ningún factor), 0,15mg/24 h (un factor), 0,10mg/24 h (2 o 3 factores). Se utilizará la formulación en comprimidos de 0,25mg para la dosis de 0,25 mg/24 h y la solución pediátrica (0,05mg/ml) para el resto de dosis. Se realizarán los ajustes de dosis necesarios en el seguimiento para mantener las concentraciones de digoxina dentro del rango terapéutico (0,5-2 ng/ml). En el grupo de ivabradina se administrará una dosis de 5 mg/12 h durante 1 mes y después, si la dosis se tolera bien y en ausencia de bradicardias significativas en el Holter (FC <40 lpm mantenida durante> 10 s o asistolia> 4 s), se aumentará a una dosis de mantenimiento de 7,5 mg/12 h. A los pacientes de 75 o más años aleatorizados a ivabradina, se les administrará una dosis inicial de 2,5 mg/12 h con la posibilidad de subir la dosis a 5 mg/12 h en la siguiente semana) en función de la tolerancia y en ausencia de bradicardia (FC <60 lpm) en el ECG realizado en reposo.
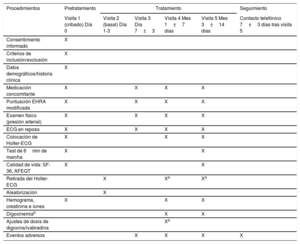
VisitasEl ensayo clínico se realiza a lo largo de 5 visitas presenciales: una de cribado (en la que se comprueba que el paciente cumple todos los criterios de selección) y firma del consentimiento informado y 4 de tratamiento (aleatorización y controles en 1 semana, 1 mes y 3 meses). Se realizará asimismo una visita telefónica de seguimiento 1 semana después de interrumpir la medicación del estudio. Los procedimientos de las distintas visitas del ensayo clínico se recogen en la tabla 2.
Calendario de visitas y procedimientos del ensayo BRAKE-AF
| Procedimientos | Pretratamiento | Tratamiento | Seguimiento | |||
|---|---|---|---|---|---|---|
| Visita 1 (cribado) Día 0 | Visita 2 (basal) Día 1-3 | Visita 3 Día 7±3 | Visita 4 Mes 1±7 días | Visita 5 Mes 3±14 días | Contacto telefónico 7±3 días tras visita 5 | |
| Consentimiento informado | X | |||||
| Criterios de inclusión/exclusión | X | |||||
| Datos demográficos/historia clínica | X | |||||
| Medicación concomitante | X | X | X | X | ||
| Puntuación EHRA modificada | X | X | X | X | ||
| Examen físico (presión arterial) | X | X | X | X | ||
| ECG en reposo | X | X | X | X | ||
| Colocación de Holter-ECG | X | X | X | |||
| Test de 6min de marcha | X | X | ||||
| Calidad de vida: SF-36, AFEQT | X | X | ||||
| Retirada del Holter-ECG | X | Xa | Xa | |||
| Aleatorización | X | |||||
| Hemograma, creatinina e iones | X | X | X | |||
| Digoxinemiab | X | X | ||||
| Ajustes de dosis de digoxina/ivabradina | Xa | |||||
| Eventos adversos | X | X | X | X | ||
AFEQT: cuestionario de calidad de vida Atrial Fibrillation Effect On Quality-Of-Life; ECG: electrocardiograma; EHRA: European Heart Rhythm Association; SF-36: cuestionario de calidad de vida The Medical Outcomes Study 36-item Short-Form Health Survey.
Se utilizó como referencia el estudio de Farshi et al.6 en el cual se estudiaron las frecuencias cardiacas medias con diversos regímenes terapéuticos. Se observó una reducción de la FC media diurna de 12 lpm al añadir digoxina en los pacientes en tratamiento de base con diltiazem y la misma reducción en los pacientes con atenolol como tratamiento de base (con desviaciones estándar de 17,4 y 10,3 lpm respectivamente).
El total de pacientes requeridos para el estudio bajo diseño de no inferioridad será de 232 sujetos (116 pacientes en cada brazo de tratamiento). La estimación se basó en las siguientes asunciones: hipótesis unilateral con nivel α del 5%, potencia del 80% y un límite de no inferioridad especificado de diferencia en la reducción de la FC entre los tratamientos de ivabradina frente a digoxina de –6 lpm (el 50% de la reducción de la FC media diurna previamente observada), desviación estándar de las FC diurnas de 17,4 lpm (mayor desviación estándar encontrada)5 y pérdidas de seguimiento esperadas del 10% de los pacientes.
Pérdidas de seguimientoPara evitar pérdidas en el seguimiento se realizará un contacto telefónico previo a cada visita. Se estudiará el origen de los datos perdidos en relación con el seguimiento de los pacientes y su evolución. Las variables perdidas durante el seguimiento se reemplazarán por la medición en tiempo más cercana si el número de pérdidas no representa más del 40% de valores ausentes.
AleatorizaciónLa aleatorización se estratificará por centro y por tratamiento de base (bloqueador beta o antagonista del calcio) y se llevará a cabo de manera centralizada mediante una página web que mantendrá oculta la secuencia.
Criterios de retirada de pacientesSolicitud del propio paciente, incumplimiento significativo del régimen de tratamiento o de las visitas, necesidad de recibir un tratamiento concomitante prohibido (p. ej., antiarrítmicos del grupo Ic o del grupo III), ablación del NAV, reacción adversa grave o clínicamente relevante que a juicio del investigador obligue a retirar al paciente del estudio o fallecimiento.
Criterios de finalización del estudioRiesgos imprevistos considerados como inaceptables para los pacientes, imposibilidad de poder incluir un número aceptable de pacientes, insuficiente cumplimiento de los requisitos del protocolo o suspensión o discontinuidad en el suministro de los fármacos del estudio por parte de las compañías farmacéuticas que los comercializan.
Análisis estadísticoLos objetivos de eficacia serán evaluados, en caso de cumplir la normalidad (test de Kolmogorov-Smirnov), a través del test estadístico de la t de Student para diferencias de medias: distancia caminada, parámetros de calidad de vida y FC en las distintas evaluaciones y, en caso de rechazarse la normalidad, se utilizará la prueba de la U de Mann-Whitney. Los síntomas de acuerdo con la puntuación EHRA modificado se evaluarán utilizando el test de Cochran-Mantel-Haenszel. Las medidas que expresen cambio entre 2 mediciones en el tiempo podrán evaluarse utilizando un análisis de cambio de puntuación o, de manera complementaria, un análisis de la covarianza de la puntuación posterior. Los objetivos de seguridad entre los tratamientos se compararán utilizando el test estadístico de la χ2 o el test exacto de Fisher. El nivel de significación empleado será igual a 0,05 (error α bilateral del 5%) para todos los contrastes, a excepción de la hipótesis principal de eficacia del estudio, donde se empleará un nivel de significación bilateral de 0,10. El análisis de eficacia se realizará en la población por intención de tratar. Todos los pacientes que recibieron al menos una dosis del tratamiento asignado serán incluidos en el análisis de seguridad. Se valorará evaluar la relación entre tratamiento y variable de eficacia ajustada en un modelo multivariante por edad, sexo y tratamiento basal concomitante (bloqueadores beta o antagonistas del calcio).
DISCUSIÓNBRAKE-AF es un proyecto de investigación traslacional que evalúa el posible papel de la ivabradina en el control de FC durante FA a través de un estudio a nivel celular que analiza la modificación de ivabradina en el potencial de acción del NAV humano y, en paralelo, a través de un ensayo clínico en pacientes con FA permanente para estudiar su efecto bradicardizante. La validez interna del ensayo clínico está determinada por su diseño aleatorizado, el seguimiento exhaustivo que se realizará de la FC en todos los pacientes y el análisis por intención de tratar. La validez externa se basa en el diseño multicéntrico y en el hecho de que la población de estudio representa en gran medida a los pacientes con FA permanente mal controlada que se presentan en la práctica clínica.
Si bien es cierto que la corriente If es el principal determinante del automatismo sinusal, dicha corriente no se encuentra exclusivamente en el nódulo sinusal. La primera evidencia de ello se dio por la observación de que, en perros anestesiados, la inhibición de If con zatebradina reducía la frecuencia intrínseca de disparo del NAV, así como el aumento de la frecuencia de este en respuesta a la estimulación simpática17. Posteriormente se puso de manifiesto que existe una corriente de entrada If durante la fase de hiperpolarización (entre –60 y –90 mV) en las células con actividad de marcapasos subsidiario del NAV18. Más recientemente, se ha descrito mediante inmunohistoquímica que los canales HCN, encargados de la corriente If, están presentes tanto en el NAV compacto como en sus extensiones posteronodulares19. Por otra parte, se ha observado que, en pacientes sin cardiopatía estructural, la administración intravenosa de zatebradina, un inhibidor de la corriente If, producía un alargamiento significativo del intervalo aurícula-His (A-H) y una prolongación del periodo refractario efectivo del NAV, pero no modificaba la conducción intraauricular o intraventricular20. En otro estudio experimental realizado en un modelo de FA en cobayas, la administración de ivabradina prolongaba de manera dependiente de la frecuencia los intervalos A-H y reducía la frecuencia ventricular durante la FA21. Sin embargo, no se observaban cambios en los intervalos QT y H-V, la frecuencia dominante de la FA, la presión arterial ni la contractilidad cardiaca.
La evidencia sobre del uso clínico de ivabradina en pacientes con FA es escasa, aunque arroja datos prometedores. En una serie de 6 pacientes con FA rápida tratada con bloqueadores beta, la ivabradina mejoró el control de la respuesta ventricular y la capacidad funcional en 4 de ellos22. Por último, un ensayo clínico aleatorizado en 32 pacientes con FA no paroxística ha mostrado que la ivabradina produce una reducción de la FC media y máxima sin producir efectos adversos23. En la misma línea, se ha publicado que la ivabradina empleada en esta indicación como uso compasivo puede ser una alternativa eficaz y segura a la ablación del NAV cuando fracasa el tratamiento con fármacos que deprimen la conducción a través del NAV24,25. Más recientemente, se ha comunicado la eficacia de la ivabradina para el tratamiento de la taquicardia ectópica de la unión congénita en 3 pacientes en edad pediátrica26.
La posibilidad de demostrar la utilidad para el control de la FC en pacientes con FA de un fármaco ampliamente utilizado en la clínica abre una opción novedosa y relevante, ya que se trata de un compuesto con un perfil de seguridad favorable demostrado en pacientes con cardiopatía estructural. Por otra parte, la ausencia de efectos en la contractilidad cardiaca y el sistema vascular lo hacen especialmente atractivo como antiarrítmico.
LimitacionesEl diseño de los experimentos en células transfectadas hace necesario utilizar modelos matemáticos para estimar el efecto de la ivabradina en el potencial de acción del NAV sin poder validar este efecto en un tejido nodular real.
El ensayo clínico es abierto tanto para el paciente como para el investigador, debido fundamentalmente a que el comparador activo (digoxina) causa en el ECG evidentes alteraciones de la repolarización y tiene un estrecho rango terapéutico, por lo que precisa ocasionalmente ajuste de dosis y monitorización de la concentración del fármaco. Aunque puede producirse un sesgo en la medida de parámetros subjetivos (como síntomas o calidad de vida), es poco esperable que afecte significativamente a la medida de la variable objetivo principal del estudio (FC media diurna en Holter). Esta limitación se compensará con una evaluación en ciego de los objetivos del estudio, mediante la desagregación de la información del tratamiento recibido en el análisis centralizado de los registros Holter y en la comparación entre grupos.
CONCLUSIONESBRAKE-AF es un proyecto de investigación multicéntrico que evalúa la eficacia y la seguridad de la ivabradina en el control de la FC en FA frente a la digoxina en pacientes en los que los fármacos de primera línea han fracasado. Se apoya en una investigación sobre el mecanismo de acción de la ivabradina a nivel celular que analiza el efecto del fármaco en el potencial de acción del NAV.
Este proyecto tiene el potencial de incluir a la ivabradina dentro del limitado número de fármacos disponibles actualmente para el control de la FC en FA.
FINANCIACIÓNFinanciado con la ayuda obtenida en la convocatoria del Ministerio de Economía y Competitividad de España a través del ISCIII (Instituto de Salud Carlos III). N° de expediente PI17/01272. Cuenta con el apoyo de la Plataforma Española de Investigación Clínica y Ensayos Clínicos, SCReN (Spanish Clinical Research Network), financiada por el ISCIII-Subdirección General de Evaluación y Fomento de la Investigación mediante el proyecto PT13/0002/0012, PT17/0017/0011, integrado en el Plan Estatal de I+D+I 2013-2016 y cofinanciado por el Fondo Europeo de Desarrollo Regional.
CONFLICTO DE INTERESESM.A. Arias es Editor Asociado de Revista Española de Cardiología.
- –
El control de la FC es esencial para el tratamiento de la FA, si bien el arsenal farmacológico disponible es escaso y presenta limitaciones.
- –
Se han dedicado pocos esfuerzos a mejorar el conocimiento sobre nuevos fármacos que puedan utilizarse como cronotrópicos negativos en FA.
- –
La ivabradina es un fármaco bradicardizante que ha mostrado un buen perfil de seguridad en pacientes coronarios y con disfunción ventricular.
- –
Se estudiará por primera vez el efecto de la ivabradina en el potencial de acción del NAV humano para deprimir la conducción a través de este.
- –
A través de un ensayo clínico, se explorará el uso de la ivabradina en la práctica clínica como agente cronotrópico negativo en pacientes con FA permanente.
- –
La demostración de que la ivabradina no es inferior a la digoxina en el control de la FC en FA, tanto en seguridad como en eficacia, puede abrir la posibilidad de ampliar el abanico de fármacos disponibles en este contexto clínico.
Los autores agradecen al Dr. Héctor Bueno Zamora (jefe del Grupo de Investigación Multidisciplinar Traslacional del Centro Nacional de Investigaciones Cardiovasculares) su constante entusiasmo y apoyo desde los primeros pasos de este proyecto. De manera especial, agradecen a Rosa Vega Viaña, gestora de proyecto de la Unidad de Investigación Clínica y Soporte Científico de SCReN en el Hospital 12 de Octubre de Madrid, su brillante labor y su incansable dedicación al estudio.