La ivabradina reduce el ritmo cardiaco bloqueando la corriente I(f) y conserva la presión sanguínea y el volumen sistólico por mecanismos aún desconocidos. La caveolina-3 induce cardioprotección formando complejos con varias proteínas, como el inductor de metaloproteinasas EMMPRIN y HCN4, la diana de la ivabradina. Consideramos que la cardioprotección de la ivabradina se basa en la inhibición la degradación de la matriz extracelular.
MétodosEn un modelo porcino de shock cardiogénico, se estudió la integridad del corazón, las concentraciones de MMP-9 y EMMPRIN y la estabilidad de los complejos proteicos caveolina-3/HCN4 con EMMPRIN en respuesta a la ivabradina.
ResultadosLa administración de ivabradina 0,3mg/kg redujo significativamente la necrosis y la expresión de MMP-9 tras el shock cardiogénico, mientras que el ARNm de EMMPRIN, su proteína y la glucosilación (requerida para la activación de las MMP) no se vieron afectados. Sin embargo, los complejos caveolina-3/LG-EMMPRIN (EMMPRIN poco glucosilado) y caveolina-3/HCN4 aumentaron, mientras que la ivabradina inhibió también el nuevo complejo encontrado entre HCN4 y el EMMPRIN muy glucosilado. Para comprobar si la caveolina-3 puede ser puente entre HCN4 y EMMPRIN, el complejo HCN4/EMMPRIN se mantuvo incluso tras el silenciamiento génico de la caveolina-3, lo que indica una interacción directa de ambas proteínas. De manera similar, el silenciamiento de EMMPRIN redujo significativamente el complejo caveolina-3/HCN4, que regula la I(f).
ConclusionesAdemás de la inhibición de la I(f), la ivabradina puede inducir cardioprotección al inhibir la degradación de la matriz extracelular por conservar el complejo caveolina-3/LG-EMMPRIN y controlar el ritmo cardiaco estabilizando el complejo caveolina-3/HCN4.
Palabras clave
En los últimos 20 años se han prescrito bloqueadores beta e inhibidores de los canales del calcio para reducir la frecuencia cardiaca de pacientes con insuficiencia cardiaca crónica1. Sin embargo, ha sido necesario desarrollar nuevos fármacos por varios motivos, entre los cuales pueden citarse la intolerancia del paciente a los bloqueadores beta y los efectos inotrópicos negativos de los fármacos.
La ivabradina es un inhibidor selectivo de la corriente I(f) del marcapasos en las células sinoauriculares. Al inhibir los canales 1 y 4 regulados por nucleótidos cíclicos activados por hiperpolarización (HCN1 y HCN4), la ivabradina reduce la frecuencia cardiaca al tiempo que mantiene la presión arterial y la fracción de eyección del ventrículo izquierdo (FEVI)2, sin efectos adversos. El estado abierto de los canales de HCN, controlado por la concentración intracelular de monofosfato de adenosina cíclico (AMPc), regula la despolarización diastólica. Si bien la administración de bloqueadores beta reduce considerablemente la frecuencia cardiaca dependiente de la AMPc, la ivabradina mantiene la contractilidad cardiaca independientemente de la frecuencia cardiaca3, lo que hace de este fármaco uno de los más recomendados en el tratamiento de la insuficiencia cardiaca crónica con FEVI <35%. No obstante, su eficacia en la insuficiencia cardiaca aguda aún está por explorar.
El shock cardiogénico (SC) es la principal causa recurrente de muerte después de un infarto agudo de miocardio. La administración de fármacos vasoactivos en este contexto es necesaria para conseguir la adecuada perfusión de órganos, pero puede contribuir a la lesión miocárdica mediante taquicardia extensa, disminución de la eficiencia ventricular, aumento del estrés oxidativo y demanda miocárdica de oxígeno escesiva. Varios grupos de investigación4 han encontrado que la ivabradina mejora la taquicardia sinusal inducida por catecolaminas en el SC y corrige los parámetros hemodinámicos mediante mecanismos aún desconocidos.
Recientemente se ha propuesto que la ivabradina participa en la conservación de la matriz extracelular (MEC) en el contexto de la osteoartritis, la diabetes5 y la ateroesclerosis6. Además, la ivabradina puede reducir la apoptosis de los cardiomiocitos en la miocarditis viral crónica7, en un modelo murino de hipertrofia cardiaca por constricción aórtica8, en la insuficiencia cardiaca aguda y crónica9,10 y en la miocardiopatía diabética11. Sin embargo, aún se desconoce cómo la ivabradina ayuda a inhibir la degradación de la MEC y reducir la muerte celular.
Aunque HCN4 es la diana principal de la ivabradina, no está claro a través de qué mecanismo HCN4 podría alterar la degradación de la MEC. HCN4 forma complejos macromoleculares con caveolina-3, una proteína que se expresa principalmente en las caveolas de los cardiomiocitos, con lo que se regula la actividad de marcapasos cardiaca. Asimismo, la caveolina-3 puede interactuar con otras proteínas para modular su función, como ya se ha descrito en el contexto de la isquemia/reperfusión cardiaca, en la que la caveolina-3 tiene función de cardioprotector al combinarse el inductor de metaloproteasas de la matriz extracelular (EMMPRIN), con lo que inhibe no solo la degradación de la MEC, sino también la apoptosis cardiaca8.
Para evaluar si la ivabradina puede mantener la contractilidad del miocardio más allá de la corriente I(f), se estudió la integridad del corazón en un modelo porcino con SC y se analizó la contribución de la ivabradina a la conservación de la MEC examinando las enzimas involucradas en la degradación de la MEC y los mecanismos moleculares subyacentes.
MÉTODOSTodas las intervenciones quirúrgicas se realizaron en los centros de cirugía experimental de nuestro instituto. La investigación se ajustó a la Guide for Care and Use of Laboratory Animals publicada por los US National Institutes of Health (publicación de los NIH n.o 85-23, revisada en 1985) y el Animal Welfare Ethics Committee cumplió con la Directiva de la UE sobre animales de laboratorio (63/2010 UE) y la legislación española relacionada (RD 53/2013), y recibió la correspondiente aprobación local (PROEX 365-15). Los procedimientos detallados se presentan en la .
ReactivosEn el se presenta una lista detallada de reactivos.
Animales e intervención por shock cardiogénicoSe indujo SC a 20 cerdas Yorkshire (37,8±5,2kg); la tasa de supervivencia fue del 90%. Al final de la intervención experimental, 10 animales recibieron ivabradina 0,3mg/kg y 10 recibieron placebo (solución salina); 2 animales (1 de cada grupo) no sobrevivieron más de 24 h después del SC.
Se anestesió a los cerdos, previamente tratados con ketamina intramuscular (10mg/kg) y midazolam (0,5mg/kg), mediante inhalación de isoflurano con perfusión continua de propofol (2ml/kg/h), fentanilo (50mg/kg/h) y diazepam (10mg/kg/h). Los animales fueron intubados y ventilados con una saturación de oxígeno del 100%. Además, los animales recibieron 5.000 UI de heparina y amiodarona (2mg/kg/h) para evitar la coagulación sanguínea en los catéteres y arritmias cardiacas malignas respectivamente.
Se indujo isquemia/reperfusión mediante la oclusión de la arteria descendente anterior izquierda durante 45min con un catéter JL 3 de 6 Fr e inflado de balón a 5 atm; se indujo sobrecarga de volumen administrando 500ml de hidroxietil-almidón y 1.500ml de suero salino al 0,9%. En los casos en que se produjo fibrilación ventricular/taquicardia ventricular, se administró una descarga de CC bifásica (10-20J) combinada con compresiones torácicas manuales directas. Las mediciones hemodinámicas se registraron a los 15, 30 y 45min de isquemia. Posteriormente, se administraron noradrenalina (20-80μg/kg/h), dobutamina (240-660μg/kg/h) y solución salina fisiológica (1.000-2.000ml) hasta que la frecuencia cardiaca superó los 90 lpm. A los 45min de oclusión de la arteria descendente anterior izquierda, se aleatorizó a los animales a un grupo de control o a otro con administración de ivabradina.
La ivabradina en polvo se pesó en una balanza de laboratorio de alta precisión y se diluyeron en agua destilada a un mínimo de 12mg/ml. A continuación, la solución se traspasó a una jeringuilla de 10ml para la administración intravenosa al animal de un bolo lento de 0,3ml/kg. El grupo de control recibió un volumen equivalente de solución salina fisiológica.
Tinción con azul de Evans/trifenil tetrazolioLa extensión del infarto de miocardio se evaluó mediante perfusión con el reactivo azul de Evans al 5% (en suero) y tinción de trifenil tetrazolio (TTC) como se ha descrito con anterioridad12 (para obtener más detalles, consulte el ).
Determinación de las concentraciones plasmáticas de troponina ILa troponina I plasmática se midió con el kit comercial Human Cardiac Troponin 1 SimpleStep ELISA (Abcam, España) siguiendo las instrucciones del fabricante.
EcocardiografíaLos corazones de cerdo se visualizaron mediante el ecocardiógrafo Vivid Q de GE Healthcare (Estados Unidos) equipado con un cabezal de exploración de 1,9 a 4,0 MHz, como se ha descrito con anterioridad13. Se ofrece más información en el .
CélulasLas células H9c2 y HL1B se cultivaron como se ha descrito con anterioridad14 y en el . Las células se cultivaron en condiciones de hipoxia en cámaras de cultivo de hipoxia en atmósfera humidificada con un 1% de oxígeno, un 5% de dióxido de carbono y un 94% de nitrógeno. La reoxigenación se realizó en medio fresco.
Histología e inmunohistoquímicaLas técnicas de histológica, inmunohistoquímica e inmunohistofluorescencia se realizaron como se ha descrito con anterioridad13,14.
Análisis de inmunoprecipitación e inmunotransferenciaEl aislamiento de los lisados de proteínas, las inmunoprecipitaciones y las inmunotransferencias se realizaron como se ha descrito con anterioridad13.
Aislamiento de ARN y reacción en cadena de la polimerasa cuantitativa en tiempo realLa reacción en cadena de la polimerasa en tiempo real (RT-PCR) se realizó como se ha descrito con anterioridad8. En el se ofrece más información. Se utilizaron los siguientes cebadores: EMMPRIN directo: 5’-GGC ACC ATC GTA ACC TCT GT-3’; EMMPRIN inverso: 5’-CAC TGG CGT GTT CCG ATT TC-3’; β-actina directa: 5’-CTT AGT TGC GTT ACA CCC TTT CT-3’, y β-actina inversa: 5’-CTG TCA CCT TCA CCG TTC CAG TT-3’.
Análisis estadísticosTodos los datos se analizaron con el paquete estadístico SPSS 22.0 (SPSS Inc., Estados Unidos). Todos los valores se presentan como media±desviación estándar. La significación se informa al nivel del 5%. Siempre que se establecieron comparaciones con un control común, la significación de las diferencias se probó mediante análisis de varianza seguido de la modificación de Dunnett de la prueba de la t de Student.
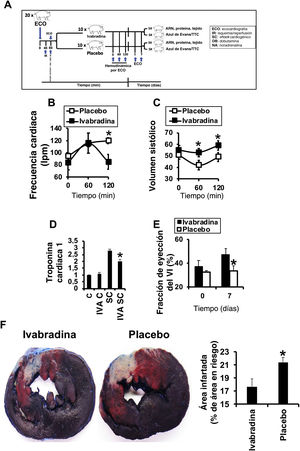
RESULTADOSLa ivabradina reduce la necrosis del ventrículo izquierdo después del shock cardiogénicoEn cerdos sometidos a SC (figura 1A), la administración intravenosa de ivabradina 0,3mg/kg o solución salina se asoció con una reducción considerable de la frecuencia cardiaca (figura 1B), conservación del volumen sistólico (figura 1C) y reducción de las concentraciones de troponina cardiaca, indicativas de lesión isquémica, 24 h después del SC (figura 1D). Los efectos de la ivabradina en la función cardiaca se determinaron mediante ecocardiografía, que reveló una mejora importante de la FEVI el séptimo día después del SC en animales tratados con ivabradina (figura 1E). Esta mejora se correlacionó estrechamente con una disminución del área necrótica del ventrículo izquierdo, detectado mediante la doble tinción con azul de Evans/TTC (figura 1F).
La ivabradina mejora la función cardiaca en un modelo porcino de SC. A: representación esquemática del ensayo. B y C: efectos de ivabradina 0,3mg/kg o placebo en la frecuencia cardiaca y el volumen sistólico después del SC. D: concentraciones de troponina cardiaca antes y a las 24 h del SC (n=9 por grupo; media±desviación estándar; *ivabradina frente a placebo, p < 0,05). E: fracción de eyección del ventrículo izquierdo (N=9/grupo) a los 7 días del SC. F: área necrótica (n=5 por grupo) como porcentaje de tejido necrótico (pálido) frente al área en riesgo (rojo) a los 7 días del SC (media±desviación estándar; *ivabradina frente a placebo, p <0,05). SC: shock cardiogénico. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
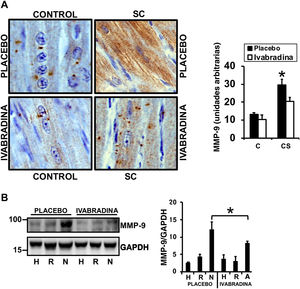
La isquemia/reperfusión coronaria induce la expresión de enzimas de degradación de la MEC cardiaca, incluidas las metaloproteinasas de la matriz (MMP). La administración de ivabradina 0,3mg/kg redujo las concentraciones de MMP-9 en el área necrótica del ventrículo izquierdo el séptimo día después del SC, según lo detectado por inmunohistoquímica e inmunotransferencia con anticuerpos anti-MMP-9 (figura 2A,B respectivamente).
La ivabradina reduce la concentración de enzimas que degradan la matriz extracelular en el corazón. A: detección de MMP-9 en las áreas necróticas de corazones sometidos a SC en respuesta a placebo o ivabradina (n=5 por grupo; media±desviación estándar; *necrosis e ivabradina frente a necrosis y placebo, p < 0,05). B: inmunoblot de pro-MMP-9 de 92 kDa de secciones sanas (S), en riesgo (R) y necróticas (N) de corazones sometidos a SC (n=5 por grupo; media±desviación estándar; *necrosis e ivabradina frente a necrosis y placebo, p < 0,05). MMP-9: metaloproteinasa 9 de matriz; SC: shock cardiogénico. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
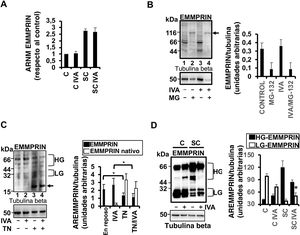
El papel de EMMPRIN como inductor de la expresión y actividad de MMP-9 se ha descrito con anterioridad3, aunque en nuestro modelo porcino la expresión inducida por SC del ARNm de EMMPRIN no se inhibió con la administración de ivabradina 0,3mg/kg (figura 3A). Sin embargo, en respuesta al SC, la ivabradina fue capaz de reducir tanto la concentración de EMMPRIN como su glucosilación, sin afectar a su degradación proteolítica, como se observa tras la incubación de lisados celulares de miocitos H9c2 con el inhibidor del proteosoma MG-132 (figura 3B). Además, la incubación de células H9c2 en reposo con ivabradina no inhibió la glucosilación de EMMPRIN (un paso clave en la expresión y la actividad de las MMP mediada por EMMPRIN), como se observó con el tratamiento de células durante 24 h con tunicamicina 5 μg/ml, un inhibidor farmacológico de la N-glucosilación (figura 3C), y se obtuvieron resultados semejantes en cultivos celulares de miocitos HL1B (). En cambio, in vivo y en respuesta al SC, en comparación con los cerdos sometidos a SC y tratados con placebo, la ivabradina redujo considerablemente las formas de EMMPRIN muy glucosiladas (HG-EMMPRIN), lo que originó la acumulación de formas de EMMPRIN poco glucosiladas (LG-EMMPRIN) mediante mecanismos aún desconocidos (figura 3D).
La ivabradina reduce la concentración de enzimas que degradan la matriz extracelular en el corazón. A: expresión por RT-PCR del ARNm de EMMPRIN en corazones de cerdos tratados con ivabradina 0,3mg/kg. Se utilizó GAPDH como control (n=3 por grupo; media±desviación estándar). B: immunoblot de EMMPRIN en células cardiacas H9c2 incubadas con MG-132. C: immunoblot de EMMPRIN en células cardiacas H9c2 incubadas con tunicamicina; la flecha indica la localización de EMMPRIN no glucosilada nativa de bajo peso molecular de 20 kDa. D: expresión de EMMPRIN en áreas necróticas de corazones sometidos a SC e incubados con ivabradina (n=3 por grupo; media±desviación estándar; *HG-EMMPRIN frente a LG-EMMPRIN con SC+ivabradina, p < 0,05). Se utilizó betatubulina como control (B-D). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
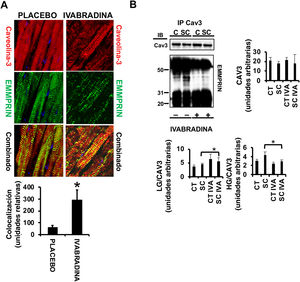
Las caveolas son vesículas enriquecidas con esfingolípidos y colesterol donde se localizan muchas vías de señalización que desempeñan funciones clave en la supervivencia, la muerte, la proliferación o la migración celulares. En el corazón, el componente principal de las caveolas es la caveolina-3, que ejerce funciones cardioprotectoras al unirse a varias proteínas. Previamente se demostró que el óxido nítrico induce cardioprotección al estabilizar el complejo caveolina-3/LG-EMMPRIN y, por lo tanto, prevenir la necrosis cardiaca inducida por MMP dependiente de HG-EMMPRIN14. En este caso, se ha detectado una fuerte colocalización entre caveolina-3 y EMMPRIN en respuesta a ivabradina 0,3mg/kg (figura 4A, panel combinado de ivabradina, amarillo); los análisis de coinmunoprecipitación revelaron un aumento de LG-EMMPRIN unido a caveolina-3 (figura 4B) en respuesta a ivabradina, lo que indica que la ivabradina puede reducir la degradación de la MEC inducida por SC al conservar el complejo caveolina-3/LG-EMMPRIN.
La ivabradina previene el desacoplamiento del complejo EMMPRIN/caveolina-3 en cerdos sometidos a shock cardiogénico. A: detección por microscopia confocal de caveolina-3 (Cy3, rojo) y EMMPRIN (FITC, verde) en secciones de corazón de cerdos tratados con ivabradina o placebo (colocalización en paneles combinados en amarillo) (n=3 por grupo; media±desviación estándar; *ivabradina frente a placebo, p <0,002). B: immunoblot de caveolina-3 y EMMPRIN en extractos inmunoprecipitados de caveolina-3 (n=3 por grupo; media±desviación estándar; *SC frente a IVA SC, p < 0,05). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
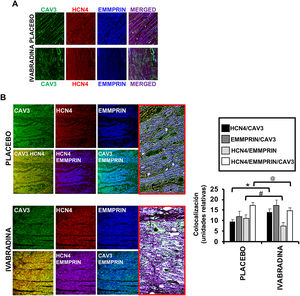
Además de EMMPRIN, la caveolina-3 también se une a HCN415, diana principal de la ivabradina. La observación de caveolina-3 mediante microscopio confocal en secciones del ventrículo de corazones sanos permitió detectar un complejo proteico que incluye caveolina-3, EMMPRIN y HCN4 (figura 5A), aunque los más interesante es que se detectó que tras el SC, los complejos caveolina-3/EMMPRIN y caveolina-3/HCN4 aumentaron en presencia de ivabradina frente a placebo (figura 5B). Este resultado indica que la caveolina-3 puede ser un objetivo de la ivabradina en la cardioprotección, por una parte, al prevenir la degradación de la MEC mediante el aumento de la unión a EMMPRIN y, por la otra, al estabilizar el complejo con HCN4 y reducir la frecuencia cardiaca, como se ha observado anteriormente (figura 1). Además, por vez primera se ha desvelado el complejo proteico existente entre HCN4 y EMMPRIN y la capacidad de la ivabradina para su desacoplamiento.
La ivabradina regula la unión de caveolina-3, HCN4 y EMMPRIN. A: detección por microscopia confocal de caveolina-3 (FITC [verde]), HCN4 (TRITC 561 [rojo]) y EMMPRIN (Alexa Fluor 350 [azul]) en secciones de corazón de cerdos sanos. B: a los 7 días del SC en cerdos tratados con ivabradina 0,3mg/kg o placebo (n=3 por grupo; media±desviación estándar; *HCN4/CAV3 placebo frente a ivabradina, p <0,05; #HCN4/EMMPRIN placebo frente a ivabradina, p < 0,002; @HCN4/EMMPRIN placebo frente a ivabradina, p <0,05). FITC: isotiocianato de fluoresceína; TRITC: isotiocianato de tetrametilrodamina; SC: shock cardiogénico. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
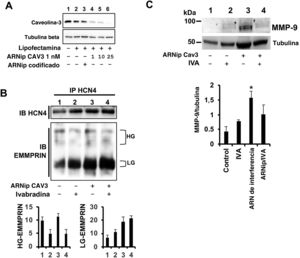
Con el objetivo de demostrar si la caveolina-3 puede servir como punto de acoplamiento entre HCN4 y EMMPRIN, se silenció la expresión de caveolina-3 con ARN de interferencia (siRNA) específicos en células cardiacas H9c2, utilizando la concentración de 10nM de siRNA por reducir la expresión de caveolina-3 en más del 75% frente a células no transfectadas o células transfectadas con una forma de siARN utilizada como control negativo (figura 6A). Se pudo confirmar que la HCN4 se unió a EMMPRIN tanto en células que expresan caveolina-3 como en células silenciadas, lo que indica que hay una interacción directa entre ambas proteínas (figura 6B), mientras que en presencia de ivabradina se produjo un desacoplamiento significativo, independientemente de la expresión de caveolina-3 (figura 6B). Asimismo, el silenciamiento de la caveolina-3 supuso la sobrexpresión de la MMP-9, que se inhibió en presencia de ivabradina (figura 6C), lo que indica que la ivabradina influye en la acción de la caveolina-3 preventiva de la degradación de la MEC.
La falta de caveolina-3 altera la formación del complejo EMMPRIN/HCN4. A: inmunoblot de caveolina-3 de células H9c2 transfectadas con lipofectamina (sin ARNip) o ARNip1 de caveolina-3 1, 10 y 25nM. Se utilizó tubulina beta como control negativo. B: panel superior, immunoblot de HCN4 de extractos inmunoprecipitados con HCN4 de células H9c2 silenciadas con siARNi de caveolina-3 10nM; panel inferior, immunoblot de EMMPRIN de los mismos extractos (n=3). C: immunoblot de MMP-9 en células silenciadas con H9c2 incubadas con ivabradina 0,3mg/kg (n=3; media±desviación estándar; *ARNip frente a ARNip + ivabradina, p <0,001). MMP-9: metaloproteinasa de la matriz extracelular 9; siARN: ARN de interferencia. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
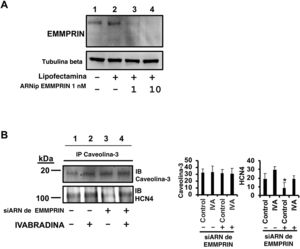
De la misma manera, para investigar el papel de EMMPRIN en el complejo entre caveolina-3 y HCN4, se silenció la EMMPRIN mediante ARN de interferencia específicos (figura 7A), gracias a lo cual se pudo reducir las concentraciones del complejo HCN4/caveolina-3, detectado mediante inmunotransferencia de HCN4 en lisados celulares de H9c2 inmunoprecipitadas con caveolina-3 (figura 7B, carril 3). Este resultado indica que se requiere EMMPRIN para mantener el complejo HCN4/caveolina-3 y que su interacción se restaura parcialmente mediante la incubación con ivabradina (figura 7B, carril 4), lo que señala que la unión entre caveolina-3 y HCN4 independiente de EMMPRIN se produce en respuesta a la ivabradina.
La falta de EMMPRIN altera la formación del complejo caveolina-3/HCN4. A: silenciamiento génico de EMMPRIN con siARN específico de EMMPRIN; Se empleó tubulina beta como control de carga. B: inmunoblot de HCN4 de extractos inmunoprecipitados con anticaveolina-3 de células H9c2 silenciadas con siARN de EMMPRIN 10nM (n=3; media±desviación estándar; *siARN de HCN4 frente a siARN + ivabradina, p <0,004). siARN: ARN de interferencia. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En el presente trabajo, se ha observado que la ivabradina induce cardioprotección más allá de la corriente I(f). En condiciones de SC, la administración de ivabradina puede ayudar a prevenir la necrosis cardiaca al reducir las concentraciones de la enzima MMP-9 que degrada a MEC y de EMMPRIN, así como su glucosilación (necesaria para la degradación de la MEC inducida por MMP), mediante la estabilización del complejo caveolina-3/LG-EMMPRIN y la unión de HCN4, diana principal de la ivabradina, a LG-EMMPRIN. Asimismo se pudo comprobar que la ivabradina estabilizó el complejo HCN4/caveolina-3, lo que apunta a un efecto bradicárdico más allá de la corriente I(f). En conjunto, se propone un nuevo mecanismo molecular en que la administración de ivabradina promueve la cardioprotección frente al SC.
La lesión por isquemia/reperfusión induce la degradación de la MEC y la necrosis miocardiaca mediante la expresión de MMP en las células cardiacas16–18, al menos en parte a través de la activación de EMMPRIN13. La selección de EMMPRIN no solo reduce la expresión ventricular de MMP-9, sino que también previene con éxito la progresión de la necrosis, con lo cual mejora la FEVI tras la reperfusión19.
Se ha comprobado que la administración de ivabradina tras el SC mantiene la EMMPRIN unida a la caveolina-3 en un estado poco glucosilado, lo que explica el efecto de la ivabradina inhibitorio de la degradación de la MEC, ya que son las formas muy glucosiladas de EMMPRIN las que intervienen en la activación de las metaloproteinasas, incluida la MMP-913,14. Todo ello indica que, además de la corriente I(f), y dado que la estimulación betaadrenérgica desencadena la expresión de EMMPRIN en los cardiomiocitos20,21, la inhibición de EMMPRIN también puede tener efectos cardioprotectores al inhibir la estimulación betaadrenérgica de la frecuencia cardiaca en nuestro modelo de SC.
El efecto de la ivabradina en la expresión de las MMP ya se había hallado en ratones diabéticos22. En ese modelo, la ivabradina redujo la cantidad de MMP-2 y mejoró la función cardiaca por mecanismos aún desconocidos. En consonancia con esos hallazgos, nuestro trabajo ha descubierto un mecanismo cardioprotector con la ivabradina más allá de la corriente I(f) que implica una reducción in vivo de la cantidad de EMMPRIN y su glucosilación, necesaria para inducir la actividad de las MMP mediada por EMMPRIN.
Nuestros datos muestran que la EMMPRIN se induce en células cardiacas en condiciones de hipoxia, tal como sucede en células renales embrionarias humanas23, de microglía24 y en varios tipos de cultivos de células cancerosas25,26. La hipoxia es un poderoso estímulo inductor de necrosis y apoptosis en varios tejidos, que en el caso de las células cardiacas responden activando varias rutas de señalización, como la estabilización de proteínas específicas inhibiendo la degradación mediada por ubiquitinación, como recientemente se detectó en el caso de la caveolina-3, lo que aclara su papel contra la lesión isquémica27. Nuestro estudio ha demostrado que, en respuesta al SC, la ivabradina estabiliza el complejo caveolina-3/LG-EMMPRIN como mecanismo para evitar la degradación de la MEC dependiente de las MMP.
El empleo de la ivabradina se basa en su capacidad para inhibir la corriente I(f) dependiente de HCN4 en los cardiomiocitos mediante mecanismos hasta el momento aún por explorar. La caveolina-3 se une al HCN4 en las caveolas cardiacas, lo que le permite regular la actividad de marcapasos15, de modo que la desregulación del complejo caveolina-3/HCN4 se ha relacionado con varios tipos de comportamiento arritmogénico, como recientemente se ha evidenciado al detectar la expresión de la variante T78M28 de la caveolina-3 o en algunos fenotipos del síndrome de QT largo, mediante la aceleración de la cinética de activación de HCN429. En consonancia con la bibliografía, nuestros datos indican que la ivabradina induce cardioprotección y conserva la conductancia de la I(f) estabilizando el complejo caveolina-3/HCN4.
Hasta el momento, ningún estudio ha abordado la participación de EMMPRIN en el complejo caveolina-3/HCN4. Curiosamente, nuestros datos apuntan a una interacción directa entre HCN4 y EMMPRIN, en que la ivabradina participa en la desestabilización el complejo. La interacción entre HCN4 y EMMPRIN era desconocida hasta ahora, por lo que se necesitan más estudios para determinar si la unión es meramente circunstancial o si representa un nuevo objetivo en la necrosis. Por otro lado, no se puede excluir la posibilidad de que HCN4 y EMMPRIN se unan a socios comunes y no a través de una interacción directa. Tal es el caso de los receptores betaadrenérgicos, que se unen a HCN430 y EMMPRIN31, donde la estimulación betaadrenérgica activa la HCN4 y está relacionada con las acciones inflamatorias de EMMPRIN.
LimitacionesUna de las limitaciones del estudio es haber empleado hembras, pues machos y hembras tienen diferentes fisiologías cardioprotectoras32, lo que puede comprometer el grado de lesión cardiaca e insuficiencia cardiaca relacionadas con el evento isquémico. El uso de cultivos de células H9c2 de rata también es una limitación, ya que el aislamiento de cardiomiocitos de cerdo sería el mejor enfoque experimental para probar los parámetros específicos abordados en este trabajo. Sin embargo, el aislamiento de cardiomiocitos porcinos entraña una complicación significativa, lo que llevó a utilizar células H9c2 y HL1B para evaluar la hipoxia y la reoxigenación.
CONCLUSIONESLa ivabradina induce cardioprotección más allá de la inhibición directa de la corriente I(f). Durante el SC, la ivabradina estabiliza el complejo HCN4/caveolina-3 y previene la necrosis cardiaca al mantener la EMMPRIN en su forma poco glucosilada. La ivabradina también estabiliza el complejo caveolina-3/HCN4, notificado ya como un mecanismo para regular la corriente I(f). Estudios adicionales estarán encaminados a explorar el papel molecular de la ivabradina en la dimerización de EMMPRIN y HCN4 como una nueva herramienta terapéutica.
FINANCIACIÓNEste trabajo contó con el apoyo de la Universidad Francisco de Vitoria (número de subvención 2017/18), Fundación BBVA (2017) y Proyectos de I+D+i, del programa Investigación orientada a los retos de la sociedad (MINECO/AEI/FEDER/UE [SAF2017-87342-R] a CZ).
CONFLICTO DE INTERESESNinguno.
- –
La ivabradina, un inhibidor selectivo de la corriente de marcapasos I(f) en las células sinoauriculares, inhibe los canales HCN1 y HCN4, reduce la frecuencia cardiaca y conserva la presión arterial y la función del ventrículo izquierdo, por lo que se recomienda para el tratamiento de la insuficiencia cardiaca crónica y la FEVI <35%; sin embargo, no está clara su eficacia en la insuficiencia cardiaca aguda.
- –
El shock cardiogénico es una causa frecuente de muerte después de un infarto agudo de miocardio.
- –
Los fármacos vasoactivos pueden contribuir a la lesión miocárdica mediante una taquicardia extensa y un aumento del estrés oxidativo y la demanda de oxígeno.
- –
Ya se había hallado previamente que la ivabradina mejora la taquicardia sinusal inducida por catecolaminas en condiciones de shock cardiogénico y mejora los parámetros hemodinámicos mediante mecanismos desconocidos.
- –
La ivabradina inhibe la corriente I(f) dependiente de HCN mediante mecanismos que todavía no se han evaluado; la caveolina-3 se une a HCN4 en los cardiomiocitos para regular la actividad de marcapasos.
- –
Nuestros datos indican que la ivabradina ejerce efectos cardioprotectores al conservar la conductancia de la I(f) estabilizando el complejo caveolina-3/HCN4.
- –
La caveolina-3 induce cardioprotección al formar un complejo con LG-EMMPRIN, lo que proporciona un nuevo mecanismo molecular de cardioprotección que implica impedir la degradación de la MEC en el corazón.
- –
Se necesita más investigación para estudiar los hallazgos relacionados con el complejo HCN4/EMMPRIN durante el SC.





![La ivabradina regula la unión de caveolina-3, HCN4 y EMMPRIN. A: detección por microscopia confocal de caveolina-3 (FITC [verde]), HCN4 (TRITC 561 [rojo]) y EMMPRIN (Alexa Fluor 350 [azul]) en secciones de corazón de cerdos sanos. B: a los 7 días del SC en cerdos tratados con ivabradina 0,3mg/kg o placebo (n=3 por grupo; media±desviación estándar; *HCN4/CAV3 placebo frente a ivabradina, p <0,05; #HCN4/EMMPRIN placebo frente a ivabradina, p < 0,002; @HCN4/EMMPRIN placebo frente a ivabradina, p <0,05). FITC: isotiocianato de fluoresceína; TRITC: isotiocianato de tetrametilrodamina; SC: shock cardiogénico. Esta figura se muestra a todo color solo en la versión electrónica del artículo. La ivabradina regula la unión de caveolina-3, HCN4 y EMMPRIN. A: detección por microscopia confocal de caveolina-3 (FITC [verde]), HCN4 (TRITC 561 [rojo]) y EMMPRIN (Alexa Fluor 350 [azul]) en secciones de corazón de cerdos sanos. B: a los 7 días del SC en cerdos tratados con ivabradina 0,3mg/kg o placebo (n=3 por grupo; media±desviación estándar; *HCN4/CAV3 placebo frente a ivabradina, p <0,05; #HCN4/EMMPRIN placebo frente a ivabradina, p < 0,002; @HCN4/EMMPRIN placebo frente a ivabradina, p <0,05). FITC: isotiocianato de fluoresceína; TRITC: isotiocianato de tetrametilrodamina; SC: shock cardiogénico. Esta figura se muestra a todo color solo en la versión electrónica del artículo.](https://static.elsevier.es/multimedia/03008932/0000007400000012/v1_202111260542/S0300893220305509/v1_202111260542/es/main.assets/thumbnail/gr5.jpeg?xkr=eyJpdiI6Ii9pVGVLbTB0N3FFWlNpUGtqdS94K0E9PSIsInZhbHVlIjoiK3Vab2tRUElLSnJnSVRJeVFnLzhzWGtsRUVxYW9KVEozWnFWVzNxN0pVOD0iLCJtYWMiOiJkYzczZDE4YzBiZDc1ZGYzZmQ0YTNlYjhkNjVhYWQ2Y2E5N2RiYjEwNzc2OTY3MzhlYjNiMzU5YmNmZDJlMDAxIiwidGFnIjoiIn0=)

