La amiloidosis cardiaca (AC), tanto en amiloidosis de cadenas ligeras de inmunoglobulina (AL) como en amiloidosis por transtirretina (ATTR), es la principal causa de morbimortalidad por amiloidosis sistémica. Por ello, la imagen cardiaca es un aspecto crucial en el diagnóstico y la monitorización de estos pacientes, en especial la ecocardiografía, la resonancia magnética cardiaca y la gammagrafía ósea. La monitorización de la respuesta al tratamiento en la ATTR-CA mediante imagen cardiaca se ha empleado principalmente en ensayos clínicos aleatorizados que investigan nuevos fármacos para esta enfermedad. El conocimiento acerca del seguimiento en ATTR-AC por imagen cardiaca indudablemente mejorará con los estudios en fase III actualmente en curso. En los últimos años, la utilidad de la resonancia magnética cardiaca en la evaluación de la respuesta al tratamiento en AL-AC ha aumentado considerablemente y se han incrementado la comprensión de la respuesta individual al tratamiento, el conocimiento del proceso subyacente a la enfermedad y, por lo tanto, la mejora de las estrategias terapéuticas. El objetivo de esta revisión es explorar el papel de la imagen cardiaca en el diagnóstico y sobre todo la monitorización de la AC.
Palabras clave
La amiloidosis cardiaca (AC) es un proceso infiltrativo debido a los depósitos de fibrillas de amiloide en el miocardio que a la larga causan una miocardiopatía restrictiva. Si bien varios tipos de amiloidosis pueden afectar al corazón, hay 2 tipos predominantes: la amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina (AL) y la amiloidosis cardiaca por transtirretina (ATTR)1. La afección cardiaca es la principal causa de morbilidad y mortalidad en la amiloidosis sistémica, independientemente de la patogenia implícita de la producción de amiloide.
La AL surge de un trastorno proliferativo clonal de células plasmáticas, en el cual las cadenas ligeras de inmunoglobulina mal plegadas se depositan como fibrillas de amiloide en algunos órganos, como el corazón, hasta en el 75% de los casos2,3. La cardiotoxicidad de la AC-AL es producto del depósito de fibrillas de amiloide en el miocardio, que tiene un efecto tóxico directo en los miocitos4,5. Debido a los efectos cardiotóxicos de las fibrillas de amiloide, unos rápidos diagnóstico e inicio del tratamiento son fundamentales para que mejore el pronóstico. El riesgo de muerte de los pacientes con retraso en el diagnóstico de AC-AL es 3-5 veces mayor6. Los esquemas terapéuticos utilizan una combinación de fármacos citotóxicos que actúan sobre clones de células plasmáticas e inhiben la producción de cadenas ligeras de inmunoglobulina amiloidogénicas. Hasta el momento, los avances en el tratamiento han mejorado de manera considerable la respuesta clínica de los pacientes, gracias al éxito del tratamiento con quimioterapia seguido de un trasplante de células madre que conlleva una supervivencia media de más de 4 años7.
La ATTR está causada por el plegamiento incorrecto de la proteína transtirretina sintetizada en el hígado. La transtirretina es un tetrámero, que es una proteína de transporte fisiológico de tiroxina y retinol. La enfermedad se produce cuando esta proteína precursora se pliega mal en fibrillas ATTR. La ATTR puede ser de tipo natural (nativa) -que se produce como consecuencia de un proceso patógeno adquirido asociado con el envejecimiento- o hereditaria, por una mutación hereditaria del gen TTR. La ATTRn aparece más tarde en la vida, tiene un predominio masculino y, por lo general, se presenta como miocardiopatía restrictiva8; en cambio, la ATTR mutada o hereditaria (ATTRm) se presenta a una edad más temprana, a menudo con un fenotipo mixto que conlleva polineuropatía y miocardiopatía9. Las estrategias de tratamiento iniciales giran en torno a la estabilización del tetrámero de transtirretina para evitar la separación en monómeros y oligómeros amiloidogénicos, seguida del desarrollo de silenciadores génicos. En la actualidad se investigan nuevos tratamientos de modificación del genoma, ya que reducen la producción de transtirretina y, por lo tanto, se inhibe la proteína precursora de amiloide10,11.
La AC es un proceso patológico heterogéneo y complejo. El fenotipo clínico y las estrategias de tratamiento varían considerablemente y dependen del tipo de amiloide implicado. Los avances en las técnicas de imagen cardiaca multimodal han mejorado nuestra comprensión de las respuestas de los individuos a los tratamientos, lo que tiene implicaciones importantes en la atención clínica y el pronóstico. Por ello, el objetivo de esta revisión es explorar el papel de la imagen cardiaca en el diagnóstico y el seguimiento de los cambios en la AC a lo largo del tiempo (figura 1).
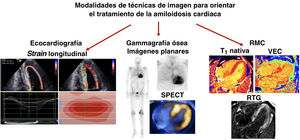
Figura central. Modalidades de técnicas de imagen para realizar el seguimiento de la amiloidosis cardiaca a lo largo del tiempo. Entre las modalidades de las técnicas de imagen para orientar el tratamiento de la amiloidosis cardiaca se utiliza la ecocardiografía, en particular el strain (o deformación) longitudinal global con el típico «patrón en escarapela» de los mapas polares del strain longitudinal. Gammagrafía ósea con resultados positivos en todos los pacientes con amiloidosis cardiaca por transtirretina y una proporción con amiloidosis cardiaca de cadenas ligeras de inmunoglobulina. Los hallazgos típicos de la resonancia magnética cardiaca (RMC) compatibles con la amiloidosis cardiaca presentan valores elevados em T1 nativa, volumen extracelular (VEC) elevado y realce tardío con gadolinio (RTG) difuso y transmural en el ventrículo izquierdo±el ventrículo derecho. SPECT: tomografía computarizada por emisión monofotónica.
La ecocardiografía es de fácil acceso, gran disponibilidad y, a menudo, la exploración de primera línea para pacientes que presentan síntomas de insuficiencia cardiaca. Entre las características típicas asociadas con la AC se encuentran engrosamiento de las paredes ventriculares, válvulas engrosadas, dilatación biauricular, disfunción diastólica con posible grado III o disfunción diastólica restrictiva y cociente E/e’ elevado, que refleja el aumento de las presiones de llenado del ventrículo izquierdo (VI). En las primeras etapas de la AC, generalmente están conservadas la fracción de eyección del VI o la función radial, pero en última instancia disminuyen con la progresión de la enfermedad y el aumento de la carga de amiloide. El strain (deformación) longitudinal global (SLG) con frecuencia está reducido (figura 1). Por lo general, en la AC el strain longitudinal está reducido de manera desproporcionada en los segmentos basales, lo que genera un patrón típico de ojo de buey en los mapas polares del strain longitudinal12. Aunque la conservación apical en el strain longitudinal tiene una sensibilidad del 93% y una especificidad del 82% para el diagnóstico de AC en comparación con la hipertrofia del VI, este patrón no es patognomónico de la enfermedad13. Por lo tanto, este gradiente de deformación apical:basal puede ser útil para diferenciar la AC de otros fenotipos hipertróficos, como la miocardiopatía hipertensiva o la miocardiopatía hipertrófica14,15. La identificación de estos rasgos característicos puede determinar la existencia de afección cardiaca en pacientes con AL sistémica conocida. Sin embargo, debido a la falta de caracterización tisular por ecocardiografía, esa identificación carece de la sensibilidad necesaria para permitir el diagnóstico precoz de la infiltración cardiaca12.
Las guías de práctica clínica actuales identifican la afección cardiaca por AL como un grosor del tabique interventricular >12 mm en eco, sin otra causa cardiaca identificable, junto con la confirmación histológica de la AL en cualquier localización16. Aunque el SLG medio no es un requisito de las guías de práctica clínica para determinar la afección cardiaca por AL, un promedio reducido es un marcador pronóstico sensible17, mientras que un SLG >–10,2% en el momento del diagnóstico se ha asociado con una supervivencia especialmente baja18.
El pronóstico de AC-AL en el momento del diagnóstico se basa en la clasificación de Mayo, que estratifica a los pacientes en 3 categorías de pronóstico (estadio I-III de Mayo) según los biomarcadores cardiacos, la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) y la troponina T. Una posterior modificación europea de la estadificación de Mayo de 2004 subdividió el estadio III en los estadios IIIa y IIIB, basándose en una NT-proBNP especialmente alta >8.500 ng/l asociada con un peor pronóstico a 3 meses19. Puesto que los biomarcadores cardiacos se ven afectados por procesos como la insuficiencia renal, se ha propuesto utilizar el SLG determinado por ecocardiografía como un método alternativo para estratificar el riesgo de los pacientes según la clasificación de Mayo modificada actual20,21. En un estudio reciente, el empeoramiento del SLG se correlacionó con el aumento del estadio de Mayo21. El SLG medio asociado con el estadio I de Mayo en el momento del diagnóstico fue del –21,1% en comparación con el –12,1% en pacientes con el estadio IIIb de Mayo (p<0,0001). Los cuartiles del SLG que se correlacionan con la supervivencia se determinaron de manera similar, mientras que los 2 cuartiles más bajos proporcionaron información pronóstica más allá de la clasificación de Mayo (SLG de –12,1 a –9,1%, supervivencia a 22 meses; >–9%, supervivencia a 5 meses) (tabla 1).
Resumen de las modalidades de técnicas de imagen cardiovascular para determinar el pronóstico de la AC-ATTR y la AC-AL
| Parámetro de imagen | Resultado | Referencia |
|---|---|---|
| AC-ATTR | ||
| Ecocardiografía | ||
| SLG e índice del VS | La reducción del SLG, el índice del VS reducido y la estenosis aórtica grave fueron factores predictivos independientemente de un mal pronóstico | Chacko et al., 202022 |
| Fracción de contracción miocárdica | La reducción de la fracción miocárdica fue superior a la FEVI en la predicción del pronóstico | Rubin et al., 201823 |
| RMC | ||
| VEC | El aumento del VEC se asoció con la reducción del pronóstico | Martínez-Naharro et al., 201721,24 |
| RTG | El RTG transmural fue un factor predictivo de muerte tanto en AC-ATTR como en AC-AL, pero con una mediana de supervivencia más corta en pacientes con AC-AL | Fontana et al., 201525 |
| AC-AL | ||
| Ecocardiografía | ||
| SLG | La reducción del SL en AC-AL fue predictiva de supervivencia | Cohen et al., 202221 |
| Dimensiones del VD | La dilatación del VD en la ecocardiografía se asoció con una menor supervivencia en pacientes con AC-AL | Patel et al., 199726 |
| RMC | ||
| VEC | La reducción del VEC a partir de los 6 meses posteriores al tratamiento fue un marcador pronóstico | Martínez-Naharro et al., 202227 |
| Valores elevados de T2 | Los valores de T2 estaban elevados en la AC-AL no tratada, pero no en la AC-ATTR, y fueron un factor predictivo del pronóstico solo en la AC-AL | Kotecha et al., 201828 |
| VEC miocárdico y hepático | Una reducción del VEC miocárdico y hepático a los 6 meses fue un factor independiente predictivo de un mejor pronóstico | Ioannou et al., 202329 |
AC-AL: amiloidosis cardiaca de cadenas ligeras de inmunoglobulina; AC-ATTR: amiloidosis cardiaca por transtirretina; FEVI: fracción de eyección del ventrículo izquierdo; RMC: resonancia magnética cardiaca; RTG: realce tardío con gadolinio; SL: strain longitudinal; SLG: strain longitudinal global; VD: ventrículo derecho; VEC: volumen extracelular; VS: volumen sistólico.
La resonancia magnética cardiaca (RMC) es una herramienta muy sensible en el diagnóstico de la AC. Tras la administración de medios de contraste con gadolinio, se puede observar el aumento del elevado volumen extracelular (VEC) causado por la acumulación de fibrillas de amiloide en el espacio extracelular. Los patrones característicos resultantes del realce tardío con gadolinio (RTG) son circunferenciales y difusos, y progresan cuando el proceso de la enfermedad avanza del realce subendocárdico al transmural (figura 1). Se cuantifica el VEC con la cartografía de T1 antes y después del contraste para generar un mapa del VEC del miocardio. A diferencia del VEC, T1 representa los espacios intracelular y extracelular combinados y aumenta por el contenido de agua y, por lo tanto, por el edema. Aunque T1 y VEC están elevados en AC-AL y AC-ATTR y son factores pronósticos, el VEC suele ser más preciso en la representación del espacio extracelular, donde se acumulan las fibrillas de amiloide30.
El VEC elevado asociado con la AC permite la cuantificación de la carga de amiloide en el miocardio31. El uso de la RMC como medio diagnóstico de la AC permite una mejor comprensión de esta como una gama de magnitudes de infiltración de amiloide con edema e inflamación asociados que provocan distintas respuestas de los miocitos32. Puesto que T1 disminuye con la hipertrofia miocárdica, generalmente es menor en la AC-ATTR que en la AC-AL30. De manera similar, los valores naturales de T1 han surgido como un medio útil para diferenciar la AC de otros fenotipos hipertróficos, como la miocardiopatía hipertrófica, aunque son un parámetro menos sensible que el VEC, que a menudo es el primer marcador30,33. T2, un marcador de edema miocárdico, también puede estar elevado en la AC y es un predictor de mortalidad en la AC-AL (tabla 1)28,30.
Finalmente, un área actualmente en investigación sobre la AC es el uso del strain longitudinal determinado por RMC, pero su uso como instrumento diagnóstico y de seguimiento está actualmente restringido por la escasa evidencia34.
Gammagrafía óseaLa gammagrafía ósea tiene preferencia por la AC-ATTR y, aunque la razón no está clara, puede deberse a la distribución de calcio dentro de las fibrillas de amiloide en la ATTR35. Por lo tanto, en los pacientes en que se sospecha una AC-ATTR y una vez descartada la discrasia de células plasmáticas, se puede utilizar la gammagrafía ósea con radionucleótidos para diagnosticar AC-ATTR con un elevado grado de certeza sin prueba histológica36. Para diagnosticar AC-ATTR con gammagrafía ósea se utilizan 3 radiotrazadores con avidez por el hueso. Entre estos se encuentra el pirofosfato marcado con tecnecio-99m (99mTc-PYP), el más utilizado en Estados Unidos, mientras que el ácido 3,3-difosfono-1,2-propanodicarboxílico marcado con tecnecio-99m (99mTc-DPD) y el difosfonato de hidroximetileno marcado con tecnecio-99m (99mTc-HMDP) se utilizan en Europa. Aunque los 3 facilitan el diagnóstico de la AC-ATTR, cada uno requiere diferentes tiempos desde la inyección hasta la obtención de imágenes. Hasta la fecha, no se han realizado estudios de comparación directa en que se comparen estos radiotrazadores entre sí.
Las gammagrafías óseas mediante radionúclidos para diagnosticar AC-ATTR se clasifican de acuerdo con una escala derivada (escala Perugini o Dorbala) que varía de 0 a 3 en función del grado de captación de los radionucleótidos en el corazón en comparación con el del pulmón contralateral o el de todo el cuerpo en imágenes planares37,38. En ambos sistemas, los grados del 0 al 1 indican la ausencia de AC, mientras que los grados del 2 al 3 (captación miocárdica de moderada a fuerte) son diagnósticos (figura 1). Una vez descartada la discrasia de células plasmáticas, los criterios sin biopsia para diagnosticar AC-ATTR con gammagrafía ósea con radionucleótidos tienen una certeza superior al 98%36.
Una proporción de pacientes con AC-AL también pueden captar radionucleótidos en el corazón en la gammagrafía ósea35,39. En un estudio, el 40% de los pacientes con AC-AL presentaron alguna captación de radionucleótidos, que en el 10% era de grado 2-3 de Perugini40. La gammagrafía ósea no puede distinguir entre los subtipos de AC, lo que destaca la importancia de descartar la discrasia de células plasmáticas antes de completarla. Asimismo los pacientes en que se sospecha AC por la RMC o la ecocardiografía pero sin captación de radionucleótidos o solo con baja captación cardiaca en la gammagrafía ósea justifican exploraciones complementarias urgentes, ya que probablemente esto represente AC-AL41.
Aunque no es necesario para diagnosticar AC-ATTR, la adición de imágenes de tomografía computarizada por emisión monofotónica (SPECT) con gammagrafía mejora la interpretación de la exploración con DPD, en especial cuando hay cambios tempranos de AC, por ejemplo, grado Perugini 142. También aumenta la especificidad diagnóstica al distinguir la acumulación local de sangre con radiotrazador de la verdadera captación miocárdica, que es muy útil en pacientes con insuficiencia renal43.
Tomografía computarizada cardiacaFactores como no disponer de RMC pueden dificultar su uso al controlar la respuesta al tratamiento de la AC. El acceso puede verse aún más limitado por el uso restringido de la RMC, con arreglo a las políticas locales, en algunas cohortes de pacientes, como en casos de insuficiencia renal avanzada, y por los retos que plantean los dispositivos cardiacos al cuantificar el VEC. Por ello, el potencial para determinar el VEC mediante tomografía computarizada cardiaca (VECTCC) sería un posible modo de sortear estos problemas, especialmente porque puede haber más disponibilidad de TC en algunos centros. Un artículo reciente analizó la VECTC septal en 72 pacientes con diagnóstico de AC secundaria a AL (n=35) y ATTR (n=37)44. Se encontró que el VECTCC medio estaba elevado en el 42,7%±13,1% de la población con AL y en el 55,8%±10,9% de los pacientes con ATTR. Durante un seguimiento medio de 5,3±2,4 años, el aumento de la carga de amiloide cardiaco cuantificado por VECTCC tuvo valor predictivo en el aumento de la mortalidad por cualquier causa en pacientes con ATTR, pero no en aquellos con AL, después del ajuste por edad y grosor de la pared septal. Aunque el uso del VEC determinado por TCC se encuentra en una etapa preliminar, se necesitan más estudios para explorar más a fondo su uso, ya que puede convertirse en una modalidad útil para el seguimiento de la enfermedad en el futuro.
SEGUIMIENTO DE LOS CAMBIOS DE LA AMILOIDOSIS CARDIACA A LO LARGO DEL TIEMPOAmiloidosis cardiaca por ATTRLos cambios en las pruebas de imagen detectados en la AC-ATTR en respuesta al tratamiento farmacológico se han determinado mediante ensayos clínicos aleatorizados (ECA) de fase III que investigan la eficacia de los tratamientos dirigidos tanto a la AC-ATTR como a la polineuropatía amiloidótica familiar (PAF) de la ATTR. El medicamento aprobado para tratar la AC-ATTR se limita actualmente al tafamidis, un estabilizador de la TTR. Aunque existen tratamientos alternativos, como el basado en ARN de interferencia (p. ej., patisirán) y los tratamientos con oligonucleótidos de antisentido (p. ej., inotersén), están autorizados para su uso en pacientes con neuropatía secundaria a ATTRm (es decir, PAF-ATTR)45,46. Puesto que muchos pacientes con ATTRm presentan AC-ATTR concomitante, algunos datos describen los efectos de la medicación en el corazón a través del análisis de subgrupos de ECA y estudios retrospectivos.
El diflunisal es un antiinflamatorio no esteroideo del que se descubrió que actúa como un estabilizador de la TTR que se une al punto de unión de la tiroxina del tetrámero de TTR y lo estabiliza para que no se degrade a monómeros individuales47. El fármaco obtuvo respaldo inicialmente para su uso en pacientes con PAF-ATTR en un estudio cuyos pacientes que recibieron diflunisal redujeron el grado de progresión de la polineuropatía48. Un estudio retrospectivo reciente detectó un aumento de la supervivencia de los pacientes con un diagnóstico de AC-ATTRn que tomaban diflunisal frente a aquellos sin tratamiento dirigido49. Sin embargo, a pesar de esta diferencia en los resultados, el fármaco no se tradujo en cambios en el grosor del tabique interventricular y la fracción de eyección del VI en la ecocardiografía.
Aunque hay pocos datos sobre los cambios ecocardiográficos en pacientes en tratamiento dirigido para la AC-ATTR, la evidencia indica que el seguimiento del SLG y el volumen sistólico indexado son los parámetros ecocardiográficos óptimos para realizar el seguimiento a largo plazo (tabla 2 y figura 2). En un ECA reciente en ATTR-ACT, se demostró que el tafamidis, frente a placebo, reduce el riesgo de mortalidad y hospitalizaciones relacionadas con enfermedades cardiovasculares50. Este ECA incluyó a 441 participantes, de los que 264 recibieron tafamidis y 177, placebo. El análisis secundario de los cambios ecocardiográficos en el ensayo ATTR-ACT mostró una menor reducción del volumen sistólico en la ecocardiografía de pacientes que recibieron tafamidis en comparación con quienes recibieron placebo después de 30 meses de tratamiento. De manera similar, un estudio retrospectivo que analizó el efecto del tafamidis en los parámetros de ecocardiografía mostró una reducción significativa de la progresión del SLG en los pacientes que recibieron el tafamidis (n=23) en el décimo segundo mes de tratamiento al compararlos con una cohorte a placebo emparejada (n=22) (p=0,02)51. En ese estudio retrospectivo, también se produjo una reducción considerablemente menor del índice de trabajo miocárdico y la eficiencia en el grupo de tafamidis, pero no se observaron diferencias en otros parámetros ecocardiográficos, como el cambio en la fracción de eyección del VI o el strain radial51.
Resumen de las modalidades de imagen cardiovascular para el seguimiento de la enfermedad en la AC-ATTR y la AC-AL
| Parámetro de imagen | Resultado | Referencia |
|---|---|---|
| AC-ATTR | ||
| Hallazgos ecocardiográficos | ||
| Índice del volumen sistólico | Reducción de la tasa de reducción del índice del VS a los 30 meses con tafamidis | Maurer et al., 201850 |
| SLG e índice de trabajo miocárdico | Menor tasa de disminución del SLG y disminución del índice de trabajo miocárdico con el uso de tafamidis a los 12 meses en comparación con placebo | Giblin et al., 202251 |
| SLG, VTDVI y grosor de la pared del VI | Mejora del SLG, reducción del VTDVI y reducción del grosor medio de la pared del VI en pacientes que reciben patisirán en comparación con los controles a los 18 meses | Solomon et al., 201952 |
| Hallazgos de la RMC | ||
| VEC | Reducción del VEC a los 12 meses después del tratamiento con patisirán con una reducción de la absorción de DPD | Fontana et al., 202153 |
| AC-AL | ||
| Hallazgos de la ecografía | ||
| SLG medio | Mejora del SLG en la ecocardiografía de los pacientes que logran una RC a los 12 meses de iniciarse el tratamiento | Cohen et al., 202221 |
| Hallazgos de la RMC | ||
| VEC y RTG | Reducción del VEC de los pacientes después de la quimioterapia; el 38% de ellos presentaban una mejora del patrón de RTG | Martínez-Naharro et al., 201854 |
| VEC | Reducción del VEC miocárdico detectado 12 meses después del tratamiento en comparación con las reducciones anteriores en la regresión del VEC hepático y esplénico observadas a los 6 meses | Ioannou et al., 202355 |
AC-AL: amiloidosis cardiaca de cadenas ligeras de inmunoglobulina; AC-ATTR: amiloidosis cardiaca por transtirretina; DPD: ácido 3,3-difosfono-1,2-propanodicarboxílico marcado con tecnecio-99m; RC: respuesta completa; RTG: realce tardío con gadolinio; SLG: strain longitudinal global; VEC: volumen extracelular; VI: ventrículo izquierdo; VS: volumen sistólico; VTDVI: volumen telediastólico del ventrículo izquierdo.
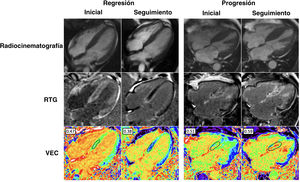
Cambios a lo largo del tiempo de la amiloidosis cardiaca por transtirretina (AC-ATTR) mediante resonancia magnética cardiaca. Uso de la resonancia magnética cardiaca para determinar la regresión y progresión del amiloide cardiaco en la AC-ATTR. Las imágenes del caso de la izquierda representan la respuesta al tratamiento de un paciente que recibió patisirán en comparación con el paciente de la derecha, que no recibió tratamiento dirigido. La regresión después del tratamiento con patisirán se ejemplifica mediante una reducción del realce tardío con gadolinio (RTG) y el volumen extracelular (VEC) en comparación con el valor inicial. La progresión del paciente que no recibe tratamiento farmacológico dirigido a la ATTR se ilustra con el empeoramiento del RTG biventricular y el aumento del VEC en comparación con el valor inicial. Intervalo normal del VEC, 0,23-0,30.
El ensayo APOLLO analizó la eficacia del patisirán en el SLG, un tratamiento con ARN de interferencia que reduce la producción hepática de TTR en pacientes con PAF-ATTRm45. Si bien ese ensayo mostró una mejora significativa de los síntomas neurológicos y la calidad de vida de los pacientes con PAF-ATTR45, se realizó un análisis de subgrupos de los participantes del ensayo (n=126) con características ecocardiográficas predeterminadas compatibles con AC simultánea52. A los 18 meses, los pacientes que recibieron patisirán mostraron en la ecocardiografía una reducción importante del grosor medio de la pared del VI (p=0,017) y una mayor incidencia de mejora absoluta del SLG (es decir, >–2% de cambio) en comparación con el grupo de control sin tratamiento (el 21,3 frente al 8%).
El documento de consenso publicado en 2021 por Garcia-Pavia et al.56 recomienda la ecocardiografía como la modalidad de técnica de imagen de control de elección para la AC-ATTR con un estudio de repetición aconsejado cada 6-12 meses. Aparte de los problemas de costes y recursos, la falta de datos de seguimiento a largo plazo con RMC contribuye a esta recomendación de seguimiento. Sin embargo, es probable que los ensayos actuales de tratamiento farmacológico de la AC-ATTR ofrezcan cada vez más pruebas que respalden el uso de la RMC para el seguimiento en el futuro46.
Un pequeño estudio prospectivo ilustró de manera similar la utilidad potencial de la RMC en con RMC y gammagrafía con DPD el seguimiento cardiaco de pacientes con tratamientos de la AC-ATTR53. El estudio analizó durante 1 año el efecto cardiaco del patisirán en 16 pacientes en comparación con un grupo de control emparejado y no tratado. El mes 12 hubo una reducción general considerable del VEC (valor medio ajustado, –6,2; intervalo de confianza del 95%, –9,5 a –3; p=0,001) en el grupo de tratamiento en comparación con la del grupo de control (figura 2). Se consideró que esto reflejaba la regresión del amiloide cardiaco general debido al patisirán. Entre el grupo de tratamiento total, el 38% presentó una reducción del VEC el mes 12, un fenómeno que no se vio en ningún participante del grupo de control. El estudio también encontró una mediana de reducción general de la captación cardiaca del 19,6% [intervalo intercuartílico, 9,8%-27,1%] en las exploraciones con DPD secundarias al patisirán. Dado que la captación de radionucleótidos en los tejidos blandos y en los huesos puede variar con el tiempo, puede modificar el aspecto de la captación de radiotrazadores cardiacos, lo que la convierte en una modalidad imprevisible para el seguimiento de la enfermedad en la práctica clínica. Por consiguiente, el estudio concluyó que la gammagrafía ósea debe reservarse solo como instrumento diagnóstico. Esta conclusión está respaldada por la recomendación de consenso de Garcia-Pavia et al.56.
Están en curso varios ECA de fase III que analizan la seguridad y la eficacia de otros tratamientos dirigidos de la AC-ATTR. Entre estos ensayos se encuentran la investigación de la eficacia del tratamiento con vutrisirán, con ARN de interferencia (HELIOS B, NCT04153149), el tratamiento con acoramidis, un estabilizador de la TTR (ATTRibute-CM, NCT03860935), y el tratamiento con eplontersén, un oligonucleótido de antisentido (CARDIO-TTRansform, NCT04136171) en pacientes con AC-ATTR. El estudio sobre tratamiento para la modificación del genoma «NTLA-2001» analiza de manera similar el efecto de la atenuación del gen TTR hepático en pacientes con AC-ATTR11. Las imágenes de seguimiento con ecocardiografía y los subestudios de RMC ofrecerán información muy valiosa sobre los cambios cardiacos que se producen en respuesta al tratamiento farmacológico, así como el conocimiento sobre las modalidades óptimas de imágenes de seguimiento.
Amiloidosis cardiaca por ALEl objetivo del tratamiento de la AL es el cese de la producción libre de cadenas ligeras de inmunoglobulina para evitar mayor daño a los órganos y, en potencia, permitir que estos recuperen su función. El tiempo medio hasta la mejora del órgano es de 10,2 meses después del inicio de la quimioterapia, pero solo un 25-50% de los pacientes presentan una respuesta del órgano5,57. En la AL, el tratamiento óptimo a menudo implica un trasplante autólogo de células madre con inducción de quimioterapia previa58. Debido a la alta morbilidad asociada con el trasplante autólogo de células madre, generalmente solo el 20% de los pacientes reúnen las condiciones para esta intervención. Para el 80% de los pacientes, el tratamiento se basa únicamente en quimioterapia, y la línea de tratamiento preferida consiste en ciclofosfamida-bortezomib-dexametasona y daratumumab, con la cual se logra una tasa de respuesta completa (RC) o respuesta parcial muy buena (RPMB) en el 78% de los pacientes59. Los tratamientos alternativos consisten en ciclofosfamida-bortezomib-dexametasona sola o bortezomib-melfalán-dexametasona60.
EcocardiografíaEl seguimiento de la respuesta al tratamiento comprende tanto la respuesta hematológica como la respuesta orgánica; por ejemplo, la respuesta cardiaca. La guía de práctica clínica vigente que define la respuesta cardiaca al tratamiento de AC-AL se basa en la respuesta del NT-proBNP. Una respuesta cardiaca se define como una reducción >30% y >300 ng/l del NT-proBNP en comparación con el valor en el momento del diagnóstico61. Sin embargo, este es un marcador inespecífico de estrés mecánico en los miocitos que está influido por factores no cardiacos, como la insuficiencia renal, que a menudo dificulta su interpretación. Por lo tanto, son necesarios más marcadores cardiacos que identifiquen la respuesta al tratamiento para mejorar el seguimiento del paciente. En un estudio realizado por Cohen et al.21 se encontró que los pacientes con una RC hematológica después de la quimioterapia presentaban un SLG considerablemente mejorado en la ecocardiografía a los 12 meses del diagnóstico en comparación con aquellos con una RPMB, una respuesta parcial o sin respuesta (tabla 2). Se estableció como cambio significativo del SLG aquel cambio >–2% para tener en cuenta la variabilidad entre distintos operadores. En ese estudio, la mejora del SLG se produjo solo en pacientes con una RC y no se observó en ningún otro grupo de respuesta hematológica (es decir, aquellos con una RPMB o una respuesta parcial).
En ese estudio, tardó un año en producirse una mejora del SLG en ecocardiografía, mientras que el deterioro del SLG se observó ya a los 6 meses en pacientes sin respuesta hematológica. Puesto que las fibrillas de amiloide son relativamente resistentes a la descomposición y la reabsorción, se necesita tiempo sin depósito libre de cadenas ligeras de inmunoglobulina para permitir que se produzca este proceso de regresión. Por lo tanto, se planteó la hipótesis de que se necesitan hasta 12 meses para que se produzca el proceso de regresión de la AC y se traduzca en una mejora del SLG. La supervivencia de los pacientes con mejora del SLG y una RC hematológica a los 12 meses habían mejorado en comparación con aquellos con solo una RC hematológica. La mediana de supervivencia de este grupo con RC hematológica y mejora del SLG mejoró más allá de la finalización del estudio a los 50 meses. En comparación con solo una reducción del NT-proBNP, la mejora combinada de NT-proBNP y SLG se asoció con una mayor supervivencia.
Aunque la respuesta cardiaca se sigue definiendo como un cambio del NT-proBNP, este estudio propuso la adición de «cambio del SLG» en respuesta a la quimioterapia como posible marcador de la respuesta cardiaca. Se proponía que un cambio del SLG >–2% después de la quimioterapia representa una definición alternativa a la «respuesta cardiaca» del cambio del NT-proBNP. Del mismo modo, ningún cambio del SLG representaría «cardiopatía estable», mientras que el deterioro del SLG muestra «progresión cardiaca»21.
Resonancia magnética cardiacaEl uso de la RMC para el seguimiento de la respuesta cardiaca a la quimioterapia en pacientes con AC-AL es un campo prometedor. Un estudio reciente que analizaba los cambios del VEC en la RMC en respuesta a la quimioterapia estableció que el cambio del VEC era un potente marcador pronóstico de supervivencia27. Ese estudio realizó un seguimiento prospectivo de 176 pacientes que recibían quimioterapia con bortezomib para la AC-AL con una RMC a los 6, 12 y 24 meses. Una pequeña proporción de pacientes (3%) mostraron una reducción del VEC >0,05 a los 6 meses y todos ellos mostraron una RC hematológica temprana durante los primeros 3 meses de tratamiento. La existencia de pacientes con regresión de la AC, determinado por la reducción del VEC, aumentó al 22% al cabo de 1 año y al 38% a los 2 años, y todos ellos mostraron una RC hematológica o una RPMB. De los pacientes con progresión cardiaca, el 63% al cabo de 1 año y el 80% a los 2 años obtuvieron una respuesta parcial hematológica o no obtuvieron ninguna respuesta.
En ese estudio, 25 pacientes murieron durante el seguimiento y ninguno de ellos mostró una reducción del VEC o regresión cardiaca determinada en la RMC. La respuesta cardiaca en la RMC a los 6 meses demostró ser un marcador pronóstico de supervivencia, incluso después del ajuste de la respuesta hematológica, el NT-proBNP y el cambio del SLG (p<0,01)53. El estudio ejemplifica la heterogeneidad de las respuestas cardiacas en cada grupo de respuesta hematológica. Puesto que la RC y la RPMB representan cifras de amiloide bajas como respuesta al tratamiento, el estudio confirma que estas respuestas hematológicas son necesarias para la RC, lo que permite una tasa de eliminación de amiloide que excede la tasa de depósito en el miocardio. La RMC puede mejorar a predecir los resultados en los grupos de RC y RPMB al identificar a los pacientes con VEC estable o disminuido como los que tienen un mejor pronóstico de supervivencia en comparación con aquellos con VEC aumentado. En última instancia, el estudio aporta evidencia de la utilidad potencial y el valor añadido que se obtiene al realizar el seguimiento de los pacientes en tratamiento de la AC-AL utilizando la cartografía de VEC y T1 a partir de la RMC (figura 3).
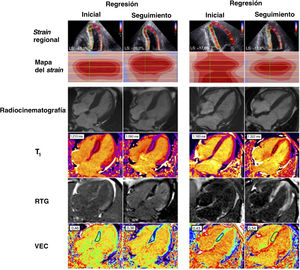
Cambios a lo largo del tiempo de la amiloidosis cardiaca de cadenas ligeras de inmunoglobulina (AC-AL) mediante ecocardiografía y resonancia magnética cardiaca. Uso de la resonancia magnética cardiaca para determinar la regresión y la progresión del amiloide cardiaco en la AC-ATTR. Las imágenes del caso de la izquierda representan la regresión del amiloide después de lograr una respuesta completa tras la quimioterapia en comparación con el paciente de la derecha, que muestra evidencia de progresión del amiloide. La regresión después de la quimioterapia se ejemplifica con la mejora en la ecocardiografía del strain longitudinal global, la reducción de los valores naturales de T1, el realce tardío con gadolinio (RTG) y el volumen extracelular (VEC) en comparación con el valor inicial. La progresión se ilustra mediante el empeoramiento del strain longitudinal global, los valores naturales de T1, el RTG biventricular y el aumento del VEC en comparación con el valor inicial. Strain longitudinal global normal,<–16%. El intervalo normal de T1 nativa (escáner clínico de 1,5 T) es 950-1.100ms. Intervalo normal del VEC, 0,23-0,30.
A medida que aumente la comprensión de la fisiopatología subyacente a la AC, aumentará el número de posibles objetivos de tratamiento y opciones terapéuticas. En la última década se ha producido el desarrollo de tratamientos de silenciamiento génico para el tratamiento de la ATTR y, después de los exitosos resultados de los ensayos, actualmente está en prueba la primera sustancia de modificación del genoma (NTLA-2001) en un ensayo de fase I y se espera que se amplíe a la fase III durante los próximos años10. Los avances en las técnicas de imagen cardiaca han contribuido a que la ATTR se diagnostique en una fase más temprana de la enfermedad, lo que se ha traducido en un aumento de la supervivencia62. Esto finalmente influirá en el diseño de futuros ensayos clínicos, con la selección de más pacientes y con seguimientos más largos para garantizar una potencia adecuada para evaluar la eficacia de las nuevas sustancias. Estos cambios aumentarán considerablemente el coste de los ensayos clínicos y sigue en el aire la pregunta de si los parámetros de las técnicas de imagen se pueden aprovechar como sustitutos para permitir una evaluación más rentable de los nuevos medicamentos63,64.
El VEC derivado de la RMC como sustituto de la carga de amiloide representa un descubrimiento importante, sobre todo con la perspectiva de tratamientos de anticuerpos que faciliten la eliminación de fibrillas de amiloide que se encuentran en etapas avanzadas de desarrollo65–67. Las mediciones del VEC en serie posiblemente permitan visualizar la eliminación de fibrillas de amiloide y la posterior regresión de la enfermedad tras la administración de estas nuevas sustancias. Con un arsenal terapéutico en constante expansión, es probable que la capacidad de reconocer a los respondedores y a los no respondedores permita tratamientos personalizados en el futuro, lo que a su vez mejorará los resultados64.
CONCLUSIONESLos avances en las técnicas de imagen han transformado el panorama del tratamiento tanto del diagnóstico como del seguimiento de la respuesta al tratamiento de la AC. El aumento de la sensibilidad de la ecocardiografía, la gammagrafía ósea y la RMC ha contribuido a un diagnóstico y un inicio del tratamiento más tempranos y han mejorado los resultados posteriores64. Además, la aparición de técnicas cartográficas multiparamétricas ha mejorado nuestra comprensión de cómo responde al tratamiento cada paciente en concreto. Cada avance se traduce en una mayor comprensión del proceso de la enfermedad y, a su vez, ayuda a guiar las estrategias de tratamiento.
FINANCIACIÓNTodos los autores comunican que no hay financiación externa para este trabajo.
CONTRIBUCIÓN DE LOS AUTORESN. Starr, A. Ioannou y A. Martínez-Naharro contribuyeron a la investigación, la redacción y la creación de las figuras de este artículo de revisión.
CONFLICTO DE INTERESESA. Martínez-Naharro ha recibido honorarios por conferencias y actividades educativos de Pfizer. N. Starr y A. Ioannou no tienen nada que declarar.