La prevalencia de la enfermedad de Chagas (EC) ha estado aumentando a nivel mundial1. En EE. UU. se ha notificado la EC en, aproximadamente, 300.000 personas, mientras que se han identificado también casos en Europa1,2. La tasa de reactivación de la EC en los receptores de un trasplante muestra una variabilidad entre el 40 y el 61%3,4. Esta reactivación se determina por los resultados positivos de la reacción en cadena de la polimerasa (PCR, polymerase chain reaction), los resultados de una biopsia endomiocárdica (BEM) o la existencia de una enfermedad sintomática. En este artículo se presentan 4 casos clínicos de neurochagas (NCh) de un mismo centro. Cabe destacar que este hospital no adopta de manera habitual ningún tratamiento inmunosupresor de inducción. No obstante, se observó un abordaje uniforme en todos los casos, con administración de corticoesteroides intravenosos preoperatorios. La pauta de inmunosupresión estándar utilizada para el mantenimiento incluye ciclosporina o tacrolimus, micofenolato sódico y prednisona. Sin embargo, los pacientes con un diagnóstico de EC se apartaron de esta pauta, con el empleo de azatioprina en vez de micofenolato4. Se obtuvo el consentimiento informado de los 4 pacientes.
El primer caso es el de un hombre de 45 años que presentó una miocardiopatía de Chagas (MCC) con criterios de insuficiencia cardiaca (IC) avanzada, al cual se le practicó un trasplante de corazón ortotópico bicavo (TxCOB) en 2014. Tras el alta, el paciente fue tratado con tacrolimus, prednisona y micofenolato porque no toleraba la azatioprina. Sin embargo, 3 meses después del alta fue hospitalizado a causa de una cefalea frontal y un único episodio de crisis epiléptica generalizada (CEG). Tras la exploración se observó un nódulo inflamatorio en la extremidad inferior izquierda, que fue positivo para paniculitis de Chagas en la biopsia. La tomografía computarizada (TC) craneal mostró un área frontal izquierda con hipoatenuación. La resonancia magnética (RM) craneal puso de manifiesto una zona córtico-subcortical de señal heterogénea en la misma región. Por tanto, se planteó la hipótesis diagnóstica de NCh. Se inició de inmediato un tratamiento con benznidazol, acompañado de una reducción de los inmunosupresores. El paciente presentó un curso favorable, sin que se registrara ningún otro episodio de CEG.
El segundo caso es el de un hombre de 48 años que cumplía los criterios de IC avanzada a causa de una MCC, al cual se le practicó un TxCOB en 2020. Durante el primer mes después del trasplante de corazón (TxC), presentó una disfunción ventricular (40%) mientras estaba en tratamiento con los fármacos que se detallan en la tabla 1. La BEM indicó un rechazo celular de grado 2R, que motivó la administración de tratamiento con metilprednisolona, con el cual se obtuvo una mejora de la función ventricular. No obstante, el paciente presentó una CEG que se controló con medicación antiepiléptica. Las exploraciones de imagen con TC y RM sugirieron un síndrome de encefalopatía reversible posterior y se sustituyó el tratamiento de ciclosporina A (CSA) por el de tacrolimus. Tres semanas más tarde, el paciente presentó otra CEG, acompañada de disartria, una reducción del nivel de conciencia y hemiparesia izquierda. Se realizó una RM que mostró la existencia de una lesión cerebral. El análisis del líquido cefalorraquídeo (LCR) puso de manifiesto la existencia de tripomastigotes (video 1 del material adicional). Se introdujo un tratamiento con benznidazol, junto con una reducción del de CSA. El paciente está en rehabilitación actualmente, con una mejoría parcial.
Manifestaciones clínicas y características radiológicas en el momento de la presentación inicial
| Manifestaciones clínicas | |||||||
|---|---|---|---|---|---|---|---|
| Serología de Chagas | Crisis convulsivas | Cefalea | Hemiplejia | Nivel de conciencia | Disartria | Forma de presentación extraneurológica | |
| Caso 1 | √ | √ | √ | √ | √ (paniculitis) | ||
| Caso 2 | √ | √ | √ | √ | √ | ||
| Caso 3 | √ | √ | √ | √ | √ | ||
| Caso 4 | √ | √ | √ | √ | |||
| Características radiológicas | |||||
|---|---|---|---|---|---|
| Signos en la tomografía | Signos en la resonancia | ||||
| Agrandamiento de cisternas | Zona de hipoatenuación | Dilatación de ventrículos | Intensificación tras contraste | Lesión de sustancia blanca | |
| Caso 1 | √ | √ | √ | √ | √ |
| Caso 2 | √ | √ | √ | √ | |
| Caso 3 | √ | √ | |||
| Caso 4 | √ | √ | |||
| Datos previos y posteriores a la reactivación | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| PCR CMV | BEM/prueba de PCR | ETT | Hongos, toxoplasmosis | Inmunosupresión antes de reactivación | Rechazo de base > 2R | Tratamiento pulsado | Concentración en suero ng/ml | Inmunosupresión después de reactivación | |
| Caso 1 | Negativa | 0R/PCR (-) | Normal | Negativa | MMF 720 mg 2 v/dTacrolimus 5 mg 2 v/d Prednisona 20 mg 1 v/d | No | No | 22 | AZT 50 mg 2 v/d Tacrolimus 4 mg 2 v/d Prednisona 10 mg 1 v/d |
| Caso 2 | Negativa | 0R/PCR (+) | Normal | Negativa | AZT 50 mg 2 v/d CSA 200 mg 2 v/d Prednisona 40 mg 1 v/d | Sí | Sí | 391 | AZT 50 mg 2 v/d CSA 175 mg 2 v/d Prednisona 10 mg 1 v/d |
| Caso 3 | Negativa | 1R/PCR (+) | Normal | Negativa | AZT 50 mg 2 v/d CSA 175 mg 2 v/d Prednisona 20 mg 1 v/d | No | No | 425 | AZT 50 mg 2 v/d CSA 150 mg 2 v/d Prednisona 5 mg 1 v/d |
| Caso 4 | Negativa | 1R | Normal | Negativa | MMF 500 mg 2 v/d CSA 200 mg 2 v/d Prednisona 10 mg 1 v/d | Sí | No | MMF 500 mg 2 v/d CSA 200 mg 2 v/d Prednisona 10 mg 1 v/d | |
1 v/d, una vez al día; 2 v/d, dos veces al día; AZT, azatioprina; BEM, biopsia endomiocárdica; CMV, citomegalovirus; CSA, ciclosporina A; ETT, ecocardiografía transtorácica; MMF, micofenolato; PCR, reacción en cadena de la polimerasa.
El tercer caso es el de un hombre de 47 años con un diagnóstico de MCC e IC avanzada, al cual se le practicó un TxCOB en 2022. Al tercer día del postoperatorio presentó una CEG. La TC mostró un área subcortical frontal con hipoatenuación en el lado izquierdo. Un mes después del TxC se produjo otra CEG. A pesar del inicio de un tratamiento antiepilético, la CEG persistió. La RM craneal posterior puso de manifiesto la existencia de una lesión compatible con un chagoma. Además, se detectó Trypanosoma cruzi en el LCR. Se redujo la dosis de CSA y se inició la administración de benznidazol, con lo que no hubo nuevos episodios posteriores de CEG.
El cuarto caso es el de un hombre de 46 años en que se cumplían los criterios de IC avanzada a causa de una MCC, tratado con un TxCOB en 2002. Cinco meses después del TxC fue hospitalizado a causa de una CEG acompañada de una disminución del nivel de conciencia y hemiplejia izquierda. La medicación inmunosupresora se detalla en la tabla 1. En una TC se detectó hemorragia subaracnoidea. Lamentablemente, el paciente presentó una progresión hasta la muerte cerebral y se realizó la autopsia. En la biopsia cerebral por escisión se puso de manifiesto la existencia de redes de amastigotes (figura 1).
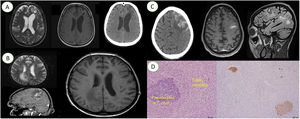
A. De izquierda a derecha: imagen de resonancia magnética craneal con dilatación de los ventrículos y un área subcortical de señal heterogénea en la región frontal izquierda; secuencia T1, con hiposeñal en la misma región; imagen de tomografía computarizada craneal con área frontal izquierda con hipoatenuación. B. De izquierda a derecha: imagen de resonancia magnética craneal con hiperseñal en la transición frontoparietal; imagen de resonancia magnética T2flair que muestra una hiperseñal en la misma región; imagen de resonancia magnética axial que muestra una hiposeñal. C. De izquierda a derecha: tomografía computarizada craneal con hiperdensidad en los surcos corticales frontales izquierdos; imagen de resonancia magnética que muestra un chagoma en la misma región; imagen de resonancia magnética que muestra el mismo chagoma. D. De izquierda a derecha: corte histológico con presencia de pseudoquistes de Trypanosoma cruzi; inmunotinción para Trypanosoma cruzi que muestra la presencia de pseudoquistes.
La forma de presentación clínica de la EC puede ser asintomática o, incluso, de miocarditis o encefalitis con ictus. Los métodos diagnósticos utilizados con más frecuencia son el análisis de PCR en sangre, el análisis del LCR y la BEM3. Según lo indicado por nuestros datos, la incidencia de NCh fue de 4 casos (2,9%) desde 2013. La prevalencia de la reactivación con compromiso neurológico no se ha documentado de forma amplia y en un ensayo retrospectivo se indicó una prevalencia del 3,1%4. Esta tasa de reactivación no se notifica con frecuencia, incluso en trasplantes de otros órganos5,6. En este centro, el análisis de PCR antes del trasplante no forma parte de la práctica habitual. Sin embargo, se realiza un análisis de PCR después del trasplante cuando hay factores de riesgo específicos, en casos de sospecha clínica o, incluso, en pacientes asintomáticos, junto con cada BEM. Se llevó a cabo un análisis de PCR para la EC en 3 pacientes incluidos en la tabla 1.
Los síntomas clínicos neurológicos observados en esta serie consistieron en hemiplejia, crisis epilépticas, disartria y alteración de nivel de conciencia. Las observaciones radiológicas más frecuentes fueron áreas de hipoatenuación, agrandamiento de las cisternas y dilatación de los ventrículos. En este centro, el tratamiento con benznidazol se inicia de inmediato, a la vez que se reduce la dosis del inmunosupresor. El tratamiento con benznidazol se emplea durante 60 días, pero no se han publicado datos sobre el tratamiento y la duración de la reactivación con afectación del sistema nervioso central2. No hay consenso respecto a los efectos beneficiosos del empleo profiláctico de benznidazol en los pacientes con EC a quienes se practica un TxC.
Las recomendaciones principales de este estudio son las siguientes: identificar los factores de riesgo que predisponen a la reactivación, establecer un umbral inferior al decidir el grado de inmunosupresión y realizar un seguimiento frecuente de esos pacientes basándose en la sospecha clínica y los análisis complementarios (BEM y PCR).
FINANCIACIÓNLos autores declaran no haber recibido ninguna financiación para este trabajo.
CONSIDERACIONES ÉTICASSe obtuvo el consentimiento informado de los 4 pacientes. El presente artículo ha recibido la aprobación por parte del comité de ética del centro. El artículo se elaboró cumpliendo lo establecido en las recomendaciones SAGER y las posibles variables relacionadas con el sexo y el género no fueron relevantes.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALLa inteligencia artificial no tuvo ningún papel en la creación de este trabajo.
CONTRIBUCIÓN DE LOS AUTORESC. Espinoza Romero, D. Catto de Marchi, F.G. Marcondes-Braga, S. Mangini, M. Samuel Avila y F. Bacal participaron en todos los aspectos de este artículo, incluida la planificación y diseño del estudio, la elaboración del modelo, la realización de experimentos, la obtención y análisis de los datos, y la preparación y revisión del original.
CONFLICTO DE INTERESESNinguno.
AGRADECIMIENTOSA la Unidad de Enfermedades Infeccionas (Dra. Tânia Strabelli), Anatomía Patológica (Dr. Paulo Sampaio Gutierrez) y los miembros de la unidad de trasplante de corazón del Instituto do Coração, São Paulo, Brasil.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.09.006.