La insuficiencia mitral es la valvulopatía más prevalente en Estados Unidos y la segunda en Europa. Una vez se establecen los síntomas o produce una repercusión significativa en la función cardiaca, la insuficiencia mitral grave tiene un pronóstico adverso con tratamiento médico. A pesar de ello, no se opera hasta la mitad de los pacientes con insuficiencia mitral grave sintomática por edad avanzada, disfunción ventricular y otras comorbilidades. Se ha demostrado que la cirugía obtiene mayor supervivencia a las insuficiencias mitrales orgánicas por prolapso, pero no se ha podido demostrar un beneficio clínico de intervenir insuficiencias mitrales funcionales. En este escenario, la reparación percutánea de la insuficiencia mitral nativa permite intervenir la valvulopatía en pacientes con alto riesgo quirúrgico. La reparación percutánea de la insuficiencia mitral es un campo en expansión con gran dependencia de las técnicas de imagen tanto para el diagnóstico de la anatomía funcional que reparar como para guiar el procedimiento.
Palabras clave
La insuficiencia mitral (IM) es la valvulopatía más prevalente en Estados Unidos y la segunda en Europa1–3. La competencia funcional de la válvula mitral (VM) implica un trabajo en sincronía de varias estructuras para dirigir el flujo de sangre de la aurícula al ventrículo en diástole y del ventrículo a la aorta en sístole. El fallo orgánico de las estructuras que forman parte directa del complejo valvular mitral es lo que define la IM primaria. Con la reducción de las enfermedades reumáticas, la degeneración valvular es actualmente su principal causa2,3. La IM secundaria o funcional se debe a una distorsión o disfunción del aparato subvalvular por dilatación, remodelado ventricular o isquemia4.
Una vez se establecen los síntomas o produce repercusión significativa en la función cardiaca (disfunción ventricular, hipertensión pulmonar o fibrilación auricular recurrente), la IM grave tiene un pronóstico adverso con tratamiento médico3,5–8. A pesar de ello, no se opera hasta la mitad de los pacientes con IM grave sintomática por edad avanzada, disfunción ventricular y otras comorbilidades9. Se ha demostrado que la cirugía consigue mayor supervivencia a las IM orgánicas por prolapso5,10, pero no se ha demostrado beneficio clínico de intervenir IM funcionales11.
En este escenario, la reparación percutánea de la IM nativa permite intervenir la valvulopatía en pacientes con alto riesgo quirúrgico12. La reparación percutánea de la IM es un campo en expansión con gran dependencia de las técnicas de imagen tanto para el diagnóstico de la anatomía funcional que reparar como para guiar el procedimiento.
Por su resolución espaciotemporal, su disponibilidad, su portabilidad y su coste-efectividad, la ecocardiografía es la principal técnica de imagen para evaluar las válvulas cardiacas. Con la experiencia acumulada en el análisis ecográfico de la válvula mitral, la ecocardiografía transesofágica (ETE) es la técnica de referencia para guiar procedimientos sobre los velos mitrales. Sin embargo, su limitado campo de visión ha permitido la entrada de la tomografía computarizada cardiaca (cardio-TC) con multidetectores para la valoración integral del complejo valvular mitral.
Los diferentes procedimientos terapéuticos de la reparación percutánea de la IM se basan en técnicas quirúrgicas e incluyen la plicatura de las valvas (MitraClip®), la anuloplastia (Carillon®, Mitralign®, Accucinch®, Cardioband®), las neocuerdas (NeoChord®, V-Chordal®) y el implante percutáneo de bioprótesis (CardiAQ®, Fortis®, Tiara®, Tendyne®)13–15. Los dispositivos aprobados para su venta en Europa son MitraClip®, Carillon® y NeoChord®, aunque el más expandido actualmente es MitraClip®, con más de 25.000 implantes en todo el mundo y más de 270 casos en España16.
DESCRIPCIÓN ANATÓMICA DE LA VÁLVULA MITRALEl conocimiento de la anatomía de la VM normal es imprescindible para entender su mecánica, comprender los mecanismos que conducen a la insuficiencia valvular e identificar los hallazgos que las diferentes técnicas de imagen pueden mostrar.
El complejo valvular mitral está integrado por un anillo fibroso en la unión auriculoventricular donde se anclan los velos de la válvula, y un aparato subvalvular compuesto por cuerdas tendinosas (CT) y músculos papilares (MP) anclados al miocardio del ventrículo izquierdo (VI).
El anillo mitralEl anillo de la VM se describe como una estructura fibrosa con una morfología en silla de montar. Los picos se encuentran más alejados del ápex ventricular en posición anterior (riding horn) y posterior, mientras que sus valles se localizan mediales y laterales, en las comisuras17–19. Es el lugar de anclaje de la válvula y permite el aislamiento eléctrico auriculoventricular.
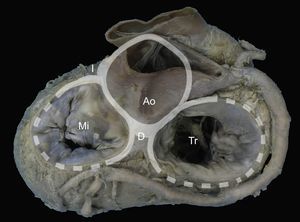
La presencia de un anillo completo de tejido conectivo que bordea la unión auriculoventricular izquierda es excepcional20. Una banda fibrosa engrosada actúa como bisagra de la unión mitroaórtica, entre los trígonos derecho e izquierdo. Desde ahí se extiende como una membrana discontinua a lo largo de la unión auriculoventricular y permite el anclaje de la valva posterior y de la aurícula izquierda21 (figura 1).
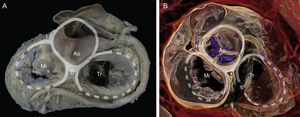
Anillo mitral. Visión macroscópica de la base del corazón que detalla las relaciones del anillo mitral con el esqueleto fibroso (representado gráficamente por los anillos aórtico y tricuspídeo) a través de los trígonos derecho e izquierdo y la unión mitroaórtica entre trígonos. Ao: aorta; D: trígono derecho; I: trígono izquierdo; Mi: válvula mitral; Tr: válvula tricúspide.
El velo mitral es una estructura continua insertada alrededor del anillo mitral, cuyo borde libre presenta varias indentaciones22. Dos de ellas tienen una distribución regular y dividen la estructura en dos valvas, la anterior o aórtica y la posterior o mural. Estas indentaciones principales identifican dos áreas de comisuras, la anterolateral y la posteromedial, que se caracterizan por tener una región central clara mediante transiluminación, sin zona rugosa distal, con los MP apuntando hacia ellas22.
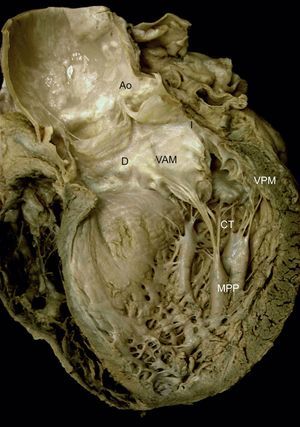
La valva anterior o aórtica es grande, triangular, con pocas o sin indentaciones. En la superficie auricular de la valva existe un reborde rugoso semilunar que ocupa el centímetro distal del velo. Define la línea de cierre valvular y su grosor se debe a la abundancia de cuerdas que se insertan en la superficie ventricular de esta área. Próxima a la zona rugosa se diferencia una zona membranosa, clara por transiluminación, que se extiende hasta la base de anclaje22,23 (figura 2).
Complejo valvular mitral. Visión macroscópica de un corte longitudinal del corazón a través de su pared anterior y de la válvula aórtica, eliminando el músculo papilar anterior y sus cuerdas tendinosas. Obsérvese la relación de las estructuras anatómicas y el anclaje del complejo mitral al ventrículo a través de los músculos papilares. También es posible apreciar la inserción de las cuerdas tendinosas en la superficie ventricular de la valva anterior en su zona rugosa y la extensión hacia la aorta a través de la unión mitroaórtica, delimitada por los trígonos derecho e izquierdo. Ao: aorta; CT: cuerdas tendinosas; D: trígono derecho; I: trígono izquierdo; MPP: músculo papilar posterior; VAM: valva anterior mitral; VPM: valva posterior mitral.
La valva posterior o mural tiene un anclaje más ancho al anillo auriculoventricular, pero es más corta que la anterior. Las indentaciones a lo largo del margen libre le dan una apariencia festoneada muy variable entre individuos, pero que se utiliza en la nomenclatura de Carpentier24 para describir los diferentes segmentos: P1 como el más lateral, adyacente a la comisura anterior; P2 es el segmento central, y P3 es el segmento más medial, adyacente a la comisura posterior. El velo anterior que se opone a cada segmento recibe el mismo nombre: A1, A2 y A3. Se puede definir tres zonas en la valva posterior: una rugosa donde se sitúa la línea de cierre valvular, una clara o membranosa y una basal.
Las cuerdas tendinosasLas CT son finas estructuras fibroelásticas25 que se originan de los MP o directamente de la pared ventricular y se insertan en la cara ventricular de la VM (CT verdaderas), aunque también pueden conectar MP entre ellos o con la cavidad ventricular (CT falsas). De promedio, 25 CT se insertan en la VM y la mayoría de ellas se ramifican26. Se diferencian dos grandes grupos de cuerdas en función de su lugar de inserción y la forma de ramificación:
- •
Las cuerdas comisurales: son dos CT que nacen de las puntas de los MP, se ramifican radialmente como las aspas de un ventilador y se insertan en el margen libre de las comisuras. Tienen un grosor de 0,7-1 mm y una longitud de 12-14 mm.
- •
Las cuerdas de las valvas:
- –
Unas nueve CT se insertan en la valva anterior exclusivamente en la parte distal del velo, en la zona rugosa. Característicamente, cada cuerda se divide en tres poco después de su origen en el MP. Una se inserta en el borde libre de la valva, otra más allá del borde libre en la misma zona rugosa y una intermedia se inserta entre las dos. El grosor medio es de 0,84 mm, con una longitud de 17,5 mm. Hay dos cuerdas especialmente gruesas (1,24 mm) que se insertan en la superficie ventricular de la línea de coaptación a las 4:00-5:00 (posteromedial) y a las 7:00-8:00 del cuadrante (anterolateral). Estas cuerdas son los struts y están presentes en más del 90% de los corazones examinados por el grupo de Lam et al26.
- –
Tres tipos de CT se insertan en la valva posterior. Las cuerdas características de esta son las basales que se originan directamente de la pared ventricular o de pequeñas trabéculas carnales y tienen una presencia y número muy variables (en promedio, dos cuerdas). De modo parecido a la valva anterior, 10 cuerdas se insertan en la zona gruesa de la valva posterior, aunque en general son más finas y cortas (0,65 y 14 mm), y otras dos se insertan en las indentaciones adoptando una ramificación radial similar a las cuerdas comisurales.
- –
Los MP son una especialización del miocardio del VI, una forma de transición del músculo al tejido conectivo de la VM pasando por las CT. Constituyen el anclaje del borde valvular libre al ventrículo y se posicionan en los segmentos medioapicales del VI alineados con las comisuras (figura 2). A la comisura anterolateral, habitualmente se conecta un solo MP y a la comisura posterolateral, dos o tres músculos en más del 60% de los casos (o un músculo con 2-3 cabezas)23. La irrigación del MP anterior es habitualmente doble con ramas septales de la arteria coronaria descendente anterior y ramas de la arteria coronaria circunfleja. El MP posterior tiene una irrigación coronaria dependiente de un solo vaso, habitualmente la arteria coronaria derecha, aunque en ocasiones la arteria circunfleja es la encargada de irrigarlo4. Esta particular distribución contribuye a la vulnerabilidad del MP posterior a lesiones y disfunciones isquémicas.
ANATOMÍA FUNCIONAL DE LA INSUFICIENCIA MITRALDiferentes etiologías convergen en la incompetencia funcional final de la VM a través de distintos mecanismos27. Desde una visión quirúrgica, Carpentier clasificó tres tipos funcionales de insuficiencia mitral24,28 según la movilidad de los velos:
- •
Tipo I: movilidad de las valvas normal. Es el mecanismo funcional en los casos de dilatación anular y perforación de las valvas.
- •
Tipo II: movilidad de las valvas excesiva. Secundaria a elongación de cuerdas y prolapso que pueden asociarse a rotura de cuerdas y eversión del velo (flail).
- •
Tipo III: movilidad de las valvas restringida.
- o
IIIa: movilidad sistodiastólica restringida típica de afección infiltrativa, habitualmente reumática.
- o
IIIb: movilidad sistólica restringida típica de la cardiopatía isquémica.
- o
El análisis de las válvulas cardiacas por imagen requiere una elevada resolución temporal para reducir los artefactos de movimiento cardiaco y respiratorio29. Técnicamente se puede considerar la resolución temporal de un objeto en movimiento como la mínima diferencia de tiempo que la técnica es capaz de captar. Por lo tanto, esta se mide en milisegundos. La tabla 1 compara las características técnicas de las principales modalidades de imagen para la evaluación de las válvulas cardiacas y respecto a la fluoroscopia (principal técnica en intervencionismo).
Aspectos técnicos de las modalidades de imagen
| Fluoroscopia | Ecocardiografía | TC | RM | |
|---|---|---|---|---|
| Resolución temporal (ms) | 7,5-33 | 15-60 | 75-135 | 20-50 |
| Resolución espacial (mm) | 0,3-1,2 | 0,6-1 | 0,4-0,6 | 1-2 |
| Reconstrucción 3D | No | Sí | Sí | No |
| Campo de visión | No limitante | Limitante | No limitante | No limitante |
3D: tridimensional; RM: resonancia magnética; TC: tomografía computarizada.
La ecocardiografía y la resonancia magnética cardiaca (cardio-RM) tienen mayor resolución temporal que la cardio-TC. La manera de adquirir los datos es el principal factor diferenciador, ya que la cardio-TC necesita mover físicamente todo el arco de detectores (gantry) entre un cuarto y media vuelta (según el tubo sea único o doble), mientras que la ecocardiografía y la cardio-RM emiten pulsos (de ultrasonidos o de radiofrecuencia) para adquirir las imágenes. Estas dos técnicas (la ecocardiografía en su modalidad tridimensional [3D] y la cardio-RM en general), además, pueden realizar un promediado de diferentes ciclos cardiacos para mejorar su resolución temporal30–36.
La resolución espacial es la mínima distancia que la técnica es capaz de detectar como dos estructuras diferentes. Nuevamente, las diferentes modalidades de imagen presentan grandes diferencias en resolución espacial. El ecocardiograma, por ejemplo, tiene su mayor resolución espacial cuando el objeto medido está en línea con el haz de ultrasonidos, cercano al transductor y en el área de máximo foco. En estas condiciones óptimas, la resolución espacial es de 0,6-1 mm. Las secuencias de cine en cardio-RM, las balanced steady-state free precession, tienen una resolución espacial máxima de 1-2 mm, mientras que la resolución espacial de la cardio-TC es de 0,4-0,6 mm en sus tres ejes del espacio (isotropismo) y no depende del área de interés, característica idónea para la reconstrucción 3D de datos29,37.
Estos aspectos técnicos, junto con su disponibilidad y el tiempo de adquisición de los estudios, marcan el papel de las diferentes modalidades de imagen en la valoración y la monitorización de la reparación valvular. La tendencia actual prioriza la ecocardiografía (y la fluoroscopia) para guíar el implante, y se considera la cardio-TC para la planificación del procedimiento38–41.
MONITORIZACIÓN ECOCARDIOGRÁFICA EN LA REPARACIÓN PERCUTÁNEA DE LA INSUFICIENCIA MITRAL: MITRACLIP®Sistema MitraClip®La plicatura quirúrgica de las valvas descrita por Alfieri ha permitido simplificar la reparación valvular de la IM nativa creando una técnica independiente del mecanismo de regurgitación42–44. Su sencillez y su versatilidad han permitido realizar un abordaje menos invasivo de la técnica, inicialmente con robótica45 y finalmente percutánea.
Tras las primeras aproximaciones percutáneas fallidas con el sistema de sutura Mobius® (Edwards LifeSciencies Inc.; Irvine, California, Estados Unidos)46, los primeros resultados esperanzadores fueron los publicados por St. Goar et al47 en 2003 con el implante exitoso del MitraClip® en 12 de 14 cerdos. Hubo una desinserción de uno de los velos en los otros dos animales que reforzó la necesidad de monitorización ecocardiográfica de la captura o grasping.
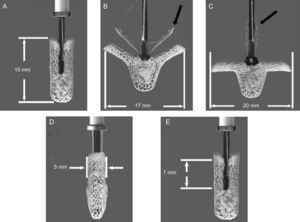
MitraClip® (Abbott Vascular; Menlo Park, California) es un sistema de catéteres triaxial con un clip implantable en la punta. Está compuesto por un catéter guía deflectable a través del cual se cruza el catéter liberador del clip (clip delivery system [CDS]). El CDS permite realizar movimientos en los tres planos del espacio. Finalmente, el dispositivo MitraClip® es de cromo-cobalto de 5 mm de ancho, con dos brazos articulados que pueden abrirse hasta 240°. En su interior hay un sistema de ganchos o grippers que permiten capturar con firmeza las valvas y crear un doble orificio mitral. El exterior del clip está recubierto por una malla de poliéster. Es un dispositivo reposicionable y extraíble, y se puede implantar múltiples clips para optimizar el resultado14,48 (figura 3).
Sistema MitraClip®. Dimensiones y movimientos del clip. Se muestran las dimensiones máximas del dispositivo cerrado (A), abierto a 120° (B) con el sistema de grippers parcialmente cerrado (flecha negra) y abierto a 180° (C) con el sistema de grippers totalmente levantado (flecha negra). El panel inferior muestra la longitud máxima de velo que entra en el clip: 5 mm transversalmente y 7 mm longitudinalmente. Reproducido con modificaciones con el permiso de Abbott Vascular®.
La complejidad anatómica de la VM hace necesario el uso de diferentes planos para construir un sistema de estudio con ETE bidimensional que incluya cuatro planos medioesofágicos y un plano transgástrico49. Sin embargo, desde una perspectiva 3D, y gracias a la experiencia generada por los implantes de MitraClip®, se puede redefinir este sistema.
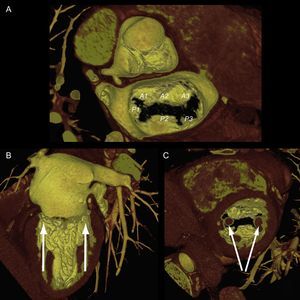
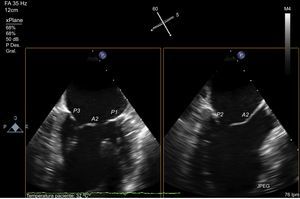
Como se ha relatado previamente, cuando los patólogos comenzaron a describir la VM, uno de los problemas que se encontraron fue el de definir los velos, ya que en realidad se trata de una estructura continua insertada en el anillo, separada por indentaciones22. El marcador anatómico que definieron para separar el velo aórtico del mural fue las comisuras, que a su vez identificaron por la inserción de un tipo específico de CT (las cuerdas comisurales) alineadas con los MP23. Es decir, que los MP apuntan a las comisuras (figura 4), y esta referencia marca el eje largo de la válvula, el plano intercomisural mitral. Siguiendo la nomenclatura de Carpentier24, este plano en ecocardiografía muestra tres festones de la válvula, de medial a lateral, P3-A2-P1. El plano ortogonal al intercomisural (añadiendo 90° de rotación de motor), cuando está centrado en A2-P2, corta característicamente el tracto de salida del VI y se conoce como tracto de salida del VI (TSVI). Con ligeras rotaciones manuales de la sonda hacia una y otra comisura, se puede cortar los festones A3-P3 y A1-P1.
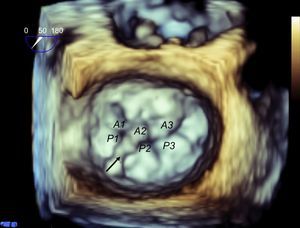
Complejo valvular mitral en tomografía computarizada cardiaca. Reconstrucción tridimensional en renderización de volumen que muestra una válvula mitral desde una visión quirúrgica y sus diferentes segmentos según Carpentier (A). Las vistas longitudinal (B) y transversal (C) del ventrículo muestran la alineación de los músculos papilares hacia las áreas comisurales.
El desarrollo matricial de las sondas de ecografía permite visualizar simultáneamente dos planos ortogonales. Partiendo del plano intercomisural, un plano ortogonal por el centro obtiene A2-P2 (figura 5). Si se lateraliza el plano ortogonal hacia los segmentos laterales, se obtiene A1-P1, y si se mueve el plano ortogonal hacia los segmentos mediales, A3-P3. Finalmente y para completar el análisis, es necesario visualizar la válvula en 3D (figura 6). Esto permite definir mejor todos los festones y las indentaciones de la válvula.
Análisis valvular mitral con ecocardiografía transesofágica. Imagen de ecocardiografía transesofágica multiplanar que visualiza simultáneamente dos planos ortogonales. Obsérvese la vista intercomisural a la izquierda, identificada por la visualización de tres segmentos valvulares independientes (P3-A2-P1) y por la cabeza de los músculos papilares. Una vez identificado el eje largo de la válvula, en el plano ortogonal a 90° se halla la vista en tres cámaras, completamente coaxial a la línea de coaptación central (A2-P2). Se obtiene el mismo plano ortogonal rotando el plano a 150°.
Este sistema de estudio con tres planos de ecocardiografía (intecomisural, TSVI y 3D) permite definir con exactitud la anatomía funcional y la localización de la regurgitación.
Selección de pacientesLos primeros criterios anatómicos de la VM para seleccionar a los pacientes candidatos a la reparación con MitraClip® se establecieron en los estudios EVEREST48,50,51 (figura 7). Tras demostrar la seguridad y los resultados en una primera fase48,50, se llevó a cabo el estudio pivotal de la técnica, el EVEREST II. En él se aleatorizó a 279 pacientes con IM candidatos a cirugía en dos grupos con asignación 2:1 a percutánea o quirúrgica. El perfil clínico de los pacientes tratados percutáneamente fue el de un varón (62%) de 67 años con antecedentes de cardiopatía isquémica (el 47%, el 22% de ellos con infarto de miocardio previo), afectado de IM degenerativa (73%) de grado III-IV, sintomática (el 91% con insuficiencia cardiaca, el 34% con fibrilación auricular) y en clase funcional de la New York Heart Association (NYHA) II (40%) o III (45%) que mantenían una fracción de eyección del VI del 60%51. Este perfil clínico ha evolucionado en la práctica real16,52–55 hacia el tratamiento de pacientes no quirúrgicos, más añosos (71 años), con IM funcional (70%) en NYHA III-IV (90%) y fracción de eyección del 34%, que alcanzan, a los 9 meses de seguimiento, NYHA I-II (el 78% de los pacientes), con IM de grado I-II (89%) y mortalidad del 15%56 en el periodo de seguimiento.
Criterios anatómicos de reparabilidad clave. A: criterios anatómicos de reparabilidad en una insuficiencia mitral funcional; la profundidad de coaptación es la medida desde la altura del anillo al borde de los velos (a) y debe ser < 10 mm; la longitud de coaptación es la superficie de contacto entre ambos velos (b). B y C: criterios anatómicos de reparabilidad clave en insuficiencias mitrales degenerativas por prolapso o flail desde una reconstrucción tridimensional (B) y en un plano de tracto de salida del ventrículo izquierdo (C); la anchura del flail (c) debe ser < 15 mm y la altura (d), < 10 mm.
Los criterios ecocardiográficos también han evolucionado. La elevada seguridad del procedimiento y el perfil de los pacientes tratados con alto riesgo quirúrgico y sin otras opciones terapéuticas han extendido los criterios de elegibilidad para la reparación con este dispositivo, aparentemente sin penalizar los resultados de seguridad el éxito del procedimiento57,58. Los criterios propuestos actualmente con base en la experiencia acumulada son los publicados por Boekstegers et al59 y se recogen en la tabla 2. Identifican tres categorías de morfología valvular a reparar; una morfología óptima para los centros que empiezan con el dispositivo y que agrupa los criterios EVEREST, una morfología valvular posible reservada para centros con experiencia y una morfología valvular difícil o imposible.
Criterios anatómicos ampliados para MitraClip®
| Morfología valvular óptima | Morfología valvular posible | Morfología valvular difícil o imposible |
|---|---|---|
| Enfermedad central en segmento 2 | Enfermedad en segmentos 1 o 3 | Válvula mitral perforada o cleft |
| Ausencia de calcificación valvular | Ligera calcificación fuera de la zona de grasping, calcificación del anillo, tras anuloplastia | Calcificación importante en la zona de grasping |
| Área valvular mitral > 4 cm2 | Área valvular mitral > 3 cm2 con buena movilidad residual | Estenosis mitral hemodinámicamente significativa (AVM < 3 cm2 y gradiente medio ≥ 5 mmHg |
| Velo posterior móvil ≥ 10 mm | Velo posterior móvil de 7–10 mm | Velo posterior móvil < 7 mm |
| Profundidad de coaptación < 11 mm | Profundidad de coaptación ≥ 11 mm | |
| Velo de grosor y movilidad normales | Restricción sistólica de la movilidad (tipo IIIb de Carpentier) | Restricción sistodiastólica de la movilidad (tipo IIIa de Carpentier) |
| Anchura del flail < 15 mm y altura del flail < 10 mm | Anchura del flail > 15 mm en caso de dilatación del anillo y posibilidad de implantar múltiples clips | Síndrome de Barlow con flail multisegmentario |
AVM: área valvular mitral.
La ecocardiografía es imprescindible para guiar el implante de MitraClip® y actualmente es el procedimiento intervencionista más dependiente de una técnica no fluoroscópica. El sistema del implante se resume en los siguientes pasos.
Punción transeptalEs un punto clave del procedimiento y la fuente de la mayoría de las complicaciones. El sistema de catéteres triaxial permite movimientos en las tres direcciones del espacio y la punción transeptal (TS) es el eje a partir del cual todos estos movimientos van a realizarse. Cuando la punción TS está alineada con la línea central de coaptación mitral (A2-P2), se consiguen movimientos más puros sobre los ejes de la válvula (lateral-medial y anterior-posterior). La distancia desde la TS al punto de coaptación de los velos debe ser > 40 mm para permitir las maniobras en la aurícula, con una distancia ideal alrededor de 45 mm para que el catéter liberador llegue al VI.
La punción óptima se consigue habitualmente en la zona posterior de la fosa oval. Para superar esta primera etapa, es imprescindible utilizar un lenguaje común con el hemodinamista:
- •
Se describe como superior-inferior el sentido en el plano bicavo (90-120°) y es el movimiento de avance y retroceso de la aguja de TS. Superior cuando se desplaza hacia la vena cava superior o craneal e inferior cuando lo hace en sentido caudal.
- •
Se describe como anterior-posterior el sentido en el plano de grandes vasos (25-45°). Es un movimiento de rotación de la aguja de TS y el marcador por fluoroscopia suele ser un catéter pigtail en la aorta. Anterior cuando se desplaza hacia la aorta y posterior cuando se aleja de ella hacia la pared posterior de la aurícula.
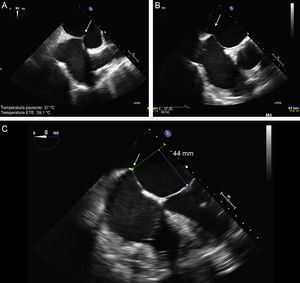
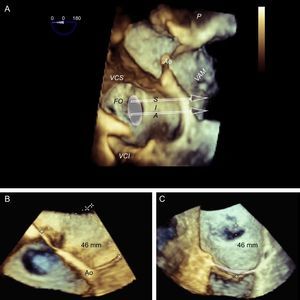
El protocolo en la guía del TS incluye tres vistas de ETE: dos de posicionamiento (bicava y de eje corto) y una de confirmación de altura (de cuatro cámaras a 0°). La recomendación habitual es realizar una punción en la parte más superior de la fosa oval del plano de bicava y en la zona medioposterior del plano de grandes vasos, con una altura alrededor de los 45 mm (figura 8).
Punción transeptal guiada con ecocardiografía transesofágica bidimensional. A: plano en bicava y punción en el centro de la fosa oval (flecha). B: plano en eje corto de grandes vasos con una punción posterior (flecha), alejada de la aorta. C: plano de cuatro cámaras para medir la altura desde la punción a la línea de coaptación valvular, que debe hallarse a unos 45 mm.
Se tiende a pensar que el movimiento superior-inferior se traduce proporcionalmente a la altura de punción, es decir, que si en un punto concreto el TS está a 50 mm, bajando 5 mm en el plano de bicava el TS quedará a 45 mm. Pero para que ello ocurriera, el corazón debería estar completamente vertical. Y lo habitual es que el corazón, y más cuando hay dilatación auricular, se encuentre en posición horizontal (figura 9). Por ello puede ser difícil encontrar el punto de punción y que los movimientos craneocaudales no se traduzcan en cambios significativos en la altura. En estos casos la ETE 3D ayuda a entender el comportamiento del catéter y puede definir con mayor precisión el sitio de punción (figura 10).
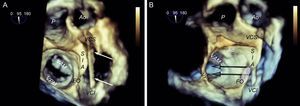
Comportamiento del catéter de punción transeptal en corazones horizontalizados. A: relación de las estructuras con el catéter de punción (flechas); en la posición craneal del septo interauricular, el catéter está situado en la región anterior, mientras que en la posición más caudal, el catéter está situado en la región posterior. B: la misma imagen tridimensional, ligeramente ladeada para apreciar mejor la relación de la fosa oval con la línea de coaptación mitral; obsérvese que el trayecto craneocaudal del catéter tiene poca repercusión en la altura de punción (flechas), que depende más de la posición anterior-posterior; cuando el catéter gira acercándose a la aorta, la punción es más baja, y cuando se aleja, es más alta. Ao: aorta; FO: fosa oval; SIA: septo interauricular; VAM: valva anterior mitral; VCI: vena cava inferior; VCS: vena cava superior; VPM: valva posterior mitral.
Planificación tridimensional de la punción transeptal. Imagen de ecocardiografía transesofágica tridimensional desde una vista ventricular (A), en la que se puede observar la posición horizontal del corazón y cómo los movimientos craneocaudales del catéter no reflejan cambios significativos de la altura de la punción en la línea de coaptación mitral (flechas); por este motivo la punción en la visión en bicava se puede hacer en el centro sin que ello repercuta en la altura. B: vista de cuatro cámaras en tres dimensiones; la punción en la zona más posterior de la fosa (alejada de la aorta) tiene una altura alrededor de los 45 mm. C: vista tridimensional modificada con el septo interauricular de cara, alineando el anillo mitral al plano Z; este movimiento de alineación del anillo al plano Z permite tomar mediciones más exactas, calculando una altura desde la parte posterior de la fosa a la línea de coaptación de 46 mm. Combinando la información de los tres paneles, se puede planificar una punción en el centro de la fosa oval en el plano en bicava y posterior en el plano de grandes vasos, ligeramente diferente de la punción superior y posterior que se recomienda habitualmente. Ao: aorta; FO: fosa oval; SIA: septo interauricular; VAM: valva mitral anterior; VCI: vena cava inferior; VCS: vena cava superior.
Una vez realizado el TS, lo habitual es realizar el intercambio de catéteres a través de una guía Amplatz®extra stiff en la vena pulmonar superior izquierda, guiado por fluoroscopia y ecografía. El catéter guía deflectable se introduce con un dilatador, que se reconoce por su forma cónica y sus marcas ecogénicas. A continuación se retira el dilatador junto con la guía y queda el catéter guía en la aurícula izquierda. Este se reconoce fácilmente por dos líneas ecogénicas circunferenciales en su punta (figura 11). Después se introduce el CDS a través del catéter guía con monitorización ecográfica y evitando lesionar la pared auricular. Diferentes movimientos combinados del catéter guía deflectable y el CDS son necesarios para dirigir la punta del clip al centro de la VM y en dirección al ápex ventricular. Para la monitorización ecocardiográfica, habitualmente se utiliza una vista en dos planos ortogonales, intercomisural y del TSVI, observando la trayectoria del clip.
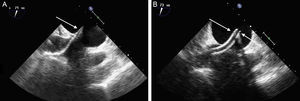
Monitorización del acceso transeptal. A: imagen de ecocardiografía transesofágica que muestra el paso del dilatador a nivel del septo interauricular con las marcas ecogénicas en la punta (flecha). B: imagen del catéter guía una vez retirado el dilatador, con las marcas que limitan su punta (flechas).
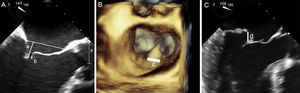
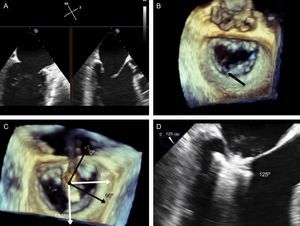
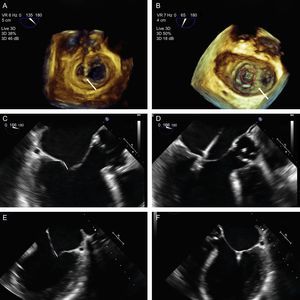
El siguiente paso es alinear los brazos del clip con la línea de coaptación valvular mediante giros en sentido horario y antihorario hasta alcanzar la coaxialidad buscada. Se usa la ETE 3D posicionando la VM en visión quirúrgica, con la aorta a las 12:00 y la orejuela a las 9:00 del cuadrante (figura 12).
Plano de implante. La geometría de esta válvula mitral presenta el plano intercomisural a 60° (A), por lo que el plano de tracto de salida del ventrículo izquierdo está a 150°. Sin embargo, debido a la marcada indentación que separa P1 de P2 (B, flecha), el plano de implante está ligeramente angulado. Para localizar el plano de implante, primero hay que confirmar con ecocardiografía transesofágica tridimensional la coaxialidad con la zona que se va a tratar (C), y seguidamente buscar con movimientos de motor el plano bidimensional donde se visualizen mejor los dos brazos del clip abiertos (D).
Tras comprobar la perpendicularidad del CDS y la coaxialidad del clip, se procede a avanzarlo al VI. Estos pasos previos son de vital importancia para minimizar los movimientos del clip dentro del VI y evitar complicaciones con las CT. El avance del CDS, cuando se trata de un primer clip, se realiza con el dispositivo abierto y orientado, habitualmente, al centro de la regurgitación. Se monitorizan estos pasos con planos ortogonales simultáneos intercomisural y del TSVI. Es importante seleccionar correctamente el plano de ecocardiografía para monitorizar el implante, de modo parecido a la proyección óptima de la fluoroscopia en los implantes percutáneos de prótesis aórticas60. Para ello hay que buscar el plano en cada paciente. Cuando el implante del clip está planeado en A2-P2, la búsqueda de un buen plano intercomisural permite definir el plano de implante sumando 90° al intercomisural. Cuando el clip no está planeado en el centro de A2-P2, una vez confirmada con ETE 3D la coaxialidad del sistema con la válvula, hay que buscar con el motor de la sonda transesofágica el plano, alrededor del TSVI, que mejor visualiza el clip en toda su extensión (figura 12).
Una vez en el ventrículo, la máxima preocupación es la captura o grasping de los velos, monitorizados con una vista ampliada del plano de implante. El grasping se realiza retirando el clip con los brazos abiertos y maniobrando el catéter para conseguir que los velos reposen en estos brazos (figura 12). Una vez alcanzado, se bajan las grippers, se cierra el clip y se valora el resultado.
Valoración del resultadoLa valoración del grasping es un aspecto clave que depende completamente de la ecocardiografía. Analiza tres aspectos: la reducción del grado de regurgitación, el grado de estenosis generada y la anatomía del grasping.
Se debe evaluar el grado de regurgitación residual en las condiciones hemodinámicas (presión arterial, apoyo vasoactivo) y técnicas (parámetros del ecógrafo) más parecidas a las de la evaluación basal de la regurgitación, en la sala de hemodinámica y con anestesia general. De acuerdo con las guías desarrolladas por las sociedades europeas y americanas de ecocardiografía, varios son los parámetros que gradúan la gravedad de la IM3,61. No es el objetivo de este texto realizar un análisis exhaustivo de la gradación de la IM, aunque sí se comentan las limitaciones de algunos métodos de valoración tras el MitraClip®. No hay consenso sobre cómo evaluar la IM residual tras la formación de un doble o triple orificio valvular62. Aunque el análisis en un laboratorio central de ecocardiografía mostró cambios significativos en el volumen regurgitante, la valoración por Doppler color y por flujo en venas pulmonares63, un trabajo reciente ha mostrado baja concordancia interobservadores y sobrestimación de la gradación de la IM residual por ecocardiografía respecto a la cardio-RM64.
Así pues, se debe realizar un abordaje multiparamétrico, similar al realizado en las válvulas nativas3,61, teniendo en cuenta algunas consideraciones:
- •
La valoración por área de color cuando hay múltiples jets sobrestima el grado de regurgitación65.
- •
La velocidad de la onda E se incrementa a medida que lo hace el grado de estenosis valvular3,61,66.
- •
La cuantificación por el método Proximal Isovelocity Surface Area (PISA) no está validado cuando hay más de un orificio regurgitante67.
- •
La medida sumatoria de venas contractas no está validada cuando hay más de un orificio regurgitante.
- •
Una reducción «significativa» del grado de IM refleja un cambio hemodinámico instantáneo, valorable eliminando la onda sistólica invertida en las venas pulmonares, normalizando la presión auricular izquierda, aumentando el gasto cardiaco y la presión arterial sistólica y reduciendo las resistencias vasculares68.
La estenosis valvular significativa —definida como un área < 1,5 cm2— es excepcional cuando se implantan 1-2 clips, sin evidencia de progresión a los 4 años de seguimiento48,69. Una valoración en la sala de hemodinámica mediante el gradiente medio es la alternativa más rápida y factible, con un punto de corte de 5 mmHg como predictor de gradientes elevados al alta70.
Tras conseguir una satisfactoria reducción de la IM con el grasping, es necesario aplicar un protocolo de evaluación de la anatomía del tejido alrededor del clip para reducir la potencial desinserción del dispositivo44,71. Este protocolo incluye la movilidad del velo anterior y la cantidad de velo introducido en un plano a 0°, la movilidad del velo posterior y la cantidad de velo introducido en el plano de implante (habitualmente el TSVI) y la amplitud de ambos velos introducida en una imagen 3D (figura 13):
- •
En los planos a 0° y en el TSVI, se debe observar una restricción del movimiento de los velos anterior y posterior respectivamente. Con pequeños movimientos de rotación manual de la sonda, es posible medir la longitud de velo introducida, que puede llegar a ser de hasta 7 mm; se recomienda una cantidad de velo ≥ 5 mm.
- •
En la imagen 3D se observa la amplitud del tejido insertado y la formación de dos pirámides cuyo vértice debe ser al menos de la amplitud del clip, 5 mm. En los grasping con amplia cantidad de tejido capturado, los vértices de las pirámides tienen mayor amplitud que el propio clip, probablemente por la tensión generada.
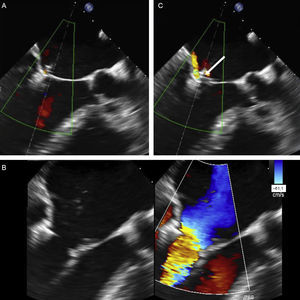
Anatomía del grasping. La amplitud del grasping se analiza con ecocardiografía transesofágica tridimensional de la válvula mitral. A: amplitud de inserción del velo posterior menor que la del clip (flecha), con una imagen del vértice de la «pirámide» estrecha. B: el clip se ha soltado del velo posterior (asterisco) y se ha implantado un nuevo clip medial al primero; obsérvese la amplitud del vértice de la «pirámide» con el nuevo clip (flecha) en comparación con el clip anterior. C-E: longitud de los velos posterior (C y D) y anterior (E y F) capturados por el clip; se obtienen a partir de pequeños movimientos de barrido de la sonda alrededor del clip.
Si el resultado conseguido es satisfactorio, se procede a la liberación del dispositivo. En caso contrario, se puede reposicionar. Este paso se debe monitorizar para detectar complicaciones. La más frecuente (aunque no reportada en los trabajos) es el aumento del grado de regurgitación. La liberación del clip elimina el soporte que ofrecía el CDS y la tensión acumulada. Esto cambia la relación del dispositivo con el tejido valvular adyacente e incrementa los jets regurgitantes de ambos lados del clip (las nuevas comisuras generadas).
Una complicación temida, aunque infrecuente, es la desinserción (detachment) de uno de los velos (figura 14). No se ha descrito la embolización completa del dispositivo. El protocolo de análisis del implante ha reducido su incidencia desde el 14,3%47 en experimentación animal y el 4,8%52 al inicio de la experiencia clínica hasta el actual 1,9%53.
Desinserción aguda del velo anterior. A: aparentemente hay buen grasping de ambos velos y reducción de su movimiento. B: sin embargo, tras la liberación del clip se observa desinserción aguda del velo anterior. C: analizando el grasping con detalle, se observa una estructura que se mueve por encima del clip (flecha) y un chorro regurgitante que se origina a ese nivel. El implante previo de un primer clip dificultó el análisis del grasping de este segundo dispositivo.
Varios factores están favoreciendo el uso de la cardio-TC en la planificación de la reparación percutánea de la IM con la mirada puesta en la prótesis mitral transcatéter. Hay significativas diferencias en la planificación del implante transcatéter de una prótesis entre la posición mitral y la aórtica: la mitral está poco calcificada, tiene un anillo de mayor tamaño con una morfología 3D en silla de montar, un complejo aparato subvalvular y una cámara de salida del VI que se debe preservar (figura 15). Esta compleja anatomía prioriza el uso de técnicas de imagen 3D para su estudio72, y actualmente la cardio-TC es la técnica con mayor resolución espacial 3D.
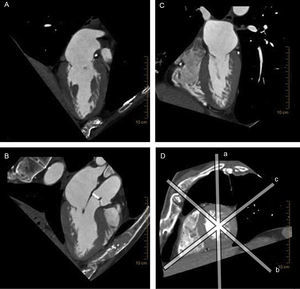
Reconstrucción multiplanar en tomografía computarizada cardiaca. Obsérvese la excelente resolución espacial en los tres planos del espacio que permite un análisis minucioso de todo el complejo valvular mitral. A: plano longitudinal vertical del corazón. B: plano de tres cámaras con el tracto de salida del ventrículo izquierdo. C: plano longitudinal horizontal del corazón. D: eje corto del corazón y los cortes por donde pasan los otros tres planos (a-c).
Las aportaciones de la cardio-TC en la planificación de la prótesis mitral transcatéter dependen del lugar de anclaje de esta. En el caso de la Fortis® (Edwards Lifesciences; Irvine, California, Estados Unidos), que tiene un acceso transapical y se ancla directamente en los velos anterior y posterior, la tomografía computarizada ha complementado el estudio con ecocardiografía en la valoración del anillo y los velos y ha sido imprescindible para valorar el aparato subvalvular. Una anatomía subvalvular desfavorable para el avance y el anclaje de la prótesis puede ser la ramificación irregular o fusión de MP y la presencia de CT struts elongadas o que se extiendan más allá de la zona rugosa de los velos73,74. La prótesis mitral transapical Tiara® (Neovasc Inc.; Richmond, Canadá) se apoya en la superficie auricular del anillo mitral y se ancla a la cara ventricular a nivel de los trígonos y el anillo posterior (figura 16). En su implante se ha utilizado la cardio-TC para una medición del anillo más precisa y para la planificación de las proyecciones óptimas en fluoroscopia41,75,76.
Renderización de volumen tridimensional en tomografía computarizada cardiaca. Obsérvese la relación de las estructuras anatómicas alrededor del esqueleto fibroso con vistas a la planificación de procedimientos de implante valvular percutáneo. Ao: aorta; D: trígono derecho; I: trígono izquierdo; Mi: válvula mitral; Tr: válvula tricúspide.
La revisión publicada por Blanke et al77 tiene el objetivo de unificar los términos que empiezan a aparecer sobre la geometría del complejo valvular mitral, a la vez que valora las diferentes modalidades de imagen en la planificación, el implante y el seguimiento de la prótesis mitral transcatéter.
La reparación percutánea de la IM con anuloplastia indirecta a través del seno coronario con el sistema Carillon® ha utilizado también la cardio-TC en su planificación. Una de las complicaciones que impiden el implante del dispositivo es la compresión coronaria de la arteria circunfleja. A pesar de la excelente resolución espacial de la técnica para analizar la anatomía cardiaca venosa78 y sus estructuras adyacentes, el conocimiento previo de esta información no cambió el éxito del implante en el ensayo AMADEUS79.
CONCLUSIONESLa reparación percutánea de la IM nativa es una terapia emergente con gran dependencia de las técnicas de imagen más allá de la fluoroscopia. Actualmente la principal modalidad para selección y guía de estos procedimientos es la ETE 3D. La complejidad técnica de las reparaciones hace necesaria una formación específica en este campo, tanto del cardiólogo intervencionista como del especialista en imagen cardiaca, y se requiere además una formación complementaria en técnicas de imagen cardiaca avanzadas como la cardio-TC y la cardio-RM.
De manera similar a lo ocurrido en el tratamiento transcatéter de la válvula aórtica, la cardio-TC aporta exactitud, reproducibilidad y un amplio campo de visión que permite un análisis 3D del corazón y las estructuras adyacentes. Con el foco puesto en la compleja anatomía de la VM, la cardio-TC sin duda aporta información complementaria al reducido campo de visión de la ecografía y puede ser clave para planificar y guiar algunos de estos procedimientos.
La cardio-RM tiene su potencial en la ausencia de radiación ionizante y su versatilidad para un estudio completo de anatomía, función, flujos cardiacos y caracterización tisular. Las mejoras en la disponibilidad de la técnica (incluida la reducción de los tiempos de adquisición) y en el incremento de su resolución espacial serán clave para incrementar su protagonismo.
CONFLICTO DE INTERESESC.H. Li y D. Arzamendi son asesores de Abbott y han recibido ayudas no condicionadas para la realización de distintos proyectos de investigación.
Se agradece al Prof. Alfonso Rodríguez Baeza, Catedrático del Departamento de Ciencias Morfológicas de la Facultad de Medicina de la Universitat Autònoma de Barcelona (UAB), por atendernos y facilitar las imágenes de anatomía publicadas en este artículo. A Jorge Carbajo y María Perez de Abbott Vascular®, por ayudarnos y asesorarnos en los aspectos técnicos. Y el agradecimiento más especial es a Nuria López y Martina Li, por su paciencia y comprensión.