La hipertensión arterial (HTA) está muy presente en la insuficiencia cardiaca (IC). Sin embargo, su prevalencia, su variación circadiana y la relación con los fenotipos de IC es poco conocida. Nuestro objetivo es describir esta prevalencia y sus patrones en la IC.
MétodosEstudio observacional y transversal sobre la IC crónica estable optimizada. Se obtuvo la presión arterial (PA) en consulta y monitorización ambulatoria durante 24 h. Se estimó la prevalencia de HTA, sus patrones diurnos (controlada, no controlada, de bata blanca y enmascarada) y nocturnos (dipper, nondipper y reverse dipper). Se analizaron factores asociados con patrones y fenotipos de IC.
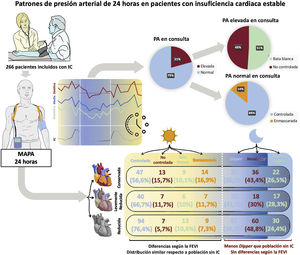
ResultadosEntre 2017 y 2021, se incluyó a 266 pacientes con una media de edad de 72±12 años; el 67% eran varones y el 46% tenían IC con FEVI reducida. El 83% tenía HTA: el 68% controlada, el 10% no controlada, el 10% de bata blanca y el 11% enmascarada. El 51% de los pacientes con PA elevada en consulta resultaron en HTA de bata blanca. El 14% de los pacientes con PA normal en consulta tenían HTA enmascarada. Las prevalencias de dipper, nondipper y reverse dipper fueron del 31, el 43 y el 26% respectivamente. La PA sistólica fue menor en la IC con FEVI reducida que en la IC con FEVI conservada (p <0,001).
ConclusionesLa monitorización ambulatoria de la PA en IC identificó HTA de bata blanca en más de la mitad de los pacientes con PA elevada en consulta y un porcentaje relevante de HTA enmascarada. La distribución de patrones diurnos fue similar a la de la población sin IC descrita. Sin embargo, la mayoría tuvo un patrón nocturno patológico.
Palabras clave
La hipertensión arterial (HTA) es el factor de riesgo con mayor impacto en la aparición de enfermedades cardiovasculares1,2. En la insuficiencia cardiaca (IC), la HTA es un factor de riesgo establecido, con un papel determinante en la aparición del síndrome clínico, tanto en la disfunción diastólica (se atribuye el 50% de los casos de IC en pacientes hipertensos) como en la sistólica3.
La prevalencia de HTA en los pacientes que sufren IC se estima en torno al 90%3, con un incremento progresivo del riesgo de IC conforme aumentan las cifras de presión arterial (PA) sistólica y diastólica por encima de 120 y 80mmHg respectivamente4,5.
Las mediciones aisladas de PA braquial obtenidas en consulta tienen un papel pronóstico limitado en pacientes hipertensos6. Sin embargo, los valores obtenidos mediante la monitorización ambulatoria de la presión arterial (MAPA) aportan cifras más ajustadas a la realidad y se relacionan mejor con la presencia de daño en órgano diana7, eventos cardiovasculares y mortalidad8–11. Además, la MAPA aporta información sobre el comportamiento nocturno de la PA y permite identificar la presencia de patrones específicos, como la HTA de bata blanca y enmascarada, esta última de reconocido valor pronóstico en población con HTA10,12.
En la IC se producen una serie de cambios neurohormonales que, asociados al tratamiento recomendado para esta enfermedad, producen modificaciones tanto en la PA como en la frecuencia cardiaca13,14. La información disponible sobre las cifras de PA en consulta, su relación con la MAPA y la dinámica nocturna en esta población es escasa. Por este motivo, nuestro objetivo es realizar un estudio descriptivo sobre la prevalencia y los factores asociados con los diferentes fenotipos de HTA diurna (controlada, no controlada, enmascarada y de bata blanca) y los patrones nocturnos (dipper, nondipper y reverse dipper) en una población amplia de pacientes con IC, así como estudiar su asociación con los diferentes fenotipos de IC según la fracción de eyección del ventrículo izquierdo (FEVI).
MÉTODOSEstudio observacional y transversal con recogida de datos prospectiva, realizado entre 2017 y 2021 en 2 hospitales universitarios españoles con unidades de IC. El estudio fue aprobado por el Comité de Ética de la Investigación con medicamentos (CEIm) del Hospital Universitario 12 de Octubre, con número 17/225. Se obtuvieron y archivaron todos los consentimientos informados de los pacientes participantes en el estudio.
Población del estudioSe incluyó a pacientes consecutivos con IC estable (más de 1 mes sin descompensaciones, empeoramiento clínico o cambios en el tratamiento) y cuando su médico consideraba que el tratamiento estaba optimizado según la definición de las guías de práctica clínica14. Atendiendo a la FEVI, estimada mediante el método de Simpson biplano, se clasificaron como: IC con FEVI reducida (IC-FEr) si esta era ≤ 40%, ligeramente reducida (IC-FElr) si 41-49% y conservada (IC-FEc) si ≥ 50%. Se tomó como referencia la FEVI más reciente al momento del estudio, siempre dentro del año previo. Se excluyó a los pacientes menores de 18 años, a aquellos cuya condición clínica hubiera variado en el mes previo o que precisaran ajustes de medicación con efecto hipotensor en la consulta, rechazaran participar en el estudio o no firmaran el consentimiento informado. Se consideraron como «otros antihipertensivos» o «antihipertensivos adicionales» los fármacos usados para el control de la PA pero sin indicación para la IC.
Medición de la presión arterialLa PA en consulta se obtuvo mediante un aparato oscilométrico semiautomático validado (OMRON M6 Comfort), en sedestación y tras 5 min en reposo, y el valor considerado fue la media de 2 mediciones separadas 2 min. Se utilizó principalmente un manguito de diámetro estándar (25-35cm en consulta y 24-32cm en MAPA), aunque puntualmente se precisó uno mayor o menor para pacientes de mayor o menor tamaño. En caso de una diferencia significativa (> 10mmHg) entre las determinaciones, se obtuvo una tercera y se descartó la discordante. En el primer mes de inclusión, el paciente se realizó una MAPA de 24 h con un aparato oscilométrico automático validado para MAPA (Mobil-O-Graph y Spacelabs). El manguito se colocó en el brazo no dominante y se realizaron mediciones de PA cada 15-20 min durante el día y cada 20-30min durante la noche. Los periodos diurnos y nocturnos se acotaron en función de la información comunicada por el paciente. Se consideraron para el análisis los registros que obtuvieron al menos un 70% de mediciones válidas.
Definiciones de patrones de presión arterialCon base en los resultados de la MAPA, se obtuvieron las siguientes variables: PA sistólica (PAS) media de 24 h, PA diastólica (PAD) media de 24 h, PAS media diurna, PAD media diurna, PAS media nocturna y PAD media nocturna.
Se clasificó a los pacientes en los siguientes grupos según los valores de PA en consulta y los resultados de la MAPA:
- •
HTA controlada (o sin HTA si no tenía diagnóstico previo): PAS <140mmHg y PAD <90mmHg en consulta con PAS media de 24 h <130mmHg y PAD media de 24 h <80mmHg en la MAPA.
- •
HTA no controlada (o nuevo diagnóstico de HTA): PAS ≥ 140mmHg y/o PAD ≥ 90mmHg en consulta con PAS media de 24 h ≥ 130mmHg y/o PAD media de 24 h ≥ 80mmHg en la MAPA.
- •
HTA de bata blanca (o efecto de bata blanca en pacientes previamente diagnosticados de HTA): PAS ≥ 140mmHg y/o PAD ≥ 90mmHg en consulta con PAS media de 24 h <130mmHg y PAD media de 24 h <80mmHg en la MAPA.
- •
HTA enmascarada (o HTA enmascarada no controlada en pacientes previamente diagnosticados de HTA): PAS <140mmHg y PAD <90mmHg en consulta con PAS media de 24 h ≥ 130mmHg y/o PAD media de 24 h ≥ 80mmHg en la MAPA.
Patrones nocturnos de la MAPA:
- •
Dipper: descenso de la PAS media ≥ 10% por la noche respecto al día.
- •
Extreme dipper: descenso de la PAS media ≥ 20% por la noche respecto al día.
- •
Nondipper: descenso de la PAS media 0-10% por la noche respecto al día.
- •
Riser (o reverse dipper): aumento de la PAS media por la noche respecto al día.
Dado que la mayor parte de nuestra población (79%) había sido diagnosticada de HTA antes del estudio y en aras de facilitar el análisis y la exposición de los datos, se decidió agrupar a los pacientes con patrones análogos de PA en la MAPA: sin HTA con HTA controlada, HTA de nuevo diagnóstico con HTA no controlada, HTA de bata blanca con efecto de bata blanca y HTA enmascarada con HTA no controlada enmascarada. Nos referiremos a cada uno de los grupos por la nomenclatura de la HTA. De igual manera, debido al bajo número de pacientes con patrón nocturno extreme dipper, estos se agruparon con el dipper.
Para el cálculo de la prevalencia total de HTA en nuestra población se consideraron todas las formas de HTA. Únicamente se excluyó del numerador a los pacientes sin antecedentes de HTA y cuyas PA en consulta y MAPA estaban en el intervalo normal.
Análisis estadísticoLas variables cuantitativas se expresan como media±desviación estándar o mediana [intervalo intercuartílico] y las cualitativas, como frecuencia absoluta y relativa. Se utilizó el test de la χ2 o el exacto de Fisher para comparar las variables cualitativas y ANOVA o test de Kruskal-Wallis y las pruebas de la t de Student o de la U de Mann-Whitney, cuando fuese apropiado, para comparar variables cuantitativas. Las características basales se compararon entre los diferentes patrones de HTA. La normalidad de la distribución se evaluó mediante la prueba de Kolmogorov-Smirnov.
Se realizó un análisis multivariante de regresión logística para evaluar los factores asociados con los diferentes patrones de HTA de interés (HTA de bata blanca, enmascarada y reverse dipper), y se reportaron como odds ratio (OR) con su intervalo de confianza del 95% (IC95%). En el modelo inicial se incluyeron las variables con una asociación univariable con un valor de p <0,1. Se eliminaron variables del modelo inicial con el método de pasos hacia atrás (backward elimination method) con un punto de corte en p <0,05. Los datos se analizaron con el paquete estadístico STATA versión 15.0 (Stata Corp., Estados Unidos).
RESULTADOSPoblación totalDesde agosto de 2017 hasta febrero de 2021, se incluyó a 360 pacientes, de los que finalmente se analizó para este estudio a 266 (). Las características basales se muestran en la tabla 1. La media de edad fue 71,8±12 años, 177 (66,5%) eran varones y 210 (79%) tenían diagnóstico previo de HTA. Durante el estudio se diagnosticó a 10 pacientes (3,8%) hipertensos más, con una prevalencia total de HTA del 82,7%. De los 266 de pacientes, 123 (46,2%) presentaban IC-FEr; 60 (22,6%), IC-FElr y 83 (31,2%), IC-FEc.
Características basales en relación con los fenotipos de presión arterial
| Factor (n) | Total (n=266) | HTA controlada (n=181) | HTA no controlada (n=27) | p | HTA bata blanca (n=28) | p | HTA enmascarada (n=30) | p | p grupos |
|---|---|---|---|---|---|---|---|---|---|
| Edad (años) | 71,8±12,0 | 71,1±11,8 | 71,0±11,2 | 0,95 | 75,9±11,6 | 0,048 | 72,5±13,9 | 0,55 | 0,26 |
| Varones | 177 (66,5) | 130 (71,8) | 13 (48,1) | 0,013 | 13 (46,4) | 0,007 | 21 (70,0) | 0,84 | 0,01 |
| IMC | 27,8±4,6 | 27,6±4,5 | 28,0±5,1 | 0,68 | 28,4±4,6 | 0,34 | 28,3±5,0 | 0,42 | 0,72 |
| HTA | 210 (79,0) | 135 (74,6) | 26 (96,3) | 0,012 | 21 (75,0) | 0,96 | 28 (93,3) | 0,023 | 0,01 |
| DM | 97 (36,5) | 56 (30,9) | 14 (51,9) | 0,032 | 11 (39,3) | 0,38 | 16 (53,3) | 0,017 | 0,03 |
| DL | 157 (59,0) | 100 (55,2) | 19 (70,4) | 0,14 | 15 (53,6) | 0,87 | 23 (76,7) | 0,028 | 0,08 |
| Tabaquismo | 0,32 | ||||||||
| No fumador | 130 (48,9) | 84 (46,4) | 14 (51,9) | 0,74 | 19 (67,9) | 0,10 | 13 (43,3) | 0,49 | |
| Fumador | 21 (7,9) | 16 (8,8) | 3 (11,1) | 1 (3,6) | 1 (3,3) | ||||
| Exfumador | 115 (43,2) | 81 (44,8) | 10 (37,0) | 8 (28,6) | 16 (53,3) | ||||
| FA | 137 (51,5) | 101 (55,8) | 8 (29,6) | 0,011 | 14 (50,0) | 0,57 | 14 (46,7) | 0,35 | 0,08 |
| EPOC | 34 (12,8) | 19 (10,5) | 3 (11,1) | 0,92 | 4 (14,3) | 0,55 | 8 (26,7) | 0,014 | 0,10 |
| SAHS | 42 (15,8) | 26 (14,4) | 4 (14,8) | 0,95 | 5 (17,9) | 0,63 | 7 (23,3) | 0,21 | 0,64 |
| ACVA | 24 (9,02) | 18 (9,9) | 1 (3,7) | 0,29 | 1 (3,6) | 0,27 | 4 (13,3) | 0,57 | 0,42 |
| EAP | 28 (10,5) | 15 (8,3) | 5 (18,5) | 0,093 | 2 (7,1) | 0,84 | 6 (20,0) | 0,047 | 0,11 |
| NYHA | |||||||||
| Clase I | 59 (22,2) | 39 (21,5) | 3 (11,1) | 0,44 | 7 (25,0) | 0,27 | 10 (33,3) | 0,33 | 0,34 |
| Clase II | 180 (67,7) | 126 (69,6) | 21 (77,8) | 16 (57,1) | 17 (56,7) | ||||
| Clase III | 27 (10,2) | 16 (8,8) | 3 (11,1) | 5 (17,9) | 3 (10,0) | ||||
| FEVI | |||||||||
| Conservada | 83 (31,2) | 47 (26,0) | 13 (48,1) | 0,024 | 9 (32,1) | 0,78 | 14 (46,7) | 0,041 | 0,06 |
| Levemente reducida | 60 (22,6) | 40 (22,1) | 7 (25,9) | 6 (21,4) | 7 (23,3) | ||||
| Reducida | 123 (46,2) | 94 (51,9) | 7 (25,9) | 13 (46,4) | 9 (30,0) | ||||
| Ritmo | |||||||||
| Sinusal | 154 (57,9) | 98 (54,1) | 22 (81,5) | 0,015 | 20 (71,4) | 0,23 | 14 (46,7) | 0,73 | 0,06 |
| FA/aleteo | 74 (27,8) | 54 (29,8) | 5 (18,5) | 5 (17,9) | 10 (33,3) | ||||
| MCP/TRC | 38 (14,3) | 29 (16,0) | 0 | 3 (10,7) | 6 (20,0) | ||||
| Analítica | |||||||||
| Hemoglobina (g/dl) | 13,7±1,8 | 13,9±1,8 | 13,0±1,3 | 0,014 | 13,7±1,6 | 0,69 | 13,8±1,9 | 0,87 | 0,10 |
| Creatinina (mg/dl) | 1,2 [0,97-1,49] | 1,2 [1,0-1,4] | 1,1 [0,8-1,7] | 0,53 | 1,3 [1,0-1,5] | 0,59 | 1,2 [0,9-1,8] | 0,78 | 0,85 |
| TFGe (CKD-EPI) (ml/min) | 49 [36-65] | 48 [38-64] | 50 [32-88] | 0,34 | 49 [40-63] | 0,98 | 52,5 [31-78] | 0,82 | 0,80 |
| Sodio (mEq/l) | 141±3 | 141,4±2,8 | 142,7±3,1 | 0,020 | 141,6±3,1 | 0,63 | 141,1±2,3 | 0,57 | 0,09 |
| Potasio (mEq/l) | 4,6±0,5 | 4,6±0,5 | 4,7±0,6 | 0,42 | 4,8±0,5 | 0,046 | 4,5±0,7 | 0,46 | 0,18 |
| NT-proBNP (pg/ml) | 1.161 [551-2.557] | 1.204 [586-2.844] | 1.168 [405-2.152] | 0,48 | 841 [536-1.550] | 0,27 | 1.009 [466-2.114] | 0,57 | 0,64 |
| Tratamiento | |||||||||
| IECA | 80 (30,1) | 52 (28,7) | 11 (40,7) | 0,21 | 8 (28,6) | 0,99 | 9 (30,0) | 0,89 | 0,65 |
| ARA-II | 56 (21,1) | 33 (18,2) | 10 (37,0) | 0,024 | 5 (17,9) | 0,96 | 8 (26,7) | 0,28 | 0,12 |
| Sacubitrilo- valsartán | 89 (33,5) | 73 (40,3) | 3 (11,1) | 0,003 | 9 (32,1) | 0,41 | 4 (13,3) | 0,004 | 0,002 |
| Bloqueadores beta | 232 (87,2) | 162 (89,5) | 21 (77,8) | 0,081 | 25 (89,3) | 0,97 | 24 (80,0) | 0,14 | 0,21 |
| ARM | 148 (55,9) | 115 (63,9) | 9 (33,3) | 0,003 | 8 (28,6) | <0,001 | 16 (53,3) | 0,27 | <0,001 |
| Ivabradina | 24 (9,0) | 17 (9,4) | 2 (7,4) | 0,74 | 3 (10,7) | 0,82 | 2 (6,7) | 0,63 | 0,94 |
| Diuréticos | 206 (77,4) | 138 (76,2) | 21 (77,8) | 0,86 | 21 (75,0) | 0,89 | 26 (86,7) | 0,20 | 0,64 |
| Otros antihipertensivos | 46 (17,3) | 21 (11,6) | 12 (44,4) | <0,001 | 2 (7,1) | 0,48 | 11 (36,7) | <0,001 | <0,001 |
ACVA: accidente cerebrovascular agudo; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; DL: dislipemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IECA: inhibidores de la enzima de conversión de la angiotensina; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IMC: índice de masa corporal; MCP: marcapasos; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; SAHS: síndrome de apneas-hipopneas del sueño; TFGe: tasa de filtrado glomerular estimada; TRC: terapia de resincronización cardiaca.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
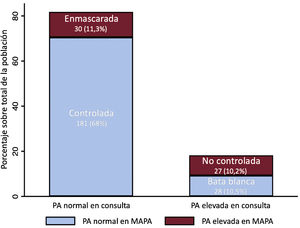
La mediana de PA en consulta fue de 120/70mmHg (105/63-133/80) y la media 120/72±20/12mmHg. Su distribución en la población se muestra en la .
Patrones diurnos de presión arterialDe los 266 pacientes incluidos, 181 (68%) tenían HTA controlada; 27 (10,2%), HTA no controlada; 28 (10,5%), HTA de bata blanca y 30 (11,3%), HTA enmascarada. Presentaron cifras elevadas de PA en la consulta 55 pacientes (20,7%), de los cuales 28 (50,9%) eran por HTA de bata blanca. De 211 pacientes (79,3%) con PA normal en consulta, 30 (14,2%) tenían HTA enmascarada (figura 1). Los pacientes con HTA no controlada fueron con mayor frecuencia mujeres, con mayor prevalencia de diabetes mellitus (DM), HTA e IC-FEc. Sin embargo, la HTA no controlada se asoció con menor uso de sacubitrilo-valsartán y antialdosterónicos, pero en cambio la toma de antihipertensivos adicionales no específicos para la IC fue mayor. Los pacientes con HTA de bata blanca eran mayores y más frecuentemente mujeres. Por otro lado, los pacientes con HTA enmascarada presentaron mayor carga de comorbilidades (HTA, DM, dislipemia, enfermedad pulmonar obstructiva crónica y enfermedad arterial periférica), tenían mayor prevalencia de IC-FEc y mayor prescripción de antihipertensivos adicionales, pero menos sacubitrilo-valsartán.
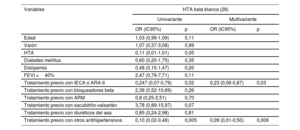
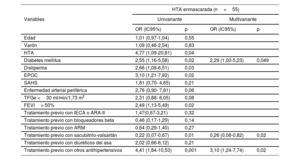
Entre los pacientes con PA elevada en consulta, el análisis de regresión logística permitió identificar los siguientes factores independientes asociados con menos casos de HTA de bata blanca: estar en tratamiento con inhibidores de la enzima de conversión de la angiotensina, antagonistas del receptor de la angiotensina II u otros antihipertensivos (tabla 2). Entre los pacientes con PA normal en consulta, los factores asociados con HTA enmascarada fueron la DM y el tratamiento con otros antihipertensivos, mientras que tomar sacubitrilo-valsartán redujo su presencia (tabla 3).
Factores asociados con la HTA de bata blanca en pacientes con HTA en consulta
| Variables | HTA bata blanca (28) | |||
|---|---|---|---|---|
| Univariante | Multivariante | |||
| OR (IC95%) | p | OR (IC95%) | p | |
| Edad | 1,03 (0,99-1,09) | 0,11 | ||
| Varón | 1,07 (0,37-3,08) | 0,89 | ||
| HTA | 0,11 (0,01-1,01) | 0,05 | ||
| Diabetes mellitus | 0,60 (0,20-1,75) | 0,35 | ||
| Dislipemia | 0,48 (0,15-1,47) | 0,20 | ||
| FEVI <40% | 2,47 (0,79-7,71) | 0,11 | ||
| Tratamiento previo con IECA o ARA-II | 0,247 (0,07-0,79) | 0,02 | 0,23 (0,06-0,87) | 0,03 |
| Tratamiento previo con bloqueadores beta | 2,38 (0,52-10,69) | 0,26 | ||
| Tratamiento previo con ARM | 0,8 (0,25-2,51) | 0,70 | ||
| Tratamiento previo con sacubitrilo-valsartán | 3,78 (0,89-15,97) | 0,07 | ||
| Tratamiento previo con diuréticos del asa | 0,85 (0,24-2,98) | 0,81 | ||
| Tratamiento previo con otros antihipertensivos | 0,10 (0,02-0,48) | 0,005 | 0,09 (0,01-0,50) | 0,006 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; OR: odds ratio.
Factores asociados con la HTA enmascarada en pacientes con presión arterial normal en consulta
| HTA enmascarada (n=55) | ||||
|---|---|---|---|---|
| Variables | Univariante | Multivariante | ||
| OR (IC95%) | p | OR (IC95%) | p | |
| Edad | 1,01 (0,97-1,04) | 0,55 | ||
| Varón | 1,09 (0,46-2,54) | 0,83 | ||
| HTA | 4,77 (1,09-20,81) | 0,04 | ||
| Diabetes mellitus | 2,55 (1,16-5,58) | 0,02 | 2,29 (1,00-5,23) | 0,049 |
| Dislipemia | 2,66 (1,08-6,51) | 0,03 | ||
| EPOC | 3,10 (1,21-7,92) | 0,02 | ||
| SAHS | 1,81 (0,70- 4,65) | 0,21 | ||
| Enfermedad arterial periférica | 2,76 (0,90- 7,81) | 0,06 | ||
| TFGe <30 ml/min/1,73 m2 | 2,31 (0,88- 6,05) | 0,08 | ||
| FEVI> 50% | 2,49 (1,13-5,49) | 0,02 | ||
| Tratamiento previo con IECA o ARA-II | 1,47(0,67-3,21) | 0,32 | ||
| Tratamiento previo con bloqueadores beta | 0,46 (0,17-1,29) | 0,14 | ||
| Tratamiento previo con ARM | 0,64 (0,29-1,40) | 0,27 | ||
| Tratamiento previo con sacubitrilo-valsartán | 0,22 (0,07-0,67) | 0,01 | 0,26 (0,08-0,82) | 0,02 |
| Tratamiento previo con diuréticos del asa | 2,02 (0,66-6,12) | 0,21 | ||
| Tratamiento previo con otros antihipertensivos | 4,41 (1,84-10,53) | 0,001 | 3,10 (1,24-7,74) | 0,02 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de angiotensina; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; OR: odds ratio; SAHS: síndrome de apneas-hipopneas del sueño; TFGe: tasa de filtrado glomerular estimada.
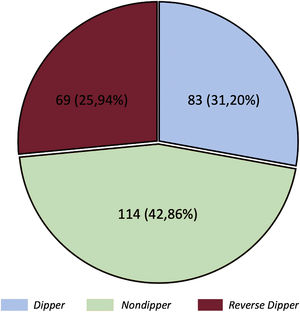
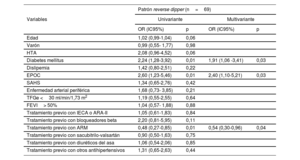
El patrón más frecuente fue el nondipper (114, 42,9%), seguido por el dipper (83, 31,2%) y el reverse dipper (69, 25,9%) (figura 2). Sus características basales se muestran en las . El cociente de medianas de la PAS noche/día fue de 0,9 (0,9-1,0) y la media, 0,95±0,1. El cociente de las medianas de PAD noche/día fue 0,9 (0,8-1,0) y la media, 0,9±0,1. El perfil nondipper se relacionó con una clase funcional peor y más IC-FEr. El patrón reverse dipper se observó en pacientes de más edad, con más HTA, DM y uso de ivabradina. La DM y la enfermedad pulmonar obstructiva crónica se asociaron de forma independiente con un mayor riesgo de patrón reverse dipper, mientras que el tratamiento con antialdosterónicos se relacionó de manera inversa (tabla 4). No se observó una asociación entre la PA en consulta y el patrón de PA nocturno.
Factores asociados con el patrón reverse dipper
| Patrón reverse dipper (n=69) | ||||
|---|---|---|---|---|
| Variables | Univariante | Multivariante | ||
| OR (IC95%) | p | OR (IC95%) | p | |
| Edad | 1,02 (0,99-1,04) | 0,06 | ||
| Varón | 0,99 (0,55- 1,77) | 0,98 | ||
| HTA | 2,08 (0,96-4,52) | 0,06 | ||
| Diabetes mellitus | 2,24 (1,28-3,92) | 0,01 | 1,91 (1,06 -3,41) | 0,03 |
| Dislipemia | 1,42 (0,80-2,51) | 0,22 | ||
| EPOC | 2,60 (1,23-5,46) | 0,01 | 2,40 (1,10-5,21) | 0,03 |
| SAHS | 1,34 (0,65-2,76) | 0,42 | ||
| Enfermedad arterial periférica | 1,68 (0,73- 3,85) | 0,21 | ||
| TFGe <30 ml/min/1,73 m2 | 1,19 (0,55-2,55) | 0,64 | ||
| FEVI> 50% | 1,04 (0,57- 1,88) | 0,88 | ||
| Tratamiento previo con IECA o ARA-II | 1,05 (0,61-1,83) | 0,84 | ||
| Tratamiento previo con bloqueadores beta | 2,20 (0,81-5,95) | 0,11 | ||
| Tratamiento previo con ARM | 0,48 (0,27-0,85) | 0,01 | 0,54 (0,30-0,96) | 0,04 |
| Tratamiento previo con sacubitrilo-valsartán | 0,90 (0,50-1,63) | 0,75 | ||
| Tratamiento previo con diuréticos del asa | 1,06 (0,54-2,06) | 0,85 | ||
| Tratamiento previo con otros antihipertensivos | 1,31 (0,65-2,63) | 0,44 | ||
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de angiotensina; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; OR: odds ratio; SAHS: síndrome de apneas-hipopneas del sueño; TFGe: tasa de filtrado glomerular estimada.
La PAS, en todas las mediciones realizadas (clínica, de 24 h, nocturna y diurna), fue significativamente inferior en los pacientes con IC-FEr (tabla 3 y ) respecto al resto de grupos de IC.
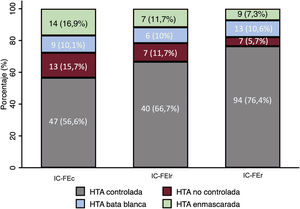
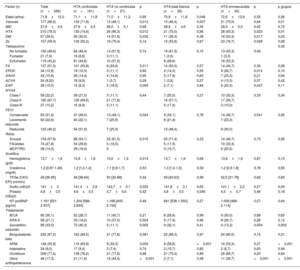
En cuanto a los patrones de HTA, se observaron diferencias entre los diferentes grupos de IC según la FEVI. Los pacientes con IC-FEr tuvieron una mayor proporción de HTA controlada que el grupo de IC-FEc (el 76,4 frente al 56,6%; p <0,001) y similar proporción de HTA de bata blanca (figura 3). Por el contrario, tuvieron una menor prevalencia de HTA no controlada (el 5,7 frente al 15,7%; p=0,018) y enmascarada (el 7,3 frente al 16,9%; p=0,033) que el grupo de IC-FEc.
Patrones de presión arterial diurnos en función del tipo de insuficiencia cardiaca. HTA: hipertensión arterial; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección levemente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida.
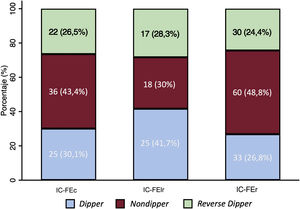
En general no se observaron diferencias en los patrones nocturnos entre los diferentes grupos de FEVI (p=0,17), con similar prevalencia de patrón reverse dipper (p=0,84). Se observó una tendencia no significativa a un mayor patrón dipper en la IC-FElr (p=0,12) (figura 4).
Patrones de presión arterial nocturnos en función del tipo de insuficiencia cardiaca. IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección levemente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida.
El principal valor de este trabajo es exponer la distribución de patrones tensionales diurnos y nocturnos en una población amplia de pacientes con IC crónica estable, en tratamiento médico óptimo y con representación de todo el espectro de FEVI (figura 5). Nuestros resultados muestran la utilidad clínica de la MAPA en pacientes con IC crónica y los hallazgos más relevantes son: a) la MAPA permite identificar patrones frecuentes (prevalencia de HTA de bata blanca y enmascarada del 10,5% y el 11,3% respectivamente); b) se observa una elevada alteración del patrón tensional nocturno, y c) existen variaciones específicas de los patrones tensionales según la FEVI.
Figura central. Diseño del estudio y principales hallazgos sobre la prevalencia de patrones tensionales diurnos, nocturnos y según la FEVI. FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; MAPA: monitorización ambulatoria de la presión arterial; PA: presión arterial.
En la IC, además de que la información sobre el comportamiento tensional en los pacientes es escasa, el hecho de que el tratamiento específico impacte en la PA hace de especial interés estudiarlo. Más del 80% de nuestra población tenía HTA, en su gran mayoría diagnosticada antes del estudio, pero habiendo identificado a un 4% más durante este. Mientras que los patrones diurnos se mostraron en una proporción similar que en la población sana o con HTA, los nocturnos difirieron notablemente en la población con IC. La HTA de bata blanca, que puede estar presente hasta en la mitad de los pacientes con PA elevada en consulta, especialmente en población anciana y con alto riesgo cardiovascular, se mostró en el 50% de nuestra población15. La HTA enmascarada, que se observó en un 11%, en la población general está en el 8-17%16,17. El hallazgo de que la PA de consulta difiera con la de la MAPA (HTA de bata blanca y enmascarada) en un porcentaje relevante de pacientes (el 22% en nuestro estudio) refuerza la importancia que tiene esta prueba para los pacientes con IC, ya que de otro modo no se podría identificar estos patrones. Sin embargo, el alto volumen de pacientes con IC amerita seleccionar a qué pacientes se realiza una MAPA. Por este motivo, puede ser de utilidad haber identificado en nuestro estudio factores independientes asociados con estos patrones.
Es llamativo que en nuestro estudio se identificara una gran prevalencia de alteraciones en los patrones nocturnos. El patrón dipper fue solo del 31%, a diferencia de lo observado en poblaciones sana e hipertensa, que ronda el 70% con los mismos criterios que nuestro estudio18. Los diferentes mecanismos fisiopatológicos que podrían estar involucrados en este fenómeno son un incremento del tono simpático con disminución de la variabilidad circadiana de la PA, el aumento del volumen sanguíneo circulante en decúbito ante un corazón con escasa capacidad de manejar el aumento de la precarga y la frecuente implicación de una función renal alterada19. Por otro lado, es posible que el patrón dipper sea más prevalente en los pacientes con menores concentraciones de catecolaminas circulantes y euvolémicos. Se dispone de evidencia sobre el impacto pronóstico negativo de los patrones nondipper y reverse dipper9,20–24, pero la información de pacientes con IC es escasa25,26. Se ha descrito mayor riesgo de hospitalización y muerte por IC en pacientes ancianos con IC crónica y patrón nondipper. Además, un trabajo mostró mayor prevalencia de reverse dipper en la IC-FEc y otro observó que este patrón se asociaba con una mayor mortalidad total y cardiovascular en la IC27,28. Sin embargo, estos últimos 2 estudios se realizaron en IC aguda. Por el contrario, nuestro trabajo muestra un porcentaje similar de patrones nocturnos entre los diferentes tipos de IC.
En general, los estudios publicados en este campo tienen en común que incluyen muestras no representativas de la totalidad de pacientes con IC, y aunque una serie reciente expone una distribución similar de patrones nocturnos26, no refleja los patrones diurnos ni hace un análisis estratificado por FEVI como en este trabajo. Actualmente se está realizando un registro de MAPA en la IC-FEc que arrojará luz sobre esta población29. Observar que la PAS es menor en la IC-FEr tiene sentido desde el punto de vista fisiopatológico, dado que la pérdida de contractilidad miocárdica conlleva un menor gasto cardiaco, lo cual se relaciona con una menor PA13. Esto explicaría también la mayor prevalencia observada de HTA controlada y la menor prevalencia de enmascarada en la IC-FEr. Además, esta población es tratada más a menudo con fármacos neuromoduladores que, además de influir en el pronóstico de la enfermedad, disminuyen la PA. Sin embargo, que no se observaran diferencias en los patrones nocturnos en función de la FEVI podría estar en relación con el aumento persistente del tono simpático en todo el espectro de la IC13,30.
Por otra parte, aunque la definición de los patrones tensionales es uniforme, los criterios diagnósticos usados en la literatura presentan una significativa variabilidad. Para este trabajo se utilizaron los más repetidos, cuya justificación goza de más respaldo científico y consenso8,23,26,31.
En la HTA existe abundante evidencia sobre qué objetivos tensionales alcanzar31-33. Sin embargo, se desconocen cuáles son las cifras óptimas de PA en los pacientes con IC14,31, y aunque las guías de práctica clínica recomiendan iniciar tratamiento médico cuando la PA sea> 140/90mmHg, también indican evitar cifras <120/70mmHg, dado el mayor riesgo de eventos observado en esta población con PA bajas. Un paso previo necesario es establecer las cifras tensionales y los patrones de comportamiento de la PA en la IC. Con nuestro trabajo se pretende contribuir a esta cuestión.
Por lo tanto, este estudio refuerza el valor que la MAPA tiene para diagnosticar patrones específicos de HTA que de otra manera no se pueden identificar y son prevalentes (HTA de bata blanca y enmascarada), expone un probable comportamiento nocturno de la PA diferente que en otras poblaciones y muestra el comportamiento tensional en función de la FEVI.
LimitacionesSe considera que, a pesar de la relevancia que tiene mostrar la prevalencia y las características de los diferentes patrones de PA en una amplia población con IC, nuestro estudio adolece de diversas limitaciones que merecen mención. Se trata de un estudio observacional transversal y, por lo tanto, expuesto a las particularidades de este tipo de análisis. Su carácter transversal refleja las características de los pacientes en un momento puntual y no permite valorar la evolución de la PA, la FEVI o el tratamiento que algunos de estos pacientes padecen a lo largo de su evolución. Por otra parte, aunque se ha incluido a pacientes con todo el espectro de FEVI, la población proviene de unidades de IC de 2 centros hospitalarios donde predominan los pacientes con ingresos hospitalarios en los meses previos y una mayor proporción de IC-FEr. Por lo tanto, no se puede asegurar que todos los pacientes con IC de esa área estén representados en dichas unidades ni extrapolar los resultados a otros ámbitos. El posible impacto pronóstico de estos patrones tensionales está por describir.
CONCLUSIONESLa prevalencia de HTA en pacientes con IC es elevada. La MAPA es un medio útil para valorar los diferentes perfiles tensionales, con HTA de bata blanca en más de la mitad de los pacientes con PA elevada en consulta, independientemente de la FEVI, y un porcentaje relevante de HTA enmascarada. La distribución de patrones diurnos fue similar a la descrita en población sin IC, pero el patrón fisiológico dipper solo se mostró en un tercio de los pacientes estudiados. Los pacientes con IC-FEr tenían una PAS más baja y más HTA controlada.
- –
La HTA es uno de los principales factores de riesgo de IC y su tratamiento previene su aparición. Los diferentes patrones de PA diurna y nocturna y los factores relacionados con su desarrollo están bien definidos en la población sin IC. Sin embargo, el comportamiento de la PA en la MAPA, su relación con la PA en consulta y el perfil de los pacientes no son bien conocidos.
- –
Se describe la prevalencia de los diferentes patrones tensionales por la MAPA, las características de los pacientes y los factores relacionados con su aparición en una población con IC que abarca todo el espectro de FEVI. Además, se detallan estos datos en función del intervalo de FEVI de los pacientes incluidos. Esto permite conocer el comportamiento de la PA en esta enfermedad, influida por la función cardiaca y la medicación concomitante, y planificar nuevos estudios para valorar su impacto pronóstico junto con posibles estrategias de tratamiento.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESJ. de Juan Bagudá, A. Rodríguez Chaverri, P. Caravaca Pérez, J. de la Cruz, L.M. Ruilope y J.F. Delgado Jiménez han contribuido en el diseño del estudio. J. de Juan Bagudá, A. Rodríguez Chaverri, P. Caravaca Pérez, F. Aguilar Rodríguez, M.D. García-Cosío Carmena, S. Mirabet Pérez, M.L. López y J.M. Guerra han contribuido en la recogida de los datos. J. de Juan Bagudá, P. Caravaca Pérez, J. de la Cruz y J.F. Delgado Jiménez han contribuido en el análisis de los datos. Todos los autores han contribuido en la redacción y la revisión del manuscrito.
CONFLICTO DE INTERESESM.D. García-Cosío Carmena declara honorarios por presentaciones científicas de Chiesi y AstraZeneca. L.M. Ruilope declara honorarios por consultoría y testimonio de experto de Bayer y por presentaciones científicas de Daiichi-Sankyo, Novartis, Medtronic, Pfizer, ReCor, Sandoz y Sanofi. Los demás autores declaran no tener conflictos de intereses.
Los autores agradecen la colaboración de Ana Benito, Mercedes Ferrón y Alejandro Cruz en la recogida de datos para el artículo.