Se ha desarrollado una nueva técnica basada en tomografía computarizada para la evaluación de la reserva fraccional de flujo (TC-RFF) con un algoritmo de subpíxel «de grueso a fino» para generar contornos luminales precisos. El objetivo de este estudio es evaluar el rendimiento diagnóstico de este nuevo algoritmo de TC-RFF para discriminar la isquemia específica de lesión utilizando la evaluación invasiva de la RFF ≤ 0,80 como referencia en pacientes con enfermedad coronaria.
MétodosEste estudio prospectivo y multicéntrico evaluó a 330 pacientes sometidos a angiografía coronaria no invasiva con TC (ACTC) y evaluación invasiva de la RFF (mediana del intervalo, 2 días) en 6 hospitales terciarios. La TC-RFF se evaluó a ciegas con un algoritmo de subpíxel «de grueso a fino» para la evaluación de la luz.
ResultadosEntre marzo de 2019 y mayo de 2020, se incluyó a un total de 316 pacientes con 324 vasos. Hubo una buena correlación entre la TC-RFF y la evaluación invasiva de la RFF (r=0,76; p<0,001). La sensibilidad, la especificidad y la exactitud diagnóstica por vaso fueron, respectivamente, del 95,3, el 89,8 y el 92,0% para la TC-RFF y del 96,4, el 26,4 y el 53,1% para la ACTC para las estenosis>50%. La TC-RFF mostró mejor discriminación de la isquemia que la ACTC sola en general (ABC=0,95 frente a ABC=0,74; p<0,001) y en lesiones intermedias (ABC=0,96 frente a ABC=0,62; p<0,001) y en «zona gris» (ABC=0,88 frente a ABC=0,61; p<0,001). La especificidad, la exactitud y el ABC diagnóstica de la TC-RFF (el 71,9%, el 82,8% y 0,84) superaron las de la ACTC (el 9,4%, el 48,3% y 0,66) en pacientes o vasos con calcificación grave (todos, p<0,05).
ConclusionesLa TC-RFF con un algoritmo de subpíxel «de grueso a fino» proporcionó un alto rendimiento en la identificación de estenosis hemodinámicamente significativas. El rendimiento diagnóstico de la TC-RFF fue superior al de la ACTC en lesiones intermedias, de «zona gris» y con calcificación grave.
Palabras clave
La angiografía coronaria con tomografía computarizada (ACTC) es una modalidad no invasiva que puede identificar o descartar estenosis anatómicas en pacientes en quienes se sospecha enfermedad coronaria1,2. No obstante, la ACTC tiene una precisión moderada a la hora de predecir isquemia específica de la lesión según las mediciones de la reserva fraccional de flujo (RFF), en particular en el caso de las lesiones intermedias con calcificación grave. La mala correlación entre la estenosis luminal y la significación funcional podría llevar a una angiografía coronaria invasiva (ACI) innecesaria e incluso a una revascularización3.
La RFF derivada de la ACTC (TC-RFF) es un nuevo enfoque para identificar una estenosis coronaria no invasiva y hemodinámicamente significativa. Se han aplicado métodos basados en la dinámica de fluidos computacional (DFC) y el aprendizaje automático para calcular la TC-RFF que establece buena correlación con la RFF invasiva y con una mejor eficacia comparado con la ACTC sola4-10. Recientemente, ha aparecido una nueva técnica de TC-RFF con un algoritmo de subpíxel «de grueso a fino» (RuiXin-FFR, Raysight Medical, China) que podría generar contornos luminales precisos para la simulación de la DFC, que podría tener más aplicaciones en las lesiones calcificadas graves.
En este estudio prospectivo multicéntrico, se evaluó la eficacia diagnóstica de este nuevo algoritmo TC-RFF para detectar lesiones significativas en la función a partir de la RFF obtenida con guía intracoronaria de presión como método de referencia. También se comparó la precisión de la TC-RFF con la ACTC para predecir isquemia específica de la lesión.
MÉTODOSDiseño del estudio y poblaciónEstudio de cohortes multicéntrico (NCT04731285) realizado en 6 hospitales terciarios de China. El protocolo del estudio fue aprobado por los comités de ética del Sixth Medical Center of PLA General Hospital, el Renmin Hospital de la Wuhan University, el Beijing Hospital, el Anzhen Hospital de Beijing, la Capital Medical University, el Zhongshan Hospital, la Fudan University y el The People's Hospital of Liaoning Province. La investigación cumplió los principios descritos en la Declaración de Helsinki. Todos los participantes proporcionaron el consentimiento informado por escrito.
Eran aptos para participar en el estudio los pacientes adultos con enfermedad coronaria sospechada o conocida. Los criterios de inclusión fueron los siguientes: a) edad ≥ 18 años; b) síntomas de angina de pecho o equivalentes; c) pacientes con una probabilidad pretest intermedia-alta de enfermedad coronaria obstructiva, y d) pacientes con una indicación clínica de ACI (síntomas graves resistentes a tratamiento médico, angina de pecho característica a bajo nivel de ejercicio, evaluación clínica con electrocardiogramas de esfuerzo que indican alto riesgo de eventos y disfunción del ventrículo izquierdo indicativa de enfermedad coronaria). Solo se incluyó a los pacientes sometidos a ACTC, además de ACI y RFF invasiva. Los principales criterios de inclusión de la ACTC fueron la presencia de una o más lesiones con estenosis del 30 al 90% del diámetro y un tamaño del vaso de referencia ≥ 2mm en el segmento estenótico. Los criterios de exclusión fueron: a) haberse sometido a intervención coronaria percutánea, cirugía de revascularización coronaria o cirugía de válvula cardiaca o llevar marcapasos cardiaco o desfibrilador automático implantable; b) estar en situación de inestabilidad clínica como shock cardiogénico, insuficiencia cardiaca congestiva (clase funcional de la New York Heart Association [NYHA] III o IV) o edema pulmonar agudo; c) haber sufrido un infarto agudo de miocardio en la semana previa; d) otras enfermedades graves, tales como cardiopatía congénita compleja, síndrome del seno enfermo, síndrome de QT largo, arritmia grave o taquicardia, asma grave, enfermedad pulmonar obstructiva crónica, enfermedad renal crónica (aclaramiento de creatinina <45ml/min/1,73 m2) o enfermedad no cardiaca con esperanza de vida <2 años; e) alergia a las sustancias de contraste con yodo o al trifosfato de adenosina, y f) embarazo o estado de embarazo desconocido. Los principales criterios de exclusión de la ACTC fueron los artefactos de mala alineación y la oclusión total crónica.
Procedimiento de la ACTCTodas las imágenes de la TC se obtuvieron con escáneres provistos de 64 o más filas de detectores. La realización de la ACTC y sus interpretaciones coincidieron con las pautas de la Society of Cardiovascular Computed Tomography con los distintos escáneres de tomografía computarizada de cada centro (Aquilion ONE, TOSHIBA, Japón; iCT 256, Philips, Países Bajos; Optima CT680 Series/Revolution CT, GE MEDICAL SYSTEMS, Estados Unidos; SOMATOM Definition/Definition Flash/Force, SIEMENS, Alemania; uCT 960/960+, United Imaging Healthcare, China)11. Los radiólogos de cada centro siguieron la misma norma para obtener las imágenes de la ACTC. Según esta norma, la cantidad se determinaba en función del peso del paciente, y la dosis de contraste fue de 0,8-0,9ml/kg, mientras que la concentración fue de 350-370mg/ml. Antes de la ACTC se administró nitroglicerina sublingual a 258 pacientes (82%) y bloqueadores beta a 271 (86%). La mediana de tiempo entre la ACTC y la ACI fue de 2 [intervalo intercuartílico, 1-3] días. No se produjeron efectos adversos importantes entre las pruebas de la ACTC y las mediciones de la RFF invasiva. Del análisis de las ACTC se encargaron investigadores locales expertos que desconocían los valores de la RFF con guía intracoronaria de presión o de la TC-RFF. Una estenosis >50% en la ACTC se consideró significativa12. Investigadores locales expertos clasificaron visualmente las estenosis. Las lesiones intermedias se derivaron de las mediciones de la ACTC y se definieron como estenosis del 30 al 70%.
Realización e interpretación de la TC-RFFDos observadores expertos analizaron las TC-RFF enmascaradas en un laboratorio central independiente (Yaping Zeng y Xiao Wang) con un sistema de software especializado externo (RuiXin-FFR, versión 1.0, Raysight Medical, China). El laboratorio central indicó las localizaciones de las mediciones de la RFF con guía intracoronaria en un modelo reconstruido de anatomía coronaria. Este proceso permite comparar la TC-RFF y la RFF invasiva en las mismas localizaciones exactas.
Reconstrucción del modelo tridimensionalLos modelos anatómicos tridimensionales del árbol coronario se reconstruyeron a partir de imágenes de la ACTC. Primero se hizo una segmentación gruesa del árbol coronario con Frangifilter y se detectó el componente conectado más largo. En segundo lugar, se extrajeron automáticamente las líneas centrales arteriales por regiones que crecían a partir de la segmentación gruesa anterior13. Después, a lo largo de las líneas centrales extraídas, se utilizó un nuevo método basado en gradientes llamado algoritmo de subpíxel «de grueso a fino» para generar los contornos luminales en las imágenes transversales. Por último, se reconstruyó el modelo de superficie del árbol coronario mediante interpolación de spline y lofting (trazado) en todos los contornos transversales.
Nuevo algoritmo de subpíxel «de grueso a fino» para el contorno luminalPuesto que la segmentación coronaria gruesa a la escala de píxeles fue insuficiente para reconstruir el modelo de superficie, se propuso un nuevo algoritmo de subpíxel «de grueso a fino» para el contorno luminal para conseguir reconstrucciones más precisas. Los detalles de este algoritmo se muestran en el apartado «Métodos» del material adicional y en la figura 1 del material adicional. En resumen, primero se obtuvo la imagen transversal y se calculó su mapa de gradiente. Los contornos del subpíxel se calcularon según la intensidad y el gradiente en unidades Hounsfiled (UH). Para obtener el límite luminal, se utilizó un método de ajuste de curvas para registrar el contorno cerrado en la región de gradiente alto. Después se optimizó el contorno adaptándolo más, tanto en el plano transversal como a lo largo de la dirección axial, donde se producía la estenosis o la curvatura de la línea central era grande. Los parámetros del algoritmo se optimizaron y validaron mediante comparación con la ACI (datos de otra cohorte independiente) antes de realizar este estudio (figura 2 del material adicional). Por último, se generaron contornos luminales precisos en puntos específicos a lo largo de la línea central coronaria (figura 1). El tamaño del píxel de la ACTC de cada paciente oscila entre 0,3 y 0,7mm, según el grosor de las distintas reconstrucciones. La intensidad de las UH en la luz coronaria oscila entre 200 y 450 UH, y la magnitud del gradiente calculado en cada píxel oscila entre 0 y 1. El algoritmo de segmentación del subpíxel «de grueso a fino» consiguió una precisión de subpíxel y dio como resultado un modelo más regular. Los resultados de la segmentación a la escala de subpíxel no son lo bastante regulares para representar con precisión la luz real del vaso, lo que llevaría a un mayor descenso de presión en la simulación de la DFC. En la tabla 1 del material adicional se muestra una comparación de los métodos de segmentación de reconstrucción de distintas técnicas de TC-RFF. En la figura 3 del material adicional se muestra una comparación de los modelos reconstruidos por segmentación a escalas de píxel y subpíxel «de grueso a fino».
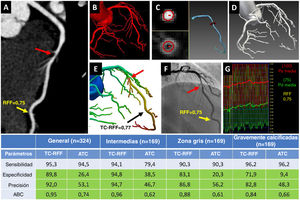
Figura central. Caso representativo y eficacia diagnóstica de la TC-RFF de Ruixin con un nuevo algoritmo de subpíxel «de grueso a fino» en la discriminación de la estenosis funcional. A: la ACTC demuestra una lesión no calcificada con estenosis intermedia (60%) (flecha roja) en medio de la ADAI. B-D: algoritmo de subpíxel «de grueso a fino» para el modelado geométrico: segmentación inicial a nivel de vóxel (B), contornos de subpíxel calculados según la intensidad y el gradiente en UH y modelo arterial generado a partir de los contornos (C) y el modelo geométrico completo del árbol coronario (D). E: TC-RFF calculada a partir del modelo geométrico y utilizando dinámica de flujo computacional, que demuestra estenosis obstructiva (flecha roja), con valor de la TC-RFF=0,77. F: angiograma coronario invasivo que muestra la estenosis intermedia en medio de la ADAI (flecha roja). G: se confirma una estenosis obstructiva mediante valor de la RFF invasiva de 0,75 (flecha amarilla). En la TC-RFF se observó mejora de la especificidad, la precisión y el ABC, comparado con la ACTC en general y en las lesiones intermedias, de la «zona gris» y gravemente calcificadas a nivel de vaso (tabla). La casilla verde claro indica la diferencia significativa entre la TC-RFF y la ACTC (p<0,05). ABC: área bajo la curva ROC; ACTC: angiografía coronaria por tomografía computarizada; ADAI: arteria descendente anterior izquierda; RFF: reserva fraccional de flujo; TC-RFF: reserva fraccional de flujo derivada de la angiografía por tomografía computarizada.
Las imágenes de la ACTC también permitieron obtener datos específicos del paciente, tales como el volumen del miocardio del ventrículo izquierdo. La distribución de fluidos entre las arterias descendente anterior izquierda, circunfleja izquierda y coronaria derecha se determinó por el número y el área de salida de ramas en el modelo anatómico. Para calcular el flujo coronario total en la hiperemia para la TC-RFF, se multiplicó el flujo coronario total en reposo por un coeficiente constante. La sangre se modeló como un fluido newtoniano. Las ecuaciones de Navier-Stokes para fluidos no comprimibles se resolvieron con un método de elementos finitos. Por último, se obtuvieron los valores de la TC-RFF a partir de la solución de la DFC. Una TC-RFF ≤ 0,80 se consideró hemodinámicamente significativa.
Medición invasiva de la RFFCirujanos que desconocían los resultados de la TC-RFF obtuvieron mediante un sistema comercializado la RFF con guía intracoronaria de presión según la eficacia habitual durante la hiperemia máxima, inducida por administración de adenosina intravenosa o intracoronaria14, según eligiera el cirujano. Antes de la medición, se igualaron la guía intracoronaria de presión y la presión aórtica en la punta del catéter guía. Al final de la intervención, se hizo una comprobación de la deriva devolviendo el cable de presión al catéter guía en la misma localización que en la igualación inicial. Las diferencias >3mmHg entre el cable de presión y el catéter guía indicaban fallo en la medición y se hacía otro intento. La RFF se consideró funcionalmente significativa en el umbral ≤ 0,80 según el paciente y el vaso. Una RFF entre 0,75 y 0,85 se consideró «zona gris»15.
Objetivos del estudioLos objetivos coprimarios del estudio fueron la sensibilidad y la especificidad de la TC-RFF en la predicción de estenosis coronaria hemodinámicamente significativa con RFF con guía intracoronaria de presión ≤ 0,80. Los principales objetivos secundarios fueron la precisión diagnóstica, el valor predictivo positivo, el valor predictivo negativo (VPN), el área bajo la curva (ABC) ROC de la TC-FFR y su correlación con la RFF. También se comparó la eficacia diagnóstica de la TC-RFF con la de la ACTC.
Cálculo del tamaño de la muestra y análisis estadísticosSe establecieron hipótesis para el cumplimiento de los objetivos de eficacia de los criterios de valoración principales: sensibilidad de la TC-RFF=90% y especificidad de la TC-RFF=70%. Se establecieron los valores objetivo correspondientes a la sensibilidad (80%) y la especificidad (60%). Con una prevalencia supuesta de RFF positiva del 33 al 50%, un error de tipo I (α)=0,025 (unilateral), una potencia estadística (1 – β)=80% y una pérdida de datos del 10%, se requirió un total de 330 pacientes para el estudio.
Los valores continuos se expresan como media±desviación estándar o mediana [intervalo intercuartílico], según convenga. Las variables binarias se expresan en número y porcentaje. Se utilizó la prueba de la χ2 para las variables cualitativas. Se calcularon medidas diagnósticas como la sensibilidad, la especificidad, la precisión, el valor predictivo positivo y el VPN según el paciente o el vaso para la TC-RFF y la ACTC y se compararon con la prueba de McNemar. Se calcularon las ABC ROC para la TC-RFF con RFF invasiva ≤ 0,80 como patrón de referencia y se compararon con la ACTC mediante la prueba de DeLong. También se evaluó la eficacia diagnóstica en subgrupos que incluían a pacientes y vasos con lesiones intermedias (estenosis del 30-70% según ACTC), lesiones calcificadas (puntuación de Agatston >0) o gravemente calcificadas (puntuación de Agatston ≥ 400) y lesiones en la «zona gris» en la RFF (0,75 ≤ RFF ≤ 0,85). Se calcularon los coeficientes de correlación de Pearson para determinar la relación entre la TC-RFF y la RFF invasiva. Se hizo el análisis de Bland-Altman para analizar la concordancia entre la TC-RFF y la RFF invasiva. Se utilizaron los coeficientes de correlación intraclase para medidas aisladas para evaluar la concordancia entre observadores y en un mismo observador del valor de la TC-RFF con intervalos de confianza del 95% (IC95%) (30 vasos seleccionados al azar). Se consideró que un valor de p bilateral <0,05 indicaba significación estadística. Todos los análisis se hicieron con el software patentado SAS (versión 9,4, SAS Institute, Estados Unidos).
RESULTADOSCaracterísticas del paciente y de la lesiónEntre marzo de 2019 y mayo de 2020, se cribó a un total de 330 pacientes. Se excluyó a 14 pacientes por llevar un desfibrilador automático implantable (n=1), sufrir insuficiencia cardiaca congestiva (NYHA III) o porque no se pudo determinar la RFF (n=12). Por último, se analizó a 316 pacientes con 324 vasos (figura 4 del material adicional). En la tabla 1 se describen las características basales. La media de edad fue 61,4±9,1 años, 204 pacientes (64,6%) eran varones y 65 (20,6%) tenían diabetes mellitus. Según la RFF invasiva ≤ 0,80, en 126 pacientes (39,9%) y 127 vasos (39,2%) se constataron lesiones que se consideraron hemodinámicamente significativas. Hubo 139 pacientes (44,0%) con TC-RFF ≤ 0,80, 214 (67,7%) con estenosis >50% en la ACI, 212 (67,1%) con estenosis >50% en la ACTC y 164 (51,9%) con estenosis intermedias.
Características basales
| Pacientes, n | 316 |
|---|---|
| Edad (años) | |
| Media±DE | 61,4±9,1 |
| Intervalo | 33-82 |
| Varones | 204 (64,6) |
| Índice de masa corporal | 25,2±3,2 |
| Diabetes | 65 (20,6) |
| Hipertensión | 169 (53,5) |
| Hiperlipemia | 93 (29,4) |
| Fumador en el momento del estudio | 67 (21,2) |
| Infarto de miocardio previo | 8 (2,5) |
| Cuadro clínico | |
| Isquemia silente | 52 (16,5) |
| Angina de pecho estable | 25 (7,9) |
| Angina de pecho inestable | 239 (75,6) |
| Creatinina (mg/dl) | 0,77 [0,66-0,88] |
| Fracción de eyección del ventrículo izquierdo* | 61 [58-66] |
| Vaso afectado (n=324) | |
| DAI | 212 (65,4) |
| CxI | 44 (13,6) |
| CD | 68 (21,0) |
| Número de vasos | |
| 1 | 308 (97,5) |
| 2 | 8 (2,5) |
| Diámetro de referencia del vaso (mm) | 3,0 [3,0-3,5] |
| Estenosis (% del diámetro, estimación visual) | 62,5 [50,0-80,0] |
| Longitud de la lesión (mm) | 22,0 [15,0-30,0] |
| Puntuación de Agatston | |
| Por paciente (190 pacientes) | 157 [51-428] |
| Por vaso (195 vasos) | 161 [51-404] |
CD: coronaria derecha; DAI: descendente anterior izquierda; CxI: circunfleja izquierda.
Los valores expresan media±desviación estándar, mediana [intervalo intercuartílico] o n (%).
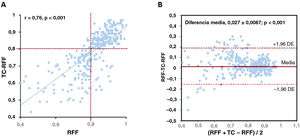
Por vasos, las medianas de RFF invasiva y TC-RFF fueron 0,84 [0,76-0,90] y 0,83 [0,70-0,87]. Se observó una buena correlación entre las variables continuas de la TC-RFF y la RFF invasiva (r=0,76, p<0,001) a nivel de los vasos (figura 2A), así como una buena concordancia (diferencia media, 0,027±0,087; límites de concordancia del 95%, −0,144 a 0,198) (figura 2B). La concordancia entre observadores en la TC-RFF fue de 0,92 (IC95%, 0,83-0,96) y en un mismo observador, 0,91 (IC95%, 0,82-0,96).
Correlación entre la TC-RFF y la RFF invasiva y gráfico de Bland-Altman a nivel de vaso. A: correlación entre el diagrama de dispersión y la regresión lineal (r=0,76). B: gráfico de Bland-Altman con intervalo de confianza del 95% entre −0,144 y 0,198 para las diferencias absolutas; la diferencia media se muestra como una línea roja, y las líneas de puntos indican los límites correspondientes de la concordancia. RFF: reserva fraccional de flujo; TC-RFF: reserva fraccional de flujo derivada de la angiografía por tomografía computarizada.
Frente a la RFF invasiva ≤ 0,80, la sensibilidad, la especificidad, el valor predictivo positivo, el VPN y la precisión de la TC-RFF ≤ 0,80 fueron del 95,2, el 90,0, el 86,3, el 96,6 y el 92,1% respectivamente, según el paciente, y del 95,3, el 89,8, el 85,8, el 96,7 y el 92,0% según el vaso. Tanto por paciente como por vaso, la TC-RFF ≤ 0,80 mejoró considerablemente la especificidad, el valor predictivo positivo, el VPN y la precisión comparada con la estenosis > 50% en la ACTC (tabla 2). El ABC para la TC-RFF ≤ 0,80 (0,95; IC95%, 0,92-0,97) excedió el de la estenosis > 50% en la ACTC clasificada visualmente (0,74; IC95%, 0,69-0,79) a nivel de paciente (todos los valores de p<0,001) (tabla 2, figura 3A,B). Estos resultados también concordantes en pacientes con lesiones intermedias (tabla 2, figura 3C,D). Curiosamente, todos los vasos se diagnosticaron correctamente con TC-RFF cuando la RFF invasiva fue <0,75. Cuando la RFF invasiva fue >0,85 o <0,75, se diagnosticaron correctamente 193 de las 203 lesiones estenóticas (figura 5 del material adicional).
Eficacia diagnóstica de la TC-RFF y la ACTC frente a la RFF invasiva, en general y entre pacientes y vasos con una lesión de gravedad intermedia
| General | Por paciente (n=316) | Por vaso (n=324) | ||||
|---|---|---|---|---|---|---|
| TC-RFF ≤ 0,80 | ACTC >50% | p* | TC-RFF ≤ 0,80 | ACTC >50% | p* | |
| PV/FN/FP/NV, n | 120/6/19/171 | 119/7/140/50 | - | 121/6/20/177 | 120/7/145/52 | — |
| Sensibilidad (%) | 95,2 (89,9-98,2) | 94,4 (88,9-97,7) | 0,999 | 95,3 (90,0-98,2) | 94,5 (89,0-97,8) | 0,999 |
| Especificidad (%) | 90,0 (84,8-93,9) | 26,3 (20,2-33,2) | <0,001 | 89,0 (84,8-93,7) | 26,4 (20,4-33,1) | <0,001 |
| VPP (%) | 86,3 (79,5-91,6) | 45,9 (39,8-52,2) | <0,001 | 85,8 (78,9-91,1) | 48,3 (39,2-51,5) | <0,001 |
| VPN (%) | 96,6 (92,8-98,7) | 87,7 (76,3-94,9) | 0,01 | 96,7 (93,0-98,8) | 88,1 (77,1-95,1) | 0,01 |
| Precisión (%) | 92,1 (88,5-94,8) | 53,5 (47,8-59,1) | <0,001 | 92,0 (88,5-94,7) | 53,1 (47,5-58,6) | <0,001 |
| ABC (%) | 0,95 (0,92-0,97) | 0,74 (0,69-0,79) | <0,001 | 0,95 (0,92-0,97) | 0,74 (0,69-0,79) | <0,001 |
| Lesiones intermedias | Por paciente (n=164) | Por vaso (n=169) | ||||
|---|---|---|---|---|---|---|
| TC-RFF ≤ 0,80 | ACTC >50% | p* | TC-RFF ≤ 0,80 | ACTC>50% | p* | |
| PV/FN/FP/NV, n | 32/2/7/123 | 27/7/80/50 | — | 32/2/7/128 | 27/7/83/52 | — |
| Sensibilidad (%) | 94,1 (80,3-99,3) | 79,4 (62,1-91,3) | 0,18 | 94,1 (80,3-99,3) | 79,4 (62,1-91,3) | 0,18 |
| Especificidad (%) | 94,6 (89,2-97,8) | 38,5 (30,1-47,4) | <0,001 | 94,8 (89,6-97,9) | 38,5 (30,3-47,3) | <0,001 |
| VPP (%) | 82,1 (66,5-92,5) | 25,2 (17,3-34,6) | <0,001 | 82,1 (66,5-92,5) | 24,5 (16,8-33,7) | <0,001 |
| VPN (%) | 98,4 (94,3-99,8) | 87,7 (76,3-94,9) | 0,002 | 98,5 (94,6-99,8) | 88,1 (77,1-95,1) | 0,002 |
| Precisión (%) | 94,5 (89,8-97,5) | 47,0 (39,1-54,9) | <0,001 | 94,7 (90,1-97,5) | 46,7 (39,0-54,6) | <0,001 |
| ABC | 0,96 (0,92-0,99) | 0,62 (0,54-0,70) | <0,001 | 0,96 (0,92-0,99) | 0,62 (0,55-0,70) | <0,001 |
ABC: área bajo la curva ROC; ACTC: angiografía coronaria por tomografía computarizada; FN: falsos negativos; FP: falsos positivos; TC-RFF: reserva fraccional de flujo mediante tomografía computarizada; VPN: valor predictivo negativo; VPP: valor predictivo positivo; VN: verdaderos negativos; VP: verdaderos positivos.
Curva ROC (de eficacia diagnóstica) y ABC de la TC-RFF frente a la ACTC para detectar la isquemia funcional significativa (RFF invasiva ≤ 0,8) en todos los pacientes (A, B) y los pacientes con lesiones intermedias (C, D), a nivel de paciente (A, C) y a nivel de vaso (B, D). ABC: área bajo la curva ROC; ACTC: angiografía coronaria por tomografía computarizada; TC-RFF: reserva fraccional de flujo derivada de la angiografía por tomografía computarizada.
La mediana de la puntuación de Agatston (190 pacientes, 195 vasos) fue 157 [51-428] por paciente y 161 [51-404] por vaso. Se halló una puntuación de Agatston ≥ 400 en el 30,5% a nivel de paciente y en el 29,7% a nivel de vaso. La especificidad diagnóstica, la precisión y el ABC en la TC-RFF ≤ 0,80 a nivel de vasos (el 87,1%, el 90,3% y 0,95) superaron las de la estenosis > 50% en la ACTC (el 21,8%, el 48,7% y 0,74) (todos, p<0,001). Esto fue cierto sobre todo en pacientes con lesiones gravemente calcificadas. No se observó ninguna diferencia significativa en la sensibilidad y el VPN entre la TC-RFF ≤ 0,80 y la estenosis > 50% en la ACTC (tabla 3). En la figura 6 del material adicional se muestra un caso representativo.
Eficacia diagnóstica de la TC-RFF y la ACTC frente a la RFF invasiva entre pacientes y vasos con lesiones calcificadas
| Lesiones calcificadasa(Puntuación de Agatston >0) | Por paciente (n=190) | Por vaso (n=195) | ||||
|---|---|---|---|---|---|---|
| TC-RFF ≤ 0,80 | ACTC >50% | pb | TC-RFF ≤ 0,80 | ACTC >50% | pb | |
| PV/FN/FP/NV, n | 68/3/15/104 | 68/3/93/26 | — | 68/3/16/108 | 68/3/97/27 | — |
| Sensibilidad (%) | 95,8 (88,1-99,1) | 95,8 (88,1-99,1) | 0,999 | 95,8 (88,1-99,1) | 95,8 (88,1-99,1) | 0,999 |
| Especificidad (%) | 87,4 (80,1-92,8) | 21,8 (14,8-30,4) | <0,001 | 87,1 (79,9-92,4) | 21,8 (14,9-30,1) | <0,001 |
| VPP (%) | 81,9 (72,0-89,5) | 42,2 (34,5-50,3) | <0,001 | 81,0 (70,9-88,7) | 41,2 (33,6-49,1) | <0,001 |
| VPN (%) | 97,2 (92,0-99,4) | 89,7 (72,6-97,8) | 0,08 | 97,3 (92,3-99,4) | 90,0 (73,5-97,9) | 0,08 |
| Precisión (%) | 90,5 (85,4-94,3) | 49,5 (42,2-56,8) | <0,001 | 90,3 (85,2-94,0) | 48,7 (41,5-56,0] | <0,001 |
| ABC | 0,94 (0,89-0,97) | 0,73 (0,66-0,79) | <0,001 | 0,95 (0,89-0,97) | 0,74 (0,67-0,80) | <0,001 |
| Lesiones gravemente calcificadas(puntuación de Agatston ≥ 400) | Por paciente (n=190) | Por vaso (n=58) | ||||
|---|---|---|---|---|---|---|
| TC-RFF ≤ 0,80 | ACTC >50% | pb | TC-RFF ≤ 0,80 | ACTC >50% | pb | |
| VP/FN/FP/VN, n | 25/1/9/23 | 25/1/29/3 | — | 25/1/9/23 | 25/1/29/3 | — |
| Sensibilidad (%) | 96,2 (80,4-99,9) | 96,2 (80,4-99,9) | 0,999 | 96,2 (80,4-99,9) | 96,2 (80,4-99,9) | 0,999 |
| Especificidad (%) | 71,9 (53,3-86,3) | 9,4 [2,0-25,0] | <0,001 | 71,9 (53,3-86,3) | 9,4 [2,0-25,0] | <0,001 |
| VDP (%) | 73,5 (55,6-87,1) | 46,3 (32,6-60,4) | 0,01 | 73,5 (55,6-87,1) | 46,3 (32,6-60,4) | 0,01 |
| VPN (%) | 95,8 (78,9-99,9) | 75,0 (19,4-99,4) | 0,14 | 95,8 (78,9-99,9) | 75,0 (19,4-99,4) | 0,14 |
| Precisión (%) | 82,8 (70,6-91,4) | 48,0 (35,0-61,8) | <0,001 | 82,8 (70,6-91,4) | 48,0 (35,0-61,8) | <0,001 |
| ABC | 0,84 (0,72-0,92) | 0,66 (0,52-0,78) | 0,03 | 0,84 (0,72-0,92) | 0,66 (0,52-0,78) | 0,03 |
ABC: área bajo la curva ROC; ACTC: angiografía coronaria por tomografía computarizada; FN: falsos negativos; FP: falsos positivos; TC-RFF: reserva fraccional de flujo mediante tomografía computarizada; VN: verdaderos negativos; VP: verdaderos positivos; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
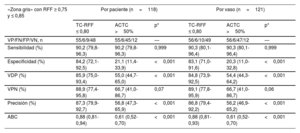
En 118 (36,4%) vasos con lesiones de la «zona gris» (RFF invasiva 0,75-0,85), la especificidad, la precisión y el ABC diagnósticos se mantuvieron altos con la TC-RFF ≤ 0,80 según el vaso (el 83,1%, el 86,8% y 0,88) y superaron la estenosis > 50% en la ACTC (el 20,3%, el 56,2% y 0,61) (todos, p<0,001) (tabla 4). Los 6 vasos «falsos negativos» en los casos en que la TC-RFF no identificó isquemia presentaron valores de la RFF invasiva entre 0,75 y 0,80 (figura 5 del material adicional).
Eficacia diagnóstica de la TC-RFF y la ACTC frente a la RFF invasiva entre pacientes y vasos con lesiones de la «zona gris»
| «Zona gris» con RFF ≥ 0,75 y ≤ 0,85 | Por paciente (n=118) | Por vaso (n=121) | ||||
|---|---|---|---|---|---|---|
| TC-RFF ≤ 0,80 | ACTC >50% | p* | TC-RFF ≤ 0,80 | ACTC >50% | p* | |
| VP/FN/FP/VN, n | 55/6/9/48 | 55/6/45/12 | — | 56/6/10/49 | 56/6/47/12 | — |
| Sensibilidad (%) | 90,2 (79,8-96,3) | 90,2 (79,8-96,3) | 0,999 | 90,3 (80,1-96,4) | 90,3 (80,1-96,4) | 0,999 |
| Especificidad (%) | 84,2 (72,1-92,5) | 21,1 (11,4-33,9) | <0,001 | 83,1 (71,0-91,6) | 20,3 (11,0-32,8) | <0,001 |
| VDP (%) | 85,9 (75,0-93,4) | 55,0 (44,7-65,0) | <0,001 | 84,8 (73,9-92,5) | 54,4 (44,3-64,2) | <0,001 |
| VPN (%) | 88,9 (77,4-95,8) | 66,7 (41,0-86,7) | 0,07 | 89,1 (77,8-95,9) | 66,7 (41,0-86,7) | 0,06 |
| Precisión (%) | 87,3 (79,9-92,7) | 56,8 (47,3-65,9) | <0,001 | 86,8 (79,4-92,2) | 56,2 (46,9-65,2) | <0,001 |
| ABC | 0,88 (0,81-0,94) | 0,61 (0,52-0,70) | <0,001 | 0,88 (0,81-0,93) | 0,61 (0,52-0,70) | <0,001 |
ABC: área bajo la curva ROC; ACTC: angiografía coronaria por tomografía computarizada; FN: falsos negativos; FP: falsos positivos; TC-RFF: reserva fraccional de flujo mediante tomografía computarizada; VN: verdaderos negativos; VP: verdaderos positivos; VPN: valor pronóstico negativo; VPP: valor pronóstico positivo.
En el presente estudio prospectivo multicéntrico, se demostró la buena eficacia diagnóstica de la TC-RFF con un nuevo algoritmo de subpíxel «de grueso a fino» para detectar la estenosis hemodinámicamente significativa. La sensibilidad, la especificidad y la precisión diagnósticas globales fueron altas (todas >89%) comparada con la RFF invasiva y superaron el objetivo de eficacia preespecificado. En concreto, la eficacia diagnóstica de la TC-RFF fue superior a la detección de estenosis con ACTC en varios tipos de lesiones, como las lesiones intermedias, las de la «zona gris» y las gravemente calcificadas.
La estenosis anatómica según la ACTC o la angiografía muestra mala correlación con la presencia de isquemia hemodinámicamente significativa3,16. La RFF ha aparecido como criterio de referencia para determinar la isquemia específica de la lesión y orientar la revascularización coronaria17-19, pero se halla limitada inherentemente por su invasividad y por los costes. En la última década se han creado varios algoritmos de TC-RFF no invasiva basados en el aprendizaje automático o la DFC4-10, como los 2 productos de China llamados uCT-FFR y CT-QFR4,5. Comparado con estudios previos, en el presente estudio se observaron una sensibilidad (95%), una especificidad (90%) y una precisión (92%) notablemente mayores a la hora de detectar la isquemia específica de la lesión. Más de la mitad de los pacientes (171/316) recibieron un diagnóstico correcto sin lesiones obstructivas con TC-RFF, con RFF como patrón de referencia. Además, con la TC-RFF se identificó de manera satisfactoria a un tercio de los pacientes (120/316) con isquemia funcional que probablemente se beneficiarían de una revascularización. Esto fue así en los pacientes con lesiones intermedias. Aunque la presencia de lesiones de la «zona gris» influyó negativamente en la eficacia de la TC-RFF, esta siguió siendo superior a la ACTC en el diagnóstico de isquemia (ABC: 0,88 frente a 0,61).
Las lesiones calcificadas son un reto diagnóstico para la ACTC y son la causa más frecuente de resultados falsos positivos comparada con la ACI20. La calcificación coronaria grave afecta a la segmentación de la luz del vaso y a las condiciones de contorno para el modelado fisiológico y altera la eficacia diagnóstica de la TC-RFF21. En el presente estudio, la especificidad y la precisión diagnósticas de la TC-RFF fueron significativamente superiores a las de la ACTC en lesiones calcificadas y lesiones con puntuación de Agatston ≥ 400 (todos, p<0,001) con una sensibilidad parecida. En las lesiones gravemente calcificadas (el 30% de los pacientes), se constató mejor discriminación de la isquemia con la TC-RFF que con la ACTC, tanto a nivel de paciente (p=0,03) como de vaso (p=0,03), un resultado similar al observado también en publicaciones recientes4,6,21-23, lo que destaca su potencial prometedor en una amplia aplicación clínica.
Es de destacar que la buena eficacia diagnóstica de la TC-RFF podría atribuirse a la nueva técnica del algoritmo de subpíxel «de grueso a fino» de contorno de la luz. En la tabla 1 del material adicional se comparan varios de los métodos de reconstrucción de la segmentación con TC-RFF. El método de reconstrucción de HeartFlow (FFRct) y el United Imaging (uCT-FFR) son ambos a escala de píxel. El primero utiliza los algoritmos clásicos de procesado de imágenes y el segundo, el algoritmo de las redes neuronales convolucionales. La TC-RFF de Toshiba tiene que reconstruirse en 4 fases (el 70, el 80, el 90 y el 99% del intervalo R-R de las imágenes de la ACTC). La RFFc de Siemens extrae la geometría coronaria tridimensional mediante vectores de característica 1D y a continuación predice la TC-RFF con un modelo de aprendizaje automático. Aunque su velocidad de predicción es rápida, los vectores de característica abstracta pierden abundante información tridimensional y llevan a una disminución de la precisión. Con la técnica propuesta se calculó el contorno de la luz a escala de subpíxel y se generó la línea central de la arteria tras la primera segmentación coronaria gruesa a escala de píxel. La nueva tecnología consiguió reconstrucciones más precisas del vaso y el contorno de la luz y mejoró considerablemente la eficacia diagnóstica. Una segunda explicación fue el cumplimiento riguroso de las pautas y la recomendación para la adquisición con ACTC y el control de calidad de las imágenes, en especial en el control de la frecuencia cardiaca (el 86% de los pacientes tomaron bloqueadores beta antes de la tomografía) y la administración de nitrato sublingual (el 82% de los pacientes). Se ha demostrado que esto último se correlaciona con la calidad de la ACTC, la simulación de la DFC y la eficacia diagnóstica11. Por último, la mediana de 2 días entre la adquisición con ACTC y la RFF invasiva fue menor que en el estudio NXT (media de 18 días) y en un estudio retrospectivo realizado en China (3 meses)4,8 y fue parecido al del estudio DISCOVER-FLOW (diagnóstico de estenosis causantes de isquemia obtenido mediante reserva fraccional de flujo no invasiva en 2,3 días, con un amplio intervalo de 0 a 26 días)10, lo que puede haber contribuido a la consistencia en la precisión diagnóstica.
LimitacionesEn este estudio, no se exploraron todos los vasos de todos los pacientes incluidos. Los vasos con estenosis <30% o >90% del diámetro no se evaluaron. Se excluyó a los pacientes ya sometidos antes a una intervención coronaria percutánea o una cirugía de revascularización coronaria. La administración de nitroglicerina sublingual o bloqueadores beta no fue congruente entre los distintos pacientes y la frecuencia en la toma de nitroglicerina sublingual fue relativamente baja comparada con la de otros informes8,11. Por consiguiente, se hizo un subanálisis que reveló precisión diagnóstica congruente entre los pacientes que tomaban nitroglicerina y los que no (el 91,9 frente al 93,1%; p=0,96). En el presente estudio, el cuadro clínico fue angina de pecho inestable en la mayoría de los pacientes y ninguno tenía enfermedad de 3 vasos o del tronco coronario izquierdo, lo que indica posible sesgo de selección. Se requieren más estudios para validar esta nueva técnica en una población más amplia. Frente a otros estudios9,22, los pacientes incluidos en este presentaban una calcificación coronaria relativamente reducida. Puesto que la calcificación coronaria influiría en la precisión diagnóstica de la TC-RFF, se hizo un análisis de subgrupo y se observaron resultados congruentes en los pacientes con calcificación grave (tabla 3). Además, no se hizo ninguna comparación directa entre el algoritmo de subpíxel «de grueso a fino» de la TC-RFF y otros algoritmos basados en la TC. En este estudio no se tuvo en cuenta la gran cantidad de artefactos, como el calcio, los movimientos de los pacientes y la mala obtención de imágenes, que pueden influir en la eficacia diagnóstica de la ACTC. Por último, el valor pronóstico y socioeconómico de esta TC-RFF no invasiva en los sistemas médicos nacionales requiere más estudio.
CONCLUSIONESEn este estudio prospectivo multicéntrico, la TC-RFF con un nuevo algoritmo de subpíxel «de grueso a fino» tuvo mayores especificidad y precisión diagnóstica que la ACTC. Esta nueva técnica puede discriminar la estenosis hemodinámicamente significativa en varios tipos de lesiones como las lesiones intermedias, las de «zona gris» y las gravemente calcificadas.
- –
Se ha creado una nueva técnica de TC-RFF con un algoritmo de subpíxel «de grueso a fino» para generar contornos luminales precisos para la simulación de la DFC, pero su eficacia diagnóstica sigue siendo dudosa.
- –
En el presente estudio prospectivo multicéntrico se demuestra que el nuevo algoritmo de la TC-RFF proporcionó buena eficacia diagnóstica para detectar la estenosis hemodinámicamente significativa. La sensibilidad, la especificidad y la precisión diagnósticas globales fueron altas (todas >89%) frente a la RFF invasiva. La eficacia diagnóstica de la TC-RFF fue superior a la detección de estenosis con ACTC en varios tipos de lesiones, como las lesiones intermedias, las de la «zona gris» y las gravemente calcificadas.
Este estudio fue financiado por subvenciones del National Key R&D Program de China (2022YFC2505600, 2020YFC2004800), el Beijing Nova Program (Z201100006820087) y el proyecto de cooperación interdisciplinario del Beijing Nova Program (Z211100002121165).
CONTRIBUCIÓN DE LOS AUTORESIdea y diseño del estudio: Z. Li y S. Nie. Adquisición, análisis, o interpretación de los datos: Y. Zeng, X. Wang, Z. Tang, T. Li, X. Jiang, F. Ji, Y. Zhou, J. Ge, Z. Li y S. Nie. Redacción del artículo: Y. Zeng y X. Wang. Revisión estadística del artículo: Y. Zhao. Revisión crítica del artículo por su importante contenido intelectual: C. Ma, G.S. Mintz y S. Nie. Todos los autores han leído y aprobado este artículo.
CONFLICTO DE INTERESESC. Ma: honorarios de Bristol-Myers Squibb, Pfizer, Johnson & Johnson, Boehringer-Ingelheim (BI), Bayer y AstraZeneca por dar conferencias. G.S. Mintz: honorarios de Boston Scientific, Philips y Terumo. S. Nie: becas de investigación a la institución de Boston Scientific, Abbott, Jiangsu Hengrui Pharmaceuticals, China Resources Sanjiu Medical & Pharmaceuticals, East China Pharmaceuticals. Los demás autores no tienen nada que declarar.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.05.013