El emergente tratamiento por catéter (TPC) de la embolia pulmonar (EP) aguda combina técnicas heterogéneas. El objetivo del estudio es describir la práctica clínica contemporánea y los resultados relacionados con la TPC en un registro de ámbito nacional.
MétodosRegistro multicéntrico iniciado por investigador, destinado a incluir a pacientes con EP aguda consecutivos y en riesgo intermedio-alto (IAR) o alto riesgo (AR) elegibles para TPC. El resultado primario del estudio fue la muerte por cualquier causa en el hospital.
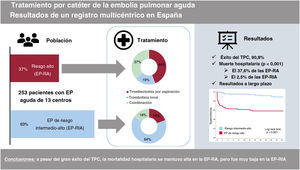
ResultadosSe incluyó en total a 253 pacientes, 93 (36,8%) con EP-AR y 160 (63,2%) con EP-IAR, de una media de edad de 62,3±15,1. Se realizó trombolisis local al 70,8% de los pacientes, trombectomía aspirativa al 51,8% y ambas al 23,3%. Sin embargo, la trombectomía por aspiración fue más frecuente en la cohorte de EP-AR (el 80,6 frente al 35%; p<0,001). Solo 51 pacientes (20,2%) se sometieron a TPC con dispositivos específicos de EP. El éxito de la TPC fue del 90,9% (el 98,1% de los casos de EP-IAR frente al 78,5% de los de EP-AR; p<0,001). La mortalidad hospitalaria fue del 15,5%, muy concentrada en los casos de EP-AR (37,6%) y significativamente menor entre los de EP-IAR (2,5%; p<0,001). La mortalidad a largo plazo (24 meses) fue del 40,2 en EP-AR frente al 8,2% en EP-IAR (p<0,001).
ConclusionesA pesar del elevado éxito de la TPC, la mortalidad hospitalaria por EP-AR sigue siendo alta (37,6%) respeto a la muy baja mortalidad de la EP-IAR (2,5%).
Palabras clave
Entre los principales aspectos del tratamiento de la embolia pulmonar (EP) en el momento del diagnóstico se encuentran la estratificación del riesgo, la inmediata prescripción de anticoagulantes y la selección de pacientes para la reperfusión. La reperfusión se puede definir como el tratamiento dirigido a la reducción a corto plazo de la carga de trombos y el shock obstructivo: trombolisis sistémica, tratamiento por catéter (TPC) o embolectomía quirúrgica. Si está contraindicada la trombolisis sistémica, que es el método preferido para la reperfusión, o el riesgo hemorrágico es extremo, se debe plantear el TPC1,2. En la guía de práctica clínica de la Sociedad Europea de Cardiología (ESC) sobre el diagnóstico y tratamiento de la embolia pulmonar aguda de 20193, el TPC está indicado para: a) la EP de riesgo alto (EP-RA) cuando la trombolisis sistémica está contraindicada o ha fracasado (indicación IIA, nivel de evidencia C), y b) la EP de riesgo intermedio-alto (EP-RIA) cuando un paciente en anticoagulación presenta deterioro hemodinámico, como alternativa a la trombolisis sistémica (indicación IIA, nivel de evidencia C). Dado que el miedo a las complicaciones también contribuye a la infrautilización de la trombolisis sistémica, el TPC podría aumentar el número de pacientes tratados mediante reperfusión si está clínicamente indicado4.
El TPC se puede clasificar en 3 enfoques: trombolisis local (simple o con ecografía), trombectomía por aspiración (aspiración de trombo con o sin fragmentación) y tratamiento combinado (por lo general, se empieza por trombectomía por aspiración y se sigue con trombolisis local)5,6. El TPC como tratamiento de reperfusión se utilizó con poca frecuencia hasta la década después de 2010 a causa de las pocas indicaciones de la guía de práctica clínica, la falta de estandarización técnica y las desigualdades en el acceso al tratamiento. Sin embargo, el volumen de intervenciones ha aumentado de manera considerable en los últimos 10-15 años tanto en España como en el mundo7-10. Este aumento se puede atribuir a 2 factores principales: primero, la mayor conciencia del infratratamiento de pacientes que requieren reperfusión1,11, y segundo, la aparición de nuevos dispositivos específicos que facilitan la intervención percutánea, con evidencia prometedora en estudios con un solo grupo y pequeños ensayos clínicos aleatorizados12-14. Actualmente, el TPC para la EP submasiva (equivalente a la clase de riesgo intermedio-alto e intermedio-bajo de la ESC) es frecuente en Estados Unidos. En cambio, el contexto europeo contemporáneo del tratamiento de la EP es muy heterogéneo, con menos pacientes incluidos en los registros y un mayor perfil de riesgo15,16. Por lo tanto, es necesaria la notificación sistemática de datos clínicos, idealmente a través de registros multicéntricos que incluyan a pacientes consecutivos. En este estudio, se presenta el primer registro nacional de TPC para el tratamiento de la EP aguda.
MÉTODOSEl registro nacional de TPC para el tratamiento de la EP aguda es un registro académico multicéntrico iniciado por los investigadores que se inició en 2018 y está avalado por la Asociación de Cardiología Intervencionista (parte de la Sociedad Española de Cardiología). El registro incluyó a pacientes consecutivos con EP aguda de RIA o RA (de acuerdo con las guías de estratificación del riesgo de la ESC) que eran aptos para TPC según decisión de los equipos de respuesta a la EP (EREP) locales. El diseño del registro es prospectivo, pero se permitió que los centros que ya tenían registros locales de pacientes con EP tratados por catéter que cumplían los criterios del registro nacional los incluyeran en retrospectiva.
Los criterios de exclusión fueron: a) pacientes adultos (mayores de 18 años); b) diagnóstico confirmado de EP aguda (en tomografía computarizada o ecocardiograma más angiografía pulmonar); c) EP-RA o EP-RIA según la estratificación del riesgo de la guía ESC 2019 (brevemente, biomarcadores cardiacos elevados: troponina o fracción aminoterminal del propéptido natriurético cerebral, y relación entre ventrículo derecho y ventrículo izquierdo >0,9 en tomografía computarizada o ecocardiograma e índice de gravedad de la EP de III a IV o índice simplificado de gravedad de la EP ≥ 1, y c) candidato a TPC. Los criterios de exclusión fueron: a) diagnóstico no confirmado de EP; b) estratificación del riesgo imprecisa, y c) EP con cronología incierta o pasados más de 7 días desde el inicio de los síntomas.
El objetivo principal del estudio fue la muerte por cualquier causa en el hospital. Los objetivos secundarios fueron éxito de la intervención (definido como intervención técnica completada sin complicaciones de la intervención ni muerte a las 48 h), complicaciones hospitalarias (definidas como hemorragia con clasificación de la International Society of Thrombosis and Hemostasis, EP de repetición, parada cardiaca posterior al TPC, complicación vascular, insuficiencia renal o muerte), muerte por cualquier causa a 1 y 24 meses. Los resultados se estratificaron por estratificación del riesgo de EP. Existe un vacío de conocimientos sobre las definiciones estandarizadas de los objetivos para los estudios de intervención ante la EP, por lo que no había criterios preestablecidos para finalizar la intervención por catéter y cada médico intervencionista tomaba esta decisión. La definición de fracaso de la trombolisis sistémica tampoco está estandarizada, sino que se basa en la poca bibliografía previa y el razonamiento clínico5,17.
Los datos anonimizados se conservaron en una base de datos segura en línea y el seguimiento se realizó según los protocolos locales a 1, 12 y 24 meses. Facilitaron los datos investigadores locales y los eventos adversos se auditaron para su divulgación completa. Todos los pacientes firmaron el consentimiento informado. De conformidad con la normativa local de investigación, el protocolo del registro fue aceptado por el comité de ética de la investigación clínica del Hospital Clínico San Carlos (código 18/010-E), que actuó como comité de ética central para todos los centros de España. El registro era puramente observacional, sin ninguna recomendación sobre el tratamiento de la EP. Se trata de un estudio académico iniciado por los investigadores sin financiación. Los centros participantes aceptaron una invitación abierta de la Asociación de Cardiología Intervencionista que no estaba restringida a ninguna subespecialidad e incluía intervenciones realizadas por los equipos de cirugía vascular (1 centro), radiología intervencionista (1 centro) y cardiología intervencionista (11 centros). Este artículo cumple la declaración Strengthening the reporting of observational studies in epidemiology (STROBE) sobre la comunicación de la investigación observacional.
No se preestableció un tamaño de muestra para este estudio. El registro está en curso y en este estudio se presenta a los primeros 253 pacientes incluidos antes del 30 de septiembre de 2022, procedentes de 13 centros españoles. Se utilizó la prueba de la t de Student y la prueba de la χ2 (o la prueba exacta de Fisher cuando correspondía) para comparar variables continuas y cualitativas respectivamente. Las curvas de Kaplan-Meier se compararon mediante la prueba del orden logarítmico. Los análisis estadísticos se realizaron con IBM SPSS Statistics versión 22.
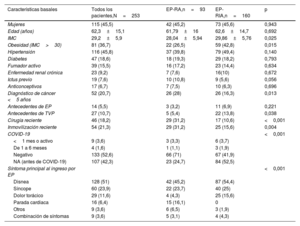
RESULTADOSCaracterísticas basales y estratificación del riesgoSe incluyó en el registro a 253 pacientes consecutivos de 2014 a 2022, que representan todos los TPC realizados en los 13 centros (un promedio de 5,86 intervenciones/año/millón de población) (tabla 1 del material adicional y figura 1 del material adicional). En el momento del TPC, tenían EP-RA 93 pacientes (36,8%) y EP-RIA 160 (63,2%). Las características basales se describen en la tabla 1. La media de edad era 62,3±15,1 años, con un intervalo amplio entre 16 y 86 años, y el 45,5% eran mujeres. Los pacientes con EP-RA tenían una similares edades y factores de riesgo cardiovascular, pero más cáncer activo, cirugía reciente o inmovilización reciente.
Características clínicas basales
| Características basales | Todos los pacientes,N=253 | EP-RA,n=93 | EP-RIA,n=160 | p |
|---|---|---|---|---|
| Mujeres | 115 (45,5) | 42 (45,2) | 73 (45,6) | 0,943 |
| Edad (años) | 62,3±15,1 | 61,79±16 | 62,6±14,7 | 0,692 |
| IMC | 29,2±5,9 | 28,04±5,94 | 29,86±5,76 | 0,025 |
| Obesidad (IMC>30) | 81 (36,7) | 22 (26,5) | 59 (42,8) | 0,015 |
| Hipertensión | 116 (45,8) | 37 (39,8) | 79 (49,4) | 0,140 |
| Diabetes | 47 (18,6) | 18 (19,3) | 29 (18,2) | 0,793 |
| Fumador activo | 39 (15,5) | 16 (17,2) | 23 (14,4) | 0,634 |
| Enfermedad renal crónica | 23 (9,2) | 7 (7,6) | 16(10) | 0,672 |
| Ictus previo | 19 (7,6) | 10 (10,8) | 9 (5,6) | 0,056 |
| Anticonceptivos | 17 (6,7) | 7 (7,5) | 10 (6,3) | 0,696 |
| Diagnóstico de cáncer <5 años | 52 (20,7) | 26 (28) | 26 (16,3) | 0,013 |
| Antecedentes de EP | 14 (5,5) | 3 (3,2) | 11 (6,9) | 0,221 |
| Antecedentes de TVP | 27 (10,7) | 5 (5,4) | 22 (13,8) | 0,038 |
| Cirugía reciente | 46 (18,2) | 29 (31,2) | 17 (10,6) | <0,001 |
| Inmovilización reciente | 54 (21,3) | 29 (31,2) | 25 (15,6) | 0,004 |
| COVID-19 | <0,001 | |||
| <1 mes o activo | 9 (3,6) | 3 (3,3) | 6 (3,7) | |
| De 1 a 6 meses | 4 (1,6) | 1 (1,1) | 3 (1,9) | |
| Negativo | 133 (52,6) | 66 (71) | 67 (41,9) | |
| NA (antes de COVID-19) | 107 (42,3) | 23 (24,7) | 84 (52,5) | |
| Síntoma principal al ingreso por EP | <0,001 | |||
| Disnea | 128 (51) | 42 (45,2) | 87 (54,4) | |
| Síncope | 60 (23,9) | 22 (23,7) | 40 (25) | |
| Dolor torácico | 29 (11,6) | 4 (4,3) | 25 (15,6) | |
| Parada cardiaca | 16 (6,4) | 15 (16,1) | 0 | |
| Otros | 9 (3,6) | 6 (6,5) | 3 (1,9) | |
| Combinación de síntomas | 9 (3,6) | 5 (3,1) | 4 (4,3) |
EP: embolia pulmonar; EP-RA: embolia pulmonar de riesgo alto; EP-RIA: embolia pulmonar de riesgo intermedio-alto; IMC: índice de masa corporal; NA: no aplicable; TVP: trombosis venosa profunda.
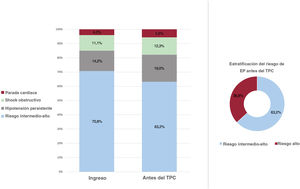
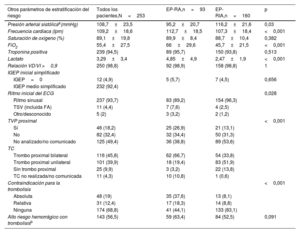
En el momento del ingreso, se clasificó a 74 pacientes (29,2%) como EP-RA y a 179 (70,8%) como EP-RIA. De los 179 pacientes con EP-RIA al ingreso, 19 (10,6%) presentaban deterioro clínico que cumplía los criterios de EP-RA antes del TPC (figura 1A). A efectos de este estudio, se consideró paciente con riesgo alto a aquellos con criterios de EP-RA según la guía ESC 2019 antes del TPC: 93 pacientes (36,8%) (figura 1B); se clasificó como EP-RIA a 160 pacientes (63,2%). Otros parámetros de estratificación del riesgo se muestran en la tabla 2.
Parámetros de estratificación del riesgo de EP al ingreso
| Otros parámetros de estratificación del riesgo | Todos los pacientes,N=253 | EP-RA,n=93 | EP-RIA,n=160 | p |
|---|---|---|---|---|
| Presión arterial sistólicaa(mmHg) | 108,7±23,5 | 95,2±20,7 | 116,2±21,6 | 0,03 |
| Frecuencia cardiaca (lpm) | 109,2±18,6 | 112,7±18,5 | 107,3±18,4 | <0,001 |
| Saturación de oxígeno (%) | 89,1±19,8 | 89,9±8,4 | 88,7±10,4 | 0,382 |
| FiO2 | 55,4±27,5 | 66±29,6 | 45,7±21,5 | <0,001 |
| Troponina positiva | 239 (94,5) | 89 (95,7) | 150 (93,8) | 0,513 |
| Lactato | 3,29±3,4 | 4,85±4,9 | 2,47±1,9 | <0,001 |
| Relación VD/VI >0,9 | 250 (98,8) | 92 (98,9) | 158 (98,8) | 1 |
| IGEP inicial simplificado | ||||
| IGEP=0 | 12 (4,9) | 5 (5,7) | 7 (4,5) | 0,656 |
| IGEP medio simplificado | 232 (92,4) | |||
| Ritmo inicial del ECG | 0,028 | |||
| Ritmo sinusal | 237 (93,7) | 83 (89,2) | 154 (96,3) | |
| TSV (incluida FA) | 11 (4,4) | 7 (7,6) | 4 (2,5) | |
| Otro/desconocido | 5 (2) | 3 (3,2) | 2 (1,2) | |
| TVP proximal | <0,001 | |||
| Sí | 46 (18,2) | 25 (26,9) | 21 (13,1) | |
| No | 82 (32,4) | 32 (34,4) | 50 (31,3) | |
| No analizado/no comunicado | 125 (49,4) | 36 (38,8) | 89 (53,6) | |
| TC | ||||
| Trombo proximal bilateral | 116 (45,8) | 62 (66,7) | 54 (33,8) | |
| Trombo proximal unilateral | 101 (39,9) | 18 (19,4) | 83 (51,9) | |
| Sin trombo proximal | 25 (9,9) | 3 (3,2) | 22 (13,8) | |
| TC no realizada/no comunicada | 11 (4,3) | 10 (10,8) | 1 (0,6) | |
| Contraindicación para la trombolisis | <0,001 | |||
| Absoluta | 48 (19) | 35 (37,6) | 13 (8,1) | |
| Relativa | 31 (12,4) | 17 (18,3) | 14 (8,8) | |
| Ninguna | 174 (68,8) | 41 (44,1) | 133 (83,1) | |
| Alto riesgo hemorrágico con trombolisisb | 143 (56,5) | 59 (63,4) | 84 (52,5) | 0,091 |
ECG: electrocardiograma; EP-RA: embolia pulmonar de alto riesgo; EP-RIA: embolia pulmonar de riesgo intermedio-alto; FA: fibrilación auricular; FiO2: fracción inspirada de oxígeno; IGEP: índice de gravedad de la embolia pulmonar; TC: tomografía computarizada; TSV: taquicardia supraventricular; TVP: trombosis venosa profunda; VD: ventrículo derecho; VI: ventrículo izquierdo.
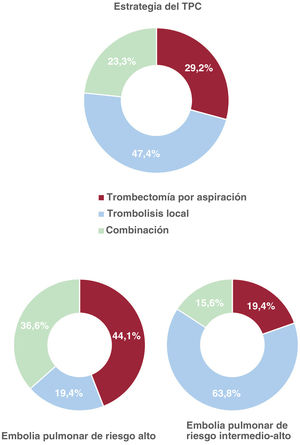
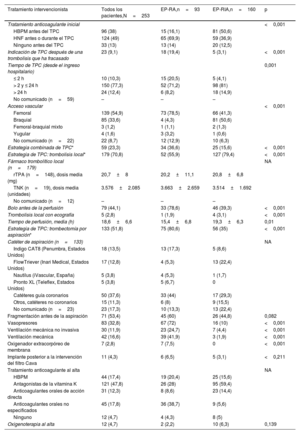
El TPC fue la estrategia de reperfusión programada en el 90,9% de los pacientes y el tratamiento de rescate tras una trombolisis fallida en el 9,1% restante. La anticoagulación se inició antes del TPC en la mayoría de los pacientes, pero la heparina no fraccionada se usó con más frecuencia en casos de EP-RA que en EP-RIA (tabla 3). La trombolisis local fue el método de TPC más frecuente en la cohorte general (70,8%), seguida de la trombectomía por aspiración (51,8%); el 23,3% de los pacientes recibieron ambos tratamientos. Sin embargo, la trombectomía por aspiración se vio favorecida en los pacientes con EP-RA en comparación con los pacientes con EP-RIA (el 80,6 frente al 35%; p<0,001) (tabla 3, figura 2 y figura 3). La mayoría de las intervenciones (77,3%) se consideraron urgentes (<24h desde el ingreso hospitalario), aunque se trató al 20,5% de los pacientes con EP-RA en menos de 2h desde el ingreso hospitalario. La mediana [intervalo intercuartílico] del tiempo de intervención fue de 60 [40-90] min.
Tratamiento intervencionista
| Tratamiento intervencionista | Todos los pacientes,N=253 | EP-RA,n=93 | EP-RIA,n=160 | p |
|---|---|---|---|---|
| Tratamiento anticoagulante inicial | <0,001 | |||
| HBPM antes del TPC | 96 (38) | 15 (16,1) | 81 (50,6) | |
| HNF antes o durante el TPC | 124 (49) | 65 (69,9) | 59 (36,9) | |
| Ninguno antes del TPC | 33 (13) | 13 (14) | 20 (12,5) | |
| Indicación de TPC después de una trombolisis que ha fracasado | 23 (9,1) | 18 (19,4) | 5 (3,1) | <0,001 |
| Tiempo de TPC (desde el ingreso hospitalario) | 0,001 | |||
| ≤ 2 h | 10 (10,3) | 15 (20,5) | 5 (4,1) | |
| > 2 y ≤ 24 h | 150 (77,3) | 52 (71,2) | 98 (81) | |
| > 24 h | 24 (12,4) | 6 (8,2) | 18 (14,9) | |
| No comunicado (n=59) | – | – | – | |
| Acceso vascular | <0,001 | |||
| Femoral | 139 (54,9) | 73 (78,5) | 66 (41,3) | |
| Braquial | 85 (33,6) | 4 (4,3) | 81 (50,6) | |
| Femoral-braquial mixto | 3 (1,2) | 1 (1,1) | 2 (1,3) | |
| Yugular | 4 (1,6) | 3 (3,2) | 1 (0,6) | |
| No comunicado (n=22) | 22 (8,7) | 12 (12,9) | 10 (6,3) | |
| Estrategia combinada de TPC* | 59 (23,3) | 34 (36,6) | 25 (15,6) | <0,001 |
| Estrategia de TPC: trombolisis local* | 179 (70,8) | 52 (55,9) | 127 (79,4) | <0,001 |
| Fármaco trombolítico local (n=179) | NA | |||
| rTPA (n=148), dosis media (mg) | 20,7±8 | 20,2±11,1 | 20,8±6,8 | |
| TNK (n=19), dosis media (unidades) | 3.576±2.085 | 3.663±2.659 | 3.514±1.692 | |
| No comunicado (n=12) | – | – | – | |
| Bolo antes de la perfusión | 79 (44,1) | 33 (78,6) | 46 (39,3) | <0,001 |
| Trombolisis local con ecografía | 5 (2,8) | 1 (1,9) | 4 (3,1) | <0,001 |
| Tiempo de perfusión, media (h) | 18,6±6,6 | 15,4±6,8 | 19,3±6,3 | 0,01 |
| Estrategia de TPC: trombectomía por aspiración* | 133 (51,8) | 75 (80,6) | 56 (35) | <0,001 |
| Catéter de aspiración (n=133) | NA | |||
| Indigo CAT8 (Penumbra, Estados Unidos) | 18 (13,5) | 13 (17,3) | 5 (8,6) | |
| FlowTriever (Inari Medical, Estados Unidos) | 17 (12,8) | 4 (5,3) | 13 (22,4) | |
| Nautilus (iVascular, España) | 5 (3,8) | 4 (5,3) | 1 (1,7) | |
| Pronto XL (Teleflex, Estados Unidos) | 5 (3,8) | 5 (6,7) | 0 | |
| Catéteres guía coronarios | 50 (37,6) | 33 (44) | 17 (29,3) | |
| Otros, catéteres no coronarios | 15 (11,3) | 6 (8) | 9 (15,5) | |
| No comunicado (n=23) | 23 (17,3) | 10 (13,3) | 13 (22,4) | |
| Fragmentación antes de la aspiración | 71 (53,4) | 45 (60) | 26 (44,8) | 0,082 |
| Vasopresores | 83 (32,8) | 67 (72) | 16 (10) | <0,001 |
| Ventilación mecánica no invasiva | 30 (11,9) | 23 (24,7) | 7 (4,4) | <0,001 |
| Ventilación mecánica | 42 (16,6) | 39 (41,9) | 3 (1,9) | <0,001 |
| Oxigenador extracorpóreo de membrana | 7 (2,8) | 7 (7,5) | 0 | <0,001 |
| Implante posterior a la intervención del filtro Cava | 11 (4,3) | 6 (6,5) | 5 (3,1) | <0,211 |
| Tratamiento anticoagulante al alta | NA | |||
| HBPM | 44 (17,4) | 19 (20,4) | 25 (15,6) | |
| Antagonistas de la vitamina K | 121 (47,8) | 26 (28) | 95 (59,4) | |
| Anticoagulantes orales de acción directa | 31 (12,3) | 8 (8,6) | 23 (14,4) | |
| Anticoagulantes orales no especificados | 45 (17,8) | 36 (38,7) | 9 (5,6) | |
| Ninguno | 12 (4,7) | 4 (4,3) | 8 (5) | |
| Oxigenoterapia al alta | 12 (4,7) | 2 (2,2) | 10 (6,3) | 0,139 |
EP-RA: embolia pulmonar de riesgo alto; EP-RIA: embolia pulmonar de riesgo intermedio-alto; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; NA: no aplicable, solo con fines descriptivos; rTPA: alteplasa; TPC: tratamiento por catéter; TNK: tenecteplasa.
Los detalles de la estrategia de tratamiento se resumen en la tabla 3. El sitio de acceso fue principalmente femoral en los pacientes con EP-RA (78,5%) y no femoral (principalmente venas antecubitales) en aquellos con EP-RIA (58,7%). En nuestro registro, solo a 51 pacientes (20,2%) se les dio TPC con dispositivos específicos: al 30,1% en intervenciones de EP-RA y al 14,4% en intervenciones de EP-RIA (p<0,003). El uso de dispositivos específicos para la EP aumentó con el tiempo y alcanzó el 73% en 2022 (figura 1 del material adicional). En la estrategia de trombolisis local se utilizó principalmente alteplasa, con una dosis media de 20,7±8mg durante una media de 18,6±6,6h. La trombolisis con ecografía fue poco frecuente (2,8%) y se utilizó el sistema EKOS (Boston Scientific, Estados Unidos). En la estrategia de trombectomía por aspiración, se utilizaron dispositivos específicos para la EP en solo el 35,1% de los pacientes y con mayor frecuencia (42%) se utilizaron catéteres guía coronarios (calibres 6 a 8 Fr). En el subgrupo de EP-RA, la necesidad de asistencia cardiorrespiratoria fue frecuente (el 72% con vasopresores, el 42% con ventilación mecánica y el 7,5% con oxigenador extracorpóreo de membrana), pero la necesidad de soporte fue poco frecuente en las intervenciones de EP-RIA.
Eficacia y seguridad del tratamiento por catéterEl éxito del TPC (definido como intervención técnica realizada sin complicaciones de la intervención ni muerte a las 48 h) fue del 90,9% (el 98,1% de los pacientes con EP-RIA frente al 78,5% de los pacientes con EP-RA; p<0,001). Los investigadores notificaron las mediciones preinvasivas y posinvasivas de 179 pacientes y las mediciones antes y después del ecocardiograma de 67 pacientes (tabla 2 del material adicional). La hemodinámica mejoró considerablemente después de la intervención, con un aumento medio de la presión sistólica de 10,5±20mmHg y un descenso medio de la presión pulmonar sistólica de 11,8±11mmHg. El diámetro del ventrículo derecho disminuyó una media de 6,1mm y el desplazamiento sistólico del plano del anillo tricuspídeo aumentó en 5,5mm (tabla 2 del material adicional). Durante el TPC, hubo 7 complicaciones (2,8%), 4 de ellas en pacientes con EP-RA (el 4,3% de los TPC en EP-RA) y 3 en EP-RIA (el 1,9% de los TPC en EP-RIA), pero solo 2 estaban claramente relacionadas con el dispositivo o el TPC (tabla 3 del material adicional). Hubo 2 complicaciones mortales, de las cuales 1 estaba claramente relacionada con el TPC (taponamiento cardiaco por una lesión directa del catéter) y otra, posiblemente relacionada (bloqueo auriculoventricular posiblemente traumático, pero en el contexto de un shock obstructivo profundo).
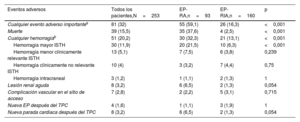
Objetivos clínicosLos eventos adversos hospitalarios se muestran en la tabla 4; hubo muchos más en los pacientes con EP-RA (59,1%) que en aquellos con EP-RIA (16,3%; p<0,001). La mortalidad hospitalaria fue del 15,5% y mucho mayor entre los pacientes con EP-RA (37,6%) que entre aquellos con EP-RIA (2,5%; p<0,001). Las causas de muerte hospitalaria fueron shock/parada cardiaca relacionados con la EP en 21 pacientes (51,3%), hemorragia mortal en 3 (7,7%), cáncer en 3 (7,7%), otras causas no relacionadas con la EP en 10 (25,6%), taponamiento cardiaco más shock relacionado con la EP en 1 (2,6%) y de causa desconocida en 1 (2,6%). La mediana de la estancia fue de 10 [8-16,5] días.
Eventos adversos hospitalarios
| Eventos adversos | Todos los pacientes,N=253 | EP-RA,n=93 | EP-RIA,n=160 | p |
|---|---|---|---|---|
| Cualquier evento adverso importantea | 81 (32) | 55 (59,1) | 26 (16,3) | <0,001 |
| Muerte | 39 (15,5) | 35 (37,6) | 4 (2,5) | <0,001 |
| Cualquier hemorragiab | 51 (20,2) | 30 (32,3) | 21 (13,1) | <0,001 |
| Hemorragia mayor ISTH | 30 (11,9) | 20 (21,5) | 10 (6,3) | <0,001 |
| Hemorragia menor clínicamente relevante ISTH | 13 (5,1) | 7 (7,5) | 6 (3,8) | 0,239 |
| Hemorragia clínicamente no relevante ISTH | 10 (4) | 3 (3,2) | 7 (4,4) | 0,75 |
| Hemorragia intracraneal | 3 (1,2) | 1 (1,1) | 2 (1,3) | 1 |
| Lesión renal aguda | 8 (3,2) | 6 (6,5) | 2 (1,3) | 0,054 |
| Complicación vascular en el sitio de acceso | 7 (2,8) | 2 (2,2) | 5 (3,1) | 0,715 |
| Nueva EP después del TPC | 4 (1,6) | 1 (1,1) | 3 (1,9) | 1 |
| Nueva parada cardiaca después del TPC | 8 (3,2) | 6 (6,5) | 2 (1,3) | 0,054 |
EP: embolia pulmonar; EP-RA: embolia pulmonar de alto riesgo; EP-RIA: embolia pulmonar de riesgo intermedio-alto; ISTH: International Society for Thrombosis and Haemostasis; TPC: tratamiento por catéter.
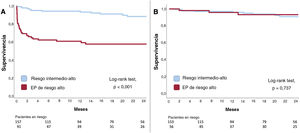
Se dispuso de datos de seguimiento de 250 pacientes (98,8%), con una media de seguimiento de 19,4±20 meses. La supervivencia a 1 mes fue mucho mayor en el grupo de EP-RIA que en el de EP-RA: la mortalidad a 1 mes fue del 1,3 frente al 29,3% (p<0,001). La mortalidad a largo plazo (24 meses) fue menor, del 8,2 frente al 40,2% (p<0,001) y las curvas de Kaplan-Meier mostraron que la mayoría de las muertes se produjeron en el primer mes (figura 4A). Curiosamente, la estimación de la supervivencia a largo plazo de los pacientes vivos al alta mostró que no había diferencias en la mortalidad a los 24 meses entre EP-RIA y EP-RA: el 5,8 frente al 5,3% (p<0,001) (figura 4B), lo que indica que no hubo una carga de mortalidad tardía después de sobrevivir a un cuadro clínico inicial de EP de mayor riesgo.
DISCUSIÓNLos resultados del estudio se pueden resumir de la siguiente manera: a) a pesar del gran éxito del TPC, la mortalidad de los pacientes con EP-RA fue elevada (el 37,6% murió durante el ingreso inicial), pero muy baja entre los pacientes con EP-RIA (2,5%); b) aproximadamente un tercio de los TPC de la EP se realizaron en pacientes con EP-RA, en comparación con pacientes con EP-RIA. La estrategia varió considerablemente, con un 80% de los pacientes con EP-RA sometidos a aspiración de trombo (con trombolisis local adicional o sin ella), mientras que el 60% de los pacientes con EP-RIA recibieron solo trombolisis local, y c) a diferencia del ictus o el infarto de miocardio, un cuadro clínico inicial de mayor riesgo de la EP no confirió un peor pronóstico a largo plazo después del ingreso inicial.
Embolia pulmonar de alto riesgoLos estudios contemporáneos muestran un índice de mortalidad hospitalaria del 6,5% en pacientes con EP no seleccionados (estable a lo largo de 2016-2019 en una gran base de datos administrativa de Estados Unidos)18. En cuanto a la EP-RA de la misma cohorte, que incluye varias estrategias de reperfusión, como el TPC, se redujo la mortalidad hospitalaria del 48,1 al 38,9%, cifras parecidas a las de la mortalidad por EP-RA en nuestro estudio (37,6%)18. La mortalidad de los pacientes con EP-RA es multifactorial y con frecuencia deriva del síndrome tras parada cardiaca o insuficiencia multiorgánica facilitada por shock obstructivo3. Para mejorar estas cifras tan elevadas, los servicios de urgencias y los EREP deben coordinarse para ofrecer a los pacientes un diagnóstico lo más rápido posible y un pronto acceso a reperfusión y cuidados intensivos de apoyo19,20. La evidencia que respalda el TPC en este entorno continúa siendo escasa y nuestro estudio es una de las mayores series (n=93) de TPC en EP-RA. Cuando se trata de pacientes inestables, el tiempo es un factor fundamental; por consiguiente, el momento y la estrategia de TPC deben tratarse en detalle. Si el TPC compite con la trombolisis sistémica, que puede administrarse prácticamente segundos después de tomar la decisión, este debe administrarse sin demora. En nuestro estudio, solo el 20,5% de los pacientes con EP-RA se sometieron a TPC en las primeras 2h desde el ingreso (80%). Una reciente declaración de consenso europea recomienda que el TPC se inicie de 60 a 90min después de la decisión o de 2 a 4h tras finalizar la trombolisis sistémica (si se considera que ha fracasado); sin embargo, este fue un consenso de expertos con poca o ninguna evidencia de apoyo, y este tema debe aclararse con futuros estudios5. Además, se debe considerar el tiempo hasta el beneficio al elegir una estrategia de TPC. La trombolisis local generalmente requiere al menos 12h de perfusión (aunque se han probado algunos protocolos más rápidos)21, pero la trombectomía por aspiración puede proporcionar una mejora hemodinámica en menos de 60min13,14. De hecho, en nuestro estudio se prefirió la trombectomía por aspiración a la trombolisis local (figura 3).
Embolia pulmonar de riesgo intermedio-altoLa EP-RIA es una categoría completamente diferente que surgió en la guía ESC 2014 e intentó abarcar a pacientes con EP estable que merecen una atención especial debido al riesgo de empeoramiento22. De hecho, el 7,2% de los pacientes con EP-RIA podrían morir a los 30 días23 y el 10,6% tiene un resultado adverso hospitalario (definido como muerte relacionada con la EP, reanimación cardiopulmonar o tratamiento con vasopresores)24. Nuestro estudio muestra que el TPC podría contribuir a reducir la mortalidad: la mortalidad hospitalaria fue del 2,5% en la cohorte general con EP-RIA y del 0% en el subgrupo de dispositivos específicos para la EP. En este contexto, está justificado un ensayo clínico aleatorizado con un grupo de tratamiento médico. Sin embargo, en su defecto, los estudios contemporáneos de TPC para EP-RIA con un solo grupo muestran una mortalidad muy baja: mortalidad a los 30 días, el 0,8% de en el registro FLASH13 y el 2,5% en el estudio Extract-PE14. Además, un metanálisis que comparó el TPC con la anticoagulación sistémica sola para la EP submasiva (n=9.789) notificó una reducción considerable de la mortalidad hospitalaria, que fue del 2,4% con TPC y el 6,3% con tratamiento médico (riesgo relativo, 0,41; intervalo de confianza del 95% (IC95%), 0,30-0,56; p<0,00001)9; de manera similar, en un metanálisis que incluyó a 65.589 pacientes con EP-RIA y EP-RA, el TPC mostró una disminución de la mortalidad a los 30 días en comparación con la trombolisis sistémica del 7,3 frente al 13,6% (odds ratio=0,51; IC95%, 0,38-0,69; p<0,001)10.
Resultados a largo plazoEl seguimiento de nuestros pacientes mostró que el pronóstico a largo plazo de los pacientes con EP-RA que sobrevivían al alta hospitalaria no fue peor que el de los pacientes con estabilidad hemodinámica al ingreso (figura 4). Este resultado es muy diferente que el de otros síndromes trombóticos importantes, como el infarto de miocardio, en el cual el tamaño del infarto se correlaciona con la mortalidad por cualquier causa a 1 año en pacientes dados de alta vivos25; el infarto de miocardio que se presenta con shock cardiogénico -que también se asocia con una mayor mortalidad a 1 y 5 años en pacientes que sobreviven más de 30 días o al alta hospitalaria26- y el ictus -cuya gravedad se asocia de manera independiente con el reingreso a 1 año27-. Este resultado respalda la necesidad de optimizar el tratamiento agudo de la EP a través de vías hospitalarias específicas (como, entre otras, los EREP) y redes locales y regionales extrahospitalarias como las redes de ictus o infarto de miocardio.
Dispositivos para el tratamiento por catéterSe necesita tiempo para perfeccionar cualquier nueva técnica de intervención mediante mejoras sucesivas del instrumental y de la planificación de la intervención. El acceso a las arterias pulmonares requiere cruzar con seguridad el corazón derecho y desplazarse a través de la tortuosidad anatómica. En este registro, 3 de 253 pacientes (1,2%) presentaron una posible lesión cardiaca directa relacionada con los propios catéteres o dispositivos, 2 de ellos con consecuencias mortales (solo uno de ellos con una relación clara). Estos eventos adversos deben notificarse adecuadamente y seguirse de cerca.
Además, el tamaño y el grado de organización frecuentemente alto de los trombos embolizados no facilitan la extracción. Los dispositivos contemporáneos específicos, como FlowTriever (Inari Medical, Estados Unidos)28 o Indigo System (Penumbra, Estados Unidos)14,29 están diseñados específicamente para esta tarea, pero no han podido utilizarse hasta 2022 (FlowTriever) y 2018 (Indigo 8 Fr). Nuestro registro también muestra una adopción escasa (pero creciente) de los dispositivos específicos para EP, lo que probablemente se relacione con el coste adicional y el reducido número de casos por hospital, lo que limita la progresión de la curva de aprendizaje con estos dispositivos. Continúa sin estar claro si el aumento general de las intervenciones con TPC o el uso de dispositivos específicos para EP han tenido repercusiones en los resultados de los pacientes con EP y justifica ensayos clínicos aleatorizados específicos.
LimitacionesEl registro tiene todos los posibles sesgos inherentes a los estudios observacionales. Sin embargo, se ha cumplido con las normas STROBE y el principal criterio de valoración fue la mortalidad por cualquier causa, que es un resultado con un menor riesgo de sesgo. El posible sesgo de selección podría haberse atenuado al incluir a pacientes consecutivos. Con todo, no se dispone de información sobre el número total de pacientes con EP evaluados o ingresados en el periodo de estudio, por lo que se debe reconocer un sesgo de supervivencia porque el registro representa solo a los pacientes que sobrevivieron a la evaluación del EREP y a la intervención de TPC. Para aumentar el número de pacientes incluidos, el periodo de estudio fue largo, lo que podría haber añadido heterogeneidad a las estrategias de tratamiento. Aunque hubo una invitación abierta a la participación, la iniciativa surgió de la Asociación de Cardiología Intervencionista, de modo que es probable que la radiología intervencionista esté infrarrepresentada. El registro contiene datos que facilitan los investigadores locales sin control externo, por lo que estos son los responsables de la integridad de los datos. Por último, el número de pacientes con dispositivos específicos para EP fue bajo (n=51). Por lo tanto, este registro no permite comparaciones entre dispositivos.
CONCLUSIONESUn tercio de los TPC para la EP se realizaron en pacientes con EP-RA mediante distintas estrategias (al 80% de los pacientes con EP-RA se les realizó trombectomía por aspiración y el 60% de los pacientes con EP-RIA recibieron trombolisis local). A pesar del gran éxito del TPC, la mortalidad hospitalaria en la EP-RA se mantuvo elevada (37,6%) en comparación con la mortalidad muy baja en la EP-RIA (2,5%).
- –
El tratamiento estándar de los pacientes con alto riesgo y los seleccionados con EP de riesgo intermedio-alto es la reperfusión por medio de trombolisis sistémica.
- –
Sin embargo, las contraindicaciones formales y el miedo a las complicaciones contribuyen a la infrautilización de la trombolisis sistémica.
- –
El TPC podría aumentar el número de pacientes tratados con reperfusión si está clínicamente indicado; con todo, existe una amplia heterogeneidad en las indicaciones, el acceso al tratamiento, las estrategias, los dispositivos y los resultados.
- –
El TPC es factible en pacientes con EP-RA, aunque la mortalidad continúa siendo elevada (el 37,6% murió durante el ingreso inicial). En este contexto, la práctica clínica favorece la trombectomía por aspiración.
- –
El TPC para pacientes seleccionados con EP de riesgo intermedio-alto se asocia con excelentes resultados (el 2,5% de mortalidad durante el ingreso inicial). La estrategia más frecuente fue la trombolisis local.
- –
A diferencia del ictus y el infarto de miocardio, una EP basal de mayor riesgo no confirió un peor pronóstico a largo plazo después del ingreso inicial.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESP. Salinas y J. Jiménez-Mazuecos diseñaron el esquema del estudio. P. Salinas diseñó el protocolo y la base de datos, coordinó el análisis e interpretación de los datos y redactó el artículo. M.E. Vázquez-Álvarez, N. Salvatella, V. Ruiz Quevedo, M. Velázquez Martín, E. Valero, E. Rumiz, A. Jurado-Román, I. Lozano, F. Gallardo, I.J. Amat-Santos, Ó. Lorenzo, J.J. Portero Portaz, M. Huanca, L. Nombela-Franco, B. Vaquerizo, R. Ramallal Martínez, N.M. Maneiro Melón, J. Sanchis, A. Berenguer, A. Gallardo-López, E. Gutiérrez-Ibañes, H. Mejía-Rentería y J.G. Córdoba-Soriano participaron en la recopilación de datos y también realizaron una revisión crítica del artículo. Todos los autores dieron la aprobación final de la versión que se envió para publicar.
CONFLICTO DE INTERESESJ. Sanchis es editor jefe de Rev Esp Cardiol. Se ha seguido el procedimiento editorial de la Revista para garantizar un tratamiento imparcial del artículo. Los demás autores no declaran ningún conflicto de intereses respecto a este manuscrito.
Los autores desean agradecer a los siguientes miembros del equipo de respuesta a la embolia pulmonar del Hospital Clínico San Carlos, que contribuye a la mejora continua en la atención al paciente y el desarrollo de este tratamiento: Noemí Ramos-López, Carlos Ferrera, Tania Sonia Luque Díaz, Daniel Enríquez-Vázquez, Patricia Mahía-Casado, Francisco Javier Noriega, Pablo Zulet Fraile, Fabián Islas, Pilar Jiménez-Quevedo, Nieves Gonzalo, Iván Núñez-Gil, Gabriela Tirado, Fernando Macaya, Javier Escaned, Ana María Mañas Hernández, Laura Galván-Herráez, José María Pedrajas, José Bustamante, Jaime Abelaira, Mónica Pérez Serrano, Esther Bernardo García, María Aranzazu Ortega Pozzi, Javier Higueras, Alberto de Agustín, Ana Viana-Tejedor, Carlos Real y Antonio Fernández-Ortiz.