El objetivo es analizar la incidencia, los predictores y el impacto pronóstico de la insuficiencia cardiaca (IC) aguda tras el implante percutáneo de una válvula aórtica (TAVI) con una prótesis autoexpandible.
MétodosDesde 2008, se incluye prospectivamente en nuestro registro de TAVI a todos los pacientes sometidos a TAVI en nuestro centro. Se analizan los factores pronósticos determinantes de IC aguda, y la relación con la mortalidad mediante modelos de regresión de Cox.
ResultadosSe sometieron a TAVI 399 pacientes, con una media de edad de 82,4 ± 5,8 años, de los que 213 (53,4%) eran mujeres. Durante el seguimiento (27,0 ± 24,1 meses), el 29,8% de los pacientes (n = 119) ingresaron en el hospital con el diagnóstico de IC aguda, lo que representa una incidencia anual del 13,2% (IC95%, 11,1-15,8%). Al final del seguimiento, habían fallecido 150 pacientes (37,59%). En el grupo de IC aguda se evidenció una tasa de mortalidad significativamente mayor (el 52,1 frente al 31,4%; HR = 1,84; IC95%, 1,14-2,97; p < 0,012). El diagnóstico previo de IC (p = 0,019) y la puntuación de la Society of Thoracic Surgeons (p = 0,004) se identificaron como predictores independientes de IC aguda tras el TAVI. Además, el índice de riesgo nutricional y la enfermedad pulmonar obstructiva crónica son los principales factores que ensombrecen el pronóstico dentro del grupo de IC aguda.
ConclusionesEl TAVI se asocia con una alta incidencia de eventos de IC aguda, lo que supone un gran impacto en la mortalidad. La IC aguda previa al implante y la puntuación de la Society of Thoracic Surgeons fueron los únicos predictores de IC aguda hallados. Un índice de riesgo nutricional bajo y la enfermedad pulmonar obstructiva crónica son potentes determinantes de mortalidad en el grupo de IC aguda.
Palabras clave
La estenosis aórtica (EA) degenerativa ha pasado a ser la valvulopatía de mayor prevalencia en los países desarrollados y tiene una incidencia creciente a causa del envejecimiento progresivo de la población1,2. Se ha demostrado que el implante percutáneo de válvula aórtica (TAVI) reduce la mortalidad en comparación con el tratamiento médico conservador en los pacientes con EA grave. También constituye una opción sólida para el tratamiento de los pacientes con un riesgo quirúrgico alto o prohibitivo como alternativa al reemplazo quirúrgico de la válvula aórtica3,4. Además, 2 estudios recientes, el PARTNER 25 y el SURTAVI6, han demostrado la no inferioridad del TAVI respecto a la cirugía convencional en los pacientes con riesgo intermedio, con resultados superiores cuando se usó la vía femoral7.
Los pacientes seleccionados para tratamiento con TAVI presentan con frecuencia comorbilidades importantes que determinan el curso clínico durante la hospitalización y que pueden implicar un mayor número de reingresos después de la intervención. El número de reingresos ha disminuido en los últimos años a causa de la mayor experiencia de los operadores y la menor frecuencia de complicaciones con los dispositivos y sistemas de aplicación más recientes. La insuficiencia cardiaca aguda (ICA) es una de las causas de reingreso de mayor prevalencia en este grupo de pacientes, según lo descrito en varias series y registros8,9.
Las puntuaciones de riesgo han pasado a ser una herramienta importante para la predicción de los resultados de la intervención y posteriores a ella en los pacientes a los que se practica un TAVI. Se observó que el EuroSCORE (European System for Cardiac Operative Risk Evaluation) logístico sobrestimaba el riesgo periintervención en el TAVI, sobre todo en los pacientes con alto riesgo, por lo que se abandonó su uso. El EuroSCORE II y la puntuación de la Society of Thoracic Surgeons (STS) resultaron más exactos en los pacientes tratados con TAVI, por lo que se emplean actualmente para estimar el riesgo de muerte de los pacientes a los que se practica esta intervención10,11.
En el presente estudio se analiza la incidencia de rehospitalización tras el TAVI en pacientes con un diagnóstico principal de ICA y se centra en la repercusión pronóstica que tiene en nuestra cohorte. Asimismo, se buscan posibles predictores del reingreso por ICA y se analizan los factores que pudieran modificar el pronóstico en este subgrupo, lo que podría ayudar a identificar un perfil de pacientes con alto riesgo de complicaciones. La intensificación del tratamiento médico y un seguimiento más estrecho podrían evitar los reingresos, con la consiguiente mejora de la calidad de vida de estos pacientes.
MÉTODOSPoblaciónSe realizó un estudio observacional, prospectivo, de un solo centro. Se incluyó a todos los pacientes a los que se practicó un TAVI en nuestro hospital universitario entre noviembre de 2008 y junio de 2017 (n = 399). Se seleccionó a todos los pacientes para un reemplazo percutáneo según las recomendaciones de las guías de práctica clínica en vigor en ese momento; solo se incluyó a pacientes con una esperanza de vida de más de 1 año y estenosis aórtica sintomática grave. La indicación de TAVI se estableció según las guías existentes en el momento de la inclusión. Un equipo cardiaco multidisciplinario, formado por cardiólogos clínicos, cardiólogos intervencionistas y cirujanos cardiacos, había comentado todos los casos. Todos los pacientes firmaron voluntariamente documentos de consentimiento antes de la intervención.
Los principales factores que contribuyeron a la decisión de realizar la intervención percutánea en vez de un reemplazo quirúrgico de válvula aórtica fueron el riesgo quirúrgico alto o inaceptable, la fragilidad asociada con la edad avanzada y las contraindicaciones técnicas para la cirugía (la más frecuente, la presencia de una aorta de porcelana).
IntervenciónEn la mayoría de los pacientes, el TAVI se realizó con anestesia local y sedación leve consciente. Se utilizó anestesia general en un 8% (n = 30) de las intervenciones, cuando se prefirió el empleo de un abordaje arterial distinto del femoral. En la mayor parte de las intervenciones se usó la vía femoral. Cuando ello no fue posible, la vía de abordaje elegida fue la arteria axilar. Se utilizó la técnica estándar descrita en la literatura médica12.
Se implantó una prótesis biológica Medtronic en la mayoría de los pacientes: CoreValve, CoreValve Evolut R o CoreValve Evolut Pro (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos), dependiendo de su disponibilidad en el momento de la intervención. En un pequeño porcentaje de pacientes se utilizaron dispositivos ACURATE-Neo (Symetis S.A.; Ecublens, Suiza).
Antes de la intervención se realizó una ecocardiografía bidimensional y una coronariografía diagnóstica a todos los pacientes. Como parte de nuestro protocolo habitual, se utilizó la tomografía computarizada para determinar la anatomía de la raíz aórtica y la idoneidad de las vías de acceso vascular. Las complicaciones observadas durante la intervención se registraron según lo establecido en el documento de consenso del Valve Academic Research Consortium-2 (VARC-2)13.
Este estudio se realizó cumpliendo los principios de la Declaración de Helsinki.
SeguimientoTodos los datos relativos al evento se registraron en la historia clínica electrónica de los pacientes. En nuestro registro de TAVI, cardiólogos adecuadamente capacitados realizaron el seguimiento empleando registros previos. Nuestro protocolo incluye llamadas telefónicas y un examen de las historias clínicas electrónicas. Se examinaron todas las intervenciones médicas, los ingresos hospitalarios y los tratamientos farmacológicos. Si no se disponía de historia clínica, se determinó el estado vital del paciente mediante llamadas telefónicas. No se perdió el seguimiento de ningún paciente.
Siguiendo el protocolo establecido, se realizó a todos los pacientes como mínimo 1 ecocardiografía de seguimiento tras el alta y otra 3 meses más tarde. Posteriormente se realizaron ecocardiografías 1 vez al año.
Variables evaluadasLa ICA se definió siguiendo lo establecido en la guía de práctica clínica vigente en el momento del reclutamiento14, con el empleo de datos clínicos y radiológicos. El índice de riesgo nutricional (IRN) se calculó como 1,519 × albúmina en suero (g/l)+41,7 × (peso corporal real [kg] / peso corporal ideal [kg]), utilizando la fórmula modificada para los ancianos por Bouillanne et al.15. El peso corporal ideal se determinó con la fórmula de Lorentz15: estatura (cm) − 100 − ([estatura (cm) − 150] / 4) para los varones o estatura (cm) − 100 − ([estatura (cm) − 150] / 2,5) para las mujeres. Si el cociente del peso corporal medido (kg) respecto al peso corporal ideal (kg) era ≥ 1, el valor asignado era 1, según lo descrito en publicaciones anteriores15,16. El IRN se calculó empleando el peso corporal medido el día del TAVI, y el valor de la albúmina se obtuvo de la muestra de sangre extraída el día antes. Mediante los valores de IRN, se clasificó a los pacientes en 4 grupos: sin riesgo nutricional (IRN > 100), riesgo nutricional leve (97,5 ≤ IRN < 100), riesgo nutricional moderado (83,5 ≤ IRN < 97,4) y riesgo nutricional grave (IRN < 83,5). Para simplificar el modelo, se establecieron 2 categorías de riesgo mediante la combinación de las siguientes: riesgo nutricional nulo o leve y riesgo nutricional moderado o grave.
La presencia y la gravedad de la insuficiencia aórtica paravalvular se evaluaron mediante ecocardiografía transtorácica. Se realizó una ecocardiografía transesofágica a los pacientes con una ventana acústica subóptima.
Análisis estadísticoEl análisis estadístico se realizó con los programas SPSS versión 22.0 y Stata versión 13. Las características según la aparición de insuficiencia cardiaca (IC) tras el TAVI durante el seguimiento se describen mediante número y porcentaje para las variables cualitativas y la media ± desviación estándar para las variables continuas respectivamente. Las diferencias existentes en las características se evaluaron con las pruebas de la χ2 y de la t de Student para 2 muestras.
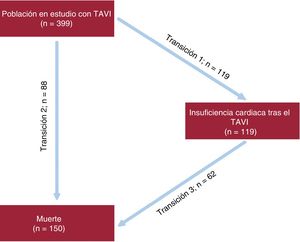
La asociación entre la IC tras el TAVI y la mortalidad se evaluó con análisis de regresión de riesgos proporcionales de Cox tomando la «IC post-TAVI» como variable dependiente del tiempo. Los resultados se presentaron gráficamente con curvas de Kaplan-Meier. Dado que la hospitalización por IC y la muerte son riesgos en semicompetencia, por cuanto la muerte impide una posterior hospitalización por IC pero puede producirse después de una hospitalización por IC, se utilizó un modelo de multiestado acíclico de enfermedad-muerte17. En dicho modelo, todos los participantes se encontraban en el estado inicial de «alta después del TAVI» y tenían un riesgo de hospitalización por IC (transición 1) o de muerte sin hospitalización por IC precedente (transición 2). Además, los pacientes que fueron hospitalizados por IC tenían también un riesgo de muerte tras una hospitalización por IC (transición 3) (figura 1). Se elaboró un modelo de regresión de enfermedad-muerte con el empleo de una parametrización de Weibull con objeto de modelizar el efecto de las covariables en los riesgos de causa específica de las 3 transiciones de estado, con riesgos iniciales no parámetros separados (estratificados) para las transiciones al estado de «IC post-TAVI» y al estado de «muerte». Todas las variables asociadas con una IC post-TAVI según lo indicado por un valor de p < 0,05 en los análisis univariantes se incluyeron en un modelo multivariante, junto con las variables clínicamente relevantes. Se calcularon los valores de hazard ratio (HR) junto con los intervalos de confianza del 95% (IC95%).
RESULTADOSCaracterísticas iniciales, incidencia y predictores de la ICA tras el TAVISe incluyó en nuestro registro a un total de 399 pacientes con EA grave tratados con TAVI entre 2008 y 2017. La media de edad de la cohorte era 82,4 ± 5,8 años y el 53,4% (n = 213) eran mujeres.
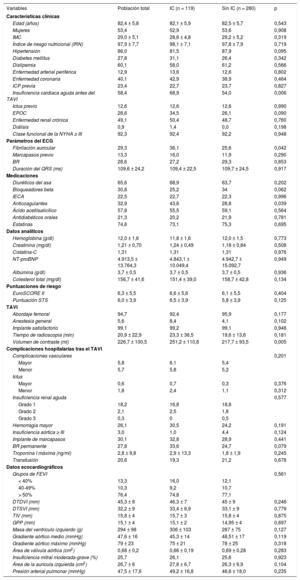
En la tabla 1 se presentan las características iniciales de la población total y de cada grupo, incluidos los datos de la historia clínica, las características ecocardiográficas, los detalles de la intervención y los resultados durante la hospitalización.
Características iniciales de la población total y de cada grupo
| Variables | Población total | IC (n = 119) | Sin IC (n = 280) | p |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad (años) | 82,4 ± 5,8 | 82,1 ± 5,9 | 82,5 ± 5,7 | 0,543 |
| Mujeres | 53,4 | 52,9 | 53,6 | 0,908 |
| IMC | 29,0 ± 5,1 | 28,6 ± 4,8 | 29,2 ± 5,2 | 0,319 |
| Índice de riesgo nutricional (IRN) | 97,9 ± 7,7 | 98,1 ± 7,1 | 97,8 ± 7,9 | 0,719 |
| Hipertensión | 86,0 | 81,5 | 87,9 | 0,095 |
| Diabetes mellitus | 27,8 | 31,1 | 26,4 | 0,342 |
| Dislipemia | 60,1 | 58,0 | 61,2 | 0,566 |
| Enfermedad arterial periférica | 12,9 | 13,6 | 12,6 | 0,802 |
| Enfermedad coronaria | 40,1 | 42,9 | 38,9 | 0,464 |
| ICP previa | 23,4 | 22,7 | 23,7 | 0,827 |
| Insuficiencia cardiaca aguda antes del TAVI | 58,4 | 68,9 | 54,0 | 0,006 |
| Ictus previo | 12,6 | 12,6 | 12,6 | 0,990 |
| EPOC | 28,6 | 34,5 | 26,1 | 0,090 |
| Enfermedad renal crónica | 49,1 | 50,4 | 48,7 | 0,760 |
| Diálisis | 0,9 | 1,4 | 0,0 | 0,198 |
| Clase funcional de la NYHA ≥ III | 92,3 | 92,4 | 92,2 | 0,948 |
| Parámetros del ECG | ||||
| Fibrilación auricular | 29,3 | 36,1 | 25,6 | 0,042 |
| Marcapasos previo | 13,3 | 16,0 | 11,9 | 0,290 |
| BR | 28,6 | 27,2 | 29,3 | 0,853 |
| Duración del QRS (ms) | 109,6 ± 24,2 | 109,4 ± 22,5 | 109,7 ± 24,5 | 0,917 |
| Medicaciones | ||||
| Diuréticos del asa | 65,6 | 68,9 | 63,7 | 0,202 |
| Bloqueadores beta | 30,8 | 25,2 | 34 | 0,062 |
| IECA | 22,5 | 22,7 | 22,3 | 0,996 |
| Anticoagulantes | 32,9 | 43,6 | 28,8 | 0,039 |
| Ácido acetilsalicílico | 57,8 | 55,5 | 59,1 | 0,564 |
| Antidiabéticos orales | 21,3 | 20,2 | 21,9 | 0,781 |
| Estatinas | 74,6 | 73,1 | 75,3 | 0,695 |
| Datos analíticos | ||||
| Hemoglobina (g/dl) | 12,0 ± 1,6 | 11,8 ± 1,6 | 12,0 ± 1,5 | 0,773 |
| Creatinina (mg/dl) | 1,21 ± 0,70 | 1,24 ± 0,49 | 1,18 ± 0,84 | 0,508 |
| Cistatina-C | 1,31 | 1,31 | 1,31 | 0,976 |
| NT-proBNP | 4.913,5 ± 13.764,3 | 4.843,1 ± 10.049,4 | 4.942,7 ± 15.092,7 | 0,949 |
| Albúmina (g/dl) | 3,7 ± 0,5 | 3,7 ± 0,5 | 3,7 ± 0,5 | 0,936 |
| Colesterol total (mg/dl) | 156,7 ± 41,6 | 151,4 ± 39,0 | 158,7 ± 42,8 | 0,134 |
| Puntuaciones de riesgo | ||||
| EuroSCORE II | 6,3 ± 5,5 | 6,6 ± 5,6 | 6,1 ± 5,5 | 0,404 |
| Puntuación STS | 6,0 ± 3,9 | 6,5 ± 3,9 | 5,8 ± 3,9 | 0,125 |
| TAVI | ||||
| Abordaje femoral | 94,7 | 92,4 | 95,9 | 0,177 |
| Anestesia general | 5,6 | 8,4 | 4,1 | 0,102 |
| Implante satisfactorio | 99,1 | 99,2 | 99,1 | 0,946 |
| Tiempo de radioscopia (min) | 20,9 ± 22,9 | 23,3 ± 36,5 | 19,6 ± 13,6 | 0,181 |
| Volumen de contraste (ml) | 226,7 ± 100,5 | 251,2 ± 110,8 | 217,7 ± 93,5 | 0,005 |
| Complicaciones hospitalarias tras el TAVI | ||||
| Complicaciones vasculares | 0,201 | |||
| Mayor | 5,8 | 6,1 | 5,4 | |
| Menor | 5,7 | 5,8 | 5,2 | |
| Ictus | ||||
| Mayor | 0,6 | 0,7 | 0,3 | 0,376 |
| Menor | 1,8 | 2,4 | 1,1 | 0,312 |
| Insuficiencia renal aguda | 0,577 | |||
| Grado 1 | 18,2 | 16,8 | 18,8 | |
| Grado 2 | 2,1 | 2,5 | 1,8 | |
| Grado 3 | 0,3 | 0 | 0,5 | |
| Hemorragia mayor | 26,1 | 30,5 | 24,2 | 0,191 |
| Insuficiencia aórtica ≥ III | 3,0 | 1,0 | 4,4 | 0,124 |
| Implante de marcapasos | 30,1 | 32,8 | 28,9 | 0,441 |
| BR permanente | 27,8 | 33,6 | 24,7 | 0,079 |
| Troponina I máxima (ng/ml) | 2,8 ± 9,8 | 2,9 ± 13,3 | 1,8 ± 1,9 | 0,245 |
| Transfusión | 20,6 | 19,3 | 21,2 | 0,678 |
| Datos ecocardiográficos | ||||
| Grupos de FEVI | 0,561 | |||
| < 40% | 13,3 | 16,0 | 12,1 | |
| 40-49% | 10,3 | 9,2 | 10,7 | |
| > 50% | 76,4 | 74,8 | 77,1 | |
| DTDVI (mm) | 45,3 ± 8 | 46,3 ± 7 | 45 ± 9 | 0,246 |
| DTSVI (mm) | 32,2 ± 9 | 33,4 ± 8,9 | 33,1 ± 9 | 0,779 |
| TIV (mm) | 15,8 ± 4 | 15,7 ± 3 | 15,8 ± 4 | 0,875 |
| GPP (mm) | 15,1 ± 4 | 15,1 ± 2 | 14,95 ± 4 | 0,697 |
| Masa del ventrículo izquierdo (g) | 294 ± 98 | 306 ± 103 | 287 ± 75 | 0,127 |
| Gradiente aórtico medio (mmHg) | 47,6 ± 16 | 45,3 ± 14 | 48,51 ± 17 | 0,119 |
| Gradiente aórtico máximo (mmHg) | 79 ± 23 | 75 ± 21 | 78 ± 25 | 0,318 |
| Área de válvula aórtica (cm2) | 0,68 ± 0,2 | 0,66 ± 0,19 | 0,69 ± 0,28 | 0,283 |
| Insuficiencia mitral moderada-grave (%) | 25,7 | 26,1 | 25,6 | 0,923 |
| Área de la aurícula izquierda (cm2) | 26,7 ± 6 | 27,8 ± 6,7 | 26,3 ± 6,9 | 0,104 |
| Presión arterial pulmonar (mmHg) | 47,5 ± 17,6 | 49,2 ± 16,8 | 46,6 ± 18,0 | 0,235 |
BR: bloqueo de rama; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; ECG: electrocardiograma; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; GPP: grosor de la pared posterior; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; TIV: tabique interventricular.
Los valores expresan porcentaje en los datos cualitativos y media ± desviación estándar en las variables continuas.
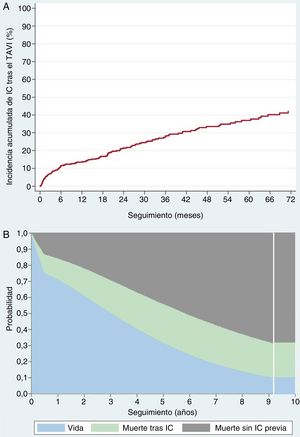
Tras una media de seguimiento de 27 ± 24,1 meses y una mediana de 21 [intervalo intercuartílico, 6,5-40,7] meses, un total de 119 pacientes (29,82%) ingresaron con un diagnóstico final de ICA (función de incidencia acumulada, 13,2%; IC95%, 11,1-15,8%) (figura 2A). La media de tiempo transcurrido hasta la aparición de la IC tras la intervención fue de 20,9 ± 21,3 meses, con una mediana de 16,1 [3,2-32,2] meses; el 39,5% de los episodios de ICA (n = 47) se produjeron durante los primeros 6 meses tras el implante valvular.
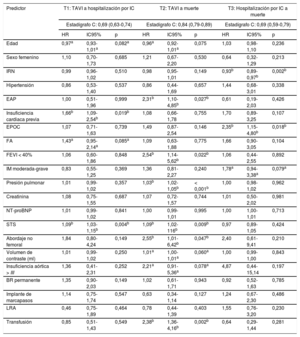
Los resultados del análisis multivariante se presentan en la tabla 2. Antes de la intervención, los episodios de ICA y la puntuación STS elevada fueron los únicos factores predictivos independientes para la ICA posterior a la intervención. No hubo diferencias entre los grupos en cuanto a la fracción de eyección del ventrículo izquierdo (ni siquiera al aplicar una estratificación según la clasificación de la guía de IC más reciente)18.
Resultados del análisis multivariante
| Predictor | T1: TAVI a hospitalización por IC | T2: TAVI a muerte | T3: Hospitalización por IC a muerte | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Estadígrafo C: 0,69 (0,63-0,74) | Estadígrafo C: 0,84 (0,79-0,89) | Estadígrafo C: 0,69 (0,59-0,79) | |||||||
| HR | IC95% | p | HR | IC95% | p | HR | IC95% | p | |
| Edad | 0,97a | 0,93-1,01a | 0,082a | 0,96a | 0,92-1,01a | 0,075 | 1,03 | 0,98-1,10 | 0,236 |
| Sexo femenino | 1,10 | 0,70-1,73 | 0,685 | 1,21 | 0,67-2,20 | 0,530 | 0,64 | 0,32-1,29 | 0,213 |
| IRN | 0,99 | 0,96-1,02 | 0,510 | 0,98 | 0,95-1,01 | 0,149 | 0,93b | 0,89-0,97b | 0,002b |
| Hipertensión | 0,86 | 0,53-1,40 | 0,537 | 0,86 | 0,44-1,69 | 0,657 | 1,44 | 0,68-3,01 | 0,338 |
| EAP | 1,00 | 0,51-1,96 | 0,999 | 2,31b | 1,10-4,85b | 0,027b | 0,61 | 0,19-2,03 | 0,426 |
| Insuficiencia cardiaca previa | 1,66b | 1,09-2,54b | 0,019b | 1,08 | 0,66-1,78 | 0,755 | 1,70 | 0,89-3,25 | 0,107 |
| EPOC | 1,07 | 0,71-1,63 | 0,739 | 1,49 | 0,87-2,54 | 0,146 | 2,35b | 1,15-4,80b | 0,018b |
| FA | 1,43a | 0,95-2,14a | 0,085a | 1,09 | 0,63-1,88 | 0,775 | 1,66 | 0,90-3,05 | 0,104 |
| FEVI < 40% | 1,06 | 0,60-1,86 | 0,848 | 2,54b | 1,14-5,62b | 0,022b | 1,06 | 0,44-2,55 | 0,892 |
| IM moderada-grave | 0,83 | 0,55-1,25 | 0,369 | 1,36 | 0,81-2,27 | 0,240 | 1,78a | 0,94-3,38a | 0,079a |
| Presión pulmonar | 1,01 | 0,99-1,02 | 0,357 | 1,03b | 1,02-1,05b | < 0,001b | 1,00 | 0,98-1,02 | 0,962 |
| Creatinina | 1,08 | 0,75-1,55 | 0,687 | 1,07 | 0,72-1,57 | 0,744 | 1,01 | 0,50-2,02 | 0,981 |
| NT-proBNP | 1,01 | 0,99-1,02 | 0,841 | 1,00 | 0,99-1,01 | 0,995 | 1,00 | 1,00-1,01 | 0,713 |
| STS | 1,09b | 1,03-1,15b | 0,004b | 1,09b | 1,02-116b | 0,009b | 0,97 | 0,89-1,05 | 0,424 |
| Abordaje no femoral | 1,84 | 0,80-4,24 | 0,149 | 2,55b | 1,01-6,42b | 0,047b | 2,40 | 0,61-9,41 | 0,210 |
| Volumen de contraste (ml) | 1,01 | 0,99-1,02 | 0,250 | 1,01a | 1,00-1,01a | 0,060a | 1,00 | 0,99-1,00 | 0,843 |
| Insuficiencia aórtica > III | 1,36 | 0,41-2,31 | 0,252 | 2,21a | 0,91-5,36a | 0,078a | 4,87 | 0,44-15,14 | 0,197 |
| BR permanente | 1,35 | 0,90-2,03 | 0,149 | 1,02 | 0,61-1,71 | 0,943 | 0,92 | 0,52-1,63 | 0,785 |
| Implante de marcapasos | 1,14 | 0,75-1,74 | 0,547 | 0,63 | 0,34-1,14 | 0,127 | 1,24 | 0,67-2,30 | 0,486 |
| LRA | 0,46 | 0,75-1,89 | 0,464 | 0,78 | 0,44-1,39 | 0,403 | 1,55 | 0,76-3,20 | 0,230 |
| Transfusión | 0,85 | 0,51-1,43 | 0,549 | 2,38b | 1,36-4,16b | 0,002b | 0,64 | 0,29-1,44 | 0,281 |
BR: bloqueo de rama; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IM: insuficiencia mitral; IRN: índice de riesgo nutricional; LRA: lesión renal aguda; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica.
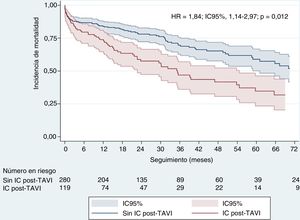
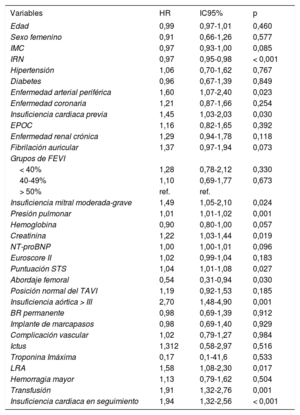
Durante el seguimiento, se produjeron 150 muertes en nuestra cohorte: 31 pacientes (el 20% del total de muertes) durante los primeros 30 días y 119 durante el resto del seguimiento (figura 2B). Los factores asociados con una mayor mortalidad se resumen en la tabla 3 (univariante) y la tabla 2 (multivariante) (tabla 2 y tabla 3 para los pacientes con y sin ICA durante el seguimiento respectivamente). Tras un ajuste respecto a esos factores, la ICA fue un potente factor independiente predictivo de mortalidad (HR = 1,84; IC95%, 1,14-2,97; p < 0,12), con una tasa de mortalidad de casi el doble en comparación con lo observado en los pacientes sin ICA en el seguimiento (figura 3).
Factores asociados con mayor mortalidad
| Variables | HR | IC95% | p |
|---|---|---|---|
| Edad | 0,99 | 0,97-1,01 | 0,460 |
| Sexo femenino | 0,91 | 0,66-1,26 | 0,577 |
| IMC | 0,97 | 0,93-1,00 | 0,085 |
| IRN | 0,97 | 0,95-0,98 | < 0,001 |
| Hipertensión | 1,06 | 0,70-1,62 | 0,767 |
| Diabetes | 0,96 | 0,67-1,39 | 0,849 |
| Enfermedad arterial periférica | 1,60 | 1,07-2,40 | 0,023 |
| Enfermedad coronaria | 1,21 | 0,87-1,66 | 0,254 |
| Insuficiencia cardiaca previa | 1,45 | 1,03-2,03 | 0,030 |
| EPOC | 1,16 | 0,82-1,65 | 0,392 |
| Enfermedad renal crónica | 1,29 | 0,94-1,78 | 0,118 |
| Fibrilación auricular | 1,37 | 0,97-1,94 | 0,073 |
| Grupos de FEVI | |||
| < 40% | 1,28 | 0,78-2,12 | 0,330 |
| 40-49% | 1,10 | 0,69-1,77 | 0,673 |
| > 50% | ref. | ref. | |
| Insuficiencia mitral moderada-grave | 1,49 | 1,05-2,10 | 0,024 |
| Presión pulmonar | 1,01 | 1,01-1,02 | 0,001 |
| Hemoglobina | 0,90 | 0,80-1,00 | 0,057 |
| Creatinina | 1,22 | 1,03-1,44 | 0,019 |
| NT-proBNP | 1,00 | 1,00-1,01 | 0,096 |
| Euroscore II | 1,02 | 0,99-1,04 | 0,183 |
| Puntuación STS | 1,04 | 1,01-1,08 | 0,027 |
| Abordaje femoral | 0,54 | 0,31-0,94 | 0,030 |
| Posición normal del TAVI | 1,19 | 0,92-1,53 | 0,185 |
| Insuficiencia aórtica > III | 2,70 | 1,48-4,90 | 0,001 |
| BR permanente | 0,98 | 0,69-1,39 | 0,912 |
| Implante de marcapasos | 0,98 | 0,69-1,40 | 0,929 |
| Complicación vascular | 1,02 | 0,79-1,27 | 0,984 |
| Ictus | 1,312 | 0,58-2,97 | 0,516 |
| Troponina Imáxima | 0,17 | 0,1-41,6 | 0,533 |
| LRA | 1,58 | 1,08-2,30 | 0,017 |
| Hemorragia mayor | 1,13 | 0,79-1,62 | 0,504 |
| Transfusión | 1,91 | 1,32-2,76 | 0,001 |
| Insuficiencia cardiaca en seguimiento | 1,94 | 1,32-2,56 | < 0,001 |
BR: bloqueo de rama; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; IRN: índice de riesgo nutricional; LRA: lesión renal aguda; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; ref.: grupo de referencia; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica.
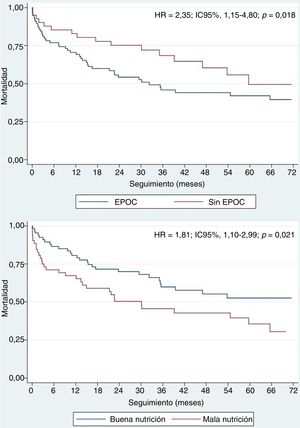
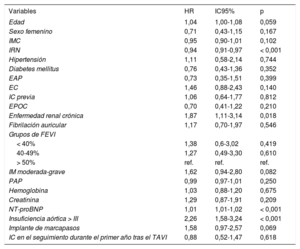
De los 119 pacientes que presentaron una IC durante el seguimiento, fallecieron 62 (52,1%), y la media de tiempo transcurrido entre el primer evento de IC y la muerte fue de 25,7 ± 16,7 meses, con una mediana de 16,8 [7,0-35,5] meses. En la tabla 4 se presentan los factores predictivos de la mortalidad en este subgrupo de pacientes. El análisis univariante de los pacientes rehospitalizados por ICA que fallecieron puso de manifiesto que eran de más edad, tenían con mayor frecuencia de FA e insuficiencia renal, presentaban un mayor riesgo de desnutrición (evaluada con el IRN) y mostraban un aumento de los valores de la fracción aminoterminal del propéptido natriurético cerebral. En los parámetros ecocardiográficos tan solo se observaron diferencias estadísticamente significativas en cuanto a la insuficiencia mitral mayor que moderada y la insuficiencia aórtica de grado ≥ III. En el análisis multivariante (tabla 2 y tabla 3), tan solo se identificó el IRN reducido (HR = 0,93; IC95%, 0,89-0,97; p = 0,002) y la enfermedad pulmonar obstructiva crónica (HR = 2,35; IC95%, 1,15-4,80; p = 0,018) como variables con una asociación significativa con mayor mortalidad (figura 4).
Factores predictivos de la mortalidad en el subgrupo de pacientes que sufrieron IC durante el seguimiento
| Variables | HR | IC95% | p |
|---|---|---|---|
| Edad | 1,04 | 1,00-1,08 | 0,059 |
| Sexo femenino | 0,71 | 0,43-1,15 | 0,167 |
| IMC | 0,95 | 0,90-1,01 | 0,102 |
| IRN | 0,94 | 0,91-0,97 | < 0,001 |
| Hipertensión | 1,11 | 0,58-2,14 | 0,744 |
| Diabetes mellitus | 0,76 | 0,43-1,36 | 0,352 |
| EAP | 0,73 | 0,35-1,51 | 0,399 |
| EC | 1,46 | 0,88-2,43 | 0,140 |
| IC previa | 1,06 | 0,64-1,77 | 0,812 |
| EPOC | 0,70 | 0,41-1,22 | 0,210 |
| Enfermedad renal crónica | 1,87 | 1,11-3,14 | 0,018 |
| Fibrilación auricular | 1,17 | 0,70-1,97 | 0,546 |
| Grupos de FEVI | |||
| < 40% | 1,38 | 0,6-3,02 | 0,419 |
| 40-49% | 1,27 | 0,49-3,30 | 0,610 |
| > 50% | ref. | ref. | ref. |
| IM moderada-grave | 1,62 | 0,94-2,80 | 0,082 |
| PAP | 0,99 | 0,97-1,01 | 0,250 |
| Hemoglobina | 1,03 | 0,88-1,20 | 0,675 |
| Creatinina | 1,29 | 0,87-1,91 | 0,209 |
| NT-proBNP | 1,01 | 1,01-1,02 | < 0,001 |
| Insuficiencia aórtica > III | 2,26 | 1,58-3,24 | < 0,001 |
| Implante de marcapasos | 1,58 | 0,97-2,57 | 0,069 |
| IC en el seguimiento durante el primer año tras el TAVI | 0,88 | 0,52-1,47 | 0,618 |
EAP: enfermedad arterial periférica; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IM: insuficiencia mitral; IMC: índice de masa corporal; IRNI: índice de riesgo nutricional; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PAP: presión arterial pulmonar; ref.: grupo de referencia; TAVI: implante percutáneo de válvula aórtica.
Curvas de supervivencia de Kaplan-Meier ajustadas para los factores independientes predictivos de la mortalidad de los pacientes con insuficiencia cardiaca tras un implante percutáneo de válvula aórtica. EPOC: enfermedad pulmonar obstructiva crónica; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
En nuestro registro de TAVI, se recogen los datos de un solo centro de alto volumen, experto en TAVI, con la inclusión de 399 pacientes tratados con esa intervención. Hasta donde se sabe, este es el primer estudio en el que se evalúan la incidencia, la repercusión pronóstica y los factores predictivos de ingreso hospitalario por ICA después del TAVI con el dispositivo CoreValve. Los principales resultados de nuestro estudio son los siguientes: a) hubo una gran incidencia de episodios de ICA que requirieron ingreso hospitalario, la mayor parte de ellos con fracción de eyección del ventrículo izquierdo (FEVI) conservada, y en un seguimiento de hasta 5 años; b) los pacientes que sufrieron ICA tras el TAVI tuvieron una mayor mortalidad y mostraron una asociación con los ingresos hospitalarios por ICA antes del TAVI y con una puntuación STS elevada, y c) un IRN desfavorable y la presencia de enfermedad pulmonar obstructiva crónica fueron factores independientes predictivos de mortalidad en los pacientes que sufrieron ICA.
Incidencia de ingresos hospitalarios a causa de ICAVarios estudios y registros han mostrado una alta tasa de reingresos de los pacientes después de un TAVI19. La tasa de reingresos tempranos (en un plazo de 30 días) osciló entre el 4,0 y el 17,9%, y fue mayor en los pacientes sometidos a TAVI con abordaje transapical. La tasa de reingresos durante el primer año posterior al TAVI fue de hasta un 50% de los pacientes, principalmente por causas no cardiovasculares. Un estudio de Nombela-Franco et al.20 presentó una incidencia de reingresos por cualquier causa del 43,9% durante un periodo de hasta 1 año tras el TAVI. De ellos, el 58,9% fueron ingresos por causas no cardiovasculares (principalmente por comorbilidades preexistentes) y el 41,1% por causas cardiacas, principalmente ICA (23,3%). Durand et al.21 han descrito resultados similares con una tasa de reingresos a 1 año en total y por ICA del 52,2 y el 24,1% respectivamente. Es de destacar que en ambos estudios la válvula utilizada fue el dispositivo SAPIEN. Nuestro registro, en el que se examinó principalmente a pacientes tratados con el dispositivo CoreValve, muestra resultados similares: el 30% de nuestra población ingresó a causa de una ICA durante el seguimiento, y menos de la mitad de esos ingresos se produjeron durante el primer año tras la intervención (46,2%).
Repercusión pronóstica del ingreso hospitalario debido a ICAAl final del seguimiento, habían fallecido 150 pacientes (37,59%). Nuestros resultados son similares a los publicados anteriormente por Avanzas et al.22: este grupo resaltó también la importancia de los ingresos debidos a IC en los pacientes con TAVI e hizo hincapié en el 92,6% de muertes tras un ingreso. Son pocos los estudios en los que se han descrito los factores determinantes y el pronóstico de la ICA tras un TAVI. Hasta donde se sabe, el estudio de Durand et al.21 fue pionero en la presentación de las repercusiones de la ICA en la mortalidad tras el TAVI. En los pacientes dados de alta del hospital, la tasa de mortalidad por cualquier causa fue del 13,7% en el año 1, después de una media de seguimiento de 27,2 ± 0,7 meses. El reingreso debido a ICA después de un TAVI mostró una intensa asociación con una mayor mortalidad a 1 año (el 24,2 frente al 10,4%; p < 0,0001) y al final del seguimiento (el 50,0 frente al 25,6%; p < 0,0001). Nuestros resultados son bastante similares. Tras una media de seguimiento de 27 ± 24,1 meses, la mortalidad de los pacientes ingresados por ICA fue del 52,1 frente al 31,4% (HR = 1,84; IC95%, 1,14-2,97; p < 0,012). Nombela-Franco et al.20 evaluaron también la repercusión del ingreso hospitalario temprano en la mortalidad, con una media de seguimiento similar a la de nuestro estudio. Su tasa de mortalidad a los 2 años aumentó significativamente en los pacientes ingresados en un plazo de 30 días tras el TAVI, en comparación con los que no reingresaron (el 30,2 frente al 19,2%; p = 0,002). Aproximadamente un 30-50% de los reingresos se debieron a causas cardiovasculares, principalmente la ICA, y tuvieron una importante repercusión pronóstica en la mortalidad.
Factores predictivos del ingreso hospitalario por ICASe identificaron 2 factores independientes que predecían la ICA después del alta de cualificación para el estudio: un episodio de ingreso hospitalario por ICA antes del TAVI y un riesgo elevado según la puntuación STS. Durand et al.21 identificaron 4 factores independientes predictivos de ICA: media de gradiente aórtico baja antes del TAVI, transfusión de sangre tras la intervención, hipertensión pulmonar persistente grave tras la intervención y dilatación de la aurícula izquierda. Tan solo 2 de ellos estaban relacionados con la intervención. En este estudio, un episodio de ICA previo al TAVI no alcanzó significación estadística en el análisis multivariante. Baron et al.23 describieron la repercusión del gradiente de la válvula aórtica en los resultados del TAVI en una serie amplia de pacientes (n = 11.292); un gradiente de válvula aórtica bajo (< 40mmHg) se asoció con mayor mortalidad (HR = 1,21; IC95%, 1,11-1,32; p < 0,001) y unas tasas más altas de ICA (HR = 1,52; IC95%, 1,36-1,69; p < 0,001), sin ningún efecto de la FEVI. En nuestro trabajo no se observa una repercusión significativa del gradiente valvular aórtico previo al TAVI ni de la FEVI. Estas discrepancias pueden explicarse por las diferencias demográficas y clínicas existentes entre las distintas poblaciones.
En nuestro registro, a pesar de que la presión arterial pulmonar fue más alta en el grupo de pacientes que presentaron una ICA después del TAVI, esto no influyó en el pronóstico en nuestra cohorte. Varias publicaciones han señalado que la hipertensión pulmonar antes del TAVI es frecuente y aumenta la mortalidad después de la intervención24,25. Los pacientes con hipertensión pulmonar grave persistente tras un TAVI tienen peor pronóstico que los que presentan una disminución de la presión arterial pulmonar sistólica por debajo de 60mmHg (tasa de mortalidad a 2 años, el 50,0 frente al 18,6%; p = 0,001). Se propuso, pues, que un cateterismo derecho podría ser útil al equipo cardiaco en la toma de decisiones.
La hemorragia grave y la transfusión son frecuentes después del TAVI y se han asociado con mayor riesgo de mortalidad temprana y tardía26. Durand et al.21 observaron que la hemorragia grave y, en especial, la necesidad de transfusiones eran factores independientes predictivos de ingreso por ICA después de un TAVI. En nuestra cohorte, la necesidad de transfusiones no se asoció con aumento de la ICA, pero sí fue un marcador de una mayor mortalidad tras el implante.
Factores predictivos de la mortalidad de los pacientes con ICA: papel del IRNEl IRN y la enfermedad pulmonar obstructiva crónica tras un implante valvular fueron elementos clave que influyeron en el pronóstico de este grupo de pacientes. Nuestros resultados muestran por primera vez que el estado nutricional evaluado con el IRN es un potente factor pronóstico independiente. El IRN es una herramienta validada para estimar el riesgo de desnutrición en diversas poblaciones. Muestra una intensa correlación con la mortalidad, los eventos adversos y el deterioro de la capacidad funcional, que es superior a la alcanzada usando el índice de masa corporal y la albúmina por separado27-30. La desnutrición tiene una prevalencia elevada y se ha observado que es un factor independiente del riesgo de eventos clínicos en la IC. Una proporción elevada de pacientes hospitalizados por IC tienen desnutrición de moderada a grave, y un IRN bajo se asocia con más reingresos y una mayor mortalidad de los pacientes con ICA, así como una mayor mortalidad de los pacientes con IC crónica27-30. En estudios previos se ha establecido una relación entre los marcadores clásicos del estado nutricional, como el índice de masa corporal y la hipoalbuminemia, y el pronóstico tras el TAVI (con una curva en forma de J)31.
La evaluación del riesgo de desnutrición debe formar parte de la evaluación geriátrica de los pacientes a los que se practica un TAVI y desempeña un papel determinante en el estado de fragilidad. El posible uso del IRN para la identificación temprana de los pacientes con riesgo de desnutrición que están siendo evaluados para un TAVI podría ser de gran interés en la práctica clínica diaria. Es posible que en estos pacientes pudiera obtenerse un beneficio con el empleo de métodos para mejorar su estado nutricional antes de la intervención. Son necesarios estudios más amplios para validar el IRN dentro de una puntuación geriátrica y de fragilidad, solo o como parte de otras puntuaciones predictivas de eventos tras el TAVI.
La enfermedad pulmonar obstructiva crónica es frecuente en los pacientes con IC y su presencia en los pacientes con disfunción sistólica se asocia con un aumento de la carga de morbilidad, un menor uso de medicaciones para la IC basadas en la evidencia, una hospitalización más prolongada y un aumento de la mortalidad no cardiovascular durante la hospitalización32.
CONCLUSIONESLa proporción de pacientes que presentaron una ICA tras el TAVI es alta, y la presencia previa de ICA tiene un valor pronóstico importante. Es necesario identificar los subgrupos de pacientes en mayor riesgo con objeto de optimizar su estado antes de la intervención. En nuestro estudio, los pacientes con antecedentes de ICA y una puntuación STS alta mostraron una mayor tendencia a sufrir ICA durante el seguimiento. Una vigilancia más estrecha de estos pacientes, con un tratamiento médico intensivo y dirigido, podría ser útil para intentar reducir los reingresos a causa de IC y mejorar su pronóstico. A la vista de nuestros resultados, los programas de intervención en el estado nutricional de los pacientes que presentan ICA después del TAVI y tienen riesgo de desnutrición podrían mejorar también su supervivencia. En nuestro estudio, como en otros anteriores, son pocos los factores que se han identificado como predictores de ICA independientes. En el futuro deberán llevarse a cabo estudios centrados en la búsqueda de otros factores predictores de ICA y deberá evaluarse si una intervención durante el seguimiento, como la optimización del tratamiento médico o el estado nutricional, tiene una repercusión real en el pronóstico de este subgrupo de pacientes.
CONFLICTO DE INTERESESR. Trillo Nouche es mentor de Medtronic.
- -
La evidencia relativa a la IC después del TAVI es escasa. En estudios previos se ha observado la influencia adversa de la IC en el pronóstico tras el TAVI, pero el número de factores predictivos bien identificados continúa siendo muy bajo.
- -
Hasta donde se sabe, este es el estudio que evalúa la incidencia, la repercusión pronóstica y los factores predictivos del ingreso hospitalario por ICA tras el TAVI con el dispositivo CoreValve.
- -
En nuestra cohorte, se observaron 2 potentes factores determinantes del pronóstico: los antecedentes de ICA y la puntuación STS alta.
- -
Nuestros resultados muestran también por primera vez que el estado nutricional evaluado con el IRN es un potente factor pronóstico independiente en este subgrupo de pacientes, lo cual indica que este índice podría incluirse en la evaluación de los pacientes candidatos a un TAVI.
A Manuela Sestayo por su extraordinaria ayuda en la corrección lingüística.