La enfermedad valvular en los pacientes con fibrilación auricular incluidos en los ensayos clínicos con anticoagulantes orales directos (ACOD) es frecuente y se asocia con peor pronóstico. El objetivo es evaluar la prevalencia de valvulopatía y su influencia en los eventos clínicos en la práctica clínica real.
MétodosRegistro multicéntrico retrospectivo que incluyó a 2.297 pacientes consecutivos con fibrilación auricular no valvular que iniciaron tratamiento con ACOD entre enero de 2013 y diciembre de 2016. La enfermedad valvular se definió como afección moderada o grave. El evento principal fue la combinación de muerte, ictus o accidente isquémico transitorio/embolia sistémica o hemorragia mayor. Se realizó un análisis de riesgos competitivos mediante un modelo de regresión de Fine y Gray, con la muerte como evento competitivo.
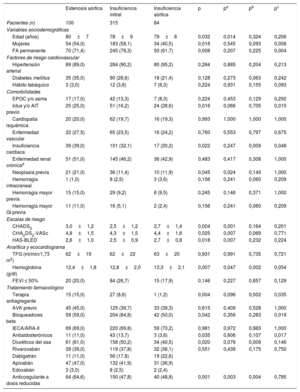
ResultadosTenían valvulopatía 499 pacientes (21,7%), y la insuficiencia mitral fue la más frecuente (13,7%). Los pacientes con valvulopatía eran de más edad y con mayor comorbilidad. Tras el análisis multivariable, la enfermedad valvular fue predictora del evento combinado (HR=1,54; IC95%, 1,22-1,94; p<0,001), muerte (HR=1,44; IC95%, 1,09-1,91, p=0,010) y hemorragia mayor (HR=1,85; IC95%, 1,23-2,79, p=0,003), pero no de eventos tromboembólicos (p >0,05).
ConclusionesEn pacientes con fibrilación auricular no valvular que inician tratamiento con ACOD, la enfermedad valvular es frecuente y se asocia con mayor riesgo de muerte, ictus o accidente isquémico transitorio/embolia sistémica o complicaciones hemorrágicas. Estos hallazgos confirman los resultados de los ensayos clínicos y los expande al ámbito de la práctica clínica real.
Palabras clave
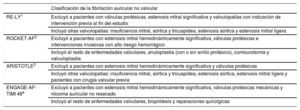
La eficacia y la seguridad de los anticoagulantes orales directos (ACOD) en la prevención del ictus y la embolia sistémica para pacientes con fibrilación auricular (FA) está bien estudiada. Actualmente los ACOD son el tratamiento de elección frente a los antagonistas de la vitamina K (AVK), especialmente para los pacientes que inician la anticoagulación1–7. Se han aprobado estos fármacos para su uso en pacientes con fibrilación auricular no valvular (FANV), un concepto heterogéneo que se deriva de los criterios de exclusión de los distintos ensayos clínicos aleatorizados (tabla 1). Sin embargo, este término ha dado lugar a confusión en la práctica clínica diaria8,9. Las guías de práctica clínica más recientes han mostrado acuerdo en la definición actual de FA de origen valvular que incluye la estenosis mitral moderada o grave (generalmente reumática) y las prótesis valvulares mecánicas6,7,10.
Criterios de inclusión de los ensayos clínicos de anticoagulantes orales directos para la prevención del ictus en pacientes con fibrilación auricular no valvular
| Clasificación de la fibrilación auricular no valvular | |
|---|---|
| RE-LY1 | Excluyó a pacientes con válvulas protésicas, estenosis mitral significativa y valvulopatías con indicación de intervención previa al fin del estudio |
| Incluyó otras valvulopatías: insuficiencia mitral, aórtica y tricuspídea, estenosis aórtica y estenosis mitral ligera | |
| ROCKET-AF2 | Excluyó a pacientes con estenosis mitral hemodinámicamente significativa, válvulas protésicas e intervenciones invasivas con alto riesgo hemorrágico |
| Incluyó el resto de enfermedades valvulares, anuloplastia (con o sin anillo protésico), comisurotomía y valvuloplastia | |
| ARISTOTLE3 | Excluyó a pacientes con estenosis mitral hemodinámicamente significativa y válvulas protésicas |
| Incluyó otras valvulopatías: insuficiencia mitral, aórtica y tricuspídea, estenosis aórtica, estenosis mitral ligera y pacientes con cirugía valvular previa | |
| ENGAGE-AF-TIMI 484 | Excluyó a pacientes con estenosis mitral hemodinámicamente significativa, válvulas protésicas mecánicas y mixoma auricular no resecado |
| Incluyó el resto de enfermedades valvulares, bioprótesis y reparaciones quirúrgicas |
La enfermedad valvular y la FA a menudo coexisten y se muestran como causas independientes de morbimortalidad. Los ensayos clínicos de los ACOD han incluido una proporción importante de pacientes con valvulopatía significativa. Este grupo muestra un perfil clínico desfavorable y resultados similares en comparación con los AVK11–15. La evidencia y la experiencia en la práctica clínica real con pacientes con valvulopatías que no contraindican el uso de los ACOD es escasa. Por ello, el objetivo de este estudio es analizar la presencia de valvulopatías en pacientes con FA que inician tratamiento con estos fármacos en la práctica clínica habitual y evaluar su influencia en la aparición de eventos clínicos.
MÉTODOSDiseño y población de estudioSe trata de un estudio de cohortes retrospectivo con el que se pretende evaluar la prevalencia de la enfermedad valvular en pacientes que inician tratamiento con ACOD en la práctica clínica habitual y su influencia en la aparición de eventos clínicos. Entre el 1 de enero de 2013 y el 31 de diciembre de 2016, se incluyó consecutivamente a todos los pacientes con FANV atendidos en 3 centros de referencia a los que se prescribía un ACOD por primera vez y tenían realizado un ecocardiograma. Los criterios de exclusión fueron la indicación de anticoagulación diferente de FA o con el objetivo de cardioversión eléctrica o farmacológica en pacientes con FA sin indicación de anticoagulación oral a largo plazo. Se excluyó también a los pacientes con miocardiopatía hipertrófica, estenosis mitral de origen reumático de grado moderado o grave, portadores de prótesis valvular mecánica o con toma previa de otro ACOD.
Se registraron los principales antecedentes médicos al inicio del tratamiento con el ACOD. Se consideró que los pacientes tenían enfermedad valvular significativa si tenían evidencia ecocardiográfica previa a la inclusión de insuficiencia valvular aórtica o mitral o estenosis valvular aórtica de grado moderado y/o grave. Todos los datos con respecto a la enfermedad valvular se recogieron durante la inclusión. La gravedad de la valvulopatía se definió con base en los criterios recomendados en las guías de práctica clínica europeas16,17. Dos cardiólogos revisaron todos los estudios ecocardiográficos con enmascaramiento de los eventos clínicos, y en caso de desacuerdo se solicitó la opinión de un tercero. La insuficiencia renal se definió como una tasa de filtrado glomerular por debajo de 60 ml/min/1,73 m2 estimada por la Chronic Kidney Disease Epidemiology Collaboration. La anemia se definió como una hemoglobina <12 g/dl en mujeres y <13 g/dl en varones. La fuente de información se basó en las historias clínicas digitalizadas de los hospitales participantes y en la de los centros de atención primaria de las áreas de salud correspondientes a estos hospitales. Cardiólogos entrenados para tal fin se ocuparon de la recogida de datos mediante un cuaderno de recogida de datos, diseñado previamente para este propósito, que contenía precodificadas todas las variables de estudio.
El estudio se ha realizado en conformidad con los principios de la Declaración de Helsinki.
Seguimiento y variables de resultadoSe dio seguimiento a los pacientes desde la fecha de la primera prescripción del ACOD hasta la fecha final del estudio, durante una mediana de 606 [intervalo intercuartílico, 474-731] días. Se completó el seguimiento del 99,7% (n=2.290) de los pacientes. El evento principal de estudio era la combinación de muerte, ictus/accidente isquémico transitorio (AIT)/embolia sistémica o hemorragia mayor. Durante el seguimiento se recogieron por separado todos los eventos que componen el evento principal de estudio. Las muertes se clasificaron como cardiovasculares, no cardiovasculares e indeterminadas en función de unos criterios propuestos previamente a la recogida de los datos18. El ictus se definió como signos o síntomas de disfunción neurológica secundarios a un infarto en el sistema nervioso central y el AIT, como signos o síntomas que duran menos de 24 horas sin evidencia de lesión en técnicas de neuroimagen18. La hemorragia mayor se definió según la definición International Society on Thrombosis and Haemostasis, que considera como tal la hemorragia fatal y/o sintomática en un área u órgano crítico, como intracraneal, intraespinal, intraperitoneal intraocular, intraarticular o pericárdica, o intramuscular con síndrome compartimental y/o hemorragia que causa reducciones de la hemoglobina de 20 g/dl o más, o que requiere transfusión de 2 o más concentrados de hematíes19.
Análisis estadísticoLas características de los pacientes se describieron como media ±desviación estándar o mediana [intervalo intercuartílico] en función de la distribución de las variables cuantitativas. Las variables categóricas se expresaron con frecuencias absolutas y relativas. Para la comparación de variables se emplearon la prueba de la t de Student o ANOVA (variables continuas) y la prueba de la χ2 de Pearson (variables categóricas).
Para identificar los factores asociados con los eventos estudiados, se realizaron análisis de regresión de Cox multivariables con los que se calcularon las hazard ratio (HR). Debido a que la muerte compite con el riesgo de eventos embólicos y hemorrágicos, se utilizó el método de riesgos competitivos de Fine y Gray para estimar la incidencia e identificar los predictores de dichos eventos20. Las variables independientes incluidas en los modelos de regresión de Cox fueron las asociadas con los eventos clínicos en los análisis univariables y las que, a juicio de los investigadores, se consideraron importantes para el ajuste. Previo al inicio de la recogida de los datos, se realizó una búsqueda bibliográfica exhaustiva para identificar las variables importantes asociadas con cada evento. Además, se evaluó el supuesto de linealidad empleando los residuos de Martingale. Se confirmó gráfica y estadísticamente la asunción de riesgos proporcionales de todos los análisis de regresión de Cox realizados con independencia del tipo de evento analizado (evento primario, muerte y eventos competitivos). La muestra con detalle las variables incluidas en los análisis de regresión de Cox univariables. Se aceptaron como estadísticamente significativos todos los valores de p <0,05. Para los análisis estadísticos, se emplearon los programas estadísticos SPSS v21 (SPSS Inc.; Chicago, Illinois, Estados Unidos) y STATA v13.0 (Stata Corp LP.; Texas, Estados Unidos).
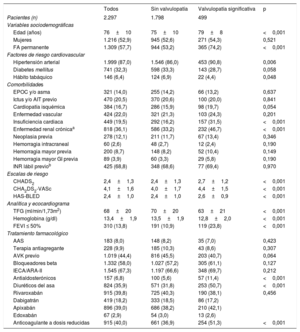
RESULTADOSSe incluyó en total a 2.297 pacientes, de los que 915 (39,8%) recibieron rivaroxabán; 419 (18,2%), dabigatrán; 896 (39,0%), apixabán y 67 (2,9%), edoxabán. De todos los pacientes, 499 (21,7%) tenían enfermedad valvular significativa. Los pacientes con valvulopatía eran de más edad y con mayor comorbilidad, de modo que tenían mayores puntuaciones en las escalas de riesgo tromboembólico y hemorrágico (CHA2DS2-VASc, 4,4 ±1,5 frente a 4,0 ±1,7; p <0,001; HAS-BLED, 2,6 ±0,9 frente a 2,4±1,0; p <0,001). No se observaron diferencias en cuanto al tipo de ACOD recibido en función de la presencia de valvulopatía (p >0,05) (tabla 2).
Características clínicas en función de la presencia de valvulopatía
| Todos | Sin valvulopatía | Valvulopatía significativa | p | |
|---|---|---|---|---|
| Pacientes (n) | 2.297 | 1.798 | 499 | |
| Variables sociodemográficas | ||||
| Edad (años) | 76±10 | 75±10 | 79±8 | <0,001 |
| Mujeres | 1.216 (52,9) | 945 (52,6) | 271 (54,3) | 0,521 |
| FA permanente | 1.309 (57,7) | 944 (53,2) | 365 (74,2) | <0,001 |
| Factores de riesgo cardiovascular | ||||
| Hipertensión arterial | 1.999 (87,0) | 1.546 (86,0) | 453 (90,8) | 0,006 |
| Diabetes mellitus | 741 (32,3) | 598 (33,3) | 143 (28,7) | 0,058 |
| Hábito tabáquico | 146 (6,4) | 124 (6,9) | 22 (4,4) | 0,048 |
| Comorbilidades | ||||
| EPOC y/o asma | 321 (14,0) | 255 (14,2) | 66 (13,2) | 0,637 |
| Ictus y/o AIT previo | 470 (20,5) | 370 (20,6) | 100 (20,0) | 0,841 |
| Cardiopatía isquémica | 384 (16,7) | 286 (15,9) | 98 (19,7) | 0,054 |
| Enfermedad vascular | 424 (22,0) | 321 (21,3) | 103 (24,3) | 0,201 |
| Insuficiencia cardiaca | 449 (19,5) | 292 (16,2) | 157 (31,5) | <0,001 |
| Enfermedad renal crónicaa | 818 (36,1) | 586 (33,2) | 232 (46,7) | <0,001 |
| Neoplasia previa | 278 (12,1) | 211 (11,7) | 67 (13,4) | 0,346 |
| Hemorragia intracraneal | 60 (2,6) | 48 (2,7) | 12 (2,4) | 0,190 |
| Hemorragia mayor previa | 200 (8,7) | 148 (8,2) | 52 (10,4) | 0,149 |
| Hemorragia mayor GI previa | 89 (3,9) | 60 (3,3) | 29 (5,8) | 0,190 |
| INR lábil previob | 425 (68,8) | 348 (68,6) | 77 (69,4) | 0,970 |
| Escalas de riesgo | ||||
| CHADS2 | 2,4±1,3 | 2,4±1,3 | 2,7±1,2 | <0,001 |
| CHA2DS2-VASc | 4,1±1,6 | 4,0±1,7 | 4,4±1,5 | <0,001 |
| HAS-BLED | 2,4±1,0 | 2,4±1,0 | 2,6±0,9 | <0,001 |
| Analítica y ecocardiograma | ||||
| TFG (ml/min/1,73m2) | 68±20 | 70±20 | 63±21 | <0,001 |
| Hemoglobina (g/dl) | 13,4±1,9 | 13,5±1,9 | 12,8±2,0 | <0,001 |
| FEVI ≤ 50% | 310 (13,8) | 191 (10,9) | 119 (23,8) | <0,001 |
| Tratamiento farmacológico | ||||
| AAS | 183 (8,0) | 148 (8,2) | 35 (7,0) | 0,423 |
| Terapia antiagregante | 228 (9,9) | 185 (10,3) | 43 (8,6) | 0,307 |
| AVK previo | 1.019 (44,4) | 816 (45,5) | 203 (40,7) | 0,064 |
| Bloqueadores beta | 1.332 (58,0) | 1.027 (57,2) | 305 (61,1) | 0,127 |
| IECA/ARA-II | 1.545 (67,3) | 1.197 (66,6) | 348 (69,7) | 0,212 |
| Antialdosterónicos | 157 (6,8) | 100 (5,6) | 57 (11,4) | <0,001 |
| Diuréticos del asa | 824 (35,9) | 571 (31,8) | 253 (50,7) | <0,001 |
| Rivaroxabán | 915 (39,8) | 725 (40,3) | 190 (38,1) | 0,456 |
| Dabigatrán | 419 (18,2) | 333 (18,5) | 86 (17,2) | |
| Apixabán | 896 (39,0) | 686 (38,2) | 210 (42,1) | |
| Edoxabán | 67 (2,9) | 54 (3,0) | 13 (2,6) | |
| Anticoagulante a dosis reducidas | 915 (40,0) | 661 (36,9) | 254 (51,3) | <0,001 |
AAS: ácido acetilsalicílico; ARA-II: antagonistas del receptor de la angiotensina II; AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GI: gastrointestinal; IECA: inhibidores de la enzima de conversión de la angiotensina; INR: razón internacional normalizada; TFG: tasa de filtrado glomerular.
Los valores expresan media±desviación estándar y n (%).
Se analizaron las características clínicas en función de la valvulopatía predominante (tabla 3). La valvulopatía más frecuente fue la insuficiencia mitral (315 pacientes; 13,7%) y la estenosis aórtica (100 pacientes; 4,4%) y la insuficiencia aórtica (84 pacientes; 3,7%), las siguientes en orden de frecuencia. La tabla 3 muestra de forma detallada una comparación de las características de la población según el tipo de valvulopatía asociada.
Características de los pacientes según el tipo de valvulopatía
| Estenosis aórtica | Insuficiencia mitral | Insuficiencia aórtica | p | pa | pb | pc | |
|---|---|---|---|---|---|---|---|
| Pacientes (n) | 100 | 315 | 84 | ||||
| Variables sociodemográficas | |||||||
| Edad (años) | 80±7 | 78±9 | 79±8 | 0,032 | 0,014 | 0,324 | 0,206 |
| Mujeres | 54 (54,0) | 183 (58,1) | 34 (40,5) | 0,016 | 0,545 | 0,093 | 0,006 |
| FA permanente | 70 (71,4) | 245 (78,3) | 50 (61,7) | 0,008 | 0,207 | 0,225 | 0,004 |
| Factores de riesgo cardiovascular | |||||||
| Hipertensión arterial | 89 (89,0) | 284 (90,2) | 80 (95,2) | 0,284 | 0,885 | 0,204 | 0,213 |
| Diabetes mellitus | 35 (35,0) | 90 (28,6) | 18 (21,4) | 0,128 | 0,273 | 0,063 | 0,242 |
| Hábito tabáquico | 3 (3,0) | 12 (3,8) | 7 (8,3) | 0,224 | 0,931 | 0,155 | 0,093 |
| Comorbilidades | |||||||
| EPOC y/o asma | 17 (17,0) | 42 (13,3) | 7 (8,3) | 0,224 | 0,453 | 0,129 | 0,292 |
| Ictus y/o AIT previo | 25 (25,0) | 51 (16,2) | 24 (28,6) | 0,016 | 0,066 | 0,705 | 0,015 |
| Cardiopatía isquémica | 20 (20,0) | 62 (19,7) | 16 (19,3) | 0,993 | 1,000 | 1,000 | 1,000 |
| Enfermedad vascular | 22 (27,5) | 65 (23,5) | 16 (24,2) | 0,760 | 0,553 | 0,797 | 0,675 |
| Insuficiencia cardiaca | 39 (39,0) | 101 (32,1) | 17 (20,2) | 0,022 | 0,247 | 0,009 | 0,048 |
| Enfermedad renal crónicad | 51 (51,0) | 145 (46,2) | 36 (42,9) | 0,483 | 0,417 | 0,308 | 1,000 |
| Neoplasia previa | 21 (21,0) | 36 (11,4) | 10 (11,9) | 0,045 | 0,024 | 0,149 | 1,000 |
| Hemorragia intracraneal | 1 (1,0) | 8 (2,5) | 3 (3,6) | 0,156 | 0,241 | 0,060 | 0,209 |
| Hemorragia mayor previa | 15 (15,0) | 29 (9,2) | 8 (9,5) | 0,245 | 0,146 | 0,371 | 1,000 |
| Hemorragia mayor GI previa | 11 (11,0) | 16 (5,1) | 2 (2,4) | 0,156 | 0,241 | 0,060 | 0,209 |
| Escalas de riesgo | |||||||
| CHADS2 | 3,0±1,2 | 2,5±1,2 | 2,7±1,4 | 0,004 | 0,001 | 0,164 | 0,201 |
| CHA2DS2-VASc | 4,8±1,5 | 4,3±1,5 | 4,4±1,6 | 0,025 | 0,007 | 0,069 | 0,771 |
| HAS-BLED | 2,8±1,0 | 2,5±0,9 | 2,7±0,8 | 0,018 | 0,007 | 0,232 | 0,224 |
| Analítica y ecocardiograma | |||||||
| TFG (ml/min/1,73 m2) | 62±19 | 62±22 | 63±20 | 0,931 | 0,991 | 0,735 | 0,721 |
| Hemoglobina (g/dl) | 12,4±1,8 | 12,8±2,0 | 13,3±2,1 | 0,007 | 0,047 | 0,002 | 0,054 |
| FEVI ≤ 50% | 20 (20,0) | 84 (26,7) | 15 (17,9) | 0,146 | 0,227 | 0,857 | 0,129 |
| Tratamiento farmacológico | |||||||
| Terapia antiagregante | 15 (15,0) | 27 (8,6) | 1 (1,2) | 0,004 | 0,096 | 0,002 | 0,035 |
| AVK previo | 45 (45,0) | 125 (39,7) | 33 (39,3) | 0,615 | 0,409 | 0,528 | 1,000 |
| Bloqueadores beta | 59 (59,0) | 204 (64,8) | 42 (50,0) | 0,042 | 0,356 | 0,283 | 0,019 |
| IECA/ARA-II | 69 (69,0) | 220 (69,8) | 59 (70,2) | 0,981 | 0,972 | 0,983 | 1,000 |
| Antialdosterónicos | 11 (11,0) | 43 (13,7) | 3 (3,6) | 0,035 | 0,606 | 0,107 | 0,017 |
| Diuréticos del asa | 61 (61,0) | 158 (50,2) | 34 (40,5) | 0,020 | 0,076 | 0,009 | 0,146 |
| Rivaroxabán | 39 (39,0) | 119 (37,8) | 32 (38,1) | 0,551 | 0,439 | 0,175 | 0,750 |
| Dabigatrán | 11 (11,0) | 56 (17,8) | 19 (22,6) | ||||
| Apixabán | 47 (47,0) | 132 (41,9) | 31 (36,9) | ||||
| Edoxabán | 3 (3,0) | 8 (2,5) | 2 (2,4) | ||||
| Anticoagulante a dosis reducidas | 64 (64,6) | 150 (47,8) | 40 (48,8) | 0,001 | 0,003 | 0,004 | 0,785 |
ARA-II: antagonista del receptor de la angiotensina II; AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GI: gastrointestinal; IECA: inhibidores de la enzima de conversión de la angiotensina; TFG: tasa de filtrado glomerular.
Los valores expresan n (%) o media ± desviación estándar.
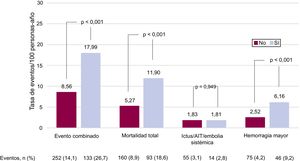
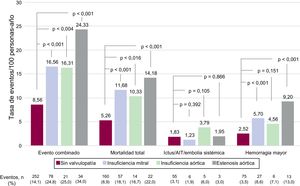
La figura 1 y la figura 2 muestran los eventos clínicos registrados durante el seguimiento (606 [474-731] días) en función de la presencia de enfermedad valvular y su localización. La presencia de enfermedad valvular se asoció con una mayor tasa de eventos bruta: evento combinado (17,99 frente a 8,56/100 personas-año; p <0,001), muerte (11,90 frente a 5,27/100 personas-año; p <0,001) y hemorragia mayor (6,16 frente a 2,52/100 personas-año; p <0,001). Sin embargo, los eventos tromboembólicos no presentaron diferencias en función del estado valvular (ictus isquémico/AIT/ embolia sistémica, 1,81 frente a 1,83/100 personas-año; p >0,05). De modo similar, todos los tipos de valvulopatía analizados se asociaron con mayores tasas de evento combinado del estudio, muerte y hemorragias mayores, si bien la insuficiencia aórtica no alcanzó la significación estadística. En cuanto a los eventos embólicos, ningún tipo de valvulopatía se asoció con mayor riesgo (figura 2).
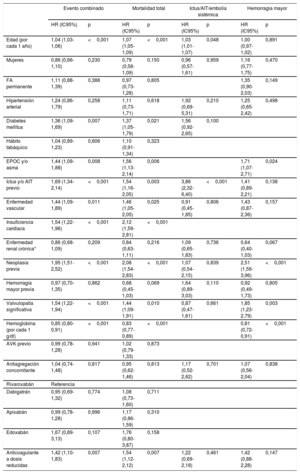
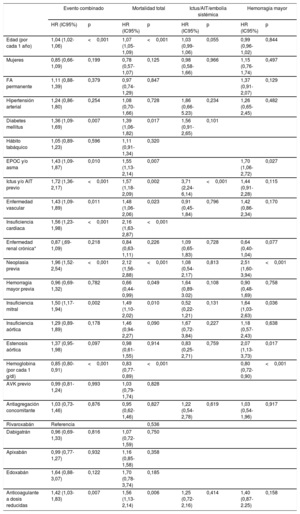
La muestra los análisis de riesgos proporcionales de Cox univariables para la predicción de cada uno de los eventos del estudio. Tras realizar el ajuste multivariable, se encontró que la presencia de enfermedad valvular significativa era predictora independiente del evento combinado (HR=1,54; intervalo de confianza del 95% [IC95%], 1,22-1,94; p <0,001), muerte (HR=1,44; intervalo de confianza del 95% [IC95%], 1,09-1,91; p=0,010) y hemorragia mayor (HR=1,85; IC95%, 1,23-2,79; p=0,003). Sin embargo, la presencia de valvulopatía no resultó predictora de ictus/AIT y/o embolia sistémica (p >0,05) (tabla 4A). Por otro lado, tal y como muestra la tabla 4B, la presencia de insuficiencia valvular mitral y estenosis valvular aórtica resultaron predictores independientes del evento combinado, muerte y hemorragia mayor. Finalmente, los análisis de discriminación de los diferentes modelos de regresión mostraron estadísticos C entre 0,71 y 0,80 (véase en detalle la tabla 4A-B).
Análisis multivariable de riesgos proporcionales de Cox para la predicción de evento combinado, mortalidad total, ictus o AIT/embolia sistémica y hemorragia
| Evento combinado | Mortalidad total | Ictus/AIT/embolia sistémica | Hemorragia mayor | |||||
|---|---|---|---|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | |
| Edad (por cada 1 año) | 1,04 (1,03-1,06) | <0,001 | 1,07 (1,05-1,09) | <0,001 | 1,03 (1,01-1,07) | 0,048 | 1,00 (0,97-1,02) | 0,891 |
| Mujeres | 0,86 (0,66-1,10) | 0,230 | 0,79 (0,58-1,09) | 0,150 | 0,96 (0,57-1,61) | 0,959 | 1,16 (0,77-1,75) | 0,470 |
| FA permanente | 1,11 (0,88-1,39) | 0,388 | 0,97 (0,73-1,28) | 0,805 | 1,35 (0,90-2,03) | 0,149 | ||
| Hipertensión arterial | 1,24 (0,86-1,79) | 0,258 | 1,11 (0,73-1,71) | 0,618 | 1,92 (0,69-5,31) | 0,210 | 1,25 (0,65-2,42) | 0,498 |
| Diabetes mellitus | 1,36 (1,09-1,69) | 0,007 | 1,37 (1,05-1,79) | 0,021 | 1,56 (0,92-2,65) | 0,100 | ||
| Hábito tabáquico | 1,04 (0,89-1,23) | 0,606 | 1,10 (0,91-1,34) | 0,323 | ||||
| EPOC y/o asma | 1,44 (1,09-1,88) | 0,008 | 1,56 (1,13-2,14) | 0,006 | 1,71 (1,07-2,71) | 0,024 | ||
| Ictus y/o AIT previo | 1,69 (1,34-2,14) | <0,001 | 1,54 (1,16-2,05) | 0,003 | 3,86 (2,32-6,40) | <0,001 | 1,41 (0,89-2,21) | 0,138 |
| Enfermedad vascular | 1,44 (1,09-1,89) | 0,011 | 1,46 (1,05-2,05) | 0,025 | 0,91 (0,45-1,85) | 0,806 | 1,43 (0,87-2,36) | 0,157 |
| Insuficiencia cardiaca | 1,54 (1,22-1,96) | <0,001 | 2,12 (1,59-2,81) | <0,001 | ||||
| Enfermedad renal crónica* | 0,86 (0,68-1,09) | 0,209 | 0,84 (0,63-1,11) | 0,216 | 1,09 (0,65-1,83) | 0,736 | 0,64 (0,40-1,03) | 0,067 |
| Neoplasia previa | 1,95 (1,51-2,52) | <0,001 | 2,08 (1,54-2,83) | <0,001 | 1,07 (0,54-2,15) | 0,839 | 2,51 (1,59-3,96) | <0,001 |
| Hemorragia mayor previa | 0,97 (0,70-1,35) | 0,862 | 0,68 (0,45-1,03) | 0,069 | 1,64 (0,89-3,03) | 0,110 | 0,92 (0,49-1,73) | 0,805 |
| Valvulopatía significativa | 1,54 (1,22-1,94) | <0,001 | 1,44 (1,09-1,91) | 0,010 | 0,87 (0,47-1,61) | 0,661 | 1,85 (1,23-2,79) | 0,003 |
| Hemoglobina (por cada 1 g/dl) | 0,85 (0,80-0,91) | <0,001 | 0,83 (0,77-0,89) | <0,001 | 0,81 (0,72-0,91) | <0,001 | ||
| AVK previo | 0,99 (0,78-1,28) | 0,941 | 1,02 (0,79-1,33) | 0,873 | ||||
| Antiagregación concomitante | 1,04 (0,74-1,48) | 0,817 | 0,95 (0,62-1,46) | 0,813 | 1,17 (0,52-2,62) | 0,701 | 1,07 (0,56-2,04) | 0,838 |
| Rivaroxabán | Referencia | |||||||
| Dabigatrán | 0,95 (0,69-1,32) | 0,774 | 1,08 (0,73-1,60) | 0,711 | ||||
| Apixabán | 0,99 (0,78-1,28) | 0,996 | 1,17 (0,86-1,59) | 0,310 | ||||
| Edoxabán | 1,67 (0,89-3,13) | 0,107 | 1,76 (0,80-3,87) | 0,158 | ||||
| Anticoagulante a dosis reducidas | 1,42 (1,10-1,83) | 0,007 | 1,54 (1,12-2,12) | 0,007 | 1,22 (0,69-2,18) | 0,461 | 1,42 (0,88-2,28) | 0,147 |
AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Modelo multivariable de evento muerte/ictus/AIT/embolia sistémica/hemorragia mayor, estadístico C=0,77 (0,74-0,79).
Modelo multivariable de mortalidad total, estadístico C=0,80 (0,78-0,83).
Modelo multivariable de ictus/AIT/embolia sistémica, estadístico C=0,72 (0,67-0,78).
Modelos multivariables de hemorragia mayor, estadístico C=0,71 (0,67-0,76).
Análisis multivariable de riesgos proporcionales de Cox para la predicción de evento combinado, mortalidad total, ictus o AIT/embolia sistémica y hemorragia
| Evento combinado | Mortalidad total | Ictus/AIT/embolia sistémica | Hemorragia mayor | |||||
|---|---|---|---|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | |
| Edad (por cada 1 año) | 1,04 (1,02-1,06) | <0,001 | 1,07 (1,05-1,09) | <0,001 | 1,03 (0,99-1,06) | 0,055 | 0,99 (0,96-1,02) | 0,844 |
| Mujeres | 0,85 (0,66-1,09) | 0,199 | 0,78 (0,57-1,07) | 0,125 | 0,98 (0,58-1,66) | 0,966 | 1,15 (0,76-1,74) | 0,497 |
| FA permanente | 1,11 (0,88-1,39) | 0,379 | 0,97 (0,74-1,29) | 0,847 | 1,37 (0,91-2,07) | 0,129 | ||
| Hipertensión arterial | 1,24 (0,86-1,80) | 0,254 | 1,08 (0,70-1,66) | 0,728 | 1,86 (0,66-5.23) | 0,234 | 1,26 (0,65-2,45) | 0,482 |
| Diabetes mellitus | 1,36 (1,09-1,69) | 0,007 | 1,39 (1,06-1,82) | 0,017 | 1,56 (0,91-2,65) | 0,101 | ||
| Hábito tabáquico | 1,05 (0,89-1,23) | 0,596 | 1,11 (0,91-1,34) | 0,320 | ||||
| EPOC y/o asma | 1,43 (1,09-1,87) | 0,010 | 1,55 (1,13-2,14) | 0,007 | 1,70 (1,06-2,72) | 0,027 | ||
| Ictus y/o AIT previo | 1,72 (1,36-2,17) | <0,001 | 1,57 (1,18-2,09) | 0,002 | 3,71 (2,24-6,14) | <0,001 | 1,44 (0,91-2,28) | 0,115 |
| Enfermedad vascular | 1,43 (1,09-1,89) | 0,011 | 1,48 (1,06-2,06) | 0,023 | 0,91 (0,45-1,84) | 0,796 | 1,42 (0,86-2,34) | 0,170 |
| Insuficiencia cardiaca | 1,56 (1,23-1,98) | <0,001 | 2,16 (1,63-2,87) | <0,001 | ||||
| Enfermedad renal crónica* | 0,87 (,69-1,09) | 0,218 | 0,84 (0,63-1,11) | 0,226 | 1,09 (0,65-1,83) | 0,728 | 0,64 (0,40-1,04) | 0,077 |
| Neoplasia previa | 1,96 (1,52-2,54) | <0,001 | 2,12 (1,56-2,88) | <0,001 | 1,08 (0,54-2,17) | 0,813 | 2,51 (1,60-3,94) | <0,001 |
| Hemorragia mayor previa | 0,96 (0,69-1,32) | 0,782 | 0,66 (0,44-0,99) | 0,049 | 1,64 (0,89-3.02) | 0,108 | 0,90 (0,48-1,69) | 0,758 |
| Insuficiencia mitral | 1,50 (1,17-1,94) | 0,002 | 1,49 (1,10-2,02) | 0,010 | 0,52 (0,22-1,21) | 0,131 | 1,64 (1,03-2,63) | 0,036 |
| Insuficiencia aórtica | 1,29 (0,89-1,89) | 0,178 | 1,46 (0,94-2,27) | 0,090 | 1,67 (0,72-3,84) | 0,227 | 1,18 (0,57-2,43) | 0,638 |
| Estenosis aórtica | 1,37 (0,95-1,98) | 0,097 | 0,98 (0,61-1,55) | 0,914 | 0,83 (0,25-2,71) | 0,759 | 2,07 (1,13-3,73) | 0,017 |
| Hemoglobina (por cada 1 g/dl) | 0,85 (0,80-0,91) | <0,001 | 0,83 (0,77-0,89) | <0,001 | 0,80 (0,72-0,90) | <0,001 | ||
| AVK previo | 0,99 (0,81-1,24) | 0,993 | 1,03 (0,79-1,74) | 0,828 | ||||
| Antiagregación concomitante | 1,03 (0,73-1,46) | 0,876 | 0,95 (0,62-1,46) | 0,827 | 1,22 (0,54-2,78) | 0,619 | 1,03 (0,54-1,96) | 0,917 |
| Rivaroxabán | Referencia | 0,536 | ||||||
| Dabigatrán | 0,96 (0,69-1,33) | 0,816 | 1,07 (0,72-1,59) | 0,750 | ||||
| Apixabán | 0,99 (0,77-1,27) | 0,932 | 1,16 (0,85-1,58) | 0,358 | ||||
| Edoxabán | 1,64 (0,88-3,07) | 0,122 | 1,70 (0,78-3,74) | 0,185 | ||||
| Anticoagulante a dosis reducidas | 1,42 (1,03-1,83) | 0,007 | 1,56 (1,13-2,14) | 0,006 | 1,25 (0,72-2,16) | 0,414 | 1,40 (0,87-2.25) | 0,158 |
AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Modelo multivariable de evento muerte/ictus/AIT/embolia sistémica/hemorragia mayor, estadístico C=0,77 (0,74-0,79).
Modelo multivariable de mortalidad total, estadístico C=0,80 (0,78-0,83).
Modelo multivariable de ictus/AIT/embolia sistémica, estadístico C=0,72 (0,67-0,78).
En el presente trabajo se evalúa la frecuencia de enfermedad valvular y su implicación pronóstica en una cohorte contemporánea de pacientes con FANV que iniciaron tratamiento con ACOD. Se ha podido observar una elevada prevalencia de enfermedad valvular significativa entre estos pacientes y que esta, a su vez, confiere un mayor riesgo de eventos adversos durante el seguimiento. Este registro multicéntrico español es el primero que evalúa la frecuencia y la implicación pronóstica de la enfermedad valvular en pacientes con FANV fuera del ámbito de los ensayos clínicos aleatorizados, por lo que se consideró que aportaría información relevante desde el punto de vista clínico.
Durante los últimos años, la definición de FA «valvular» ha sido objeto de controversia, y esto probablemente se deba en parte a la gran heterogeneidad de los criterios de exclusión empleados en los diferentes ensayos clínicos realizados con ACOD en pacientes con FA21–24 (tabla 1). Actualmente, la idoneidad de este término continúa siendo objeto de debate. Así, mientras algunos autores proponen el término alternativo mechanical and rheumatic mitral atrial fibrillation para designar a los pacientes para quienes los ACOD no están indicados, la guía europea propone su eliminación para basarse en la valvulopatía específica subyacente, y clasifica las enfermedades valvulares en 2 grupos en función del tipo de anticoagulante oral indicado: el tipo 1 que se refiere a los pacientes con FA y valvulopatía que necesitan terapia con un AVK (estenosis mitral moderada-grave de origen reumático o válvula protésica mecánica) y el tipo 2, a los pacientes con FA y valvulopatía que necesitan terapia con un AVK o un ACOD, teniendo en cuenta el riesgo tromboembólico9,10. Dado que la presencia de enfermedad valvular afecta hasta un 30% de los pacientes con FA, parece lógico que, mientras no haya consenso, se emplee la definición recogida en las guías de práctica clínica6,7,10,25.
La presencia de valvulopatía en los pacientes se asoció con un peor perfil clínico, en consonancia con lo descrito previamente en los subestudios de los ensayos clínicos11–14. De la misma forma, los pacientes de la práctica clínica que presentan alteración valvular significativa son de más edad y presentan con mayor frecuencia cardiopatía isquémica, antecedentes de hemorragia, insuficiencia cardiaca o deterioro renal que los pacientes sin afección. Es lógico pensar que este perfil contribuye a unas mayores puntuaciones en las principales escalas de riesgo. Sin embargo, no todos los subestudios coinciden. Mientras los pacientes con enfermedad valvular de los ensayos ARISTOTLE y ENGAGE-AF tenían puntuaciones en la escala CHADS2 significativamente más altas (2,2 frente a 2,1 y 2,9 frente a 2,8 respectivamente; p <0,001), los estudios RE-LY y ROCKET-AF no consiguieron mostrar diferencias11–14. Del mismo modo, los ensayos no consiguieron mostrar uniformidad en la comparación de la escala HAS-BLED entre estos pacientes. Los ensayos ROCKET-AF y ENGAGE-AF fueron los únicos que lo midieron y ambos muestran diferencias; mientras el estudio ENGAGE-AF revela un mayor riesgo hemorrágico entre los pacientes con enfermedad valvular (2,6 frente a 2,5; p=0,018), el ensayo ROCKET-AF no (2,8 frente a 2,8; p=0,18)12,14. En el presente estudio los pacientes con enfermedad valvular tenían mayor riesgo trombótico y una tendencia a un mayor riesgo hemorrágico que no alcanzó la significación estadística (CHA2DS2-VASc, 3,9±1,6 frente a 4,4±1,6; p <0,001; HAS-BLED, 1,6±0,9 frente a 1,8±0,9; p=0,060).
La presencia de valvulopatía fue uno de los más importantes predictores independientes de muerte y complicaciones hemorrágicas en esta serie. Por el contrario, no se asoció con un incremento del riesgo de eventos tromboembólicos, a pesar de que estos pacientes muestran mayores puntuaciones en las escalas de riesgo trombótico. Estos hallazgos están en consonancia, en general, con los subestudios de los ensayos clínicos, en concreto con el ENGAGE-AF14. Los pacientes con valvulopatía de los ensayos RE-LY y ROCKET-AF tenían un riesgo similar de ictus/embolia sistémica y muerte, con un incremento del riesgo de hemorragia11,12; y en el ensayo ARISTOTLE, los pacientes con valvulopatía tenían mayor riesgo de ictus/embolia sistémica y muerte, con similitud en los eventos hemorrágicos13. Un metanálisis posterior que incluyó los 4 subestudios muestra resultados concordantes con los del presente trabajo15.
La estrecha relación entre la presencia valvulopatía y la aparición de eventos adversos en el seguimiento hace pensar que el estado de la función valvular se debería tener en cuenta a la hora de estratificar el riesgo y planificar estrategias encaminadas a mejorar el pronóstico de estos pacientes. Los mecanismos implicados en la asociación de valvulopatía significativa y los diferentes eventos clínicos no están del todo esclarecidos. La FA empeora el pronóstico de los pacientes con cardiopatía valvular grave; además, la enfermedad valvular y la FA interactúan y se perpetúan mutuamente a través de la sobrecarga de volumen-presión y los factores neurohormonales26–28. Es por ello que, cuando la disfunción valvular es grave, la FA se puede considerar como un marcador de enfermedad progresiva; lo que debe favorecer la reparación o reemplazo valvular con el objetivo de disminuir la mortalidad en este subgrupo de pacientes que, como se observa en este estudio, se muestra como un importante predictor independiente29. Por otro lado, se conoce la asociación de la estenosis aórtica con la hemorragia digestiva, que se ha establecido como una cuestión relevante por las consecuencias en el deterioro de calidad de vida, los ingresos y el aumento de la mortalidad. Se ha demostrado que la hemorragia de la angiodisplasia en el síndrome de Heyde es consecuencia de los defectos adquiridos del factor de Von Willebrand secundarios a las fuerzas de cizallamiento generadas en la superficie de la válvula aórtica estenótica o calcificada, incluso en grado moderado, que favorecen la proteolisis de estos multímeros30. La consideración durante la estratificación del riesgo de hemorragia de los pacientes que van a iniciar un tratamiento anticoagulante oral es de suma importancia, dada su asociación como predictor independiente de hemorragia. Por esta razón se hace imprescindible modificar los factores de riesgo que favorecen la hemorragia en esta población, tales como el uso de la terapia antiagregante, antiinflamatorios no esteroideos o la hipertensión mal controlada, factores establecidos del aumento del riesgo hemorrágico de los pacientes con tratamiento anticoagulante concomitante31.
LimitacionesLas principales limitaciones de este trabajo derivan de su diseño retrospectivo. Sin embargo, el carácter multicéntrico, el número de eventos registrados y las escasas pérdidas de seguimiento constituyen aspectos reseñables de este estudio. Además, los datos del presente registro se han recogido por cardiólogos previamente entrenados para tal fin y no provienen de bases de datos administrativas o de aseguradoras; lo que da mayor validez a los resultados obtenidos. Por otro lado, hasta el momento, los datos existentes acerca del uso de ACOD en pacientes con FANV en España son escasos, lo que también aporta mayor relevancia a estos hallazgos. Por último, a pesar de que los subestudios de los ensayos clínicos pivotales mostraron que los ACOD proporcionan una efectividad y una seguridad generales similares en pacientes con FA con y sin enfermedad valvular, el presente estudio no ha podido evaluar estas diferencias debido a la ausencia de un grupo de control tratado con AVK15.
CONCLUSIONESEn los pacientes con FANV que inician tratamiento con ACOD, la presencia de enfermedad valvular significativa es frecuente y se asocia con un mayor riesgo de muerte, ictus o AIT/embolia sistémica o complicaciones hemorrágicas. Estos hallazgos no solo confirman los resultados de los ensayos clínicos en este tipo de pacientes, sino que además los expande al ámbito de la práctica clínica real.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La prevalencia de enfermedad valvular en los pacientes con FA incluidos en los ensayos clínicos en los que se ha probado los ACOD es alta.
- –
Diversos subestudios de estos ensayos clínicos han mostrado una asociación entre la enfermedad valvular y un peor pronóstico, si bien la función valvular no influye en las ventajas de los ACOD en este contexto.
- –
La evidencia disponible sobre prevalencia y el impacto pronóstico de la enfermedad valvular en pacientes con FANV que inician tratamiento con ACOD fuera del ámbito de los ensayos es escasa.
- –
Los pacientes con FANV que inician tratamiento con ACOD en la práctica clínica real tienen una elevada prevalencia de enfermedad valvular.
- –
La presencia de enfermedad valvular se asocia con un perfil clínico desfavorable y a un mayor riesgo de muerte y complicaciones hemorrágicas mayores, sin diferencias en cuanto a eventos tromboembólicos.
- –
Los hallazgos de este trabajo confirman los resultados de los ensayos clínicos en pacientes de la práctica clínica real.