Un diagnóstico de amiloidosis cardiaca a menudo requiere pruebas histológicas de la presencia de depósitos de amiloide, bien en el propio corazón o en biopsias procedentes de otros órganos afectados, porque el pronóstico y el tratamiento varían considerablemente en función del tipo de amiloidosis1. Se ha dado cuenta del aspecto subendocárdico general del realce tardío de gadolinio (RTG) como algo muy característico de la amiloidosis cardiaca, y se ha relacionado con un aumento de la mortalidad, que prácticamente se quintuplica2. Sin embargo, aproximadamente un 7% de los pacientes acuden a la consulta con un patrón de RTG atípico, como un RTG focal subendocárdico o mediomiocárdico, para el cual la significación pronóstica y las implicaciones terapéuticas son poco claras3. Se ha informado de regresión de la amiloidosis cardiaca de cadena ligera tras trasplante autólogo de células progenitoras o quimioterapia en pacientes con el patrón de RTG característico de la amiloidosis cardiaca4,5. No obstante, se sabe poco del impacto de estos tratamientos en pacientes con patrones de RTG atípicos.
A continuación se presentan los casos de 3 pacientes con amiloidosis de cadena ligera con un patrón de RTG atípico que se sometieron a trasplante autólogo de células progenitoras y a la obtención de imágenes seriadas con técnicas de cardiorresonancia magnética (CRM) y ecocardiograma transtorácico (ETT) antes y después del tratamiento (a los 10, 21 y 23 meses respectivamente). El ETT con deformación (strain) longitudinal global (GLS) y las imágenes de la resonancia magnética (RM) (1,5 T) que incluyen imágenes de cine, RTG y mapeo T1 se realizaron antes y después del trasplante autólogo de células progenitoras. La fracción de eyección del ventrículo izquierdo (FEVI), los tiempos de relajación T1 nativos y la fracción del volumen extracelular (FVE) se calcularon a partir de las imágenes de la RM utilizando el software disponible en el mercado (qmass, Medis Medical Imaging systems; Leiden, Países Bajos). El GLS se calculó a partir de las imágenes del ETT utilizando el software QLAB (Phillip Medical Systems; Andover, Estados Unidos). También se realizó la evaluación clínica con electrocardiograma y valor del extremo N-terminal del propéptido natriurético cerebral (NT-proBNP). Las mediciones previas al trasplante autólogo de células progenitoras se compararon con las realizadas tras dicho trasplante mediante la prueba de la t de Student.
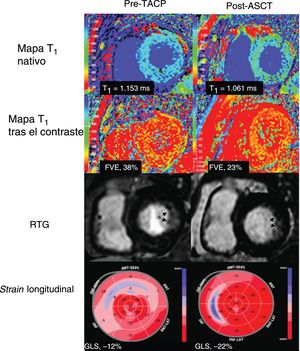
Los pacientes, 2 varones y 1 mujer, tenían 63, 64 y 73 años. Todos los pacientes se sometieron a biopsia para demostrar la existencia de amiloidosis y a trasplante autólogo de células progenitoras con respuesta hematológica completa. Para estos pacientes, el riesgo de trasplante autólogo de células progenitoras era bajo según el sistema de estadificación de la Clínica Mayo. El tiempo de relajación T1 miocárdico nativo y la FVE se hallaban aumentados en el momento inicial y disminuyeron tras el trasplante autólogo de células progenitoras (figura 1; T1, 1.186±30 frente a 1.119 ± 50 ms; p=0,036; FVE, 41±6 frente a 28±10%; p=0,026). Se constató RTG en las paredes subendocárdica inferior e inferolateral de 2 pacientes y en la pared anterolateral subendocárdica de 1 paciente. El RTG persistía en la RM posterior al trasplante autólogo de células progenitoras, aunque se constataba una ligera mejora (figura 2). Se observaba un patrón de «conservación apical» del strain longitudinal (anómalo en los niveles basal y medio del ventrículo izquierdo, pero relativamente normal en los niveles apicales) en todos los casos. El GLS era anómalo en el momento inicial y mejoró considerablemente tras el trasplante autólogo de células progenitoras (el 14±1% frente al −20±3%; p=0,037), con cambios estadísticamente no concluyentes en la FEVI (el 53±8% frente al 54±7%; p=0,074). El grosor de la pared del ventrículo izquierdo, el volumen de la aurícula izquierda y la concentración de NT-proBNP no cambiaron significativamente tras el trasplante autólogo de células progenitoras. En 2 pacientes se observaron cambios electrocardiográficos característicos de la amiloidosis (voltajes bajos o patrón de seudoinfarto) antes del trasplante autólogo de células progenitoras, los cuales mejoraron tras el trasplante en uno de ellos. Todos los pacientes estaban vivos tras un seguimiento medio de 23±7 meses y gozaban de buena capacidad funcional.
En nuestra serie se observó una mejora considerable de la FVE, los tiempos de relajación T1 miocardicos nativos y el GLS tras el trasplante autólogo de células progenitoras en pacientes con patrones atípicos de RTG, a pesar de que no se produjeron cambios considerables en los biomarcadores de amiloidosis cardiaca basados en la imagen y utilizados con mayor frecuencia, como la FEVI, la masa ventricular izquierda o el volumen auricular izquierdo.
El mecanismo que más probablemente explique esta conducta paradójica son las diferencias en la variabilidad de la medición inherente a cada parámetro. No obstante, otras explicaciones posibles podrían ser la lesión miocárdica directa debida a los depósitos residuales de la cadena ligera en el miocardio o las sustancias quimioterapéuticas utilizadas para tratar la amiloidosis de cadena ligera. Otro posible motivo de que se observe una conducta paradójica sería la aparición de arritmias tales como fibrilación auricular o lesiones valvulares como insuficiencia mitral. Cabría disponer de una mayor cohorte de pacientes para comprender mejor por qué los distintos parámetros no se alinean de manera uniforme.
El aumento del RTG (nulo, subendocárdico, transmural) se ha relacionado con cambios estructurales y funcionales (p. ej., aumento de la masa ventricular izquierda, disminución de la FEVI, dilatación auricular izquierda) y empeoramiento de la caracterización tisular (incremento de los tiempos de relajación T1 del miocardio nativo y FVE)6.
Investigaciones previas han puesto de relieve que los pacientes cuyo patrón de RTG es característico de la amiloidosis cardiaca tienen mayores grosor de la pared del ventrículo izquierdo y masa ventricular izquierda y peor función diastólica que los pacientes con un RTG atípico3. Curiosamente, en los pacientes de nuestra serie que tenían alterado el strain longitudinal en los segmentos basales, se observó mejora tras el trasplante autólogo de células progenitoras, lo que indica una afección miocárdica temprana a pesar de la ausencia de un patrón de RTG subendocárdico general característico.
Con respecto a la concentración de NT-proBNP, en 2 pacientes era menor tras el tratamiento y en 1 se observaba un ligero aumento. La alteración del NT-proBNP es un marcador de la respuesta al tratamiento solo si la concentración inicial de NT-proBNP es> 650 ng/l. En nuestra serie, solo 1 paciente tenía la NT-proBNP por encima de ese límite y se observó una disminución considerable tras el tratamiento. Curiosamente, los parámetros de la RM y el ETT mejoraron pese a la concentración basal de NT-proBNP.
En conclusión, estos datos indican que el trasplante autólogo de células progenitoras para tratar la amiloidosis cardiaca con un patrón de RTG atípico puede resultar en una regresión del proceso infiltrativo evaluado por las mejoras en los tiempos de relajación T1 del miocardio nativo, la FVE y el GLS.