Los resultados de los pacientes con reestenosis de stents farmacoactivos (SFA) son peores que los de pacientes con reestenosis de stents metálicos. No se sabe si está relacionado o no con la presencia de recubrimiento de polímero. Se compararon los resultados tras la intervención sobre la reestenosis del stent (RS) de SFA sin polímero y SFA recubiertos de polímero duradero.
MétodosSe incluyó a los pacientes del estudio aleatorizado ISAR-TEST 5 sometidos a un nuevo intervencionismo percutáneo por RS durante el seguimiento. Se analizaron los resultados angiográficos a los 6 y a los 8 meses y los eventos clínicos a los 2 años, y se compararon los 2 grupos en función del tipo de stent. Las diferencias entre uno y otro grupo se ajustaron mediante análisis multivariable.
ResultadosSe incluyó a 326 pacientes con RS: 220 de SFA sin polímero y 106 de SFA con polímero. Se dispuso de angiografía de control del 83,4% de los pacientes. No se observaron diferencias entre los grupos en cuanto a reestenosis binaria recurrente (el 31,7 y el 27,0%; p=0,38; pajustada=0,29). A los 2 años, el objetivo compuesto de muerte, infarto de miocardio o nueva revascularización de la lesión diana fue similar en los 2 grupos (el 35,7 frente al 34,0%; HR=1,04; IC95%, 0,70-1,55; p=0,83; pajustada=0,79). Las tasas de nueva revascularización de la lesión diana de ambos grupos también fueron comparables (el 29,8 y el 31,5%; HR=0,91; IC95%, 0,60-1,39; p=0,68; pajustada=0,62).
ConclusionesNo se encontraron diferencias entre los pacientes sometidos a reintervención por RS de SFA en cuanto a eventos clínicos o angiográficos en función del tipo de stent, con o sin polímero.
Palabras clave
En los pacientes tratados por una reestenosis coronaria del stent (RS), el riesgo de que se produzcan eventos adversos durante el seguimiento sigue siendo alto1. Las estrategias terapéuticas más efectivas son la angioplastia con balón recubierto de fármaco y el nuevo implante de stents farmacoactivos (SFA) de segunda generación2,3. Sin embargo, por razones que todavía no están del todo claras, en los pacientes tratados por RS en SFA, la incidencia de eventos adversos es mayor que en los tratados por RS en stents metálicos4,5.
La eficacia del SFA depende en gran medida de la liberación controlada del fármaco activo desde la estructura del stent6,7. La mayoría de los SFA aprobados para el uso clínico tienen recubrimientos de polímero que controlan la cinética de liberación del fármaco8. No obstante, se ha considerado que los recubrimientos de polímero son una causa de la respuesta inflamatoria de la arteria tras el implante del stent9,10. Tales respuestas inflamatorias podrían inducir retraso en la reparación arterial y, así, desempeñar un papel en la aparición de hiperplasia de la neoíntima y neoateroesclerosis del stent11.
El SFA sin polímero es una tecnología de stents de generación más reciente que puede subsanar los inconvenientes del recubrimiento de polímero del SFA de polímero duradero8. No obstante, se desconoce si la RS en SFA sin polímero responde al tratamiento de un modo distinto que la RS en SFA de polímero duradero. Se investigó a los pacientes con RS en el ensayo aleatorizado ISAR-TEST 512 y se intentó comparar resultados tras la intervención por RS en SFA sin polímero frente a SFA con polímero duradero.
MÉTODOSPoblación del estudio y protocolo del estudioEl ISAR-TEST 5 es un ensayo clínico aleatorizado y de no inferioridad en el cual se asignó en proporción 2:1 a 3.002 pacientes a tratamiento bien con un SFA sin polímero (SFA doble con los fármacos sirolimus y probucol, stent Yukon, Translumina; Hechingen, Alemania; actualmente comercializado como stent Coroflex Isar, B. Braun Melsungen; Melsungen, Alemania), bien un SFA con polímero duradero de segunda generación (SFA con zotarolimus Resolute, Medtronic Vascular; Santa Rosa, California, Estados Unidos)12. Se incluyó en este estudio a los pacientes del ensayo ISAR-TEST 5 que se habían sometido a intervención coronaria percutánea por la RS en los primeros 2 años tras el cateterismo inicial. Se excluyó a los pacientes que habían sido intervenidos por trombosis del stent. El principal identificador del ensayo es NCT00598533.
Intervenciones y medicamentos antitrombóticosDurante la intervención por RS, el tratamiento al que se sometió a los pacientes fue: angioplastia con SFA de primera generación, SFA de segunda generación, con balón convencional o con balón recubierto de fármaco. Los SFA de primera generación incluían SFA de sirolimus con polímero duradero (Cypher, Cordis; Warren, New Jersey, Estados Unidos), SFA de sirolimus sin polímero (Yukon, Translumina), SFA de paclitaxel con polímero duradero (Taxus, Boston Scientific; Natick, Massachusetts, Estados Unidos) y SFA de zotarolimus con polímero duradero (Endeavor, Medtronic). Los SFA de segunda generación incluían stents de everolimus con polímero duradero (Xience, Abbott Vascular; Santa Clara, California, Estados Unidos), stents de zotarolimus con polímero duradero (Resolute, Medtronic), stents de sirolimus con polímero biodegradable (Yukon, Translumina) y stents de sirolimus y probucol (Yukon, Translumina y Coroflex Isar, B. Braun Melsungen).
Tras la intervención, se prescribió a todos los pacientes ácido acetilsalicílico indefinidamente y clopidogrel 75 mg/día, o ticagrelor 90mg 2 veces al día, o prasugrel 5-10 mg/día durante un mínimo de 6 meses.
SeguimientoSe programó una angiografía de seguimiento al cabo de 6 u 8 meses de la reintervención para tratar la RS sistemáticamente en los 2 centros participantes. Los análisis angiográficos coronarios cuantitativos antes y después de la intervención y en el seguimiento se llevaron a cabo con un sistema validado de detección automática de los bordes (QAngioXA versión 7.3, Medis Medical Imaging Systems) en un Core Lab (ISAResearch Center; Múnich, Alemania). El seguimiento clínico se realizó por contacto telefónico, carta o visita en consulta al mes y al año hasta los 2 años de la nueva intervención. Investigadores independientes investigaron y clasificaron todos los eventos clínicos.
Objetivos y definicionesEl objetivo primario de este estudio es el compuesto de mortalidad por cualquier causa, infarto de miocardio o revascularización de la lesión diana (RLD) a los 2 años del tratamiento por RS. Los objetivos secundarios son la tasa de reestenosis binaria y la pérdida luminal tardía en el seguimiento angiográfico, así como la mortalidad por cualquier causa, el infarto de miocardio, la RLD y la trombosis del stent probable o definida a los 2 años. Las definiciones de cada uno de los objetivos son acordes con el protocolo del ensayo original12.
Análisis estadísticoLos datos continuos se presentan como media±desviación estándar o mediana [intervalo intercuartílico], y los datos categóricos, como valores absolutos y proporciones (%). Las diferencias entre grupos se comprobaron utilizando la prueba de la t de Student o la prueba de suma de rangos de Wilcoxon para variables continuas y la prueba de la χ2 o la prueba exacta de Fisher para variables categóricas. La supervivencia sin eventos se evaluó utilizando el método de Kaplan-Meier. Los cocientes de riesgos instantáneos acompañados de intervalos de confianza del 95% (IC95%) se calcularon a partir de modelos de riesgos proporcionales de Cox. Los valores de p <0,05 se consideraron estadísticamente significativos. Se realizó el análisis multivariable para el objetivo primario y para la RLD a fin de ajustar diferencias en las características iniciales y en los tratamientos por RS entre grupos. Para los resultados clínicos, se utilizaron los modelos de riesgos proporcionales de Cox con base en en el análisis de supervivencia; para la reestenosis binaria, se utilizó el análisis de regresión logística. A la vista del número de pacientes incluidos en el estudio, se limitó la inclusión de todas las variables con p <0,1 en el análisis univariable. Para los análisis se utilizó el software estadístico S-PLUS, versión 4.5 (S-PLUS, Insightful Corp.; Seattle, Estados Unidos).
RESULTADOSPacientes, lesiones y características de la intervenciónDel total de 3.002 pacientes incluidos en el ensayo ISAR-TEST 5, 326 debieron someterse a una nueva intervención coronaria percutánea por la RS en los primeros 2 años tras la intervención inicial. Dada la asignación inicial 2:1 del SFA sin polímero y del SFA con polímero duradero, se constató que tenían RS 220 pacientes del grupo de SFA sin polímero y 106 del grupo de SFA con polímero duradero.
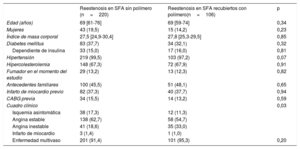
Las características iniciales de los pacientes con RS se muestran en la tabla 1. No se observaron diferencias significativas entre grupos, a excepción de la prevalencia de síndrome coronario agudo, que era inferior en el grupo de RS del SFA sin polímero que en el de RS del SFA con polímero duradero (el 20,0 frente al 34,0%; p = 0,006).
Características clínicas basales
| Reestenosis en SFA sin polímero (n=220) | Reestenosis en SFA recubiertos con polímero(n=106) | p | |
|---|---|---|---|
| Edad (años) | 69 [61-76] | 69 [59-74] | 0,34 |
| Mujeres | 43 (19,5) | 15 (14,2) | 0,23 |
| Índice de masa corporal | 27,5 [24,9-30,4] | 27,8 [25,3-29,5] | 0,85 |
| Diabetes mellitus | 83 (37,7) | 34 (32,1) | 0,32 |
| Dependiente de insulina | 33 (15,0) | 17 (16,0) | 0,81 |
| Hipertensión | 219 (99,5) | 103 (97,2) | 0,07 |
| Hipercolesterolemia | 148 (67,3) | 72 (67,9) | 0,91 |
| Fumador en el momento del estudio | 29 (13,2) | 13 (12,3) | 0,82 |
| Antecedentes familiares | 100 (45,5) | 51 (48,1) | 0,65 |
| Infarto de miocardio previo | 82 (37,3) | 40 (37,7) | 0,94 |
| CABG previa | 34 (15,5) | 14 (13,2) | 0,59 |
| Cuadro clínico | 0,03 | ||
| Isquemia asintomática | 38 (17,3) | 12 (11,3) | |
| Angina estable | 138 (62,7) | 58 (54,7) | |
| Angina inestable | 41 (18,6) | 35 (33,0) | |
| Infarto de miocardio | 3 (1,4) | 1 (1,0) | |
| Enfermedad multivaso | 201 (91,4) | 101 (95,3) | 0,20 |
CABG: cirugía de revascularización coronaria; SFA: stent farmacoactivo.
Los valores expresan mediana [intervalo intercuartílico] o n (%).
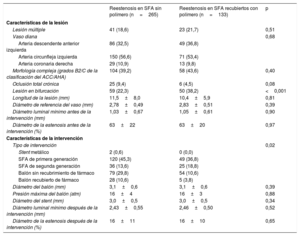
Las características iniciales de las lesiones con RS se muestran en la tabla 2. Se trataron en total 398 lesiones de RS con una nueva intervención coronaria percutánea (RS del SFA sin polímero, n=265; RS del SFA con polímero duradero, n=133). Las características de las lesiones eran en general equilibradas entre los 2 grupos. La prevalencia de lesiones en bifurcaciones fue inferior en el grupo de RS del SFA sin polímero que en el de RS del SFA con polímero duradero (el 22,3 frente al 38,2%; p <0,001). Para el tratamiento de la RS, se observaron diferencias generales entre los grupos en lo que respecta al dispositivo utilizado (p=0,017), tal como se muestra en la tabla 2.
Lesión y características de la intervención
| Reestenosis en SFA sin polímero (n=265) | Reestenosis en SFA recubiertos con polímero (n=133) | p | |
|---|---|---|---|
| Características de la lesión | |||
| Lesión múltiple | 41 (18,6) | 23 (21,7) | 0,51 |
| Vaso diana | 0,68 | ||
| Arteria descendente anterior izquierda | 86 (32,5) | 49 (36,8) | |
| Arteria circunfleja izquierda | 150 (56,6) | 71 (53,4) | |
| Arteria coronaria derecha | 29 (10,9) | 13 (9,8) | |
| Morfología compleja (grados B2/C de la clasificación del ACC/AHA) | 104 (39,2) | 58 (43,6) | 0,40 |
| Oclusión total crónica | 25 (9,4) | 6 (4,5) | 0,08 |
| Lesión en bifurcación | 59 (22,3) | 50 (38,2) | <0,001 |
| Longitud de la lesión (mm) | 11,5±8,0 | 10,4±5,9 | 0,81 |
| Diámetro de referencia del vaso (mm) | 2,78±0,49 | 2,83±0,51 | 0,39 |
| Diámetro luminal mínimo antes de la intervención (mm) | 1,03±0,67 | 1,05±0,61 | 0,90 |
| Diámetro de la estenosis antes de la intervención (%) | 63±22 | 63±20 | 0,97 |
| Características de la intervención | |||
| Tipo de intervención | 0,02 | ||
| Stent metálico | 2 (0,6) | 0 (0,0) | |
| SFA de primera generación | 120 (45,3) | 49 (36,8) | |
| SFA de segunda generación | 36 (13,6) | 25 (18,8) | |
| Balón sin recubrimiento de fármaco | 79 (29,8) | 54 (10,6) | |
| Balón recubierto de fármaco | 28 (10,6) | 5 (3,8) | |
| Diámetro del balón (mm) | 3,1±0,6 | 3,1±0,6 | 0,39 |
| Presión máxima del balón (atm) | 16±4 | 16±3 | 0,88 |
| Diámetro del stent (mm) | 3,0±0,5 | 3,0±0,5 | 0,34 |
| Diámetro luminal mínimo después de la intervención (mm) | 2,43±0,55 | 2,46±0,50 | 0,52 |
| Diámetro de la estenosis después de la intervención (%) | 16±11 | 16±10 | 0,65 |
AHA/ACC: American Heart Association/American College of Cardiology; SFA: stent farmacoactivo.
Los valores expresan media ± desviación estándar o n (%).
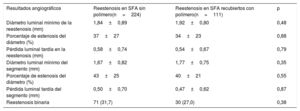
Un total de 272 pacientes (83,4%) se sometieron a seguimiento angiográfico. La pérdida luminal tardía en la RS fue de 0,58±0,74mm en el grupo de RS del SFA sin polímero y de 0,54±0,67mm en el grupo de RS del SFA con polímero duradero (p=0,79) (tabla 3). Se observó reestenosis binaria en el 31,7% de los pacientes del grupo de RS del SFA sin polímero y el 27,0% de los del grupo de RS del SFA con polímero duradero (p=0,38; pajustada=0,29).
Resultados angiográficos
| Resultados angiográficos | Reestenosis en SFA sin polímero(n=224) | Reestenosis en SFA recubiertos con polímero(n=111) | p |
|---|---|---|---|
| Diámetro luminal mínimo de la reestenosis (mm) | 1,84±0,89 | 1,92±0,80 | 0,48 |
| Porcentaje de estenosis del diámetro (%) | 37±27 | 34±23 | 0,88 |
| Pérdida luminal tardía en la reestenosis (mm) | 0,58±0,74 | 0,54±0,67 | 0,79 |
| Diámetro luminal mínimo del segmento (mm) | 1,67±0,82 | 1,77±0,75 | 0,35 |
| Porcentaje de estenosis del diámetro (%) | 43±25 | 40±21 | 0,55 |
| Pérdida luminal tardía del segmento (mm) | 0,50±0,70 | 0,47±0,62 | 0,87 |
| Reestenosis binaria | 71 (31,7) | 30 (27,0) | 0,38 |
SFA: stent farmacoactivo.
Los valores expresan media ± desviación estándar o n (%).
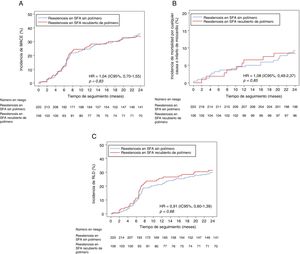
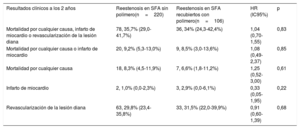
Los resultados clínicos a los 2 años se muestran en la tabla 4. No se observó diferencia significativa alguna en cuanto a la aparición del objetivo primario compuesto a los 2 años entre los grupos de RS del SFA sin polímero y de RS del SFA con polímero duradero (el 35,7 frente al 34,0%, hazard ratio [HR]=1,04; IC95%, 0,70-1,55; psinajustar=0,83) (figura 1A). Utilizando el análisis multivariable, no se observaron diferencias en los resultados clínicos a los 2 años cuando el ajuste se hizo en busca de diferencias en las características iniciales y en los tipos de tratamiento por RS (pajustada=0,79). En un análisis de sensibilidad para comparar el objetivo primario de interés en pacientes de ambos grupos tratados con balón recubierto de fármaco o con SFA de segunda generación, no se hallaron diferencias entre los 2 grupos (el 34,0 frente al 28,0%; HR = 1,31; IC95%, 0,76-3,17; p=0,54).
Resultados clínicos
| Resultados clínicos a los 2 años | Reestenosis en SFA sin polímero(n=220) | Reestenosis en SFA recubiertos con polímero(n=106) | HR (IC95%) | p |
|---|---|---|---|---|
| Mortalidad por cualquier causa, infarto de miocardio o revascularización de la lesión diana | 78, 35,7% (29,0-41,7%) | 36, 34% (24,3-42,4%) | 1,04 (0,70-1,55) | 0,83 |
| Mortalidad por cualquier causa o infarto de miocardio | 20, 9,2% (5,3-13,0%) | 9, 8,5% (3,0-13,6%) | 1,08 (0,49-2,37) | 0,85 |
| Mortalidad por cualquier causa | 18, 8,3% (4,5-11,9%) | 7, 6,6% (1,8-11,2%) | 1,25 (0,52-3,00) | 0,61 |
| Infarto de miocardio | 2, 1,0% (0,0-2,3%) | 3, 2,9% (0,0-6,1%) | 0,33 (0,05-1,95) | 0,22 |
| Revascularización de la lesión diana | 63, 29,8% (23,4-35,8%) | 33, 31,5% (22,0-39,9%) | 0,91 (0,60-1,39) | 0,68 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; SFA: stents farmacoactivos.
Los valores expresan n, % (IC95%); las tasas se han calculado mediante el método de Kaplan-Meier; las HR y los valores de p se calcularon mediante los métodos de riesgos proporcionales de Cox.
Objetivo compuesto de mortalidad por cualquier causa, infarto de miocardio y RLD. Curva del tiempo transcurrido hasta el evento en las incidencias de MACE acumuladas (A), de la mortalidad por cualquier causa o infarto de miocardio (B) y de la RLD (C). HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos cardiacos adversos mayores; RLD: revascularización de la lesión diana; SFA: stents farmacoactivos. La HR y los valores de p derivan de los métodos de riesgos proporcionales de Cox.
Las tasas de las componentes individuales del objetivo primario fueron similares entre los 2 grupos: mortalidad por cualquier causa (el 8,3 frente al 6,6%; HR=1,25, IC95%, 0,52-3,00; p=0,61) e infarto de miocardio (el 1,0 frente al 2,9%; HR=0,33; IC95%, 0,05-1,95; p=0,22) (figura 1B). La RLD también fue parecida entre los grupos: el 29,8 frente al 31,5% (HR=0,91, IC95%, 0,60-1,39; psinajustar=0,68; pajustada=0,62) (figura 1C). El tiempo promedio transcurrido desde la intervención inicial hasta la RLD en ambos grupos fue similar: 211 [190-269] frente a 204 [166-269] días (p=0,17).
No se observaron casos de trombosis del stent.
DISCUSIÓNEl objetivo era investigar si la presencia o ausencia de un recubrimiento de polímero sobre el SFA original reestenosado podría influir en los resultados de los pacientes con RS del SFA tras la reintervención por RS. Los principales hallazgos fueron que no había diferencia en el índice de reestenosis angiográfica binaria entre los grupos de SFA sin polímero y de SFA con polímero duradero. Además, tras 2 años de seguimiento, no se constató ninguna diferencia en el objetivo clínico compuesto por mortalidad por cualquier causa, infarto de miocardio, RLD o la tasa de nuevas revascularizaciones tras las nuevas intervenciones por RS en SFA sin polímero comparado con SFA con polímero duradero.
A pesar de la gran eficacia general del SFA, el tratamiento de la reestenosis del SFA es más complicado que el tratamiento de la reestenosis del stent metálico. Los datos procedentes de ensayos clínicos aleatorizados y registros muestran que la RS del SFA, comparado con la RS de los stents metálicos, se asocia con mayor riesgo de reestenosis recurrente, necesidad de nueva revascularización y eventos cardiacos adversos5,13-15. Además, se informó de una incidencia considerablemente mayor de reestenosis tardía en los pacientes tratados con balón recubierto de fármaco por reestenosis del SFA comparado con la reestenosis de stent metálico16.
Siguen sin conocerse cuáles son las razones de fondo para las diferencias en los resultados tras la intervención por RS del SFA frente a la RS de stent metálico. Es posible que la fisiopatología de la RS sea distinta. Por ejemplo, la neoateroesclerosis podría ser una causa más frecuente de RS del SFA y asociarse con peores resultados11. Otra explicación posible es que los pacientes que requieren RS del SFA podrían tener mayores tasas de resistencia o hiporreactividad a fármacos antirreestenóticos en general o a los análogos del sirolimus en particular5. No obstante, también es posible que las prolongadas reacciones inflamatorias contra el recubrimiento de polímero del stent implantado inicialmente influyan en los resultados posteriores a la nueva intervención por RS.
La tecnología del stent sin polímero se desarrolló con el objetivo de eliminar las respuestas inflamatorias persistentes relacionadas con el polímero que pueden causar retraso en la reparación arterial y neoateroesclerosis tras la colocación del stent. Aunque los stents de primera generación eran inferiores a los SFA con polímero duradero6, tecnológicamente con los SFA sin polímero mejorados se demostró su no inferioridad ante los SFA actuales en los resultados clínicos angiográficos a corto12,17 y largo plazo18. Además, se constataron resultados prometedores de los SFA sin polímero en un ensayo a gran escala en el que se incluyó a pacientes con alto riesgo hemorrágico19.
El principal hallazgo de este estudio fue que no se observaron indicios de diferencias en los resultados según el SFA reestenótico fuera sin polímero o recubierto con polímero. Que se sepa, este es el primer estudio que compara los resultados de pacientes tratados por RS en stents sin polímero frente a stents recubiertos con polímero duradero. Además, la tasa de seguimiento angiográfico tras la nueva intervención fue alta (83,4%) y, en consecuencia, los hallazgos relacionados con los resultados angiográficos probablemente sean sólidos20. Además, los pacientes que sufrieron una reestenosis portadores de SFA sin polímero y SFA recubiertos de polímero coincidieron en el momento del implante original del stent, ya que la asignación al tratamiento fue aleatoria. Las observaciones deberían interpretarse teniendo en cuenta que los stents sin polímero y los stents con polímero duradero estudiados diferían en otros aspectos además de la presencia o ausencia de recubrimiento de polímero (p. ej., estructura del stent, tipo de fármaco liberado), aunque esto es inevitable cuando se comparan los stents disponibles en el mercado que combinan componentes específicos del stent en un único dispositivo.
Son numerosas las razones que podrían explicar que no se hayan observado diferencias entre los grupos de tratamiento. En primer lugar, el tipo de SFA reestenótico, independientemente de que sea sin polímero o recubierto, puede no influir demasiado en los resultados posteriores al tratamiento de la RS. En segundo lugar, este estudio es observacional y la existencia de algunas diferencias entre los grupos de tratamiento en el momento del tratamiento de la RS puede haber ocultado la existencia de cualquier efecto real. En tercer lugar, los dispositivos utilizados para tratar a los 2 grupos en el momento de aparición de la RS fueron en cierto modo diferentes. En realidad, aunque la proporción de pacientes tratados con nuevo implante de SFA fue similar, fueron más los pacientes con SFA sin polímero sometidos a angioplastia con balón recubierto de fármaco que con balón no recubierto. Puesto que los cardiólogos intervencionistas que realizaron la nueva intervención conocían el tipo de SFA subyacente, no puede excluirse el riesgo de sesgo de selección del tratamiento. Sin embargo, el análisis multivariable ajustado por los distintos tipos de tratamiento —SFA de primera generación, SFA de segunda generación, angioplastia con balón o angioplastia con balón recubierto de fármaco— mostró que no había diferencias. Por último, este estudio carece de suficiente potencia estadística para detectar diferencia alguna en los resultados clínicos. Se estimó que un tamaño de la muestra de 326 pacientes con una incidencia de eventos del 35%, una proporción del muestreo de 2 y una diferencia estadísticamente significativa del 5% tendrían una potencia del 62% para detectar una diferencia del 20% entre los grupos de tratamiento. En consecuencia, es posible que sea necesario un estudio con mayor número de pacientes para detectar diferencias.
CONCLUSIONESLos resultados clínicos y angiográficos posteriores al tratamiento de la RS en SFA de sirolimus y probucol sin polímero fueron similares a los obtenidos tras el tratamiento de la RS en SFA con zotarolimus y polímero duradero.
FINANCIACIÓNEsta investigación contó con la financiación parcial de la Bavarian Research Foundation (BFS-ISAR Aktenzeichen AZ: 504/02 y BFS-DES Aktenzeichen AZ: 668/05) y Séptimo Programa Marco (FP7) de la Unión Europea (PRESTIGE 260309).
CONFLICTO DE INTERESESM.J. comunica que es asesor en Biotronik y Orbus Neich y que recibe financiación para la investigación por parte de Biotronik y Orbus Neich. R.A.B. comunica retribuciones personales de B. Braun Melsungen AG, Biotronik, Boston Scientific y Micell Technologies, así como subvenciones para su institución de Boston Scientific y Celonova Biosciences ajenas al trabajo presentado.
- –
Varios estudios han mostrado que los resultados de los pacientes tratados por reestenosis de SFA son peores que los de los pacientes tratados por reestenosis de stents metálicos.
- –
A pesar de que se desconoce cuáles son las razones de esta diferencia, puede que tenga relación con el efecto adverso de los recubrimientos de polímero, que permanecen en la estructura del stent mucho tiempo después de haber realizado su función (liberación de fármaco).
- –
Se analizó a los pacientes incluidos en un ensayo clínico aleatorizado y a gran escala que comparaba los SFA sin polímero y los SFA con polímero duradero que presentaban reestenosis y comparaba los resultados tras la intervención por reestenosis según el tipo del stent original.
- –
Una gran proporción de los pacientes que se sometieron a una nueva intervención por RS del SFA se sometieron a una nueva angiografía (83,4%).
- –
No se observaron diferencias en la reestenosis binaria recurrente en función de si el stent reestenosado era sin polímero o con recubrimiento de polímero duradero.
- –
La tasa de eventos adversos durante el seguimiento también fue comparable entre los pacientes tratados por reestenosis del SFA sin polímero y del SFA con polímero duradero, incluso después de ajustar en función de las diferencias en el tratamiento recibido.
Los autores agradecen la contribución de los investigadores del ensayo ISAR-TEST 5.