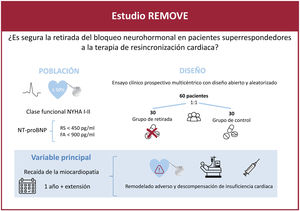
La terapia de resincronización cardiaca (TRC) es un tratamiento eficaz para la miocardiopatía dilatada no isquémica con bloqueo de rama izquierda, y en algunos casos puede normalizar la fracción de eyección del ventrículo izquierdo (FEVI). Sin embargo, se desconoce si en estos pacientes es necesario mantener el tratamiento médico bloqueador neurohormonal. El objetivo del estudio es analizar si su retirada a largo plazo es segura.
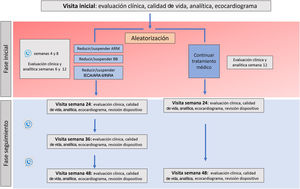
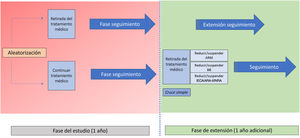
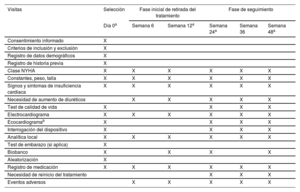
MétodosEl ensayo clínico REMOVE es un estudio multicéntrico, prospectivo, con diseño abierto y aleatorizado 1:1 para evaluar el efecto de la retirada del tratamiento bloqueador neurohormonal en pacientes con miocardiopatía dilatada no isquémica con bloqueo de rama izquierda, portadores de TRC con FEVI recuperada, seguimiento a 12 meses tras su retirada completa y posibilidad de continuar en la fase de extensión de seguimiento a 24 meses. La variable principal es la recidiva de la miocardiopatía, definida como cualquiera de las siguientes: a) reducción de la FEVI >10% (si la FEVI es <50%); b) reducción de la FEVI >10% acompañada de un aumento >15% en el volumen telesistólico indexado respecto al previo y en cifra superior al valor normal, o c) insuficiencia cardiaca descompensada con necesidad de administrar diuréticos intravenosos. Los pacientes en que se cumpla el evento primario se reiniciará el tratamiento farmacológico.
ConclusionesLos resultados de este estudio contribuirán a mejorar nuestro conocimiento sobre este grupo especial de pacientes, los superrespondedores a la TRC.
Registrado en ClinicalTrials.gov (Identificador: NCT05151861).
Palabras clave
Identifíquese
¿Aún no es suscriptor de la revista?
Comprar el acceso al artículo
Comprando el artículo el pdf del mismo podrá ser descargado
Precio: 19,34 €
Teléfono para incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h