La información clínica de la nueva generación de CoreValve Evolut R recapturable y reposicionable es escasa.
MétodosSe recopiló prospectivamente, entre febrero de 2015 y abril de 2016, la información clínica de todos los pacientes sometidos a implante percutáneo de válvula aórtica (TAVI) con la Evolut R por estenosis aórtica sintomática. El objetivo primario fue el compuesto de seguridad y éxito del implante a los 30 días. También se indicó la incidencia de nuevos implantes de marcapasos.
ResultadosEntre los 83 pacientes sometidos a TAVI durante el periodo de estudio, 71 (el 85,5% de la población; media de edad, 83 [intervalo intercuartílico, 80-87] años; puntuación de la Society of Thoracic Surgeons del 4,8%±3,5%) eran susceptibles de implante de la Evolut R y se los incluyó en el análisis. Fue necesario reposicionar la válvula en el 26,8% de los procedimientos. El objetivo de seguridad compuesto se observó en el 11,3% de los pacientes a los 30 días, con una mortalidad por todas las causas del 2,8%. Se logró el éxito del implante en el 90,1% de los pacientes. La fuga paravalvular fue de grado < II en el 98,4% de los pacientes. Se redujo el gradiente aórtico transvalvular medio del basal de 42,5±14,5 a 7,7±4,0 mmHg al alta (p<0,0001). Fue necesario implantar nuevos marcapasos en el 23,9% de los pacientes.
ConclusionesLa nueva generación de Evolut R es adecuada para la mayoría de los pacientes y muestra una tasa de éxito del implante alta y una mortalidad aceptable en una población sin sesgos, consecutiva y sin exclusiones, de un único hospital que realiza los TAVI exclusivamente con válvulas de la casa comercial Medtronic.
Palabras clave
Durante la última década, la tecnología de las válvulas cardiacas percutáneas (VCP) ha alcanzado mejoras importantes. Sin embargo, se han identificado algunos inconvenientes, a pesar de los favorables resultados clínicos de los ensayos controlados y aleatorizados en comparación con la cirugía1,2. De hecho, además de proporcionar datos de durabilidad a muy largo plazo, todos los esfuerzos deben centrarse en reducir las complicaciones del acceso vascular, las fugas paravalvulares (FPV), los ictus y los implantes de marcapasos permanentes antes de ampliar la indicación del implante percutáneo de válvula aórtica (TAVI) en poblaciones más jóvenes con menor riesgo. Con objeto de mejorar los resultados clínicos y el perfil de seguridad de las válvulas autoexpandibles CoreValve (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos), se ha desarrollado una nueva generación de VCP recapturables y reposicionables (sistema CoreValve Evolut R, al que denominaremos aquí Evolut R). Esta VCP fue autorizada mediante la Conformité Européenne en septiembre de 2014 para el tamaño de 23 mm y en febrero de 2015 para los tamaños de 26 y 29 mm, y por la Food and Drug Administration de los Estados Unidos en junio de 2015. Actualmente, el dispositivo de 31 mm está disponible solo en el modelo de CoreValve de cuarta generación. El objetivo del presente estudio es presentar los datos de seguridad obtenidos prospectivamente y los resultados clínicos validados de manera independiente en pacientes consecutivos tratados con la válvula Evolut R en un solo centro empleando exclusivamente la VCP de Medtronic durante ese periodo.
MÉTODOSPoblación de pacientes y evaluaciónTras el lanzamiento de Evolut R en Suiza en febrero de 2015 y hasta abril de 2016, de los 83 pacientes tratados con TAVI en un mismo centro, 71 (85,5%) recibieron la válvula Evolut R, mientras que en 12 (14,5%) pacientes se utilizó la CoreValve de 31 mm de cuarta generación debido a un anillo aórtico grande (perímetro entre 81,7 y 91,1 mm, equivalente a un diámetro medio de 26-29 mm) y se los excluyó del análisis. Todos los pacientes fueron tratados por una estenosis aórtica sintomática grave, definida en la ecocardiografía transtorácica en reposo por un área de válvula aórtica < 1,0 cm2 o un índice de válvula aórtica < 0,6 cm2/m2. Se calculó la puntuación logística European System for Cardiac Operative Risk Evaluation (EuroSCORE), la EuroSCORE II y la puntuación de riesgo de la Society of Thoracic Surgeons como parte de la evaluación de la operabilidad. Además, el equipo cardiaco multidisciplinario local, formado por cardiólogos intervencionistas, cirujanos cardiacos, anestesiólogos cardiovasculares y especialistas en cuidados intensivos, evaluó a todos los pacientes. Como norma general, el equipo cardiaco optó por el empleo de TAVI para los pacientes considerados con aumento del riesgo para la cirugía convencional o en situación de fragilidad. Se consideró frágiles a los pacientes en los que se daba 1 de los siguientes criterios: lentitud de la marcha (< 6 s), poca fuerza de prensión, antecedentes de caídas recientes, pérdida de peso reciente (> 5 kg/año), concentración sérica de albúmina baja (< 35 g/l) o índice de masa corporal bajo (< 20). A cada paciente se le realizó una evaluación basal de la historia clínica, la exploración física, la ecocardiografía transtorácica y la analítica basal. Los pacientes dieron su consentimiento informado por escrito para la intervención de TAVI y para el uso de datos anónimos relacionados para fines de investigación y publicación.
Se realizó una tomografía computarizada multicorte para medir las dimensiones del anillo y la raíz aórticos, así como las calcificaciones, y para evaluar el diámetro vascular mínimo, la tortuosidad y las calcificaciones iliofemorales o subclavias. Excepcionalmente, en los casos de insuficiencia renal aguda grave, se utilizó una resonancia magnética o ecocardiografía transesofágica para medir las dimensiones del anillo y la raíz aórticos. Se realizó una evaluación vascular adicional con una aortografía abdominal que incluyó los vasos iliofemorales y con angiografías femorales selectivas en el momento de llevar a cabo la angiografía coronaria, a criterio del operador en los pacientes con una tomografía computarizada multicorte disponible y en todos los casos en que no la había.
DispositivoEl dispositivo Evolut R consiste en un marco de soporte de nitinol autoexpandible radioopaco, con una falda de pericardio porcino y una válvula pericárdica supraanular de 3 valvas tratada con ácido alfaaminooleico. La geometría celular y el marco de la prótesis se han rediseñado: el objetivo fue mejorar la conformabilidad al anillo aórtico, para reducir las FPV y optimizar la interacción del marco con el anillo nativo. Además, la fuerza radial es más homogénea en la entrada en los diferentes tamaños del dispositivo, y la salida se ha acortado con un diseño en pala, en vez de las lengüetas anteriormente utilizadas para facilitar la liberación de la válvula del catéter de aplicación. El catéter de aplicación EnVeo R tiene una vaina InLine (equivalente a un calibre 14 Fr, correspondiente a un diámetro externo real de 18 Fr), que permite aplicar la válvula sin necesidad de una vaina introductora aparte. La nueva cápsula reforzada con nitinol cortado con láser se ha diseñado para hacer posible recolocar y recapturar la válvula mientras no se ha alcanzado el 80% del despliegue valvular máximo (que se considera el «punto sin retorno»).
ProcedimientoEl acceso vascular se obtuvo habitualmente mediante punción arterial percutánea, mientras que en algunas anatomías iliofemorales seleccionadas se prefirió la disección quirúrgica. Una vez obtenido el acceso arterial, se realizó una angiografía para asegurar el lugar de entrada correcto de la vaina al nivel de la arteria femoral común. Para el abordaje percutáneo, se realizó un precierre usando un dispositivo de cierre vascular de sutura Prostar XL 10 (Abbott Vascular; Reedwood City, California, Estados Unidos). En los casos en que había una arteriopatía periférica que limitaba el acceso femoral, se consideró la posibilidad de utilizar una vaina expandible con balón (Solopath Onset Medical, una subdivisión de Terumo Medical Corporation; Irvine, California, Estados Unidos). Se realizó una predilatación de la válvula aórtica nativa en el caso de que hubiera calcificaciones intensas de las valvas. Se llevó a cabo una angiografía de la raíz aórtica antes, durante y después del despliegue de la válvula, con objeto de evaluar la posición y la funcionalidad de la prótesis. No se guio el procedimiento por ecocardiografía transesofágica de manera sistemática. El cierre del acceso vascular se realizó con Prostar XL 10 en condiciones de ausencia de flujo tras el hinchado de un balón periférico en la arteria iliaca externa o iliaca común, utilizando un acceso femoral contralateral cruzado. Se confirmó la hemostasis completa y la ausencia de complicaciones vasculares mediante una angiografía cruzada. La pauta antitrombótica consistió en un tratamiento antiagregante plaquetario combinado doble con ácido acetilsalicílico y clopidogrel durante 3 meses, seguido de ácido acetilsalicílico en monoterapia, cuando no era necesaria la anticoagulación oral. A los pacientes con anticoagulación crónica se les añadió ácido acetilsalicílico en monoterapia durante 3 meses.
Objetivos del estudioTodos los episodios de los objetivos clínicos se validaron de manera independiente según los criterios del Valve Academic Research Consortium (VARC)-23. Los criterios de valoración principales fueron los objetivos combinados de seguridad inicial del VARC-2 y el éxito del dispositivo a los 30 días. Los objetivos combinados de seguridad inicial incluyeron la incidencia de la mortalidad por cualquier causa, todos los ictus, la hemorragia con peligro para la vida, la lesión renal aguda, la obstrucción coronaria que requiriera intervención, las complicaciones vasculares importantes y la disfunción relacionada con la válvula que requiriera una nueva intervención. El éxito del dispositivo según los criterios VARC–2 se define como la ausencia de mortalidad en la intervención, la colocación correcta de una sola VCP y el funcionamiento pretendido de la prótesis. Realizaron la validación de los objetivos cardiólogos intervencionistas independientes que formaban parte del registro suizo de TAVI. Se registró también la incidencia de nuevos implantes de marcapasos.
Seguimiento y obtención de datosSe realizó una evaluación clínica, un electrocardiograma de 12 derivaciones y una ecocardiografía transtorácica antes del alta hospitalaria y como parte del seguimiento a los 30 días, en nuestro centro o por el cardiólogo privado del paciente. En los casos en que los datos se obtuvieron de una consulta privada, la documentación se obtuvo del médico que trataba al paciente. Todos los datos hasta la visita de seguimiento a los 30 días se recogieron como parte de nuestro registro prospectivo local, que fue aprobado por el comité de ética, y se introdujeron también en el registro suizo de TAVI.
Análisis estadísticoLas variables discretas se presentan en forma de número y porcentaje. Las variables continuas con una distribución normal se expresan mediante la media ± desviación estándar, y las variables con distribución no normal, con la mediana [intervalo intercuartílico]. La distribución de las variables continuas se evaluó mediante el examen visual de los histogramas y se confirmó con la prueba de Shapiro-Wilk. Se comparó la media del gradiente aórtico en la situación basal y antes del alta empleando la prueba de la t de Student, y los resultados se presentan en forma de barras de error con la desviación estándar. Los análisis estadísticos se realizaron con el programa IBM SPSS Statistics, versión 23 (IBM; Armonk, Nueva York, Estados Unidos).
RESULTADOSPoblación de pacientesDurante el periodo de estudio, de los 83 pacientes consecutivos tratados con TAVI en el centro, 71 (85,5%) se consideraron adecuados para el uso de la válvula Evolut R con los tamaños valvulares actualmente disponibles y se los incluyó en el análisis. La mediana de edad fue de 83,0 [80,0-87,0] años y el 49,3% de los pacientes eran mujeres. Las características basales de los pacientes y los parámetros ecocardiográficos se presentan en la tabla 1. La media de la puntuación EuroSCORE logística calculada fue del 17,1±13,8%, la media de la puntuación EuroSCORE II fue del 5,2±5,0% y la media de la puntuación de la Society of Thoracic Surgeons, del 4,8±3,5%. Un total de 16 (22,5%), 7 (9,9%) y 11 (15,5%) pacientes tenían una puntuación EuroSCORE logística > 20%, una EuroSCORE II > 10% y una puntuación de la Society of Thoracic Surgeons > 20% respectivamente. En total, el 85,9% de los pacientes cumplían los criterios de como mínimo 1 parámetro de fragilidad. Siete pacientes (9,9%) ya eran portadores de un marcapasos permanente en el momento del TAVI.
Características basales
| Cohorte total (n = 71) | |
|---|---|
| Sexo | |
| Mujeres | 35 (49,3) |
| Edad (años) | 83,0 [80,0-87,0] |
| IMC | 26,1 [23,1-29,9] |
| Tabaquismo | |
| Nunca ha fumado o exfumador | 65 (91,5) |
| Fumador activo | 6 (8,5) |
| Diabetes mellitus | 23 (32,4) |
| Dislipemia | 52 (73,2) |
| Hipertensión | 58 (81,7) |
| EPOC | 13 (18,3) |
| EVP | 4 (5,6) |
| EC | 37 (52,1) |
| IM previo | 13 (18,3) |
| CABG previa | 4 (5,6) |
| ICP previa | 22 (31,0) |
| Ictus cerebral previo | 8 (11,3) |
| Clase de la NYHA | |
| I-II | 20 (28,2) |
| III-IV | 51 (71,8) |
| FG (ml/min/1,73 cm2) | 58,5±17,4 |
| Fibrilación/aleteo auricular | 20 (28,2) |
| Marcapasos permanente o desfibrilador ya implantados | 7 (9,9) |
| Área de válvula aórtica (cm2) | 0,7±0,2 |
| Velocidad máxima aórtica (m/s) | 4,2±0,7 |
| Gradiente medio aórtico (mmHg) | 42,5±14,5 |
| FEVI (%) | 60,0 [51,0-65,0] |
| EuroSCORE logístico (%) | 17,1±13,8 |
| EuroSCORE II (%) | 5,2±5,0 |
| Puntuación de la STS (%) | 4,8±3,5 |
| Fragilidad* | 61 (85,9) |
| Mini-Mental State Examination | 28 [25-29] |
CABG: cirugía de revascularización arterial coronaria; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; EuroSCORE: European System for Cardiac Operative Risk Evaluation; EVP: enfermedad vascular periférica; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
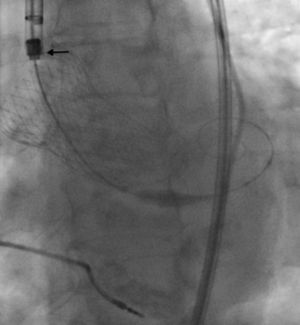
Las características de la intervención se presentan en la tabla 2. Se utilizó un abordaje vascular plenamente percutáneo en el 93,0% y en el resto de los pacientes (7,0%) se realizó una disección quirúrgica de la femoral. Se introdujo el catéter de liberación EnVeo R sin una vaina adicional en 68 pacientes (95,8%), y se utilizó una vaina expandible con balón, la vaina Solopath de calibre 19 Fr (Terumo, Japón), en 3 (4,2%) debido a una afección iliofemoral y un diámetro mínimo limítrofe. En 36 pacientes (50,7%) se realizó una predilatación antes del implante de la válvula y en 23 (32,4%), una posdilatación de la prótesis durante la misma intervención inicial. En el 25,0% de los pacientes (9 de 36) a los que se realizó predilatación, fue necesaria también una posdilatación. El tamaño valvular de 29mm fue el más comúnmente utilizado (el 57,8% de los pacientes). Se intentó un reposicionamiento en 17 pacientes (23,9%) mediante reintroducción de la vaina, con éxito en todos los casos. No se realizó ninguna recaptura con extracción completa de la prótesis. En 1 paciente (1,4%) hubo una embolización de la válvula, que requirió conversión inmediata a intervención quirúrgica, debida a un error técnico: cuando la prótesis no se había desplegado por completo, pero sí había superado el punto sin retorno del proceso de despliegue, la pala de la curva interna de la aorta continuaba cubierta en parte por la punta no radioopaca de la cápsula y, por consiguiente, continuaba fijada al sistema de aplicación (figura 1). En consecuencia, cuando se retiró el catéter de liberación, se traccionó la prótesis hacia la aorta ascendente. Dado que la válvula estaba flotando en la aorta ascendente y el paciente estaba hemodinámicamente estable y tenía un riesgo quirúrgico intermedio, se propuso una conversión a cirugía en el quirófano para retirar la prótesis y se trató al paciente al mismo tiempo con un reemplazo quirúrgico de válvula aórtica. La recuperación posoperatoria se complicó con una infección urinaria causante de bacteriemia y una fibrilación auricular de nueva aparición. Tres pacientes (4,2%) necesitaron el implante de una segunda válvula durante la misma intervención inicial, debido a un implante demasiado alto de la válvula, con una FPV significativa. En cada uno de estos 3 pacientes, la primera prótesis valvular se implantó en el límite superior y mostró una ligera migración hasta situarse por encima de este límite durante la liberación completa de la válvula, después de superado el punto sin retorno de la recolocación de la cápsula con la vaina.
Resultados de la intervención
| Cohorte total (n = 71) | |
|---|---|
| Acceso vascular | |
| Transfemoral | 68 (95,8) |
| Subclavia | 3 (4,2) |
| Disección quirúrgica | 5 (7,0) |
| Vaina Solopath de calibre 19 Fr | 3 (4,2) |
| Anestesia | |
| Local | 53 (74,7) |
| General | 18 (25,4) |
| Cantidad de contraste inyectado (ml) | 146,9±57,3 |
| Tiempo de fluoroscopia (min) | 21,4±7 |
| Tamaño de válvula utilizado (mm) | |
| 23 mm | 2 (2,8) |
| 26 mm | 28 (39,4) |
| 29 mm | 41 (57,8) |
| Número de recapturas de la válvula | 19 (26,8) |
| Recaptura de la válvula con éxito | 100% de los casos intentados |
| Nuevos implantes de marcapasos permanente (a los 30 días) | 17 (23,9) |
Los valores expresan n (%) o media ± desviación estándar.
A los 30 días, se habían observado episodios del objetivo de valoración combinado de seguridad inicial en 8 pacientes (11,3%) y 2 (2,8%) habían fallecido. El primero de ellos murió de muerte súbita 6 días después de la intervención de TAVI, a causa de una arritmia ventricular maligna, que probablemente estuvo relacionada con la amiloidosis cardiaca que se diagnosticó por primera vez en la autopsia. Se implantó al paciente un marcapasos permanente en el día 2 tras el TAVI y la ecocardiografía transtorácica realizada el día antes de su muerte mostró una función sistólica y diastólica normal, sin disfunción valvular ni derrame pericárdico. Al segundo paciente se le diagnosticó una hemorragia renal grave a las 12 h del TAVI, que se controló mediante embolización con coil. Sin embargo, el paciente falleció el día 4 por un fallo multiorgánico. Por lo que respecta a la causa de la perforación, es posible que la guía hidrófila de 0,35” utilizada para el cierre del acceso vascular se hubiera introducido inadvertidamente en los vasos renales y causara la perforación. Otra posibilidad es que la hemorragia pudiera haber estado relacionada con el tratamiento antiagregante plaquetario combinado doble y con la anticoagulación periintervención. Esta muerte se consideró relacionada con la intervención. Se registraron otros 3 casos de hemorragia con peligro para la vida no mortales, 2 de ellas correspondientes a hemorragias relacionadas con el lugar de acceso y 1 como consecuencia de la lisis por un ictus tras la hospitalización inicial. La primera hemorragia del lugar de acceso fue retroperitoneal y se debió a la perforación con la guía de una pequeña rama de la arteria iliaca interna, que se produjo en el momento del cruce realizado para verificar el cierre vascular. No se observó en la angiografía final, pero una tomografía computarizada realizada el día 5 por dolor de espalda y caída de la hemoglobina mostraron un hematoma retroperitoneal con hemorragia activa que requirió embolización con coil de la rama distal. La segunda hemorragia en el lugar de acceso con peligro para la vida se debió a un fallo del dispositivo de cierre que requirió el implante no previsto de un stent en la arteria femoral común derecha. Tres pacientes (4,2%) presentaron complicaciones vasculares de carácter mayor del VARC-2 relacionadas con perforación vascular o con fallo de dispositivo de cierre del lugar de acceso, según lo antes descrito.
Cuatro pacientes (5,6%) sufrieron un ictus, incluido 1 ictus invalidante (1,4%) (puntuación de Rankin, 4). En 1 paciente, se identificó un ictus no invalidante a los 10 días del TAVI, en una tomografía computarizada multicorte cerebral realizada por la presencia de confusión aguda. Los resultados de los demás objetivos combinados de seguridad inicial del VARC-2 se presentan en la tabla 3.
Objetivos combinados de seguridad inicial del Valve Academic Research Consortium-2 (a los 30 días) y éxitos del dispositivo
| Cohorte total (n = 71) | |
|---|---|
| Objetivos combinados de seguridad inicial | 8 (11,3) |
| Mortalidad por cualquier causa | 2 (2,8) |
| Mortalidad cardiovascular | 2 (2,8) |
| Total de ictus | 4 (5,6) |
| Invalidantes | 1 (1,4) |
| Hemorragia con peligro para la vida | 4 (5,6) |
| Lesión renal aguda, AKIN 2 o 3 | 3 (4,2) |
| Obstrucción arterial coronaria que requiere intervención | 0 (0,0) |
| Complicaciones vasculares mayores | 3 (4,2) |
| Disfunción relacionada con la válvula que requiere una nueva intervención | 0 (0,0) |
| Éxito del dispositivo | 64 (90,1) |
| Ausencia de mortalidad en la intervención | 70 (98,6) |
| Colocación correcta de una sola válvula | 67 (94,4) |
| Resultado de la válvula pretendido* | 67 (94,4) |
AKIN: Acute Kidney Injury Network.
Los valores expresan n (%).
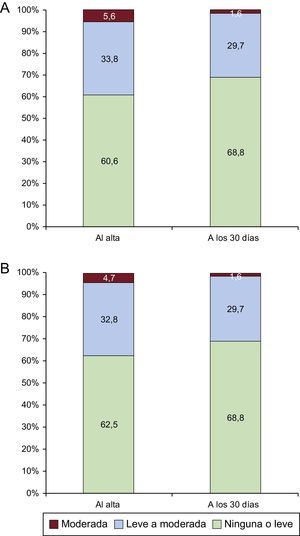
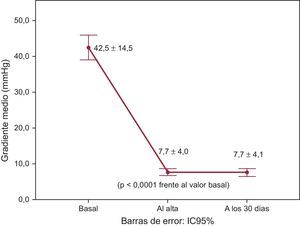
El porcentaje general de éxito del dispositivo según los criterios VARC-2 fue del 90,1%, con solo 1 caso de muerte en la intervención. La FPV se clasificó como inferior a moderada en el 94,4 y el 98,5% de los pacientes, y como moderada en el 5,6 y el 1,6% en el momento del alta y a los 30 días respectivamente. No se observó ninguna FPV grave (figura 2A). En la figura 2B se muestran los resultados de la evaluación de la FPV, con la exclusión de los 7 pacientes (9,9%) sin seguimiento ecocardiográfico a los 30 días en nuestro centro. De estos 7 pacientes, solamente 1 presentó una FPV moderada al alta, pero con una clase funcional I de la New York Heart Association a los 30 días. La media del gradiente transvalvular aórtico se redujo de 42,5±14,5mmHg en la situación basal a 7,7±4,0 mmHg en el momento del alta (p < 0,0001 en comparación con el valor basal) y 7,7±4,1 mmHg a los 30 días (figura 3).
Fue necesario implantar un nuevo marcapasos en 17 pacientes (el 23,9%; el 26,6% excluyendo a los pacientes con marcapasos previo) y todos los implantes excepto 1 se produjeron durante el periodo de hospitalización inicial. Las indicaciones fueron el bloqueo auriculoventricular de tercer grado (el 52,9% de los nuevos implantes), el bloqueo alternante de rama izquierda y derecha del haz (17,7%), el bloqueo de primer grado asociado a bloqueo de rama derecha o izquierda del haz (17,7%) y la fibrilación auricular con respuesta ventricular lenta (11,8%).
DISCUSIÓNActualmente, la única serie disponible en PubMed sobre la válvula de nueva generación, autoexpandible, recapturable y reposicionable Evolut R es la del CE Mark Clinical Study4, en la que se incluyó a 60 pacientes, probablemente seleccionados. En otras 2 series se ha incluido a pacientes tratados con la prótesis Evolut R; sin embargo, no presentaban resultados que permitieran evaluar directamente la seguridad y la eficacia de este dispositivo de nueva generación5,6. La primera experiencia en el ser humano tuvo lugar en septiembre de 2013, con una válvula Evolut R de 23 mm que se implantó con éxito en una válvula aórtica bioprotésica degenerada, sin necesidad de recaptura7. Hasta donde sabemos, este estudio es el primero que presenta los resultados de la válvula Evolut R en un contexto de práctica clínica real: una población consecutiva, no seleccionada (all-comers) de pacientes ancianos, sin sesgo de selección, ya que se realizaron los TAVI exclusivamente con la válvula Evolut R o, si el anillo tenía un perímetro > 81,7 mm, con la CoreValve de 31 mm. Todos los pacientes que durante el periodo del estudio el equipo cardiaco consideró de alto riesgo o inoperables tenían una anatomía aórtica que permitía implantar 1 de las 2 prótesis mencionadas. Los resultados principales del presente estudio son: a) el dispositivo es adecuado en el 85,5% de los pacientes no seleccionados tratados mediante TAVI con los tamaños de válvula Evolut R actualmente disponibles; b) el implante se asoció con un alto porcentaje de éxitos del dispositivo (el 90,1% de los pacientes), y c) los resultados obtenidos en los pacientes mostraron aceptables morbilidad y mortalidad asociadas (mortalidad por cualquier causa, 2,8%).
Objetivos clínicos de seguridad inicial del Valve Academic Research Consortium-2Aunque hoy el TAVI se sigue realizando de manera preferente en pacientes con riesgo quirúrgico alto o prohibitivo, la mortalidad a corto y medio plazo continúa siendo aceptable en la mayoría de las series publicadas. Se presenta una tasa de mortalidad del 2,8% a los 30 días, que concuerda con las de estudios aleatorizados y no aleatorizados previos sobre implante de válvula autoexpandible1,8–10 y es inferior a las tasas de mortalidad descritas en algunos registros nacionales11,12. A los 2 pacientes de nuestra serie que fallecieron se los consideró inoperables y tenían más de 85 años.
En el primer ensayo aleatorizado, el PARTNER Cohorte A, en el que se comparó el remplazo valvular percutáneo con el quirúrgico, la tasa de ictus fue significativamente superior en los pacientes tratados con TAVI; sin embargo, ocurrió lo contrario en el ensayo aleatorizado más reciente de CoreValve en Estados Unidos1,2. Sin embargo, los ictus invalidantes según la clasificación del VARC–2 son muy poco frecuentes y parece que se producen de manera independiente del tipo de válvula y el acceso vascular utilizado13. En nuestra serie, se produjo un ictus invalidante en 1 paciente (1,4%). Por lo que respecta a las propiedades de recapturabilidad de la válvula Evolut R, en los 15 pacientes que necesitaron una recaptura de la válvula para un reposicionamiento, de manera similar a lo descrito en el CE Mark Clinical Study4, no hubo ningún caso de ictus periintervención. La influencia de la valvuloplastia aórtica previa al TAVI en la incidencia de ictus ha pasado a ser una cuestión de debate. A pesar de que Pagnesi et al.5 han descrito recientemente ausencia de diferencias por lo que respecta a las tasas de ictus y la mortalidad a 1 año entre el TAVI con y sin predilatación, la ausencia de predilatación se asoció con mayor incidencia de ictus agudos a 30 días. En cambio, anteriormente se había descrito que la posdilatación es un factor independiente predictivo de eventos cerebrovasculares agudos14. En nuestro estudio, en el 50,7% de los pacientes se utilizó predilatación, con una tasa de ictus del 8,3% (3 de 36 pacientes) a los 30 días y en 1 paciente con un ictus no invalidante se realizó posdilatación. No obstante, hay otros factores, como la fibrilación auricular de nueva aparición, que podrían desempeñar también un papel importante en la incidencia de ictus, además de la intervención en sí. De hecho, la mitad de los ictus (2 de 4 pacientes) se diagnosticaron más de 7 días después de la intervención.
La reducción de los diámetros de los catéteres de aplicación de la válvula, junto con la experiencia creciente de los operadores y la mejor evaluación preoperatoria del acceso vascular, ha conducido a una disminución de las complicaciones vasculares. En este estudio, se produjeron complicaciones vasculares en el 15,5% de los pacientes, y se pudo tratarlas todas con éxito por vía percutánea, si bien 1 paciente (con una hemorragia renal con peligro para la vida) falleció finalmente por un fallo multiorgánico debido a un retraso en el diagnóstico. A pesar de que las complicaciones vasculares tras el TAVI continúan siendo frecuentes, el implante percutáneo es fiable y seguro15. Stortecky et al.16 han presentado unos resultados clínicos similares a los 30 días en los pacientes con complicaciones vasculares tratadas por vía percutánea y los pacientes sin complicaciones vasculares. Sin embargo, la distinción entre complicaciones vasculares de carácter mayor y menor según el VARC-2 es de capital importancia, ya que solo las complicaciones mayores se asocian con mayor mortalidad17. Según los criterios del VARC–2, se observan menos complicaciones vasculares mayores (el 4,2% de los pacientes) que en el CE Mark Clinical Study con el sistema Evolut R (8,3%). En comparación con dicho estudio, se presenta una tasa de hemorragias con peligro para la vida muy similar (el 5,0 frente al 5,6% en nuestra experiencia) y la pequeña diferencia se debe principalmente a 1 caso de hemorragia intracraneal tras una lisis por ictus 18 días después del TAVI en 1 paciente con fibrilación auricular.
Éxito según los criterios del Valve Academic Research Consortium-2Se alcanzó el éxito del dispositivo en el 90,1% de los pacientes, tasa de éxitos superior a la descrita por Manoharan et al.4 con el sistema Evolut R (78,6%). Sin embargo, nuestros resultados son similares a los de otros estudios recientes que emplearon VCP autoexpandibles, con unas tasas de éxito del dispositivo según los criterios VARC-2 que van del 77,5 al 96%4,10,18. La FPV se considera actualmente una de las principales limitaciones de las VCP disponibles, y las FPV moderadas son en gran medida los fallos del dispositivo en nuestra cohorte. Un subanálisis del ensayo PARTNER19 ha aportado evidencia indicativa de una intensa influencia de las FPV en la mortalidad a largo plazo. Un amplio metanálisis ha corroborado recientemente esta asociación20. Las capacidades de recolocación de la vaina y de recaptura de la válvula Evolut R tienen especial interés, puesto que facilitan la resolución de las FPV tras una mala colocación de la válvula. Además, el exceso de tamaño optimizado de la Evolut R mejora la cobertura de la válvula nativa. Por último, el marco de nitinol aporta una fuerza radial uniforme, lo cual reduce la FPV durante los días siguientes al TAVI, como consecuencia de la continua expansión de la prótesis. Esto se tradujo en nuestro estudio en una reducción de las FPV moderadas del 5,6 al 1,6% de los pacientes al alta y a los 30 días respectivamente. En total, la recaptura de la válvula se realizó 17 veces en 15 pacientes con objeto de optimizar la colocación de la prótesis, y todos los intentos de recaptura de la válvula tuvieron éxito.
Implante de nuevos marcapasosEl implante de nuevos marcapasos fue el evento adverso más frecuente (el 23,9% de los pacientes) en el presente estudio. Las tasas de implante de nuevos marcapasos después del TAVI son superiores entre los pacientes en que se utilizan válvulas autoexpandibles en comparación con las expandibles con balón, y en la literatura oscilan entre el 11,7 y el 39,3% a los 30 días para los dispositivos autoexpandibles1,4,10,21–24. Se ha descrito que la profundidad a la que se coloca el dispositivo es un importante factor independiente predictivo de la aparición de anomalías de la conducción y la necesidad de implantar un marcapasos permanente22. En el CE Mark Clinical Study se observó una tasa de implante de marcapasos inferior (11,7%) a la de nuestra experiencia inicial con la válvula Evolut R (23,9%). Tiene interés señalar que, cuando se implantaron marcapasos permanentes en el CE Mark Clinical Study, la profundidad media del implante respecto a la cúspide no coronaria fue de 8,1±3,5mm, mientras que cuando no fue necesario un marcapasos permanente, fue de 3,3±2,5mm. En consecuencia, una de las posibles explicaciones de nuestra tasa de implante de marcapasos más alta podría ser que, tras la migración de las 3 válvulas implantadas en el límite superior, que se desplazaron ligeramente por encima del anillo durante la liberación completa de la válvula, hubiéramos sido más conservadores en cuanto a la altura de implantación.
LimitacionesLa principal limitación de este estudio es el bajo número de pacientes incluidos, lo cual hace que la potencia estadística sea baja. Además, la evaluación de la FPV no la realizó un laboratorio central independiente. Sin embargo, todas las ecocardiografías transtorácicas previas al alta las examinó un ecocardiografista sénior que no participó en las intervenciones. Usando solo las puntuaciones de riesgo (EuroSCORE o Society of Thoracic Surgeons), nuestra población podría considerarse de riesgo quirúrgico intermedio. Sin embargo, la evaluación de la fragilidad, incluidas las pruebas de velocidad de la marcha y de fuerza de prensión, refleja la alta vulnerabilidad de estos pacientes ancianos.
CONCLUSIONESLa nueva generación del sistema Evolut R es apropiada para la mayoría de los pacientes, mostró un alto porcentaje de éxitos y morbilidad y mortalidad aceptables en una serie consecutiva de pacientes ancianos no seleccionados (all-comers) y sin sesgo de selección, tratados en un único centro mediante implante de las VCP de Medtronic exclusivamente. Aunque el menor tamaño de la vaina y la posibilidad de recaptura brindan la posibilidad de mejorar los resultados clínicos respecto a los dispositivos de primera generación, este beneficio deberá demostrarse en estudios multicéntricos amplios.
FINANCIACIÓNGEcor (fundación de investigación en cardiología de la División de Cardiología del Hospital Universitario de Ginebra).
CONFLICTO DE INTERESESS. Noble es proctor de Medtronic CoreValve y de Evolut R. M. Roffi recibió subvenciones de investigación para su centro de Abbott Vascular, Boston Scientific, Biotronik, Biosensor y Medtronic.
- –
El TAVI ha pasado a ser el nuevo tratamiento estándar para la estenosis aórtica sintomática grave de los pacientes con riesgo quirúrgico alto o prohibitivo.
- –
Las FPV, las complicaciones del acceso vascular, los ictus y la necesidad de implantar marcapasos continúan siendo las principales limitaciones que será preciso abordar mejor antes de considerar el TAVI en pacientes con menos riesgo.
- –
Para optimizar la exactitud en el implante de las válvulas y mejorar su perfil de seguridad, se ha desarrollado una nueva generación de prótesis autoexpandibles, reposicionables y recapturables, CoreValve Evolut R (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos).
- –
La nueva generación de Evolut R muestra altas tasas de éxito del dispositivo, con una baja mortalidad por cualquier causa (2,8%) a los 30 días.
- –
Esta nueva generación de VCP es adecuada para la mayoría de los pacientes, ya que todos los que el equipo cardiaco consideró de alto riesgo e inoperables durante el periodo de estudio tenían una anatomía aórtica que permitía el implante de la válvula Evolut R cuando el anillo aórtico era < 81,7 mm (ya que el tamaño máximo disponible de la válvula Evolut R era de 29 mm).
- –
Este es el primer estudio sobre los resultados de la válvula Evolut R en un contexto de práctica clínica real en una población de pacientes consecutivos no seleccionados.