Palabras clave
INTRODUCCION
Presentamos el caso de una paciente que ingresó en el hospital por dolor torácico en el contexto de un síndrome coronario agudo con elevación de las enzimas cardíacas y cambios electrocardiográficos compatibles con infarto agudo de miocardio anterior. El cuadro se complicó con hipotensión y shock cardiogénico debido a la presencia de un gradiente dinámico obstructivo en el tracto de salida del ventrículo izquierdo (TSVI), acompañado de insuficiencia mitral moderada y disfunción del ventrículo izquierdo (VI) por acinesia anteroseptoapical.
La obstrucción dinámica del TSVI se ha descrito clásicamente en el contexto de la miocardiopatía hipertrófica obstructiva (MCHO)1, debido a la hipertrofia asimétrica del septo, acompañado del movimiento sistólico anterior de la válvula mitral. Sin embargo, la obstrucción del TSVI puede aparecer en otras situaciones, de forma que si la función sistólica ventricular se torna hiperdinámica en un paciente con hipertrofia septal basal, también se produce obstrucción al TSVI de forma similar a la MCHO2,3. En el caso del infarto de miocardio se produce una hipercinesia compensadora de los segmentos preservados, por lo que el septo basal hipercinético es el que ocasiona la obstrucción del TSVI. El tratamiento usado habitualmente en el shock cardiogénico, como los fármacos inotrópicos (dopamina, adrenalina, dobutamina) o el balón de contrapulsación intraaórtico, está contraindicado, por lo cual debe orientarse hacia el uso de fármacos que disminuyan el gradiente, como los bloqueadores beta, los agonistas alfa puros, la metoxamina o la fenilefrina, evitando la depleción de volumen o el uso de vasodilatadores4.
CASO CLINICO
Mujer de 77 años con antecedentes de hipertensión arterial en tratamiento con diuréticos, que acudió a urgencias por dolor torácico en reposo, documentándose en el electrocardiograma elevación del segmento ST de 1 mm en V1-3, V6 y aVL, con descenso en II, III y aVF y ondas T negativas en I, aVL y V2, y enzimas cardíacas elevadas, creatincinasa (CK) 275 U/l y troponina I 14,67 ng/ml. Durante su estancia en urgencias presentó hipotensión, que se manejó con expansión a base de coloides e infusión de dopamina, tras lo que la paciente persistió hipotensa y taquicárdica, desarrollando un edema agudo de pulmón. En la auscultación presentó soplo sistólico 3/6 en el ápex que se irradiaba a la axila, así como crepitantes bilaterales hasta los campos medios. El cuadro se resolvió tras retirar la dopamina y realizar tratamiento con furosemida, pero posteriormente volvió a presentar hipotensión y reagudización de su insuficiencia cardíaca. Se realizó un ecocardiograma con la paciente sentada, por no tolerar el decúbito, objetivándose disfunción VI severa con acinesia anteroseptoapical para una fracción de eyección (FE) aproximada del 30%, con contractilidad de los segmentos basales preservada, con señal de insuficiencia mitral moderada a severa. El estado de la paciente empeoró y fue preciso efectuar una intubación orotraqueal y ventilación mecánica. Ante la sospecha de complicación mecánica con disfunción VI severa se colocó un balón de contrapulsación intraaórtico y se administraron catecolaminas, a pesar de lo cual la situación de la paciente no mejoró. Se realizó un ecocardiograma transesofágico para descartar una complicación mecánica, comprobándose que la insuficiencia mitral era moderada y no había evidencia de CIV, apreciándose un septo basal engrosado, de aproximadamente 17 mm, e hiperdinámico con movimiento septal anterior de la válvula mitral (fig. 1). Al no poder registrarse el gradiente del tracto de salida por ecocardiograma transesofágico (ETE), se realizó ecocardiograma transtorácico (ETT), recogiéndose un gradiente elevado, de aproximadamente 90 mmHg. Con el catéter de Swan-Ganz no se observó salto oximétrico y la presión de enclavamiento pulmonar fue de 18 mmHg, la presión venosa central de 17 mmHg, con un índice cardíaco de 1,4 l/min/m². Se realizó un cateterismo cardíaco, que reveló unas coronarias sin lesiones y disfunción VI severa, con FE del 31%, con septo hipertrófico, gradiente en el TSVI de 12,5 mmHg y presión telediastólica del VI de 35 mmHg. Ante la presencia de gradiente dinámico en el TSVI se suspendieron las catecolaminas, se retiró el balón de contrapulsación y se administró inicialmente noradrenalina y metoxamina, 1-5 mg cada hora, y expansión del volumen intravascular. Previamente se intentó el tratamiento con esmolol, pero no se objetivó ningún beneficio. Se realizó otro ecocardiograma tras administrar metoxamina, apreciándose una disminución significativa del gradiente, así como un aumento del gradiente postextrasistólico (fig. 2 B y C). Asimismo, presentó fibrilación auricular con deterioro hemodinámico, que requirió cardioversión eléctrica externa y amiodarona, 300 mg, e infusión continua de 900 mg/24 h. Posteriormente la paciente persistía con insuficiencia cardíaca y del soplo sistólico, iniciándose el tratamiento con atenolol, 12,5 mg/12 h, e incrementando la dosis hasta 50 mg/12 h. La clínica de insuficiencia cardíaca así como el soplo desaparecieron, realizándose un ecocardiograma 15 días después, en el que se apreció la recuperación de la función ventricular izquierda, sin zonas de hipocinesia y con una FE del 55% por cuantificación acústica, sin hipertrofia a excepción del septo basal. Asimismo, no se observó gradiente elevado en el TSVI y tampoco fue inducible con la maniobra de Valsalva, aunque bajo tratamiento con bloqueadores beta.
Fig. 1. Imagen de ecocardiografía transesofágica, diástole (imagen superior) y sístole (imagen inferior), en la que se puede apreciar la hipertrofia del septo basal y el desplazamiento de la valva anterior de la válvula mitral que obstruye el TSVI (flecha).
DISCUSION
En ausencia de una MCHO, la obstrucción dinámica en el TSVI precisa de dos requisitos: a) la existencia de hipertrofia del septo basal, y b) que se produzca una situación hiperdinámica del ventrículo izquierdo. Esto tiende a suceder con mayor frecuencia en pacientes ancianos que tienen historia de hipertensión e hipertrofia ventricular izquierda, aunque la hipertensión no es un requisito indispensable. Otro grupo clínico lo constituyen aquellos pacientes que en el período postoperatorio presentan depleción de volumen tratados con agentes inotrópicos. Los pacientes con estenosis aórtica después del recambio valvular son especialmente vulnerables a esta forma de obstrucción del TSVI5,6, asociándose con una mayor morbimortalidad7,8, así como los enfermos en los que se ha realizado cirugía de reconstrucción de la válvula mitral9. Se han descrito casos en individuos con amiloidosis cardíaca2, feocromocitoma, tras colocar un balón de contrapulsación, o después de un infarto de miocardio anteroapical cuando existe hipertrofia del septo basal previa, e incluso en presencia sólo de isquemia miocárdica10,11. En el caso del infarto de miocardio se produce una hipercinesia compensadora de los segmentos preservados, por lo que el septo basal hipercinético es el que ocasiona la obstrucción del TSVI12. El hecho de que se hayan descrito casos de pacientes con coronarias sin lesiones4,13 ha llevado a algunos autores a proponer la obstrucción dinámica del TSVI como la causa desencadenante del daño miocárdico, aunque no se descarta la existencia de un trombo con lisis previa a la coronariografía o el vasoespasmo. La hipercinesia compensadora de los segmentos no infartados en el contexto del infarto agudo de miocardio es un fenómeno frecuentemente observado que tiende a desaparecer a medida que se recupera la función del miocardio isquémico. El seguimiento de algunos de estos pacientes puso de manifiesto la resolución de las anomalías de la motilidad parietal, así como la desaparición del gradiente del TSVI, que no fue inducido posteriormente14. El mecanismo fisiopatológico propuesto para explicar la aparición de isquemia de forma secundaria sería la presencia de un septo basal engrosado, y ciertas circunstancias (hipovolemia, hipercontractilidad, taquicardia, etc.) que provocan una obstrucción dinámica del TSVI y, en consecuencia, un aumento de la presión intraventricular, con disminución de la relación aporte/demanda de oxígeno al miocardio que da lugar a la isquemia. De forma compensadora a la isquemia se genera hipercontractilidad de los segmentos basales, que produce una mayor obstrucción al TSVI y mantiene esta situación. Los pacientes con un septo interventricular sigmoideo, un TSVI pequeño y volúmenes ventriculares izquierdos reducidos, fundamentalmente en mujeres, y una orientación anormal de un aparato valvular mitral flácido tienen una predisposición geométrica a la obstrucción dinámica del TSVI, que se puede manifestar en el contexto de una estimulación adrenérgica intensa o hipovolemia15. Recientemente se ha descrito un síndrome que simula un infarto agudo de miocardio, clínica y electrocardiográficamente con mínima elevación de las enzimas cardíacas, caracterizado por la isquemia de la región apical que adquiere forma de globo (apical ballooning) en ausencia de enfermedad coronaria. Produce aumento del gradiente medioventricular, no en el TSVI, sin que parezca tener relevancia hemodinámica16, y es atribuido fundamentalmente al vasoespasmo.
La ecocardiografía transtorácica debe ser considerada la técnica de elección para descartar la existencia de gradiente dinámico obstructivo en el TSVI, comprobando además la presencia de insuficiencia mitral y movimiento sistólico anterior de la válvula mitral. La morfología de la curva Doppler presenta una aceleración tardía, característica de la obstrucción dinámica subaórtica (fig. 2A y B). El ecocardiograma permite descartar otras complicaciones mecánicas del infarto, como la CIV o la insuficiencia mitral aguda. La estimación del gradiente en el laboratorio de hemodinámica se realiza con un catéter de agujero distal para poder precisar la localización del mismo.
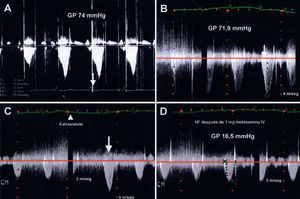
Fig. 2. Trazados con Doppler continuo a través del TSVI. A: se observa la morfología característica con aceleración tardía de la obstrucción dinámica al TSVI. B: gradiente antes de la administración de metoxamina (gradiente pico 72 mmHg). C: se aprecia el aumento del gradiente postextrasistólico después de una extrasístole supraventricular, que clínicamente se traduce con la disminución de la presión del pulso (fenómeno de Brockenbrough-Braunwald). D: disminución del gradiente 10 min después de la administración de 1 mg i.v. de metoxamina (gradiente pico 16,5 mmHg).
El tratamiento difiere del habitual del shock cardiogénico. El uso de vasodilatadores, la reducción de la poscarga y los agentes inotrópicos deben evitarse. Las medidas terapéuticas en este caso incluyen la administración de bloqueadores beta que actúan reduciendo la hipercinesia del segmento basal, ayudando a la disminución del gradiente en el TSVI; alfaagonistas puros como la metoxamina, fármaco que actúa de manera preferente sobre receptores alfa 1, provocando vasoconstricción intensa y aumento de la presión arterial, con bradicardia refleja, dando lugar a un TSVI funcional mayor y descenso del gradiente. La disminución del gradiente con la administración de metoxamina se comprobó por medio de ecocardiografía (fig. 2D). Las taquiarritmias deben tratarse de forma agresiva, fundamentalmente la fibrilación auricular, controlando la frecuencia cardíaca mediante cardioversión eléctrica para restaurar el ritmo sinusal y la administración de amiodarona.
En un paciente con infarto agudo de miocardio, la presencia de hipotensión y soplo de nueva aparición sugiere el desarrollo de una complicación mecánica, insuficiencia mitral aguda o CIV. Sin embargo, la obstrucción dinámica en el TSVI puede aparecer como una complicación del infarto y manifestarse de forma similar. La ecocardiografía transtorácica, y transesofágica en caso de no obtener una imagen óptima, es la técnica diagnóstica de elección. Predictores de obstrucción dinámica adquirida del TSVI serían el infarto agudo de miocardio anterior que da lugar a hipocinesia apical, hipercinesia basal compensadora, hipertrofia concéntrica de VI ligera y, posiblemente, enfermedad coronaria monovaso, puesto que la enfermedad multivaso podría prevenir el desarrollo de hipercinesia basal.
Correspondencia: Dr. A. García Quintana.
Servicio de Cardiología. Hospital de Gran Canaria Dr. Negrín.
Bco. La Ballena, s/n. 35020 Las Palmas de Gran Canaria.
Correo electrónico: antoniogarcia@secardiologia.es