Se describe el caso de un lactante de dos meses portador de una rara asociación: sindrome de agenesia valvular pulmonar, comunicación interventricular, estenosis «anular» pulmonar y origen ductal de la arteria pulmonar izquierda. El diagnóstico, realizado con ecocardiografía bidimensional Doppler color sin el auxilio del cateterismo cardíaco, fue confirmado en la sala operatoria.
Palabras clave
Agenesia valvular pulmonar
Origen ductal
Arteria pulmonar izquierda
Eco-Doppler-color
INTRODUCCIÓN
El síndrome de agenesia valvular pulmonar (SAVP) engloba un conjunto de defectos cardiovasculares cuyo epicentro es la presencia de un reducido rudimento de tejido fibroso adherido a la pequeña y habitualmente estenótica unión ventrículo derecho-arteria pulmonar (VD-AP, «anillo»); como excepción, la válvula sigmoidea está inequívocamente ausente. El defecto que con mayor frecuencia acompaña a esta obstrucción «anular» es la comunicación interventricular subaórtica debida a una alineación inapropiada del septo infundibular que, con su desplazamiento anterocefálico, configura una anatomía intraventricular tipificada como tetralogía de Fallot, aun cuando no existe estenosis subpulmonar sino, por el contrario, la cámara infundibular suele ser amplia y sin obstrucción hemodinámica. Otras anomalías descritas asociadas al SAVP son: atresia tricúspide, doble salida de ventrículo derecho, defecto atrioventricular, transposición de grandes arterias, comunicación interauricular, coartacion aórtica, interrupción del istmo aórtico o la típica tetralogía de Fallot (sólo una referencia bibliográfica); de forma excepcional se presenta en corazones con integridad de los tabiques intercamerales 1-3.
Lo que sí constituye una rareza es la presencia de anomalías vasculares pulmonares asociadas al síndrome que con preferencia afectan al pulmón izquierdo. Se describen tres diferentes e inusuales patrones vasculares: a) ausencia de arteria pulmonar izquierda (API); b) desconexión de API de su origen troncal con emergencia directa desde aorta ascendente o desde un ductus arterioso, y c) circulación colateral sistémico-pulmonar con o sin presencia de una verdadera API 4-7.
Esta patología vascular añadida se describe en casos aislados o se incluye en series quirúrgicas sin detalles precisos; en cualquier caso, su diagnóstico definitivo en estas referencias queda siempre confinado a la angiografía, a la sala operatoria o al estudio autópsico. Se presenta el caso de un lactante portador de SAVP con origen ductal de API, como primera descripción en la bibliografía correctamente diagnosticado mediante eco-Doppler-color sin el auxilio de la exploración angiográfica.
CASO CLÍNICO
Lactante polimalformado de 3 meses de edad, de sexo femenino, remitido con soporte ventilatorio mecánico por severo distrés respiratorio y sospecha clínico-ecográfica de SAVP. Nacida pretérmino con un peso de 2.500 g y Apgar 7/9, comienza en la tercera semana de vida a presentar episodios recurrentes de tos, fiebre y dificultad ventilatoria inicialmente tratada con antibióticos, broncodilatadores y fisioterapia respiratoria en su hospital de origen. En su ingreso en la unidad de cuidados intensivos cardiovasculares pediátricos se constató insuficiencia cardíaca congestiva, insuficiencia renal y pobre perfusión distal. El examen clínico reveló cianosis leve en correspondencia con una saturación transcutánea de oxígeno del 85%; los pulsos periféricos se palparon débiles, registrándose una presión arterial de 70/40 mmHg; la auscultación pulmonar demostró ruidos asociados con abundantes sibilancias en ambos hemitórax. El precordio se palpó activo, auscultándose un segundo ruido único con soplo sistodiastólico («to and fro») a lo ancho de todo el precordio; el borde hepático se detectó a 4 cm del reborde costal. Los gases arteriales fueron: pH 7,32, PCO 2 42, PO 2 37, EB 3, mientras que el hematócrito fue del 35%, sin evidencia de leucocitosis. Las manifestaciones polimalformativas fueron compatibles con el síndrome Charge. El ECG demostró ritmo sinusal con crecimiento evidente de cámaras derechas; en la radiografía de tórax se observó una moderada cardiomegalia con dilatación aneurismática del tronco y arteria pulmonar derecha, ambas estructuras ocupando una extensa parte del mediastino superior; la circulación pulmonar se evaluó como levemente aumentada. Se practicó tomografía torácica computarizada en la que se observaron atelectasias múltiples en el pulmón derecho. La exploración ecocardiográfica 2-D identificó desde plano subcostal un significativo crecimiento de aurícula y ventrículo derechos, una comunicación interventricular subaórtica (CIV) y un septo infundibular hipertrófico, desplazado anterocefálico sin obstrucción manifiesta de la vía de salida del ventrículo derecho (VD). La unión VD-AP se valoró como pequeña con un valor Z derivado de -2,2; un tejido rudimentario ocupaba el lugar donde normalmente se implanta la válvula semilunar. La cámara infundibular se dirigía de izquierda a derecha, continuándose con el tronco de la AP y su dilatada rama derecha; el arco aórtico se visualizó como inequívocamente izquierdo. En el examen ecográfico desde eje corto de grandes vasos o sagital subcostal fue imposible demostrar la bifurcación de la arteria pulmonar izquierda; este vaso fue detectado desde un eje largo alto subclavicular izquierdo emergiendo del arco aórtico en donde usualmente se origina el conducto arterioso (fig. 1).
La exploración con técnica Doppler y mapeo en color posibilitó el registro de dos diferentes patrones al interrogarse ambas, la unión VD-AP y el origen ductal de la API. En el primero se registró un flujo acelerado con mosaico de colores sistólico en AP asociado a un flujo diastólico retrógrado que alcanzó la zona infundibular; el gradiente pico sistólico derivado fue de 45 mmHg, mientras que en el segundo, la señal registrada desde aorta hacia API demostró un flujo acelerado anterógrado en la sístole que paulatinamente decrecía en la misma dirección durante la diástole, el gradiente pico sistólico fue de 70 mmHg (figs. 2 y 3). No se advirtió turbulencia alguna del flujo a través de la CIV de lo que se dedujo que la presión en ambos ventrículos era similar. La enferma fue remitida a la sala quirúrgica con el diagnóstico de ausencia valvular pulmonar, comunicación interventricular, origen ductal de arteria pulmonar izquierda, estenosis de la unión VD-AP, presión sistólica normal en el territorio vascular del pulmón izquierdo e hipertensión arterial pulmonar derecha; esta morfología y dinámica cardiovascular delineada con eco 2-D-Doppler color fue confirmada en la cirugía. La técnica operatoria incluyó el cierre de CIV, ampliación «anular» con parche y reimplante de la API al tronco pulmonar. La enferma fallecía 3 h después en la unidad de cuidados intensivos con un estado de bajo gasto cardíaco severo y no se concedió el estudio autópsico.
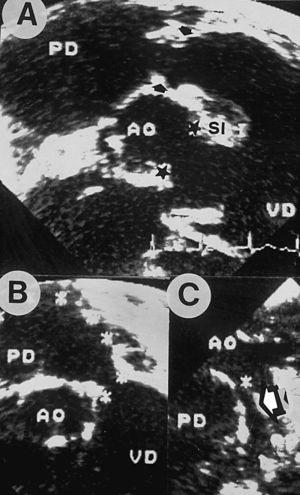
Fig. 1. Detalles morfológicos ecocardiográficos en los que se observa en A (corte subcostal sagital de ventrículo derecho): defecto interventricular subaórtico (estrellas); septo infundibular (SI) desplazado anterocefálico sin obstruir la vía de salida de ventrículo derecho (VD). Las flechas señalan la unión VD-AP («anillo» pulmonar); la arteria pulmonar derecha (PD) se presenta aneurismática. En B se remarca el «anillo» pulmonar estenótico con rudimento valvular adherido y la dilatada PD. En C (corte subclavicular izquierdo) se visualiza el origen ductal (asterisco) de la arteria pulmonar izquierda (flecha).
COMENTARIO
Se han publicado hasta la fecha menos de una treintena de casos con la rara combinación de SAVP y origen aórtico de API; aun con menor frecuencia se describe este vaso como ausente o como continuación de un conducto arterioso permeable. En un informe bibliográfico se reseña la evolución de un lactante portador de SAVP y origen ductal de la API en quien se constata la desaparición angiográfica de dicha arteria dos años después de la primera investigación hemodinámica. Esta dramática evolución de la permeabilidad angiográfica en la API se supone que es consecuencia del cierre precoz y/o progresivo del conducto arterioso; desde la perspectiva teórica, este comportamiento ductal podría explicar la ausencia de aquel vaso en no pocos casos que ya han sido publicados 4,5,8,9.
El diagnóstico del SAVP pre o posnatal es fácilmente reconocible con la exploración ecocardiográfica bidimensional; se sospecha de inmediato al visualizar la dilatación aneurismática del tronco pulmonar y en especial de su rama derecha. Se ratifica observando una imagen nodular irregular, pequeña, que implantada en un «anillo» pulmonar estrecho ocupa sólo una parte de la luz de su orificio circular; otras anomalías intracardíacas que acompañan al síndrome también se reconocen sin dificultad.
En nuestra enferma no fue posible definir la confluencia de ambas ramas pulmonares, ya que no se observó la normal emergencia de la API; sólo se sospechó su origen anómalo tras una minuciosa exploración al visualizar desde un eje largo subclavicular izquierdo la presencia de una estructura vascular, que emergiendo desde el arco aórtico, se dirigía hacia el pulmón izquierdo, siendo su diámetro menor de un tercio del correspondiente a la rama pulmonar derecha.
El estudio con Doppler-color contribuyó a la detección de dos patrones diferentes de flujo. Con la muestra continua interrogando la salida del VD se obtuvo el registro típico del SAVP: turbulencia sistólica anterógrada en tronco y APD, asociado a flujo retrógrado diastólico hacia el infundíbulo pulmonar. Cuando se interrogó el vaso interpretado como API se obtuvo un registro de flujo turbulento anterógrado durante todo el ciclo cardíaco cuya elevada aceleración inicial decrecía a lo largo de la diástole. Como fue mencionado en la descripción del caso, el registro de diferentes gradientes sistólicos determinados en cada territorio vascular pulmonar permitió deducir que el derecho tenía hipertensión moderada mientras que en el izquierdo la presión sistólica arterial era normal.
Dada la dirección espacial de la API en esta peculiar condición anatómica, el patrón de flujo Doppler no distingue el conducto arterioso restrictivo de una estenosis proximal en la propia rama pulmonar (ambos registros pueden ser similares). El nacimiento ductal de la API se dedujo por: a) el sitio de su emergencia en el arco aórtico (cualidad que fue confirmada en cirugía), y b) porque la estenosis proximal de la API sólo se describe (por imagen angiográfica o determinación autópsica) en muy limitados casos y en esencia cuando el orificio de emergencia está ubicado en aorta ascendente (usualmente entre 3 y 20 mm más allá de la propia válvula aórtica) 3,5,6.
Desde la perspectiva clínica, la gran mayoría de enfermos con esta patología combinada presenta un severo distrés respiratorio e insuficiencia cardíaca congestiva que obligan a largos períodos de soporte ventilatorio mecánico; debido a la elevada mortalidad sólo con tratamiento médico se aconseja una reparación quirúrgica precoz, en especial para evitar la pérdida potencial de la API como consecuencia del cierre ductal. Aun así, en las referencias bibliográficas analizadas la mortalidad operatoria supera el 70-75% 9,10.
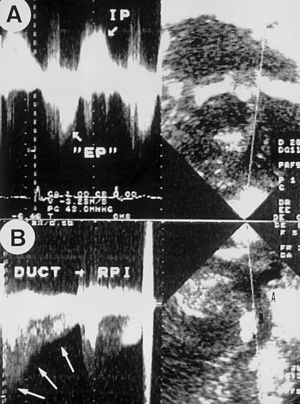
Fig. 2. Patrones Doppler en la vía de salida de VD (A) y en el ductus (B). Obsérvese el flujo «to and fro» típico de la estenosis/insuficiencia pulmonar (superior), y de alta velocidad continuo in decrescendo hacia la diástole (inferior).
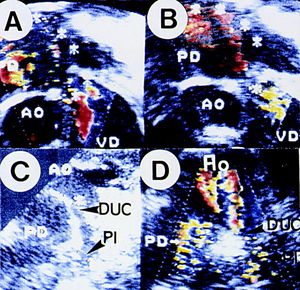
Fig. 3. La composición ecográfica Doppler color demuestra la turbulencia sistólica en pulmonar (A); el color rojo en el mismo vaso en diástole refleja la incompetencia sigmoidea. En C y D se observa la morfología ductal y de la arteria pulmonar izquierda, con la correspondiente aceleración turbulenta en color a ese nivel.
El síndrome de agenesia valvular pulmonar (SAVP) engloba un conjunto de defectos cardiovasculares cuyo epicentro es la presencia de un reducido rudimento de tejido fibroso adherido a la pequeña y habitualmente estenótica unión ventrículo derecho-arteria pulmonar (VD-AP, «anillo»); como excepción, la válvula sigmoidea está inequívocamente ausente. El defecto que con mayor frecuencia acompaña a esta obstrucción «anular» es la comunicación interventricular subaórtica debida a una alineación inapropiada del septo infundibular que, con su desplazamiento anterocefálico, configura una anatomía intraventricular tipificada como tetralogía de Fallot, aun cuando no existe estenosis subpulmonar sino, por el contrario, la cámara infundibular suele ser amplia y sin obstrucción hemodinámica. Otras anomalías descritas asociadas al SAVP son: atresia tricúspide, doble salida de ventrículo derecho, defecto atrioventricular, transposición de grandes arterias, comunicación interauricular, coartacion aórtica, interrupción del istmo aórtico o la típica tetralogía de Fallot (sólo una referencia bibliográfica); de forma excepcional se presenta en corazones con integridad de los tabiques intercamerales 1-3.
Lo que sí constituye una rareza es la presencia de anomalías vasculares pulmonares asociadas al síndrome que con preferencia afectan al pulmón izquierdo. Se describen tres diferentes e inusuales patrones vasculares: a) ausencia de arteria pulmonar izquierda (API); b) desconexión de API de su origen troncal con emergencia directa desde aorta ascendente o desde un ductus arterioso, y c) circulación colateral sistémico-pulmonar con o sin presencia de una verdadera API 4-7.
Esta patología vascular añadida se describe en casos aislados o se incluye en series quirúrgicas sin detalles precisos; en cualquier caso, su diagnóstico definitivo en estas referencias queda siempre confinado a la angiografía, a la sala operatoria o al estudio autópsico. Se presenta el caso de un lactante portador de SAVP con origen ductal de API, como primera descripción en la bibliografía correctamente diagnosticado mediante eco-Doppler-color sin el auxilio de la exploración angiográfica.
CASO CLÍNICO
Lactante polimalformado de 3 meses de edad, de sexo femenino, remitido con soporte ventilatorio mecánico por severo distrés respiratorio y sospecha clínico-ecográfica de SAVP. Nacida pretérmino con un peso de 2.500 g y Apgar 7/9, comienza en la tercera semana de vida a presentar episodios recurrentes de tos, fiebre y dificultad ventilatoria inicialmente tratada con antibióticos, broncodilatadores y fisioterapia respiratoria en su hospital de origen. En su ingreso en la unidad de cuidados intensivos cardiovasculares pediátricos se constató insuficiencia cardíaca congestiva, insuficiencia renal y pobre perfusión distal. El examen clínico reveló cianosis leve en correspondencia con una saturación transcutánea de oxígeno del 85%; los pulsos periféricos se palparon débiles, registrándose una presión arterial de 70/40 mmHg; la auscultación pulmonar demostró ruidos asociados con abundantes sibilancias en ambos hemitórax. El precordio se palpó activo, auscultándose un segundo ruido único con soplo sistodiastólico («to and fro») a lo ancho de todo el precordio; el borde hepático se detectó a 4 cm del reborde costal. Los gases arteriales fueron: pH 7,32, PCO 2 42, PO 2 37, EB 3, mientras que el hematócrito fue del 35%, sin evidencia de leucocitosis. Las manifestaciones polimalformativas fueron compatibles con el síndrome Charge. El ECG demostró ritmo sinusal con crecimiento evidente de cámaras derechas; en la radiografía de tórax se observó una moderada cardiomegalia con dilatación aneurismática del tronco y arteria pulmonar derecha, ambas estructuras ocupando una extensa parte del mediastino superior; la circulación pulmonar se evaluó como levemente aumentada. Se practicó tomografía torácica computarizada en la que se observaron atelectasias múltiples en el pulmón derecho. La exploración ecocardiográfica 2-D identificó desde plano subcostal un significativo crecimiento de aurícula y ventrículo derechos, una comunicación interventricular subaórtica (CIV) y un septo infundibular hipertrófico, desplazado anterocefálico sin obstrucción manifiesta de la vía de salida del ventrículo derecho (VD). La unión VD-AP se valoró como pequeña con un valor Z derivado de -2,2; un tejido rudimentario ocupaba el lugar donde normalmente se implanta la válvula semilunar. La cámara infundibular se dirigía de izquierda a derecha, continuándose con el tronco de la AP y su dilatada rama derecha; el arco aórtico se visualizó como inequívocamente izquierdo. En el examen ecográfico desde eje corto de grandes vasos o sagital subcostal fue imposible demostrar la bifurcación de la arteria pulmonar izquierda; este vaso fue detectado desde un eje largo alto subclavicular izquierdo emergiendo del arco aórtico en donde usualmente se origina el conducto arterioso (fig. 1).
La exploración con técnica Doppler y mapeo en color posibilitó el registro de dos diferentes patrones al interrogarse ambas, la unión VD-AP y el origen ductal de la API. En el primero se registró un flujo acelerado con mosaico de colores sistólico en AP asociado a un flujo diastólico retrógrado que alcanzó la zona infundibular; el gradiente pico sistólico derivado fue de 45 mmHg, mientras que en el segundo, la señal registrada desde aorta hacia API demostró un flujo acelerado anterógrado en la sístole que paulatinamente decrecía en la misma dirección durante la diástole, el gradiente pico sistólico fue de 70 mmHg (figs. 2 y 3). No se advirtió turbulencia alguna del flujo a través de la CIV de lo que se dedujo que la presión en ambos ventrículos era similar. La enferma fue remitida a la sala quirúrgica con el diagnóstico de ausencia valvular pulmonar, comunicación interventricular, origen ductal de arteria pulmonar izquierda, estenosis de la unión VD-AP, presión sistólica normal en el territorio vascular del pulmón izquierdo e hipertensión arterial pulmonar derecha; esta morfología y dinámica cardiovascular delineada con eco 2-D-Doppler color fue confirmada en la cirugía. La técnica operatoria incluyó el cierre de CIV, ampliación «anular» con parche y reimplante de la API al tronco pulmonar. La enferma fallecía 3 h después en la unidad de cuidados intensivos con un estado de bajo gasto cardíaco severo y no se concedió el estudio autópsico.
Fig. 1. Detalles morfológicos ecocardiográficos en los que se observa en A (corte subcostal sagital de ventrículo derecho): defecto interventricular subaórtico (estrellas); septo infundibular (SI) desplazado anterocefálico sin obstruir la vía de salida de ventrículo derecho (VD). Las flechas señalan la unión VD-AP («anillo» pulmonar); la arteria pulmonar derecha (PD) se presenta aneurismática. En B se remarca el «anillo» pulmonar estenótico con rudimento valvular adherido y la dilatada PD. En C (corte subclavicular izquierdo) se visualiza el origen ductal (asterisco) de la arteria pulmonar izquierda (flecha).
COMENTARIO
Se han publicado hasta la fecha menos de una treintena de casos con la rara combinación de SAVP y origen aórtico de API; aun con menor frecuencia se describe este vaso como ausente o como continuación de un conducto arterioso permeable. En un informe bibliográfico se reseña la evolución de un lactante portador de SAVP y origen ductal de la API en quien se constata la desaparición angiográfica de dicha arteria dos años después de la primera investigación hemodinámica. Esta dramática evolución de la permeabilidad angiográfica en la API se supone que es consecuencia del cierre precoz y/o progresivo del conducto arterioso; desde la perspectiva teórica, este comportamiento ductal podría explicar la ausencia de aquel vaso en no pocos casos que ya han sido publicados 4,5,8,9.
El diagnóstico del SAVP pre o posnatal es fácilmente reconocible con la exploración ecocardiográfica bidimensional; se sospecha de inmediato al visualizar la dilatación aneurismática del tronco pulmonar y en especial de su rama derecha. Se ratifica observando una imagen nodular irregular, pequeña, que implantada en un «anillo» pulmonar estrecho ocupa sólo una parte de la luz de su orificio circular; otras anomalías intracardíacas que acompañan al síndrome también se reconocen sin dificultad.
En nuestra enferma no fue posible definir la confluencia de ambas ramas pulmonares, ya que no se observó la normal emergencia de la API; sólo se sospechó su origen anómalo tras una minuciosa exploración al visualizar desde un eje largo subclavicular izquierdo la presencia de una estructura vascular, que emergiendo desde el arco aórtico, se dirigía hacia el pulmón izquierdo, siendo su diámetro menor de un tercio del correspondiente a la rama pulmonar derecha.
El estudio con Doppler-color contribuyó a la detección de dos patrones diferentes de flujo. Con la muestra continua interrogando la salida del VD se obtuvo el registro típico del SAVP: turbulencia sistólica anterógrada en tronco y APD, asociado a flujo retrógrado diastólico hacia el infundíbulo pulmonar. Cuando se interrogó el vaso interpretado como API se obtuvo un registro de flujo turbulento anterógrado durante todo el ciclo cardíaco cuya elevada aceleración inicial decrecía a lo largo de la diástole. Como fue mencionado en la descripción del caso, el registro de diferentes gradientes sistólicos determinados en cada territorio vascular pulmonar permitió deducir que el derecho tenía hipertensión moderada mientras que en el izquierdo la presión sistólica arterial era normal.
Dada la dirección espacial de la API en esta peculiar condición anatómica, el patrón de flujo Doppler no distingue el conducto arterioso restrictivo de una estenosis proximal en la propia rama pulmonar (ambos registros pueden ser similares). El nacimiento ductal de la API se dedujo por: a) el sitio de su emergencia en el arco aórtico (cualidad que fue confirmada en cirugía), y b) porque la estenosis proximal de la API sólo se describe (por imagen angiográfica o determinación autópsica) en muy limitados casos y en esencia cuando el orificio de emergencia está ubicado en aorta ascendente (usualmente entre 3 y 20 mm más allá de la propia válvula aórtica) 3,5,6.
Desde la perspectiva clínica, la gran mayoría de enfermos con esta patología combinada presenta un severo distrés respiratorio e insuficiencia cardíaca congestiva que obligan a largos períodos de soporte ventilatorio mecánico; debido a la elevada mortalidad sólo con tratamiento médico se aconseja una reparación quirúrgica precoz, en especial para evitar la pérdida potencial de la API como consecuencia del cierre ductal. Aun así, en las referencias bibliográficas analizadas la mortalidad operatoria supera el 70-75% 9,10.
Fig. 2. Patrones Doppler en la vía de salida de VD (A) y en el ductus (B). Obsérvese el flujo «to and fro» típico de la estenosis/insuficiencia pulmonar (superior), y de alta velocidad continuo in decrescendo hacia la diástole (inferior).
Fig. 3. La composición ecográfica Doppler color demuestra la turbulencia sistólica en pulmonar (A); el color rojo en el mismo vaso en diástole refleja la incompetencia sigmoidea. En C y D se observa la morfología ductal y de la arteria pulmonar izquierda, con la correspondiente aceleración turbulenta en color a ese nivel.
Bibliografía
[1]
Absent pulmonary valve syndrome. En: Garson A Jr, Bricker T, McNamara D, editores. The science and practice of pediatric cardiology. Vol. 3. Lea and Febiger, 1990; 64; 1.104-1.157.
[2]
Agenesia de sigmoideas pulmonares: factores diagnósticos. Ann Esp Pediatr 1981; 14: 7-18.
[3]
Aortic origin of the left pulmonary artery. Variant of tetralogy of Fallot. Am J Cardiol 1975; 35: 324-329.
[4]
Tetralogy of Fallot with absent pulmonic valve: analysis of 17 patients. Am J Cardiol 1984; 53: 1.433-1.437.
[5]
Variant of tetralogy of Fallot with absent pulmonary valve leaflets and origin of one pulmonary artery from the ascending aorta. Am J Cardiol 1980; 46: 106-116.
[6]
Congenital absence of the pulmonary valve in Tetralogy of Fallot and origin of the left pulmonary artery from the aortic arch. Am J Roentgenol 1970; 110: 505-508.
[7]
Association of systemic to pulmonary collateral arteries with Tetralogy of Fallot and absent pulmonary valve syndrome. Am J Cardiol 1996; 547-549.
[8]
Tetralogy of Fallot with absent pulmonary valve syndrome. Natural history and hemodynamic considerations. Circulation 1974; 50: 167-175.
[9]
Absent pulmonary valve syndrome: surgical treatment and consideration. Ann Thorac Surg 1996; 62: 136-142.
[10]
Tetralogy of Fallot with absent pulmonary valve syndrome. Early and late results of surgical treatment. J Thorac Cardiovasc Surg 1985; 89: 280-287.