El reemplazo percutáneo de la válvula aórtica es un tratamiento bien establecido para los pacientes con estenosis aórtica severa y sintomática que tienen contraindicaciones para el tratamiento quirúrgico o alto riesgo quirúrgico. Los avances alcanzados en el diseño de las prótesis y dispositivos y los continuos avances en las técnicas de imagen multimodal, en especial las de tipo tridimensional, han mejorado los resultados clínicos, con una reducción significativa de la incidencia de complicaciones frecuentes como la regurgitación aórtica paravalvular. Además, se están acumulando datos sobre la durabilidad de las prótesis. Las técnicas de imagen multimodales desempeñan un papel central en la selección de los pacientes candidatos a sustitución percutánea de la válvula aórtica, así como para planificar y guiar la intervención y hacer el seguimiento de la función de la prótesis. En este artículo de puesta al día se analizan los puntos fuertes y las limitaciones de cada técnica de diagnóstico por la imagen en la sustitución de válvula aórtica.
Palabras clave
La sustitución percutánea de válvula aórtica (SPVA) ha pasado a ser una alternativa segura y viable en el tratamiento de los pacientes con estenosis aórtica (EA) severa que presentan contraindicaciones para la sustitución quirúrgica de la válvula aórtica (VA) o alto riesgo quirúrgico. Por lo que respecta a la supervivencia y la reducción de los síntomas clínicos, en ensayos clínicos aleatorizados amplios se ha demostrado que la SPVA es superior al tratamiento médico (y a la valvuloplastia con balón) para pacientes a los que se considera inoperables1,2 y es no inferior a la sustitución quirúrgica de la VA para pacientes con alto riesgo operatorio3,4. Estos resultados han estimulado la rápida introducción de la SPVA en la práctica clínica, de tal manera que el número de pacientes tratados supera ya los 200.000 en todo el mundo5. La selección de los pacientes, la determinación exacta del tamaño adecuado de la prótesis y la planificación de la intervención requieren el empleo de varias modalidades de diagnóstico por la imagen para optimizar los resultados y minimizar las complicaciones como la regurgitación paravalvular (RAPV), la necesidad de implantar marcapasos, la lesión vascular o la rotura del anillo aortico. La fluoroscopia sigue siendo la principal tecnica de imagen durante el procedimiento y todavia en muchos centros se sigue utilizando la ecocardiografía transtorácica (ETT) o transesofágica (ETE). La intervención tiene una curva de aprendizaje muy rápida y ello, junto con el bajo número de complicaciones periprocedimiento en centros con gran volumen de pacientes, ha permitido una SPVA menos invasiva implantando el dispositivo con sedación consciente. Así pues, recientemente se ha puesto en duda la necesidad de la ETE durante la intervención. Además, la durabilidad de la prótesis es un factor importante a tener en cuenta si en el futuro se amplía el uso de esta intervención a pacientes con riesgo operatorio bajo o intermedio. Los datos de seguimiento a 5 años del ensayo PARTNER6,7 no mostraron degeneración estructural alguna de las prótesis expandibles con balón, con áreas de válvula aórtica (AVA) y gradientes transvalvulares estables. Sin embargo, el uso de técnicas de imagen de gran resolución espacial, como la tomografía computarizada multidetectores (TCMD), ha hecho que la presencia de engrosamiento y restricción del movimiento de las valvas de la prótesis planteara cierta preocupación, ya que indica una trombosis subclínica que podría no apreciarse con la ecocardiografía8. En este artículo de puesta al día se resume el papel de las técnicas de imagen multimodales en la planificación previa a la intervención (selección de los pacientes, determinación del tamaño del dispositivo y vía de acceso para la intervención), durante el procedimiento y el seguimiento, resaltando los pros y los contras de cada técnica.
PLANIFICACIÓN PREVIA A LA INTERVENCIÓNLa evaluación exacta de la gravedad de la EA, la anatomía y geometría de la VA y la raíz de la aorta, y la evaluación del vascular periférico son tres pasos clave durante la planificación de la SPVA.
Gravedad de la estenosis aórticaLa ETT es la técnica de diagnóstico por la imagen de elección para determinar la gravedad de la EA9,10. Esta exploración proporciona una perspectiva clara de la anatomía de la VA, el grado de calcificación, las consecuencias hemodinámicas de la EA (tamaño y función del ventrículo izquierdo [VI], grosor de la pared, presión arterial pulmonar), las posibles valvulopatías concomitantes y la enfermedad aórtica existente. La EA severa se define9,10 por una velocidad del flujo aórtico >4 m/s, un gradiente medio de presión transvalvular >40mmHg y un AVA calculada <1,0cm2. No obstante, se dan situaciones en las que estos parámetros no son congruentes, lo que plantea un verdadero reto para el diagnóstico de la EA severa y el tratamiento del paciente.
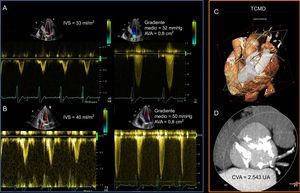
Cuando concurren EA y reducción de la función sistólica del VI, los índices de flujo calculados pueden sobrestimar la severidad de la EA. Esta situación se ha denominado EA de bajo flujo y bajo gradiente clásica, y se caracteriza10,11 por reducción de la fracción de eyección del ventrículo izquierdo (FEVI), AVA <1,0cm2, velocidad aórtica <4 m/s, gradiente medio <40mmHg e índice del volumen de eyección <35ml/m2. En este subgrupo de pacientes, la diferenciación entre una EA severa verdadera y una seudosevera tiene consecuencias terapéuticas importantes12,13. Con el uso de la ecocardiografía de estrés con dobutamina a dosis baja, la reserva contráctil del VI aumenta, y ello da lugar a un aumento del volumen de eyección (flujo) del VI11. En una EA severa verdadera, el aumento del flujo se asocia a un incremento de los gradientes transvalvulares, al tiempo que el AVA se mantiene <1,0cm2. Por el contrario, en la EA seudosevera, el aumento de la contractilidad y el flujo del VI da lugar a un incremento del AVA >1,0cm2, al tiempo que los gradientes transvalvulares se mantienen bajos (figura 1). Sin embargo, un 30–40% de los pacientes con una EA severa clásica, de bajo flujo y bajo gradiente, no muestran reserva contráctil en la ecocardiografía de estrés con dobutamina con dosis baja13. En este grupo de pacientes específico, el uso de tomografía computarizada y la evaluación de la carga de calcificación de la VA pueden ser útiles para estimar la gravedad de la EA (figura 1)14,15. Los valores de corte utilizados para establecer la calcificación de la VA ≥1.274UA en las mujeres y ≥2.065UA en los varones se asociaron con mayor frecuencia a la EA severa14.
Ecocardiografía de estrés farmacológico con dobutamina a dosis baja y evaluación de la calcificación de la válvula aórtica con tomografía computarizada multidetector en un paciente con estenosis aórtica grave de bajo flujo y bajo gradiente, con reducción de la función sistólica ventricular izquierda. A: la evaluación ecocardiográfica basal mostró una discrepancia en los índices de gravedad de la estenosis aórtica. El gradiente medio fue de 32mmHg y el área de la válvula aórtica fue de 0,8cm2. El índice de volumen sistólico fue de 33ml/cm2. B: la ecocardiografía de estrés farmacológico con dobutamina a dosis baja produjo un aumento del gradiente medio hasta un valor de 50mmHg, el área de la válvula aórtica se mantuvo inalterada y el índice de volumen sistólico aumentó en un 21%. Esto indica que el paciente presentaba una estenosis aórtica grave clásica de bajo flujo y bajo gradiente, así como una reserva de flujo (aumento del índice de volumen sistólico >20%). C: cardio-tomografía computarizada multidetector de volumen, con un plano a la altura del anillo aórtico. D: se midió por el método de Agatston una carga de calcificación de la válvula aórtica de 2.543UA, que indica una estenosis aórtica grave (los valores de corte para la estenosis aórtica grave son ≥2.065UA para los varones y ≥1.274UA para las mujeres14). AVA: área de válvula aórtica; CVA: calcificación de válvula aórtica; IVE: índice de volumen de eyección; TCMD: tomografía computarizada multidetector. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Los pacientes con EA severa de bajo flujo y bajo gradiente paradójica muestran9,10 FEVI preservada, AVA<1,0cm2, gradiente medio<40mmHge índice de volumen de eyección del VI<35ml/m2. En este subgrupo de pacientes, el estado de bajo flujo se determina por la observación de una cavidad del VI pequeña a causa de la intensa hipertrofia del VI. El tratamiento de estos pacientes continúa siendo un verdadero reto. Clavel et al16 compararon los resultados clínicos obtenidos en 187 pacientes con EA severa de bajo flujo y bajo gradiente paradójica con los de 187 pacientes con EA severa y gradiente alto (emparejados por AVA) y con los de 187 pacientes con EA de gravedad moderada (emparejados por gradiente transvalvular medio), y observaron que los pacientes con EA severa de bajo flujo y bajo gradiente paradójica mostraban una peor supervivencia total (a 1año, el 89±2%; a 5años, el 64±4%) en comparación con los pacientes de EA grave y gradiente alto (a 1año, el 96±1%; a 5años, el 82±3%) o EA de gravedad moderada (a 1año, el 96±1%; a 5años, el 81±3%). Además, la sustitución de la VA se asoció de manera significativa a una mejora de la supervivencia de los pacientes con EA severa de bajo flujo y bajo gradiente paradójica, pero no en la de los de EA de gravedad moderada16. Es de destacar que la población del estudio era relativamente heterogénea, con un porcentaje significativo de pacientes asintomáticos y variedad de tratamientos (se trató con sustitución de VA a un 80% de los pacientes con EA severa y gradiente alto, en comparación con el 56% del grupo de bajo flujo y bajo gradiente paradójico y un 40% del de EA de gravedad moderada). Por el contrario, Jander et al17 observaron que los pacientes con EA severa asintomática, gradiente bajo y FEVI preservada (el 51% tenía un indice de eyeccion bajo<35ml/m2) presentaban unos resultados clínicos similares que los pacientes con EA de gravedad moderada (eventos cardiovasculares mayores, el 14,8±1,0% frente al 14,1±1,5% respectivamente; p=0,59).
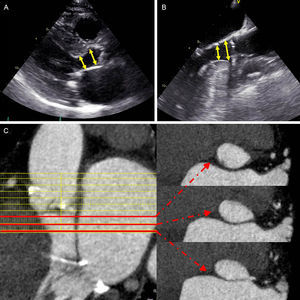
Según lo indicado en las guías actuales, la observación de una EA de bajo flujo y bajo gradiente paradójica de forma sistemática9. Es preciso abordar primero toda posible fuente de error en las variables incluidas en la ecuación de continuidad utilizada para el cálculo del AVA. El área transversal del tracto de salida del VI (TSVI) es uno de los parámetros clave. Con la ecocardiografía bidimensional, el área transversal del TSVI se obtiene tradicionalmente midiendo el diámetro del TSVI sagital mesosistólico en la proyección de eje largo paraesternal, asumiendo una geometría circular. Sin embargo, la presencia de una hipertrofia del septo interventricular basal, característica de los pacientes ancianos, puede poner en riesgo la exactitud de este método, ya que el TSVI puede adquirir una forma elíptica (figura 2)18,19. Introduciendo el área planimétrica del TSVI medida con una técnica de imagen tridimensional (3D), como la TCMD, en la ecuación de continuidad, se podría reclasificar como casos de EA de gravedad moderada al 33% de los pacientes con EA severa de bajo gradiente y FEVI preservada20. Si el área de superficie corporal es baja, es necesario introducir una corrección por el área de superficie corporal, de tal manera que un AVA indexada<0,6cm2/m2 indica una EA severa. También se debe descartar un aumento importante de la poscarga hemodinámica global (por ejemplo, la impedancia valvuloarterial). Además, se debe prestar especial atención a determinar con exactitud el volumen sistólico del VI, preferiblemente confrontando las mediciones obtenidas con otros métodos independientes (métodos bidimensionales o tridimensionales volumétricos mediante ecocardiografía, resonancia magnética cardiaca [RMC] o TCMD). La ecocardiografía de estrés con dobutamina a dosis baja puede aportar información adicional respecto a la gravedad real de la EA y permite predecir el riesgo de eventos adversos, pero no se ha establecido aún la seguridad de la ecocardiografía de estrés con dobutamina para los pacientes con gran remodelado concéntrico del VI y cavidad pequeña21. Además, la determinación del grado de calcificación de la VA mediante tomografía computarizada puede resultar útil en este grupo de pacientes14,15.
Evaluación del tracto de salida del ventrículo izquierdo mediante ecocardiografía transtorácica (A) y transesofágica (B) y tomografía computarizada multidetectores (C). En la ecocardiografía transtorácica y transesofágica bidimensional, la medición del tracto de salida del ventrículo izquierdo puede presentar una variación significativa (flechas), en especial en los pacientes con un hipertrofia septal basal (septo sigmoide), lo cual tiene importantes repercusiones en el cálculo del área de la válvula aórtica. En la tomografía computarizada multidetectores, las líneas rojas delimitan las áreas del tracto de salida del ventrículo izquierdo en tres niveles diferentes, y muestran el cambio del área y el carácter elíptico del tracto de salida del ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
A diferencia de lo que ocurre en la sustitución quirúrgica de la VA, en la que los cirujanos pueden determinar directamente el tamaño óptimo de la prótesis y visualizar el ajuste de esta a la raíz aortica, en la SPVA, la elección del tamaño de la prótesis se basa sobre todo en las exploraciones por imagen previas a la intervención. El empleo de prótesis demasiado pequeñas aumenta el riesgo de RAPV significativa y migración de la prótesis, mientras que las prótesis de tamaño excesivo pueden dar lugar a un despliegue incompleto, que puede comportar regurgitación tanto valvular como paravalvular o incluso rotura del anillo aórtico, de resultados catastróficos22,23.
Las técnicas de imagen 3D (ecocardiografía 3D, TCMD, RMC) son actualmente los instrumentos preferidos para evaluar el tamaño del anillo aórtico. El diámetro sagital del anillo aórtico, que normalmente se mide con ecocardiografía bidimensional, tiende a subestimar el tamaño real del anillo aórtico24. Por el contrario, los estudios realizados con ETE 3D o TCMD han puesto de relieve que la elección del tamaño de la prótesis basada en estas técnicas de imagen se asocia a una menor incidencia de RAPV significativa25–27. Estas técnicas de imagen 3D permiten la medición del área y el perímetro del anillo aórtico por planimetría directa y el cálculo de los diámetros a partir de los valores del área y el perímetro. La mayoría de los fabricantes han incluido también estas mediciones en los gráficos utilizados para determinar el tamaño de la prótesis, lo cual permite estandarizar la elección de la prótesis que se vaya a utilizar.
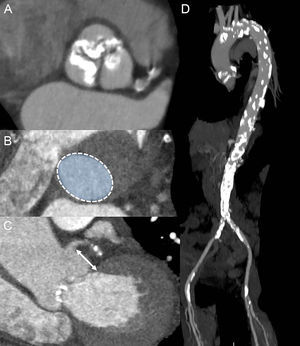
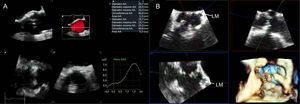
La TCMD proporciona unas imágenes del anillo aórtico y la raíz de la aorta con gran resolución espacial. Esta técnica de imagen ha pasado a ser clave en la SPVA debido a su bajo grado de invasividad y a la evaluación completa de los candidatos a SPVA, lo cual incluye evaluación del anillo aórtico, calcificación de la VA y de la raíz de la aorta, así como la anatomía de las arterias periféricas (figura 3). Además, la TCMD permite una planificación de las proyecciones del arco de fluoroscopia necesarias para la dilatación del balón de VA y el despliegue de la prótesis, con lo que se reduce la necesidad de repetidas angiografías durante la intervención28,29. No obstante, para los pacientes con deterioro de la función renal concomitante, el uso de TCMD se debe individualizar con objeto de reducir el riesgo de insuficiencia renal aguda periintervención. Se ha demostrado también el valor de la ETE 3D para determinar el tamaño del anillo aórtico, las dimensiones de la raíz de la aorta, la carga de calcificación de la VA y a qué altura se encuentra cada ostium coronario respecto al anillo aórtico (figura 4)30. Sin embargo, esta modalidad de diagnóstico por la imagen es relativamente incómoda para los pacientes, y la sombra acústica causada por las calcificaciones de las cúspides aórticas puede afectar a la resolución espacial de las imágenes y a la exactitud de las mediciones realizadas. La RMC permite un análisis 3D de la anatomía del anillo y la raíz aórtica de modo similar a la TCMD. Sin embargo, esta técnica de imagen está menos disponible y no es aplicable a los pacientes portadores de dispositivos implantados incompatibles con la RMC. Estas modalidades de diagnóstico por la imagen 3D se han comparado en varios estudios que han mostrado que tienen similar exactitud en la determinación del tamaño del anillo aórtico24,31,32. Es de destacar que la adquisición de datos debe realizarse preferiblemente sincronizado con el electrocardiograma para obtener las dimensiones sistólicas y diastólicas del anillo aórtico. En un reciente estudio de Murphy et al33, en el que se incluyó a 507pacientes con EA severa de los que se obtuvo una TCMD sincronizada con el electrocardiograma, se observaron cambios significativos del área y el perímetro del anillo aórtico entre la sístole y la diástole (el 8,23 y el 3,36% respectivamente). Las consecuencias de estas observaciones tienen gran interés, puesto que el uso de la medida diastólica habría conllevado cambio del tamaño de la prótesis (tamaño insuficiente) en el 50% de los pacientes. En consecuencia, se recomienda obtener las mediciones sistólica y diastólica34.
Papel de la tomografía computarizada multidetectores en la evaluación previa a la intervención. A: proyección transversal oblicua doble de una válvula aórtica tricúspide intensamente calcificada. B: planimetría del anillo aórtico. C: medición de la distancia entre la arteria coronaria principal izquierda y el anillo aórtico (flecha). D: la aortografía con tomografía computarizada muestra una aorta intensamente calcificada, sobre todo en el cayado aórtico y en la parte descendente. Se aprecian también calcificaciones en ambas arterias femorales.
Ecocardiografía transesofágica tridimensional en la planificación de la sustitución percutánea de válvula aórtica. A: el análisis automático de raíz de la aorta (programa informático AVQ, GE; Horten, Noruega) permite una alineación rápida de los planos ortogonales a la altura del anillo aórtico y la determinación exacta del tamaño. B: reconstrucción tridimensional multiplanar de la raíz de la aorta para medir la distancia entre el tronco común de la arteria coronaria izquierda y el anillo aórtico (flechas); al mismo tiempo, puede apreciarse la presencia de cúspides intensamente calcificadas que pueden obstruir los ostium coronarios, especialmente en la reconstrucción tridimensional. LM: arteria coronaria principal izquierda; SAX: eje corto. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Durante la intervención, se puede medir el anillo aórtico con una angiografía supraaórtica durante la valvuloplastia aórtica con balón (figura 5). Varios estudios han puesto de manifiesto la exactitud de esta metodología para determinar el tamaño de la prótesis35,36. Durante la valvuloplastia con balón, la presencia de RAPV residual en la angiografía indica tamaño insuficiente del balón35. Otros autores han propuesto medir el balón con un compás calibrador estéril durante el hinchado a 2 atm; de este modo, durante el hinchado completo del balón al nivel de la válvula, cualquier aumento adicional de la presión del interior del balón a más de 2atm indicará que el diámetro del balón es igual o mayor que el del anillo aórtico36.
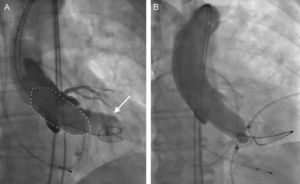
Angiografía supraaórtica durante la valvuloplastia aórtica con balón para la elección del tamaño de la prótesis. A: se optó por un balón de 23mm (línea punteada) para una valvuloplastia aórtica con balón preparatoria, en función de los datos de la ecocardiografía transesofágica bidimensional sobre el tamaño del anillo aórtico; la angiografía supraaórtica simultánea, que muestra una regurgitación de contraste hacia el ventrículo izquierdo (flecha), indicó subestimación del tamaño del anillo en la ecocardiografía transesofágica bidimensional y motivó la elección de una prótesis de mayor tamaño. B: la ausencia de regurgitación de contraste hacia el ventrículo izquierdo durante la valvuloplastia aórtica utilizando un balón de 23mm confirmó que el tamaño anular era correcto según lo indicado por la ecocardiografía transesofágica bidimensional previa a la intervención. Reproducido con permiso de Patsalis et al35.
Uno de los aspectos clave de la planificación previa a la intervención en la SPVA es la elección de la vía de acceso. Las vías de acceso que se pueden utilizar para la SPVA son la transfemoral (TF), la transapical, la transaórtica, la transubclavia, la transaxilar y la transcarotídea. El abordaje predominante en todo el mundo es el TF, puesto que esta es la técnica menos invasiva y con la que están más familiarizados los cardiólogos intervencionistas. Según los datos de los registros de SPVA, la vía de abordaje TF es la elegida en un 71–75% de las intervenciones en Europa37,38 y el 56% en Estados Unidos39. La idoneidad del uso de un abordaje TF se evalúa predominantemente con una evaluación angiográfica de la anatomía iliofemoral en el curso de una angiografía coronaria. Sin embargo, la TCMD muestra mejor caracterización del tamaño, la tortuosidad, el grado de calcificación y la carga de placa ateromatosa en las arterias iliofemorales y la aorta (figura 6). Además, permite visualizar claramente la anatomía vascular detallada, con reconstrucciones multiplanares y de volumen 3D. Para los actuales catéteres de aplicación de SPVA, se considera aceptable un umbral de 6,0–6,5mm para el diámetro luminal mínimo de la arteria femoral40.
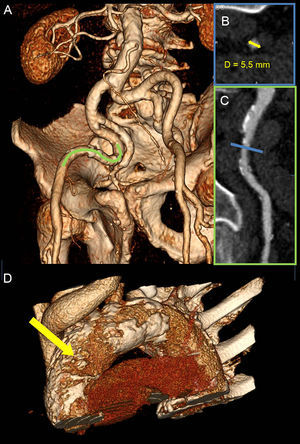
Evaluación de la vía de acceso para la sustitución percutánea de válvula aórtica mediante tomografía computarizada multidetectores. A: arterias iliofemorales bilaterales de intensa tortuosidad visualizadas con la imagen de volumen tridimensional. B: se evaluó la luz transversal de la parte más estrecha del vaso (línea azul en C); el diámetro mínimo fue 5,5 mm (flecha amarilla), lo cual impedía utilizar con seguridad el abordaje transfemoral para la sustitución percutánea de válvula aórtica. C: se estudió más detalladamente un segmento de la arteria iliaca externa derecha (línea verde en A) en un plano de reconstrucción multiplanar, que evidenció una carga aterosclerótica elevada con múltiples placas. D: aorta torácica intensamente calcificada-aorta de porcelana, especialmente en la parte anterolateral de la aorta ascendente, que corresponde a la zona de destino para la vía de abordaje transaórtico (flecha amarilla). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Tradicionalmente se ha preferido la vía de abordaje transapical para los pacientes con arterias periféricas que no sean apropiadas para la TF. Sin embargo, la vía transapical es la técnica más invasiva y podría estar contraindicada para pacientes con ciertas comorbilidades o alto índice de fragilidad (enfermedad pulmonar severa, deformidad de la pared torácica, muy mala función del VI, trombo intracavitario). Otra alternativa, la vía transaórtica, ha adquirido mayor popularidad debido a la sencillez de la intervención y los resultados en supervivencia, superiores a los obtenidos con el acceso transapical41,42. Explorar por TCMD la aorta ascendente es esencial para seleccionar a los candidatos a SPVA transaórtica. La parte anterolateral de la aorta ascendente, 5–7cm por encima del anillo aórtico, que es donde se realiza la canulación de la aorta, debe estar libre de calcio (figura 6). Bapat et al43 han puesto de relieve que el abordaje transaórtico es viable en pacientes con calcificaciones aórticas intensas (aorta de porcelana), puesto que es frecuente que la zona transaórtica para la canulación esté preservada. Por otra parte, la TCMD permite la evaluación de las relaciones espaciales existentes entre el esternón y los principales vasos del tórax. Esto tiene especial importancia en los pacientes con antecedente de cirugía de revascularización aortocoronaria, en quienes la estrecha proximidad de las estructuras citadas o de anastomosis altas de injertos venosos proximales influye en la elección del abordaje transaórtico preferido (p. ej., optar por una minitoracotomía derecha en vez de una miniesternotomía en J)42.
TÉCNICAS DE IMAGEN DURANTE EL IMPLANTE PERCUTÁNEO DE UNA VÁLVULA CARDIACAComo guía para la intervención de SPVA, se ha utilizado tradicionalmente la fluoroscopia y la angiografía con el apoyo de ETE (figura 7)44. Este enfoque continúa siendo el aconsejado por la EAE/ASE (European Association of Echocardiography/American Society of Echocardiography)45. No obstante, la generación actual de dispositivos de SPVA, con sistemas de aplicación de menor tamaño, ha aumentado la viabilidad del abordaje TF y ha reducido el tiempo y la invasividad de las intervenciones (similares a las de la valvuloplastia con balón), lo cual ha puesto en duda la necesidad de anestesia general. De hecho, algunos grandes centros de SPVA europeos han demostrado excelente viabilidad y seguridad del abordaje TF simplificado, que se realiza con asistencia anestésica monitorizada (definida como monitorización cardiovascular y respiratoria del paciente por un anestesiólogo cualificado, que puede administrar sedación concomitante o no46) o solo anestesia local47–49.
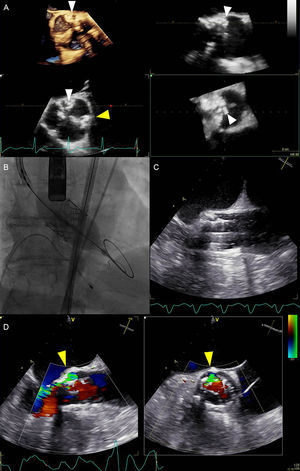
Exploración de imagen multimodal durante la sustitución de válvula aórtica. A: la ecocardiografía transesofágica tridimensional periintervención reveló una válvula aórtica tricúspide intensamente calcificada; las calcificaciones eran especialmente prominentes a la altura de la comisura de las cúspides coronaria izquierda y no coronaria (puntas de flecha blancas) y a la altura de la comisura de las cúspides coronarias izquierda y derecha (punta de flecha amarilla). B: despliegue de la válvula percutánea expansible con balón guiada por fluoroscopia. C: imagen del despliegue de la válvula en la ecocardiografía transesofágica bidimensional en tiempo real simultánea. D: regurgitación aórtica paravalvular visualizada con ecocardiografía biplanar Doppler color (puntas de flecha amarillas); regurgitación aórtica paravalvular originada a la altura de la carga de calcificación anular máxima; la circunferencia de la regurgitación aórtica paravalvular fue del 20% del armazón de la prótesis (proyección en eje corto del lado derecho), lo cual indica una regurgitación aórtica paravalvular moderada según los criterios del Valve Academic Research Consortium-214. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Sin embargo, la ETE, y en especial la ETE 3D en tiempo real, aporta un valor adicional a la fluoroscopia y la angiografía en la SPVA: facilita el paso por una VA nativa intensamente calcificada, reduce significativamente la exposición a radiación y a medios de contraste yodados nefrotóxicos50 y permite la detección precoz de las complicaciones que pueden poner en peligro la vida del paciente. La rotura del anillo aórtico, la perforación del miocardio con la consiguiente hemorragia pericárdica, la oclusión de los ostium coronarios que da lugar a isquemia miocárdica, la perforación o disección aórticas, la mala colocación o el desplazamiento de la prótesis y las fugas valvulares o paravalvulares son complicaciones que la ETE puede detectar de inmediato e influyen en la toma de decisiones (figura 7).
Aunque las prótesis disponibles actualmente se han asociado a menor incidencia de insuficiencia aórtica significativa después de la SPVA51,52, esta complicación continúa preocupando, puesto que se asocia a mal pronóstico7,53. La determinación de la posible insuficiencia aórtica y su gravedad debe incluir una evaluación de los componentes central y paravalvular, con una medición combinada de la insuficiencia aórtica «total», lo cual refleja la carga de volumen total impuesta al VI. Los métodos utilizados en la insuficiencia de una válvula nativa (evaluación cualitativa por Doppler, vena contracta, tiempo de hemipresion en el registro Doppler de onda continua) tienen limitaciones en el contexto de regurgitación paravalvulares, que con frecuencia son múltiples, excéntricos y de forma irregular. Además, determinadas partes del anillo de la prótesis y del TSVI pueden ser difíciles de visualizar debido a las sombras acústicas. Las guías de la EAE/ASE para la evaluación de las válvulas protésicas proponen el empleo del porcentaje de la circunferencia del anillo de sutura ocupado por la regurgitación como medida semicuantitativa alternativa de la gravedad de la RAPV:<10% del anillo de sutura indica RAPV leve; un 10–20%, RAPV moderada, y>20%, RAPV grave54. El Valve Academic Research Consortium-2 ha modificado ligeramente estos valores de corte en el contexto de la SPVA: se define RAPV leve, moderada y grave por valores<10%, 10–29% y ≥30% de la circunferencia de la prótesis (figura 7)44. El cálculo del volumen de regurgitación puede ser útil también en el contexto de la SPVA. Este método se basa en la comparación del volumen de eyección de la VA con el de otra válvula que no presente insuficiencia (la válvula mitral o la pulmonar). El primero puede obtenerse restando el volumen telesistólico del VI del volumen telediastólico o, con más frecuencia, utilizando la ecuación de continuidad y calculando el volumen sistólico a través de la VA. La diferencia entre el volumen sistólico a través de la VA y el de la válvula sin insuficiencia corresponde a la estimación del volumen total de regurgitación de la VA. Otros indicadores secundarios, como la inversión del flujo diastólico en la aorta descendente, pueden aportar ayuda adicional para evaluar la gravedad de la RAPV después de una SPVA.
Otra técnica de imagen alternativa periintervención es la ETE transnasal23,45. El empleo de sondas transnasales de menor tamaño permite una monitorización prolongada sin necesidad de anestesia general. Sin embargo, la calidad de la imagen es inferior a la de la ETE convencional y las sondas transnasales no permiten obtener exploraciones en 3D. Algunos centros han adoptado la ecografía intracardiaca para usarla como guía de la SPVA55. La sonda de ecografía intracardiaca se introduce a través de la vena femoral hasta la aurícula derecha, donde proporciona una imagen ampliada de la raíz de la aorta. Además de obviar la necesidad de anestesia general, la ecografía intracardiaca permite la monitorización ininterrumpida de la SPVA (sin interferencia de la fluoroscopia) y una evaluación por Doppler de las presiones arteriales pulmonares55. La tecnología de la ecografía intracardiaca se está desarrollando rápidamente, y permite también la obtención de imágenes en 3D (aunque con un volumen limitado de 22–90°). No obstante, el uso generalizado de la ecografía intracardiaca en la SPVA se ve limitado por la necesidad de gran dominio de la técnica, peor calidad de imagen que con ETE (en especial la 3D), la posible interferencia con el electrodo del marcapasos y, sobre todo, su alto coste.
SEGUIMIENTO A LARGO PLAZODespués de la SPVA, la ETT continúa siendo la técnica de imagen de elección para evaluar los resultados de la intervención, la durabilidad de la prótesis y los cambios de las dimensiones y de la función del VI. Son imprescindibles las evaluaciones clínica, electrocardiográfica y de ETT después del alta, a los 30 días de la SPVA23,44. Entre las recomendaciones de seguimiento adicional, se propone una ETT tras 6 meses y 1 año del implante, y luego con periodicidad anual44. La frecuencia de las evaluaciones de seguimiento debe aumentar si se produce algún cambio del estado clínico o un empeoramiento de los resultados ecocardiográficos. Sin embargo, a medida que aumente la experiencia con el uso de la SPVA, es posible que la frecuencia de las evaluaciones con ETT se reduzca hasta llegar a ser la de la sustitución de VA quirúrgica, para la que se propone la realización de revisiones anuales durante los 5 años siguientes al implante de la válvula54.
Por lo que respecta a la durabilidad de la prótesis implantada, la posición de la válvula, hay que evaluar mediante ecocardiografía la morfología de las valvas protésicas y los índices de estenosis e insuficiencia valvulares (figura 8). Al calcular el área efectiva del orificio u otro índice de la apertura de la válvula que utilice el cociente de velocidad prevalvular respecto a la posvalvular (p. ej., índice de velocidad por Doppler), es esencial registrar la velocidad prevalvular (y el área transversal del TSVI) en una zona inmediatamente proximal al stent de la prótesis implantada. Dada la aceleración del flujo que se produce en el interior del stent, la medición de las velocidades incluso proximalmente a las cúspides valvulares da lugar a que se sobrestime el área efectiva del orificio o el AVA23,44,45.
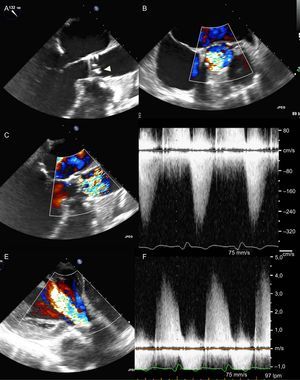
Degeneración de la prótesis 4 años después de la sustitución percutánea de la válvula. A: la ecocardiografía transesofágica muestra un engrosamiento focal y unas valvas de la prótesis calcificadas (punta de flecha). B: la imagen de Doppler color en la proyección en eje corto mesoesofágica de la válvula aórtica revela un flujo anterógrado turbulento en un área transversal limitada. C: el Doppler color de la proyección en eje largo confirma una turbulencia elevada después de la prótesis, lo cual implica una estenosis grave de la válvula protésica. D: los gradientes elevados obtenidos con Doppler de onda continua confirman la estenosis significativa de la prótesis. E:la proyección transgástrica de Doppler color muestra una insuficiencia aórtica grave. F: la alta densidad y la pronunciada pendiente de los registros de Doppler de onda continua del flujo de regurgitación confirman la insuficiencia aórtica grave. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Clavel et al56 han descrito una función hemodinámica ligeramente mejor de las prótesis percutáneas en comparación con las prótesis implantadas quirúrgicamente. Se estudió a 50 pacientes a los que se trató con SPVA, emparejados por sexo, diámetro del anillo aórtico, FEVI, área de superficie corporal e índice de masa muscular, en relación 1:1, con dos grupos de 50 pacientes tratados mediante sustitución de VA quirúrgica con prótesis valvulares con o sin stent. Los valores del gradiente transvalvular medio a los 6 y a los 12 meses de la intervención fueron significativamente inferiores en el grupo de SPVA (10±4mmHg) que en el grupo de sustitución de VA quirúrgica con prótesis con stent (13±5mmHg), mientras que no mostraron diferencia significativa respecto al grupo de sustitución de VA quirúrgica con válvula sin stent (9±4mmHg)56. Los mejores resultados hemodinámicos de las válvulas de implante percutáneo se atribuyeron a que los stents eran más finos. Además, los resultados de un seguimiento a 5 años del ensayo PARTNER7 muestran una función hemodinámica de las prótesis percutáneas y quirúrgicas estable, sin que se aprecien signos de degeneración valvular. No obstante, en un análisis retrospectivo de 4.266 pacientes tratados con SPVA en 12 centros diferentes de todo el mundo, Latib et al57 observaron una incidencia del 0,61% de trombosis de válvulas percutáneas después de una mediana de seguimiento de 6 años. De los 26 pacientes en que se sospechó trombosis valvular, el 92% presentó una elevación de los gradientes transvalvulares medios>20mmHg y un 65% tuvo disnea de esfuerzo. La anticoagulación redujo de forma significativa los gradientes transvalvulares en todos los pacientes tratados médicamente57. No obstante, algunos estudios recientes realizados con TCMD de cuatro dimensiones indican que la trombosis de válvulas percutáneas puede ser más frecuente. Leetmaa et al58 describieron una incidencia del 4% en una cohorte de 140 pacientes sometidos a TCMD 1–3 meses después de la SPVA. La trombosis de la prótesis percutánea se definió por la presencia de masas de atenuación baja adheridas a las cúspides de la válvula o un engrosamiento difuso≥1 cúspides valvulares. El tratamiento de anticoagulación fue eficaz, y produjo la resolución de los hallazgos patológicos en la TCMD de seguimiento58. Estas observaciones en la TCMD pueden no acompañarse de cambios de los síntomas o la hemodinámica valvular evaluada con la ETT, lo cual indica que la TCMD puede permitir una detección más precoz de trombosis valvular. Makkar et al8 han descrito una reducción del movimiento de las valvas de las bioprótesis, detectada en las exploraciones de TCMD de volumen de cuatro dimensiones, en un 40% de los casos (22 de 55 pacientes) en el ensayo PORTICO IDE (Portico Re-sheathable Transcatheter Aortic Valve System U.S. Investigational Device Exemption) y en un 13% de los casos (17 de 132 pacientes) en dos registros de bioprótesis aórticas percutáneas y quirúrgicas de Estados Unidos y Dinamarca. Se observó restablecimiento del movimiento de las valvas en los 11 pacientes que iniciaron anticoagulación con warfarina después de las observaciones realizadas en la TCMD y solo 1 de los 10 pacientes que no iniciaron este tratamiento8. Es de destacar nuevamente que no se observó ningún indicador ecocardiográfico de disfunción valvular. Estos resultados indicaron la necesidad de estudios prospectivos, bien diseñados y con la potencia estadística adecuada que pudieran aportar respuestas útiles acerca de la trascendencia clínica de estos resultados (tanto en evolución clínica neurológica como en durabilidad de la prótesis), el tratamiento antitrombótico óptimo tras la SPVA y el método de imagen adecuado para realizar el seguimiento a largo plazo.
Los cambios del grado de RAPV en el tiempo deben evaluarse también en el seguimiento. Además de la ETE y la ETT, también puede usarse la RMC para evaluar la gravedad de la RAPV. El mapa de fase-velocidad obtenido con la RMC del flujo sanguíneo en la aorta ascendente permite realizar una estimación independiente del volumen de regurgitación y la fracción de regurgitación de la VA59. Sherif et al60 han puesto de manifiesto que las mediciones cuantitativas de la insuficiencia aórtica mediante RMC son superiores a la evaluación semicuantitativa mediante ecocardiografía con imágenes de flujo Doppler color, y que esta puede subestimar el grado de RAPV después de una SPVA.
Otro resultado adverso tras la SPVA es la endocarditis infecciosa. Los resultados de un amplio estudio multicéntrico indican una incidencia del 0,50% de endocarditis infecciosa 1 año después de la SPVA61. Sin embargo, sus consecuencias son devastadoras, con una mortalidad hospitalaria del 47% y mortalidad al año de seguimiento del 66%61. La ETT y, especialmente en el caso de las prótesis valvulares, la ETE son las técnicas de imagen de primera elección para el estudio diagnóstico ante la sospecha de endocarditis infecciosa y ayudan a detectar vegetaciones, abscesos, seudoaneurismas, sus consecuencias hemodinámicas (generalmente regurgitación valvular o paravalvular grave) y la posible afección de otras válvulas (p. ej., extensión a la valva anterior de la válvula mitral), y para la evaluación de la función del VI. Es importante señalar que, mientras no se demuestre lo contrario, debe sospecharse siempre una endocarditis infecciosa en los pacientes que presentan una regurgitación periprotésica62. La ETE 3D en tiempo real tiene un valor adicional para el análisis de la morfología y el tamaño de las vegetaciones y puede mejorar la predicción del riesgo embólico63. La TCMD se puede usar para detectar los abscesos/seudoaneurismas con una exactitud diagnóstica similar a la de la ETE y es posible que sea superior a ella en la evaluación del grado de extensión perivalvular de la endocarditis infecciosa64. Además, las técnicas de imagen de medicina nuclear, y en especial la tomografía computarizada por emisión de fotón unico/tomografía computarizada con leucocitos marcados radiactivamente y la tomografía por emisión de positrones con 18F-fluorodesoxiglucosa/tomografía computarizada, están evolucionando como métodos complementarios importantes para pacientes con sospecha de endocarditis infecciosa. El principal valor añadido de estas técnicas es la reducción de la tasa de endocarditis infecciosas mal diagnosticadas, clasificadas en la categoría de «posible endocarditis infecciosa» según los criterios de Duke, así como la detección de los episodios de embolia periférica65.
CONCLUSIONESLa SPVA es un tratamiento bien establecido para los pacientes con EA severa sintomática que presentan contraindicaciones o un riesgo quirúrgico elevado. Para optimizar los resultados de este tratamiento, es esencial una selección exacta de los pacientes, una planificación de la intervención y la aplicación de una vigilancia adecuada en el seguimiento. Las técnicas multimodales de diagnóstico por la imagen desempeñan un papel central. Existen numerosas posibilidades, y los puntos fuertes y las limitaciones de cada técnica, así como el conocimiento experto y la disponibilidad locales, son importantes para la elección de la técnica de imagen apropiada para dar respuesta a las preguntas que surgen en cada paso de la intervención (tabla). La curva de aprendizaje y una evidencia cada vez mayor ponen de manifiesto la mayor exactitud de las técnicas de imagen 3D para determinar el tamaño del anillo aórtico y elegir la prótesis, al tiempo que el perfeccionamiento del diseño de las prótesis ha llevado a la introducción de cambios importantes que han reducido la invasividad de la intervención. Esta se lleva a cabo más frecuentemente con sedación consciente, guiada plenamente por fluoroscopia o empleando ETT para evaluar la función de la prótesis valvular. Sin embargo, el uso de TCMD y RMC en el seguimiento ha aportado observaciones de interés que pueden tener repercusiones en el tratamiento de los pacientes. La realización de nuevos estudios que aporten datos sobre la durabilidad de las prótesis de SPVA aportará nueva luz sobre la incidencia de trombosis valvular y endocarditis infecciosa.
Técnicas multimodales de diagnóstico por la imagen para la sustitución percutánea de válvula aórtica
| Técnica de imagen | Preoperatorio | Perioperatorio | Seguimiento |
|---|---|---|---|
| Ecocardiografía (ETT/ETE) | Gravedad de la EAAnatomía y grado de calcificación de la VATamaño del anillo aórtico y anatomía de la raíz de la aorta (3D)Valvulopatía concomitanteFunción del VI | Catéteres guíaPosición y despliegue de la prótesisHemodinámica de la válvulaOtras complicaciones relacionadas con la intervención (derrame pericárdico, isquemia miocárdica, disección aórtica, etc.) | Despliegue de la prótesis y hemodinámicaFunción del VIValvulopatía concomitanteTrombosis valvular, endocarditis infecciosa (ETE) |
| TCMD | Tamaño del anillo aórtico y anatomía de la raíz de la aortaAnatomía y grado de calcificación de la VAAorta torácica, incluida la carga de calcificaciónArterias periféricasFunción del VIProyecciones de arco de fluoroscopia | — | Despliegue de la prótesisTrombosis valvular (subclínica)Endocarditis infecciosa |
| Resonancia magnética cardiaca | Tamaño del anillo aórtico y anatomía de la raíz de la aortaAnatomía de la VAFunción del VIAorta torácicaArterias periféricas | — | Despliegue de la prótesis y hemodinámica (volumen de regurgitación)Función del VI |
| Fluoroscopia | Dimensión de anillo aórticoArterias periféricas | Catéteres guíaPosición y despliegue de la prótesisHemodinámica de la válvulaOtras complicaciones relacionadas con la intervención (rotura del anillo aórtico, oclusión de los ostium coronarios, disección aórtica, etc.) | — |
| Técnicas de imagen de medicina nuclear | — | — | SPECT/TC y 18F-FDG PET/TC en la evaluación de la endocarditis infecciosa |
3D: tridimensional; 18F-FDG PET: tomografía por emisión de positrones con 18F-fluorodesoxiglucosa; EA: estenosis aórtica; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; SPECT: tomografía computarizada por emisión monofotónica; TC: tomografía computarizada; TCMD: tomografía computarizada multidetectores; VA: válvula aórtica; VI: ventrículo izquierdo.
El Department of Cardiology, Heart Lung Center, Leiden University Medical Center (Leiden, Países Bajos) ha recibido subvenciones de investigación de Biotronik, Medtronic, Boston Scientific y Edwards Lifesciences. Los autores no tienen nada que declarar.