La técnica de superposición de cúspides (TSC) se ha propuesto para reducir los trastornos de la conducción intraventricular (TCIV) tras el implante percutáneo de válvula aórtica (TAVI) con dispositivos autoexpandibles supraanulares, pero existen pocos datos sobre la TSC con dispositivos intraanulares. El objetivo de este estudio fue determinar si el uso de la TSC durante la implantación de la válvula Portico resulta en un implante más alto de la válvula y menores tasas de TCIV.
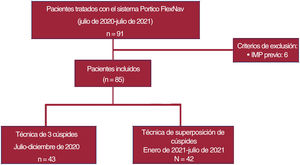
MétodosSe incluyó a 85 pacientes sometidos a TAVI con el sistema Portico FlexNav, 43 pacientes retrospectivos con la proyección clásica de las 3 cúspides (coplanar) y 42 pacientes prospectivos con la TSC. Los objetivos primarios fueron la profundidad de implantación y los nuevos TCIV (compuesto de bloqueo de rama izquierda y necesidad de marcapasos permanente).
ResultadosLa TSC resultó en una menor profundidad de implante (cúspide no coronaria: 4,9±3.9 frente a 7,4±3.0; p=0,005) y menor tasa de TCIV (31,0% frente a 58,1%; p=0,012), con una tendencia hacia una menor necesidad de marcapasos permanente (14,3% frente a 30,2%; p=0,078; 7,7% frente a 31,0%; p=0,011 en pacientes sin bloqueo de rama derecha preexistente). Los gradientes trasvalvulares aórticos fueron ligeramente inferiores con la TSC (8,7±3,7 frente a 11,0±6,1; p=0,044). No hubo diferencias en el éxito técnico o complicaciones mayores relacionadas con el procedimiento. En el análisis multivariado, el uso de la TSC se asoció con un menor riesgo de nuevos TCIV.
ConclusionesEl uso de la TSC durante la implantación del sistema Portico FlexNav es factible y facilita un implante más alto de la válvula, lo que a su vez puede ayudar a reducir las tasas de TCIV.
Palabras clave
Durante la última década, el implante percutáneo de válvula aórtica (TAVI) se ha convertido en el tratamiento de elección de la estenosis aórtica grave sintomática para la mayoría de los pacientes mayores de 80 años con acceso transfemoral adecuado1. Sin embargo, la complicación más frecuente tras un TAVI continúa siendo los trastornos de la conducción intraventricular (TCIV) de nueva aparición2. En los últimos años, varios estudios han demostrado la utilidad de una novedosa técnica de implante modificada, la técnica de superposición de cúspides (TSC), que superpone las cúspides coronarias izquierda y derecha y aísla la cúspide no coronaria3,4. Entre los posibles beneficios que comporta utilizar la TSC durante el TAVI, se encuentra la elongación del tracto de salida de ventrículo izquierdo, que permite un control más preciso de la profundidad real del implante de la prótesis, con lo que se reduce el riesgo de interacción con el sistema de conducción. Mientras que las primeras experiencias de este enfoque con válvulas autoexpandibles supraanulares han sido prometedoras, hasta la fecha ningún estudio ha evaluado la TSC con el sistema autoexpandible intraanular Portico FlexNav (Abbott Vascular, Estados Unidos). El presente estudio pretende determinar si la TSC durante el implante del sistema Portico FlexNav conlleva una menor profundidad del implante y cifras de TCIV más bajas.
MÉTODOSEstudio multicéntrico que incluyó a pacientes consecutivos sometidos a TAVI transfemoral con la válvula autoexpandible intraanular Portico con el sistema de liberación de segunda generación FlexNav en 3 centros terciarios. Entre julio de 2020 y julio de 2021, se realizó un TAVI con el sistema Portico FlexNav a 91 pacientes consecutivos. Se excluyó a los pacientes con marcapasos permanente previo (n=6) hasta llegar a una población final de estudio de 85 pacientes. De estos, 42 pacientes prospectivos recibieron una válvula Portico con la TSC (enero-julio de 2021) y se compararon con 43 pacientes consecutivos tratados previamente con una válvula Portico mediante la técnica tradicional coplanar de 3 cúspides (julio-diciembre de 2020) (figura 1). Todos los implantes los realizaron cardiólogos intervencionistas certificados con una experiencia acumulada de al menos 25 intervenciones con el sistema de liberación Portico de primera generación y al menos 5 intervenciones con el sistema de liberación FlexNav de segunda generación. Los datos se recopilaron de conformidad con el comité de ética de cada centro participante y todos los pacientes dieron su consentimiento informado por escrito para que se les realizaran las intervenciones.
Sistema Portico FlexNavEl sistema Portico TAVI es una válvula percutánea autoexpandible, intraanular y reposicionable para el tratamiento de la estenosis aórtica grave, que muestra un rendimiento hemodinámico favorable5. El sistema de liberación FlexNav de segunda generación incluye un introductor integrado con recubrimiento hidrófilo (equivalente a 14 o 15 Fr) y una capa de estabilidad para minimizar las manipulaciones y facilitar una liberación de la válvula más gradual y controlado. El sistema recibió la aprobación de la marca CE en marzo de 20206.
Técnica de implanteEl análisis pre-procedimiento y la obtención de las proyecciones óptimas del implante se realizaron con 3Mensio Structural Heart (Pie Medical Imaging, Países Bajos) o Heart Navigator (Philips Healthcare, Países Bajos). Se recomendó la predilatación con un diámetro de balón igual al diámetro medio del anillo aórtico. La técnica de implante convencional de las 3 cúspides se ha descrito anteriormente5. El implante mediante la TSC se realizó de la siguiente manera: la válvula se desplegó en una proyección oblicua anterior derecha/caudal, sin electroestimulación rápida o con electroestimulación controlada a 120 lpm a criterio del médico implantador, seguida de una proyección oblicua anterior izquierda (proyección coplanar modificada) para evaluar la profundidad coronaria izquierda y la posición del catéter de liberación antes de la liberación final (figura 2). La profundidad óptima del implante se definió entre 3 y 5mm (distancia desde la cúspide no coronaria hasta el borde inferior (ventricular) de la válvula transcatéter), independientemente de la proyección de trabajo. En ambos grupos, se evaluó la profundidad final del implante en una angiografía en proyección oblicua anterior izquierda.
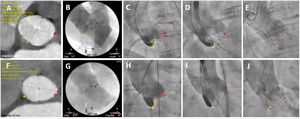
Proyección clásica de 3 cúspides (OAI) frente a técnica de superposición de cúspides (OAD/CAU). A-E: técnica convencional de implante de 3 cúspides. A-C: tomografía computarizada cardiaca y aortograma inicial que muestra la proyección clásica coplanar con 3 cúspides: CNC (amarillo) a la izquierda, CCD (verde) en el centro y CCI (rojo) a la derecha. D y E: posición inicial de una válvula Portico y evaluación final mediante una proyección de 3 cúspides. F-J: técnica de implante de superposición de cúspides. F-H: tomografía computarizada y angiograma en una proyección de superposición de cúspides de CCD/CCI: en esta proyección, la CNC (amarillo) está a la izquierda y la CCD (verde) y la CCI (rojo) se superponen a la derecha de la imagen. I-J: posición de la válvula y evaluación final en una proyección de superposición de cúspides. Las líneas de puntos representan la profundidad del implante (distancia desde la CNC hasta el extremo ventricular del marco del TAVI). CAU: caudal; CCD: cúspide coronaria derecha; CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria; OAD: oblicua anterior derecha; OAI: oblicua anterior izquierda. Esta figura se muestra a todo color solo en la versión electronica del artículo.
Los objetivos primarios fueron la profundidad del implante de la prótesis y los TCIV de nueva aparición. La profundidad del implante se evaluó durante la angiografía final después del implante de la válvula alineando el dispositivo y midiendo la distancia desde las cúspides no coronaria y coronaria izquierda hasta la parte más profunda de la prótesis valvular. Los TCIV de nueva aparición se definieron como un objetivo primario combinado de bloqueo de rama izquierda de nueva aparición y nuevo implante de marcapasos permanente (IMP). La decisión del IMP se tomó de acuerdo con el documento de consenso de 20192. El éxito de procedimiento y las complicaciones intra-hospitalarias se definieron según el Valve Academic Research Consortium 37.
Análisis estadísticosLas variables cualitativas se expresan en cifras (porcentaje) y las variables continuas, en media ± desviación estándar o mediana [intervalo intercuartílico]. Las comparaciones de grupo se analizaron con la prueba de la t de Student o su equivalente no paramétrico, la prueba de la U de Mann-Whitney para variables continuas y la prueba de la χ2 o la prueba exacta de Fischer para variables cualitativas. Se utilizó el análisis multivariante mediante regresión logística para evaluar los predictores independientes de TCIV de nueva aparición en toda la población. Las variables con p ≤ 0,10 en el análisis univariante y las consideradas clínicamente relevantes (p. ej., bloqueo de rama derecha) se incluyeron en una regresión logística multivariable; se incluyó menos de 1 variable por cada 10 eventos para evitar la sobresaturación del modelo. Un valor de p bilateral < 0,05 se consideró significativo en todas las pruebas estadísticas. Los análisis estadísticos se realizaron con STATA versión 14.0 (StataCorp LP, Estados Unidos).
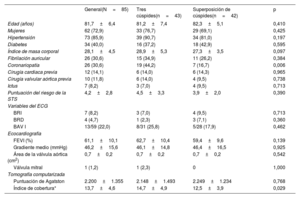
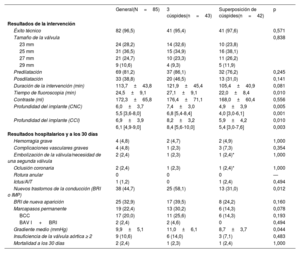
RESULTADOSPoblación de estudioEntre julio de 2020 y julio de 2021, se sometieron a TAVI con el sistema Portico FlexNav 85 pacientes consecutivos. La proyección clásica de 3 cúspides se utilizó en 43 pacientes, mientras que el TAVI se realizó con la TSC en 42 pacientes. Las principales características basales y de la intervención de TAVI de la población de estudio se muestran en la tabla 1. La media de edad fue 82 ± 6 años; el 73% eran mujeres, y la puntuación STS-PROM media, el 4,2 ± 2,8%. El bloqueo preexistente de la rama izquierda o derecha se presentó en el 13% de los pacientes. El gradiente medio fue de 46,2±15,6mmHg, con una puntuación de calcio media según el método de Agatston en la tomografía computarizada de 2.200 ± 1.355 unidades Agatston. No hubo diferencias significativas entre los grupos, excepto una menor tasa de coronariopatía en el grupo de TSC (el 17 frente al 44%; p=0,006).
Características clínicas basales
| General(N=85) | Tres cúspides(n=43) | Superposición de cúspides(n=42) | p | |
|---|---|---|---|---|
| Edad (años) | 81,7±6,4 | 81,2±7,4 | 82,3±5,1 | 0,410 |
| Mujeres | 62 (72,9) | 33 (76,7) | 29 (69,1) | 0,425 |
| Hipertensión | 73 (85,9) | 39 (90,7) | 34 (81,0) | 0,197 |
| Diabetes | 34 (40,0) | 16 (37,2) | 18 (42,9) | 0,595 |
| Índice de masa corporal | 28,1±4,5 | 28,9±5,3 | 27,3±3,5 | 0,097 |
| Fibrilación auricular | 26 (30,6) | 15 (34,9) | 11 (26,2) | 0,384 |
| Coronariopatía | 26 (30,6) | 19 (44,2) | 7 (16,7) | 0,006 |
| Cirugía cardiaca previa | 12 (14,1) | 6 (14,0) | 6 (14,3) | 0,965 |
| Cirugía valvular aórtica previa | 10 (11,8) | 6 (14,0) | 4 (9,5) | 0,738 |
| Ictus | 7 (8,2) | 3 (7,0) | 4 (9,5) | 0,713 |
| Puntuación del riesgo de la STS | 4,2±2,8 | 4,5±3,3 | 3,9±2,0 | 0,390 |
| Variables del ECG | ||||
| BRI | 7 (8,2) | 3 (7,0) | 4 (9,5) | 0,713 |
| BRD | 4 (4,7) | 1 (2,3) | 3 (7,1) | 0,360 |
| BAV I | 13/59 (22,0) | 8/31 (25,8) | 5/28 (17,9) | 0,462 |
| Ecocardiografía | ||||
| FEVI (%) | 61,1±10,1 | 62,7±10,4 | 59,4±9,6 | 0,139 |
| Gradiente medio (mmHg) | 46,2±15,6 | 46,1±14,8 | 46,4±16,5 | 0,925 |
| Área de la válvula aórtica (cm2) | 0,7±0,2 | 0,7±0,2 | 0,7±0,2 | 0,542 |
| Válvula mitral | 1 (1,2) | 1 (2,3) | 0 | 1,000 |
| Tomografía computarizada | ||||
| Puntuación de Agatston | 2.200±1.355 | 2.148±1.493 | 2.249±1.234 | 0,768 |
| Índice de cobertura* | 13,7±4,6 | 14,7±4,9 | 12,5±3,9 | 0,029 |
BAV I: bloqueo auriculoventricular de primer grado en pacientes con ritmo sinusal; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FEVI: fracción de eyección del ventrículo izquierdo; STS: Society of Thoracic Surgeons.
Los valores expresan media ± desviación estándar o n (%).
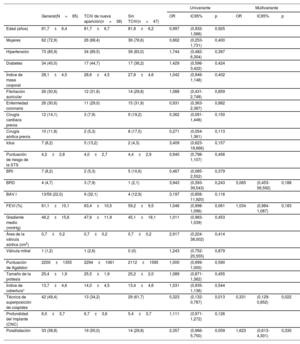
Los datos de la intervención y a los 30 días se representan en la tabla 2. El éxito técnico se logró en el 97% de los pacientes, sin diferencias entre los grupos. Se utilizó predilatación en 69 pacientes (81%) y se requirió posdilatación en 33 (39%). En general, no hubo diferencias en las principales complicaciones relacionadas con la intervención. Dos pacientes necesitaron una segunda válvula debido a la migración del dispositivo (1 en cada grupo, 2.4%); uno de ellos dio lugar a una oclusión coronaria, resuelta con éxito mediante tracción de la válvula con un lazo e implante de una seguna válvula. Hubo 2 muertes a los 30 días (2,4%), 1 en cada grupo.
Resultados clínicos y de la intervención
| General(N=85) | 3 cúspides(n=43) | Superposición de cúspides(n=42) | p | |
|---|---|---|---|---|
| Resultados de la intervención | ||||
| Éxito técnico | 82 (96,5) | 41 (95,4) | 41 (97,6) | 0,571 |
| Tamaño de la válvula | 0,838 | |||
| 23 mm | 24 (28,2) | 14 (32,6) | 10 (23,8) | |
| 25 mm | 31 (36,5) | 15 (34,9) | 16 (38,1) | |
| 27 mm | 21 (24,7) | 10 (23,3) | 11 (26,2) | |
| 29 mm | 9 (10,6) | 4 (9,3) | 5 (11,9) | |
| Predilatación | 69 (81,2) | 37 (86,1) | 32 (76,2) | 0,245 |
| Posdilatación | 33 (38,8) | 20 (46,5) | 13 (31,0) | 0,141 |
| Duración de la intervención (min) | 113,7±43,8 | 121,9±45,4 | 105,4±40,9 | 0,081 |
| Tiempo de fluoroscopia (min) | 24,5±9,1 | 27,1±9,1 | 22,0±8,4 | 0,010 |
| Contraste (ml) | 172,3±65,8 | 176,4±71,1 | 168,0±60,4 | 0,556 |
| Profundidad del implante (CNC) | 6,0±3,7 | 7,4±3,0 | 4,9±3,9 | 0,005 |
| 5,5 [3,6-8,0] | 6,8 [5,4-8,4] | 4,0 [3,0-6,1] | 0,001 | |
| Profundidad del implante (CCI) | 6,9±3,9 | 8,2±3,2 | 5,9±4,2 | 0,010 |
| 6,1 [4,9-9,0] | 8,4 [5,6-10,0] | 5,4 [3,0-7,6] | 0,003 | |
| Resultados hospitalarios y a los 30 días | ||||
| Hemorragia grave | 4 (4,8) | 2 (4,7) | 2 (4,9) | 1,000 |
| Complicaciones vasculares graves | 4 (4,8) | 1 (2,3) | 3 (7,3) | 0,354 |
| Embolización de la válvula/necesidad de una segunda válvula | 2 (2,4) | 1 (2,3) | 1 (2,4)* | 1,000 |
| Oclusión coronaria | 2 (2,4) | 1 (2,3) | 1 (2,4)* | 1,000 |
| Rotura anular | 0 | 0 | 0 | — |
| Ictus/AIT | 1 (1,2) | 0 | 1 (2,4) | 0,494 |
| Nuevos trastornos de la conducción (BRI o IMP) | 38 (44,7) | 25 (58,1) | 13 (31,0) | 0,012 |
| BRI de nueva aparición | 25 (32,9) | 17 (39,5) | 8 (24,2) | 0,160 |
| Marcapasos permanente | 19 (22,4) | 13 (30,2) | 6 (14,3) | 0,078 |
| BCC | 17 (20,0) | 11 (25,6) | 6 (14,3) | 0,193 |
| BAV I + BRI | 2 (2,4) | 2 (4,6) | 0 | 0,494 |
| Gradiente medio (mmHg) | 9,9±5,1 | 11,0±6,1 | 8,7±3,7 | 0,044 |
| Insuficiencia de la válvula aórtica ≥ 2 | 9 (10,6) | 6 (14,0) | 3 (7,1) | 0,483 |
| Mortalidad a los 30 días | 2 (2,4) | 1 (2,3) | 1 (2,4) | 1,000 |
AIT: accidente isquémico transitorio; BAV I: bloqueo auriculoventricular de primer grado; BCC: bloqueo cardiaco completo; BRI: bloqueo de rama izquierda; CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria; IMP: implante de marcapasos permanente.
*Un único paciente tuvo oclusión coronaria por el borde después de la embolización de la válvula.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
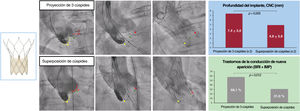
La TSC se asoció con una menor profundidad del implante de la prótesis (cúspide no coronaria, 4,9 ± 3,9 frente a 7,4 ± 3,0; p=0,005; cúspide coronaria izquierda, 5,9 ± 4,2 frente a 8,2 ± 3,2; p=0,010) y menores tasas de TCIV de nueva aparición (el 31,0 frente al 58,1%; p=0,012), con una tendencia hacia una menor necesidad de IMP (el 14,3 frente al 30,2%; p=0,078; en pacientes sin bloqueo de rama derecha preexistente, el 7,7 frente al 31,0%; p=0,011) (figura 3). Todos los marcapasos se implantaron durante el ingreso inicial y fue más probable la necesidad de marcapasos en los pacientes con bloqueo de rama derecha preexistente (3/4, 75%), todos en el grupo TSC.
Figura central. La proyección de superposición de cúspides tuvo como consecuencia una menor profundidad del implante e índices más bajos de trastornos de la conducción intraventricular de nueva aparición que con con TAVI mediante la proyección clásica coplanar de 3 cúspides. BRI: bloqueo de rama izquierda; CNC: cúspide no coronaria; IMP: implante de marcapasos permanente.
Los pacientes del grupo de TSC presentaron gradientes transvalvulares aórticos más bajos (8,7 ± 3,7 frente a 11,0 ± 6,1; p=0,044) y menor tiempo de fluoroscopia (22,0 ± 8,4 frente a 27,1 ± 9,1; p=0,010), sin diferencias en el grado de insuficiencia aórtica residual.
Predictores de trastornos de la conducción intraventricular de nueva apariciónLos principales predictores de TCIV de nueva aparición se resumen en la tabla 3. En el análisis multivariable, la TSC se asoció independientemente con una disminución del riesgo de TCIV tras el TAVI (odds ratio = 0,331; intervalo de confianza del 95% [IC95%], 0,129-0,852; p=0,022).
Predictores de los trastornos de la conducción de nueva aparición después del TAVI en la población total
| Univariante | Multivariante | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| General(N=85) | TCIV de nueva aparición(n=38) | Sin TCIV(n=47) | OR | IC95% | p | OR | IC95% | p | |
| Edad (años) | 81,7±6,4 | 81,7±6,7 | 81,8±6,2 | 0,997 | (0,932-1,066) | 0,925 | |||
| Mujeres | 62 (72,9) | 26 (68,4) | 36 (76,6) | 0,662 | (0,253-1,731) | 0,400 | |||
| Hipertensión | 73 (85,9) | 34 (89,5) | 39 (83,0) | 1,744 | (0,482-6,304) | 0,397 | |||
| Diabetes | 34 (40,0) | 17 (44,7) | 17 (36,2) | 1,429 | (0,596-3,422) | 0,424 | |||
| Índice de masa corporal | 28,1±4,5 | 28,6±4,5 | 27,8±4,6 | 1,042 | (0,946-1,148) | 0,402 | |||
| Fibrilación auricular | 26 (30,6) | 12 (31,6) | 14 (29,8) | 1,088 | (0,431-2,748) | 0,859 | |||
| Enfermedad coronaria | 26 (30,6) | 11 (29,0) | 15 (31,9) | 0,931 | (0,363-2,387) | 0,882 | |||
| Cirugía cardiaca previa | 12 (14,1) | 3 (7,9) | 9 (19,2) | 0,362 | (0,091-1,446) | 0,150 | |||
| Cirugía aórtica previa | 10 (11,8) | 2 (5,3) | 8 (17,0) | 0,271 | (0,054-1,361) | 0,113 | |||
| Ictus | 7 (8,2) | 5 (13,2) | 2 (4,3) | 3,409 | (0,623-18,666) | 0,157 | |||
| Puntuación de riesgo de la STS | 4,2±2,8 | 4,0±2,7 | 4,4±2,9 | 0,940 | (0,798-1,107) | 0,456 | |||
| BRI | 7 (8,2) | 2 (5,3) | 5 (10,6) | 0,467 | (0,085-2,552) | 0,379 | |||
| BRD | 4 (4,7) | 3 (7,9) | 1 (2,1) | 3,943 | (0,393-39,543) | 0,243 | 5,065 | (0,453-56,592) | 0,188 |
| BAV I | 13/59 (22,0) | 9 (32,1) | 4 (12,9) | 3,197 | (0,858-11,920) | 0,116 | |||
| FEVI (%) | 61,1±10,1 | 63,4±10,5 | 59,2±9,5 | 1,046 | (0,998-1,096) | 0,061 | 1,034 | (0,984-1,087) | 0,183 |
| Gradiente medio (mmHg) | 46,2±15,6 | 47,6±11,9 | 45,1±18,1 | 1,011 | (0,983-1,039) | 0,453 | |||
| Área de la válvula aórtica (cm2) | 0,7±0,2 | 0,7±0,2 | 0,7±0,2 | 2,917 | (0,224-38,002) | 0,414 | |||
| Válvula mitral | 1 (1,2) | 1 (2,6) | 0 (0) | 1,243 | (0,752-20,555) | 0,879 | |||
| Puntuación de Agatston | 2200±1355 | 2294±1061 | 2112±1595 | 1,000 | (0,999-1,000) | 0,590 | |||
| Tamaño de la prótesis | 25,4±1,9 | 25,5±1,9 | 25,2±2,0 | 1,089 | (0,871-1,362) | 0,455 | |||
| Índice de cobertura* | 13,7±4,6 | 14,0±4,5 | 13,4±4,6 | 1,031 | (0,935-1,136) | 0,544 | |||
| Técnica de superposición de cúspides | 42 (49,4) | 13 (34,2) | 29 (61,7) | 0,323 | (0,132-0,787) | 0,013 | 0,331 | (0,129-0,852) | 0,022 |
| Profundidad del implante (CNC) | 6,0±3,7 | 6,7±3,6 | 5,4±3,7 | 1,111 | (0,971-1,272) | 0,126 | |||
| Posdilatación | 33 (38,8) | 19 (50,0) | 14 (29,8) | 2,357 | (0,966-5,750) | 0,059 | 1,623 | (0,613-4,301) | 0,330 |
BAV I: bloqueo auriculoventricular de primer grado en pacientes con ritmo sinusal; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; CNC: cúspide no coronaria; FEVI: fracción de eyección del ventrículo izquierdo; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; TCIV: trastornos de la conducción intraventricular.
*El índice de cobertura se definió como 100 × ([diámetro de la prótesis – diámetro anular] / diámetro de la prótesis).
Los valores expresan n (%) o media ± desviación estándar.
El presente estudio evaluó específicamente la seguridad y la eficacia de la TSC durante el TAVI con el sistema autoexpandible intraanular Portico FlexNav. Las principales conclusiones del estudio se pueden resumir de la siguiente manera: a) el empleo de la TSC fue factible, con un gran éxito técnico y bajos índices de complicaciones mayores, similares a los logrados con la proyección clásica coplanar de 3 cúspides, b) la TSC tuvo como consecuencia una menor profundidad del implante, y c) el uso de la TSC se asoció independientemente con cifras más bajas de TCIV de nueva aparición.
La TSC se ha propuesto para el implante de válvulas autoexpandibles para conseguir implantes más altos y reducir así los TCIV asociados a la intervención. La justificación de esta proyección fluoroscópica, que aísla el punto más bajo de la cúspide no coronaria en una proyección oblicua anterior derecha/caudal, se basa en que el contacto anular con las válvulas autoexpandibles se produce principalmente desde la cúspide no coronaria hacia la cúspide coronaria izquierda8. Las ventajas potenciales de esta técnica son la eliminación del paralaje del sistema de liberación, el alargamiento del tracto de salida del ventrículo izquierdo y una distancia visual del anillo aórtico más corta (eje transversal), lo que permite una evaluación más precisa de la profundidad real del implante, con el potencial de reducir el riesgo de lesiones en el sistema de conducción9. La mayoría de las experiencias comunicadas hasta la fecha con esta técnica son con la válvula supraanular Evolut (Medtronic, Estados Unidos). En un análisis por puntuación de propensión (propensity score) de 444 pacientes tratados con Evolut, la TSC (en comparación con la técnica clásica de implante) redujo la tasa de IMP (el 11,8 frente al 21,7%; p=0,03) sin comprometer los resultados del TAVI10. En la mayor serie de pacientes consecutivos tratados con Evolut mediante TSC (n=694), Gada et al.11 demostraron que existía un riesgo muy bajo de IMP (< 5%) con esta técnica, con un bajo índice de eventos adversos cardiovasculares mayores.
Hasta la fecha, apenas se disponía de datos sobre la TSC con la válvula Portico. En un estudio retrospectivo que analiza el impacto de la TSC con diferentes válvulas autoexpandibles, Mendiz et al.12 incluyeron 19 pacientes tratados con Portico. En general y de acuerdo con estudios previos, la TSC redujo la tasa de TCIV sin comprometer la seguridad.
Nuestros resultados también respaldan el uso de la TSC con el sistema Portico FlexNav como una estrategia segura, con tasas de éxito comparables y tasas similares de complicaciones mayores. De hecho, el uso de esta técnica se asoció con un implante de la válvula más alto y la posterior reducción de trastornos de la conducción después del TAVI, sin aumento del riesgo de embolización de la válvula o deterioro hemodinámico de la misma. Curiosamente, la incorporación de esta proyección de trabajo modificada puede reducir la exposición a la radiación (menor tiempo de fluoroscopia), al ofrecer una visualización más precisa de la profundidad del implante y un posicionamiento más preciso del dispositivo, aunque no se tradujo en una reducción de la duración total de la intervención.
En el presente estudio, la TSC apenas se utilizó en las intervenciones de valve-in-valve (). Aunque es menos frecuente, este método también puede servir para tratar válvulas quirúrgicas degeneradas, ya que las prótesis quirúrgicas están directamente ajustadas a las comisuras de la válvula aórtica nativa y, en consecuencia, la anatomía posquirúrgica generalmente coincide con la anatomía nativa. De manera similar al TAVI en válvulas nativas, la proyección de superposición de cúspides puede obtenerse aislando el poste del stent bioprotésico entre las cúspides coronarias izquierda y derecha en base a la tomografía computarizada previa a la intervención, como han propuesto recientemente Wong et al.13.
Cabe destacar que los gradientes transvalvulares residuales fueron más bajos en el grupo de TSC, lo que podría deberse a una mejor hemodinámica secundaria a una posición más alta de los velos, aunque este hallazgo debe interpretarse solo como generador de hipótesis.
Es importante destacar que los pacientes del grupo de TSC presentaron tasas significativamente más bajas de trastornos de la conducción en consonancia con trabajo previos con otras válvulas autoexpandibles. La necesidad de IMP en el grupo clásico de 3 cúspides fue, aproximadamente, el doble que en el grupo de TSC (el 30 frente al 14%; p=0,078), aunque esta diferencia no fue estadísticamente significativa quizá debido al pequeño tamaño de la muestra. La diferencia fue mucho más notable cuando se excluyó a los pacientes con bloqueo de rama derecha preexistente (el 31,0 frente al 7,7%; p=0,011), que tienen el mayor riesgo de IMP independientemente del tipo de válvula y la técnica de implante.
Por último, la posdilatación se asoció con un aumento de TCIV de nueva aparición tras el TAVI en análisis univariante, pero no en el multivariante. Mientras que la valvuloplastia puede aumentar el riesgo de anomalías de la conducción después del TAVI debido al traumatismo mecánico sobre el sistema de conducción, aún no se ha identificado ninguna asociación clara entre la posdilatación y la necesidad de nuevo IMP14.
LimitacionesEste estudio tiene las limitaciones inherentes a un estudio retrospectivo observacional sin una comisión de adjudicación de eventos externa y un tamaño muestral reducido. La profundidad de implante fue evaluada por operadores experimentados pero conocedores de la intervención por lo que podría ser objeto de sesgo. No se realizaron tomografías computarizadas sistemáticas post-intervención, por lo que la profundidad del implante se evaluó principalmente mediante angiografía y no se pudo analizar el grado de alineamiento neocomisural. Por último, debido al periodo del estudio (y para reducir los factores ajenos a la técnica de implante que pueden influir en la precisión del implante de la válvula), sólo se incluyeron pacientes que recibieron la válvula Portico con el sistema de aplicación FlexNav, en lugar de la válvula Navitor de nueva generación disponible comercialmente en España desde julio de 2021, lo que puede limitar la generalización de las conclusiones. Las recomendaciones más recientes de buenas prácticas para el implante de la válvula Navitor han incorporado la TSC y los resultados clínicos con el nuevo dispositivo se evaluarán en un futuro próximo.
CONCLUSIONESLa aplicación de la TSC durante el implante del sistema Portico FlexNav es factible y puede ayudar a lograr una menor profundidad del implante y posteriores tasas más bajas de TCIV de nueva aparición sin comprometer la seguridad o el rendimiento de la válvula.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESL. Asmarats, L. Nombela-Franco, A. Regueiro y D. Arzamendi concibieron y diseñaron el análisis. L. Gutiérrez-Alonso, G. Tirado-Conte, P. Cepas y E. Fernández-Peregrina recopilaron los datos. L. Asmarats y X. Millán realizaron el análisis. CH Li, P. Jiménez-Quevedo y X. Freixa revisaron y editaron el original.
CONFLICTO DE INTERESESL. Asmarats, L. Nombela-Franco, X. Millán, CH. Li, X. Freixa y D. Arzamendi son proctors de Abbott. A. Regueiro es proctor de Abbott y Meril Life. Los otros autores informan de que no tienen ningún conflicto de intereses.
- –
Los trastornos de la conducción continúan siendo la complicación más frecuente del TAVI.
- –
Se ha propuesto la TSC para reducir los trastornos de la conducción después del TAVI con válvulas autoexpandibles supraanulares (principalmente Evolut). Sin embargo, apenas existen datos sobre la seguridad y los beneficios potenciales de esta nueva estrategia de implante con dispositivos intraanulares.
- –
El presente estudio evaluó específicamente la seguridad y la eficacia de la TSC durante el TAVI con el sistema autoexpandible intraanular Portico FlexNav.
- –
El uso de la TSC durante el implante de Portico es factible y facilita un implante de válvula más elevado, lo que a su vez podría contribuir a reducir las tasas de TCIV de nueva aparición.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.02.006