Reemplazo percutáneo de las válvulas cardiacas
El tratamiento percutáneo de las enfermedades valvulares comenzó hace 2 décadas en la estenosis mitral, donde la dilatación con balón permitió incrementar el área valvular de forma estable, con una muy baja incidencia de complicaciones y resultados comparables a los obtenidos con la cirugía. De esta técnica hemos aprendido que podemos llegar a las válvulas cardiacas tanto de forma anterógrada como retrógrada, con diferentes sistemas de balones montados sobre una o dos guías, balones dobles o modelos especiales de balones, con el objetivo final de incrementar el área valvular. Se ha demostrado que estos procedimientos son seguros, que la oclusión transitoria del flujo no crea mayor inconveniente, que los riesgos de embolización son bajos y que, con las manipulaciones apropiadas, las complicaciones derivadas del uso de los catéteres (disecciones, perforaciones, desgarros, roturas y hemorragias) son infrecuentes. Para el tratamiento de las lesiones estenóticas, las técnicas con balón han sido bastante eficaces en las válvulas mitral, tricúspide y pulmonar; sin embargo, en la válvula aórtica estenótica y calcificada, los resultados a medio y largo plazo no son aceptables. Aquí las indicaciones están limitadas al tratamiento de pacientes en los que la opción quirúrgica es de muy alto riesgo, especialmente por presentar enfermedades asociadas (renales, respiratorias, cáncer, etc.) que no permiten el reemplazo quirúrgico con utilización de circulación extracorpórea y parada cardiorrespiratoria.
El desarrollo de la circulación extracorpórea permitió el reemplazo de las válvulas cardiacas nativas de forma segura, con una mortalidad quirúrgica razonable. Sin embargo, los reemplazos valvulares tienen limitaciones importantes relacionadas con las válvulas implantadas; éstas deben ser biocompatibles, no trombogénicas, duraderas, resistentes, de múltiples tamaños, con bajo gradiente hemodinámico, silenciosas, seguras en su fijación y con complicaciones tratables. También hay inconvenientes relacionados con la técnica de implantación, como la anestesia general, la apertura del tórax, la pleura y el pericardio, las múltiples canulaciones, la circulación extracorpórea, la parada cardiaca con cardioplejía, la infusión de fármacos y transfusiones, la modificación del sustrato valvular con eventual daño estructural y su repercusión hemodinámica en las cámaras cardiacas, y el riesgo de infecciones. Además debemos considerar los altos costes de la operación, el personal y los equipos del quirófano, así como los derivados de la recuperación posquirúrgica.
Sin embargo, la integración de los conocimientos adquiridos en diversos procedimientos quirúrgicos y percutáneos, especialmente los relacionados con la tecnología de balones, stents, válvulas cardiacas metálicas y bioprótesis, han permitido enfrentar nuevos retos, como la implantación percutánea de válvulas cardiacas1.
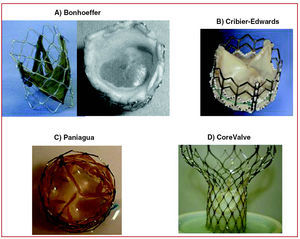
El desarrollo de válvulas con membranas biológicas, montadas y suturadas en una plataforma plegable con stents, que permiten un bajo perfil para facilitar su introducción, transporte y despliegue sobre la válvula nativa, y después mantener la posición sin perder sus propiedades como válvula durante largo tiempo, constituye la base del éxito para su aplicación en pacientes. Bonhoeffer et al2 implantaron una válvula venosa yugular bovina disecada y suturada en un stent de Platino iridiado (NuMED) (fig. 1A), que era transportada por un catéter a través de un introductor 18 Fr y desplegada por un balón de 22 mm de diámetro en el tracto de salida del ventrículo derecho, dentro de un injerto. Esta experiencia inició la era del reemplazo percutáneo de las válvulas cardiacas en pacientes.
Fig. 1. Diferentes modelos de prótesis valvulares percutáneas.
El reemplazo percutáneo valvular aórtico fue inicialmente realizado por Cribier et al3 con una técnica anterógrada, a través de la vía transeptal, cruzando de la aurícula izquierda al ventrículo izquierdo y hasta la raíz aórtica. Esta técnica es muy exigente y su tolerancia es limitada en algunos pacientes críticamente enfermos. La válvula, con 3 valvas, es de pericardio equino, está suturada en un stent de acero inoxidable de 14 mm de longitud y 23 mm de diámetro con gran fuerza radial y poca retracción (fig. 1B) (Percutaneous Valve Technologies-Edwards Lifesciences). Se monta sobre un balón de 22 mm de diámetro por 30 mm de longitud (NuMED). El dispositivo de 24 Fr se introduce por la vena femoral y se desplaza sobre un guía metálica rígida de recambio de 0,035 pulgadas, que es exteriorizada por la arteria femoral. El stent expuesto montado sobre el balón atraviesa el tabique interauricular, el ventrículo izquierdo y las diferentes estructuras intracardiacas (válvula mitral, cuerdas, trabéculas y válvula aórtica), con el riesgo de atrapamiento y/o daño de estas estructuras intravasculares, para llegar finalmente a la válvula calcificada. Una técnica de estimulación con marcapasos a alta frecuencia (220 lat/min) facilita la ubicación y la implantación de la válvula, con menos riesgo de desplazamiento y embolización de la prótesis y con tiempos de oclusión del flujo < 30 s. Con esta técnica3 se obtienen gradientes residuales < 5 mmHg y un área valvular promedio de 1,7 cm2. Algunos pacientes presentaron pequeños escapes perivalvulares. Además, la mortalidad inicial fue elevada y se derivaba de la manipulación de la prótesis con elevado diámetro y de las condiciones de alto riesgo con los pacientes tratados.
A su vez, la vía retrógrada fue iniciada por Paniagua et al4, que emplearon una válvula de pericardio porcino de 2 mm de perfil (Endoluminal Technology Research; Estados Unidos) montada y suturada en un stent de platino iridiado (fig. 1C), implantado sobre un balón de 20 × 30 mm (NuMED Inc.). La válvula se avanzaba hasta la aorta abdominal a través de un introductor de 16 Fr y posteriormente era posicionada en la válvula aórtica (previa predilatación con balón con la técnica habitual de valvuloplastia aórtica), lográndose un área valvular final de 1,6 cm2 sin escape perivalvular significativo. También se ha empleado por vía retrógrada la válvula de Cribier-Edwards, aunque presenta dificultades derivadas de su calibre (24 Fr) al avanzar por las arterias femorales e ilíacas muy tortuosas y calcificadas en pacientes ancianos, y a través de la propia válvula aórtica calcificada de deformada. Es frecuente que tras la fractura ocasionada por la predilatación, o por la disposición excéntrica de la guía metálica, se produzca el incrustamiento de esta última en la comisura valvular o incluso la fractura de la válvula, lo que impide el posterior paso de la válvula montada en el catéter balón. Recientemente se ha desarrollado un catéter especial que permite reorientar y centrar todo el dispositivo para conseguir «cruzar» por el centro de la válvula y lograr una implantación exitosa5.
La válvula balón expandible Cribier-Edwards ha sido implantada recientemente con éxito en 7 pacientes con estenosis aórtica calcificada y muy alto riesgo quirúrgico6. Lo novedoso fue el abordaje por vía transapical del ventrículo izquierdo, mediante minitoracotomía, y sin soporte de circulación extracorpórea. Esta estrategia es prometedora, ya que es una técnica quirúrgica menos agresiva y compleja que integra los equipos quirúrgicos con los intervencionistas, y que en corto tiempo permitirá realizar tanto la implantación como la reparación de válvulas, pues posibilita el abordaje directo sobre la válvula aórtica y el aparato valvular mitral.
Recientemente, Grube et al7 han implantado por vía retrógrada en pacientes con enfermedad aórtica una válvula de pericardio equino suturada en un stent con forma de reloj de arena. El stent de Nitinol autoexpandible (diseñado por Jacques Seguin, CoreValve) tiene un segmento inferior con mayor fuerza radial para fijarse y expandirse en el anillo aórtico sobre las valvas calcificadas, donde se encuentran suturadas las valvas de pericardio. Su segmento medio, más estrecho, mantiene una cámara con los senos coronarios, que impide la limitación del flujo a las coronarias. Su segmento superior es más ancho y tiene como finalidad principal estabilizar el stent y centrar la posición de la válvula (fig. 1D). La implantación de este dispositivo (inicialmente de 24 Fr) requiere mayor tiempo para su ubicación y despliegue. Por ser superior a 1 min, actualmente se implanta en condiciones de soporte hemodinámico con bomba extracorpórea fémoro-femoral (vena-aurícula derecha, arteria-aorta abdominal). Debido a que es un sistema muy rígido, inicialmente se necesitaban manipulaciones complejas que podían causar perforaciones ventriculares, posiciones incorrectas de la válvula y tiempos prolongados de intervención, con el consiguiente secuestro sanguíneo en los miembros inferiores y la acidosis metabólica. Con la segunda generación de esta válvula y el nuevo diseño del stent se logró disminuir el grosor del metal y aumentar la amplitud de su apoyo superior. Además, el cambio de una membrana pericárdica a una porcina, una mejor técnica de sutura y el despliegue con un catéter de menor calibre (21 Fr en el segmento valvular y 14 Fr en el cuerpo del catéter) han mejorado ostensiblemente los resultados del procedimiento y han disminuido las complicaciones y la mortalidad.
Actualmente están en desarrollo y en período de prueba en modelos animales otros sistemas de válvulas, especialmente las autoexpandibles; algunos se estudiarán próximamente en pacientes. Los modelos descritos con anterioridad serán estudiados de forma comparativa con los tratamientos quirúrgicos y se establecerán programas para poblaciones de pacientes con riesgo aceptable, comparables a los tratados con cirugía. Los resultados iniciales son indicativos de que en poco tiempo las técnicas de implantación percutánea de válvulas serán una opción válida para un número importante de pacientes, con menor riesgo que los procedimientos quirúrgicos.
Reparación percutánea de las válvulas cardiacas
Las lesiones regurgitantes de la válvula mitral constituyen uno de los mayores retos para el tratamiento percutáneo8,9. En la actualidad se emplean varias técnicas quirúrgicas, como el reemplazo valvular mitral, especialmente en las afecciones con daño estructural. En los casos con trastorno y/o disfunción del aparato valvular se pueden efectuar modificaciones de sus segmentos, lo que mejora la coaptación de las valvas, bien por sutura borde a borde de las valvas (técnica del Alfieri)8 o con anuloplastia para reducción del anillo mitral.
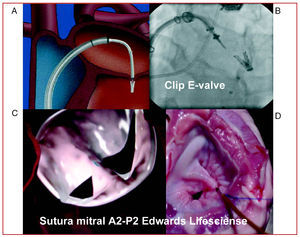
La técnica de adosamiento de los bordes libres de la válvula mitral (técnica de Alfieri) se puede practicar también de forma percutánea con sistemas específicos que permiten llegar hasta la válvula con catéteres terapéuticos especiales, ya sea por unión de los bordes valvulares con un clip (Clip E-Valve) (fig. 2A y B) o con succión-sutura de los bordes (sutura de Edwards) (fig. 2C y D) en la zona central de la válvula mitral (A2-P2). En pacientes con jet de regurgitación central, estas técnicas han mostrado ser útiles. De estos dispositivos, el clip de E-valve fue el primero en ser aplicado en pacientes por nuestro grupo, con excelentes resultados, que se mantuvieron tras 2 años de la implantación del clip10. El programa Everest I11 confirmó la factibilidad y la seguridad de esta técnica. Con el estudio Everest II, actualmente en desarrollo, los resultados se están comparando con la cirugía; los resultados iniciales parecen favorables y más de 70 pacientes ya han sido tratados con este sistema. Es una técnica que requiere la colaboración entre cardiólogos dedicados a las técnicas de imagen, cardiólogos intervencionistas y anestesistas. Para lograr una óptima ubicación y una posición segura durante la implantación del clip se requiere la realización de una ecocardiografía transesofágica bajo anestesia general y la referencia de las imágenes por fluoroscopia. Además, el dispositivo del clip es especial y bastante ingenioso, con un diámetro de 24 Fr, y se requiere experiencia para poder colocarlo en una posición central en el aparato valvular mitral. El dispositivo se manipula desde su punto de introducción por la vena femoral derecha, atravesando el tabique interauricular, para lograr el control apropiado de todos sus elementos, hasta lograr «atrapar» las valvas de la mitral.
Fig. 2. Técnicas de adosamiento de bordes de las válvulas mitrales. A y B: clip E-valve. C y D: succión-sutura de Edwards Lifescience.
Otro sistema con dispositivo de succión y sutura fue el desarrollado por Masiano et al12. El catéter es de menor calibre (12 Fr) e igualmente requiere una excelente orientación tridimensional para lograr efectuar la succión en el punto más apropiado de la valva anterior y luego de la posterior. En este sistema de sutura, la superficie de adosamiento es menor que la que se obtiene cuando se usa el clip y, por lo tanto, se requiere una mayor precisión en la ubicación del punto de sutura para lograr la máxima eficacia en la disminución de la regurgitación mitral.
El segundo grupo de técnicas para el tratamiento de la regurgitación mitral lo constituyen los sistemas que acercan las valvas mitrales actuando sobre el anillo mitral (anuloplastia), disminuyendo la distancia en la base de las valvas y optimizando su adosamiento y coaptación durante la sístole. El aparato valvular mitral es un sistema complejo. Sus elementos incluyen la pared libre del ventrículo izquierdo, los músculos papilares, las respectivas cuerdas tendinosas, las valvas y su base de implantación, y el anillo mitral. Todos ellos desempeñan un papel significativo que finalmente permite conseguir una coaptación estable de las válvulas para evitar la regurgitación mitral en una situación de alto gradiente entre el ventrículo izquierdo y la aurícula izquierda. La afección de cualquiera de sus componentes, como ocurre en las dilataciones del ventrículo izquierdo, ocasiona la dilatación del anillo mitral, que a su vez condiciona la regurgitación mitral.
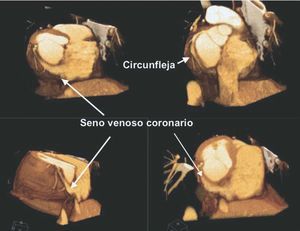
La conocida relación anatómica entre el seno venoso coronario (SVC) y el anillo mitral (fig. 3) y la experiencia con la utilización del seno coronario en múltiples tratamientos con catéteres han permitido el desarrollo de técnicas que consiguen su abordaje de forma estable. La canulación y el uso terapéutico de este conducto han permitido plantear la posibilidad de actuar sobre la válvula mitral por vía percutánea. Se han desarrollado dispositivos específicos que pueden ser introducidos a través del SVC, con objeto de lograr acercar la valva mitral posterior a la anterior cuando la regurgitación es consecuencia de la dilatación del anillo mitral.
Fig. 3. Reconstrucción tridimensional a partir de imágenes de tomografía computarizada multidetector que muestran la relación entre seno venoso y arteria circunfle ja.
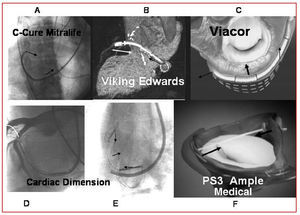
De estas técnicas, la primera aplicada en humanos fue el dispositivo C-Cure, que nuestro grupo empleó en 199913. Después de haber sido evaluado en modelos animales, tanto en condiciones agudas como crónicas, el dispositivo C-Cure (Mitralife Inc. Estados Unidos) se aplicó en forma temporal con un catéter de 10 Fr en una pequeña serie de pacientes13. El sistema se introdujo por la vena yugular derecha hasta el SVC, y ahí se manipula cambiando de su forma elongada a la cóncava, para lo cual se ejerce una compresión en el SVC que se transmite al segmento adyacente del anillo mitral (fig. 4A). Se demostró que el sistema era más efectivo para reducir la regurgitación mitral cuando se actuaba sobre el segmento medio de la valva posterior (P2), lo que se confirmaba con eco-Doppler instantánea, junto con los parámetros hemodinámicos pertinentes. Este dispositivo demostró ser eficaz para reducir la regurgitación mitral, pero su disposición y ubicación anatómica no fueron consideradas estables y seguras para el paciente, porque no se procedió a la liberación con implantación permanente. Además, cuando se hacía la constricción con apoyo más profundo en el SVC se producía un pinzamiento de la arteria circunfleja con disminución del flujo coronario, reversible una vez que se retiraba el efecto de tracción sobre ella. Esto se consideró una limitación en los dispositivos que usan el SVC como lugar de aplicación de su constricción sobre el anillo mitral. Recientemente, Maselli et al14 subrayan esta observación después de una evaluación anatómica detallada. Demostraron que la interrelación y el cruce de la arteria circunfleja con el seno venoso coronario ocurría en el 64% de los casos y con la rama obtusa marginal en el 16%, lo que establece un alto potencial de casos (80%) con riesgo de inducción de isquemia por implantación de estos dispositivos. También señalaron que la distancia media entre el SVC y el anillo mitral fue de 9,7 ± 3,2 mm por encima el anillo, con una distancia máxima de 19 mm14, lo que indicaría que, a mayor distancia, menor efecto directo sobre el anillo. Por ello, creemos necesaria la evaluación no invasiva con tomografía axial computarizada, resonancia magnética o con coronariografía izquierda que incluya la fase venosa, para permitir establecer las correlaciones vasculares, seleccionar a los pacientes más susceptibles de beneficiarse de esta técnica y prevenir complicaciones.
Fig. 4. Sistemas de constricción del anillo mitral.
Otro sistema de constricción del anillo mitral a través del SVC es el Viking de Edwards Lifescience, aplicado por Webb et al15. A través de un catéter en el SVC, se implanta una barra-resorte de Nitinol con 2 stents autoexpandibles fijados en sus extremos (fig. 4B). Se implanta estirado y se acorta con la temperatura corporal. La barra ejerce un efecto constrictivo al acortarse, que afecta al anillo mitral, con lo que se reduce la regurgitación mitral funcional. Sin embargo, de los 4 pacientes inicialmente descritos, sólo uno mantiene el efecto a los 6 meses, básicamente por fracturas de la barra.
El sistema Viacor, empleado en modelos animales agudos16 y crónicos17, consiste en un catéter que se introduce desde la vena subclavia hasta el SVC. Tiene 3 conductos que permiten introducir 3 varillas metálicas de Nitinol, lo que ocasiona una rectificación del catéter en el segmento ubicado en el SVC, efecto que se transmite al anillo mitral (fig. 4C). Su punto de apoyo son los extremos y, a diferencia de los anteriores, ocasiona una fuerza divergente en dichos extremos que pueden atenuar la rectificación. Se han iniciado las primeras aplicaciones en pacientes en fase quirúrgica y se está preparando un programa para su implementación de forma permanente en pacientes.
El dispositivo de Cardiac Dimension, que ha sido utilizado por Kaye et al18 en casos agudos y Maniu et al19 en modelos de regurgitación en animales, tanto en fase aguda como crónica, mostró una reducción del anillo y de la regurgitación mitral funcional. El dispositivo de nitinol se arma dentro del SVC mediante asas que sirven de anclaje, y entre ambas se ejerce la tensión por la sección metálica que los une (fig. 4E). También se han descrito algunos efectos no deseados en el flujo de la arteria circunfleja (fig. 4D). Todavía está pendiente el uso de este dispositivo en pacientes.
Otro modelo transvenoso en el SVC es el Q-Care Quantumcore, basado en la inducción de una respuesta de cicatrización (fibrosis) tras la aplicación de electrofulguración (65 °C en 10 s) en el semicírculo del SVC relacionado con la base de la valva posterior mitral para producir una retracción del anillo. Este dispositivo todavía no se ha empleado en pacientes.
Hay 2 formas de tracción que no necesitan efectuar el efecto mecánico a través del seno venoso. Uno de ellos es el sistema PS3 (Percutaneous Septal Sinus Shortening) de Ample Medical Inc., en el que la tracción de aproximación se establece entre el SVC y el tabique interauricular, con un punto de apoyo con una barra metálica localizada en el SVC, cerca del segmento P1-P2 y con una cuerda que cruza la aurícula izquierda hasta alcanzar el tabique interauricular. Se coloca un sistema de Amplatzer para el cierre del foramen oval, con el objeto de distribuir la fuerza de apoyo en toda la pared del tabique interauricular (fig. 4F). Después de las pruebas en animales realizadas por Rogers et al20, recientemente nuestro grupo realizó la implantación con este sistema en los primeros 2 pacientes antes de su tratamiento quirúrgico. En ellos se evaluó el grado de reducción de la regurgitación, que fue satisfactorio. Esta alternativa no mostró el inconveniente de afectar a la arteria circunfleja, porque la tracción se produce en un plano más lateral.
Con la misma idea, también se están empezando a desarrollar dispositivos que permiten disminuir la distancia del anillo mitral, para lo que se utiliza la vía de abordaje transventricular izquierdo (Mitralign), y que permiten llegar hasta el surco posterior del lado ventricular mediante catéteres y sistemas de sutura especiales. Esto permite establecer puntos de apoyo intraventriculares con sus respectivas aplicaturas y adosamiento. De momento sólo se ha efectuado en animales.
Es evidente que la tecnología va progresando y vamos optimizando todas las vías de apoyo y abordaje para las válvulas. Recientemente se ha empleado una técnica combinada quirúrgica y percutánea a través de una punción ventricular en el ápex y una toracotomía mínima, avanzando introductores por el ápex del ventrículo izquierdo, y se ha podido colocar una válvula expandible con balón en posición aórtica. Tras esta experiencia nos permitimos indicar que con esta vía transapical no solamente se ha abierto la posibilidad de colocar válvulas percutáneas, sino que con seguridad podremos efectuar intervenciones de reparación en el aparato valvular mitral, con mucho más control y en sitios de difícil acceso para los catéteres. El gran reto en estos momentos lo constituye la posibilidad de lograr implantar válvulas percutáneas en posición auriculoventricular, especialmente a nivel de la válvula mitral. Una de las grandes limitaciones de estos sistemas auriculoventriculares es que tienen unos anillos muy grandes. En animales ya se han colocado válvulas en posición mitral, pero dentro de bioprótesis previamente implantadas21.
En esta revisión de la experiencia reciente, tanto de la implantación de válvulas percutáneas como de su reparación, podemos anticipar que en la próxima década asistiremos a la segunda gran revolución de la cardiología intervencionista: el tratamiento percutáneo de las afecciones valvulares.
Correspondencia:
Dr. J.A. Condado.
Laboratorio de Hemodinamia. Hospital Privado Centro Médico de Caracas.
Urb. San Bernardino. Caracas. Venezuela 1011.
Correo electrónico: Condadoj@telcel.net.ve