La puntuación SYNTAX (PS) tiene muy escaso valor predictivo de eventos clínicos tras el implante percutáneo de válvula aórtica (TAVI), pero que podría mejorar con la combinación de variables clínicas y anatómicas, la nueva PS-II. Nuestro objetivo es evaluar el valor de la PS-II en la predicción de eventos en pacientes sometidos a TAVI.
MétodosSe incluyó en total a 402 pacientes con estenosis aórtica grave sometidos a TAVI. Se revisó la angiografía coronaria antes del procedimiento y se calcularon la PS-I y la PS-II según los algoritmos de la PS. Se estratificó a los pacientes en 3 grupos en función de los terciles de la PS-II. Los objetivos primarios fueron muerte por cualquier causa y los eventos adversos cardiovascular mayores (MACE), un compuesto de muerte, evento cerebrovascular o infarto de miocardio al año de seguimiento.
ResultadosUna PS-II aumentada se asoció con más mortalidad (p=0,036) y hemorragias mayores (p=0,015) a los 30 días. Los riesgos de muerte (HR=2,60; p=0,002) y MACE (HR=2,66; p<0,001) al año de seguimiento fueron mayores en el tercer tercil de la PS-II y similares en el segundo tercil (muerte, HR=1,27; p=0,507; MACE, HR=1,05; p=0,895) comparados con los pacientes del primer tercil. Pertenecer al tercer tercil de la PS-II fue un predictor independiente de mortalidad (p=0,046) y MACE (p=0,001) a largo plazo.
ConclusionesLa PS-II parece más adecuada que la PS-I para predecir eventos clínicos en pacientes sometidos a TAVI. Una mayor PS-II se asoció a más eventos clínicos al año y a los 4 años de la TAVI, independientemente de la presencia de enfermedad coronaria.
Palabras clave
La estenosis aórtica coexiste con frecuencia con la enfermedad coronaria (EC), y ambas tienen factores de riesgo comunes y una patogenia similar1,2. El riesgo del reemplazo quirúrgico de la válvula aórtica aumenta en presencia de una EC, y generalmente está indicada la cirugía de revascularización coronaria (CABG) en el momento de practicar la cirugía valvular3. El implante percutáneo de válvula aórtica (TAVI) ha revolucionado el tratamiento de los pacientes con estenosis aórtica sintomática grave que tienen un riesgo intermedio o alto4. El grado y la complejidad de la EC en estos pacientes son heterogéneos y continúa sin haberse establecido cuál es la manera óptima de tratarla. Además, con la expansión del TAVI en la práctica clínica, cada vez tiene más interés la capacidad de predecir los resultados de la intervención, en especial en los pacientes de menor riesgo. En estudios previos se ha descrito que la presencia de una EC en los pacientes candidatos a TAVI no tuvo repercusión en los resultados clínicos a corto y medio plazo. Se ha investigado la puntuación SYNTAX I (PS-I) anatómica, que se diseñó inicialmente para evaluar la complejidad de las intervenciones percutáneas de revascularización coronaria5, como posible instrumento para predecir los eventos cardiovasculares mayores en los pacientes tratados con TAVI6,7. Sin embargo, se observó que el valor predictivo de la PS-I era muy limitado, posiblemente como consecuencia de que se centra tan solo en la anatomía coronaria, sin tener en cuenta el importante papel que desempeñan las comorbilidades. Se ha demostrado que un índice más reciente, la puntuación SYNTAX II (PS-II), que combina características anatómicas con variables clínicas, proporciona una evaluación individualizada del riesgo a largo plazo de los pacientes con una EC compleja8–10. Aunque la PS-II se elaboró para facilitar la toma de decisiones al optar por la CABG o la intervención coronaria percutánea (ICP) para pacientes con una EC compleja, nuestra hipótesis es que la inclusión de las variables clínicas, varias de las cuales han sido identificadas como factores predictivos de mayor mortalidad en el reemplazo de la válvula aórtica11,12 y el TAVI13,14, pueden mejorar el valor pronóstico respecto al de la PS-I en la predicción de los resultados tras el TAVI.
MÉTODOSPoblación de pacientesSe incluyó a un total de 402 pacientes consecutivos con estenosis aórtica sintomática grave a los que se practicó un TAVI transfemoral en nuestro centro. La indicación del TAVI se examinó en el ámbito de la reunión del Equipo Cardiaco del centro, en la que participaron como mínimo un cirujano cardiaco y un cardiólogo intervencionista, cardiólogo de imagen y cardiólogo clínico; la evaluación se basó en la historia clínica del paciente, la idoneidad anatómica y la valoración de la fragilidad. La estenosis aórtica grave se definió como un gradiente de presión transaórtica medio > 40mmHg o un área valvular<1,0cm2 determinados en la ecocardiografía transtorácica o la ecocardiografía de estrés con dobutamina, según fuera apropiado. Se realizó a todos los pacientes una coronariografía antes del TAVI. La decisión de practicar la revascularización coronaria se tomó en la reunión del Equipo Cardiaco, basándose en la localización y la extensión de la EC y la complejidad de la ICP. En general, para las lesiones graves proximales y medias con gran cantidad de miocardio en riesgo, se practicó revascularización, y no se trataron las lesiones de segmentos distales o vasos secundarios. Para el reemplazo valvular se utilizaron la válvula cardiaca percutánea Edwards SAPIEN (Edwards LifeSciences; Irvine, California, Estados Unidos) o la prótesis valvular Medtronic CoreValve (Medtronic; Minneapolis, Minnesota, Estados Unidos), utilizando una vía de acceso transfemoral según lo descrito con anterioridad15. Se realizó sistemáticamente un seguimiento del electrocardiograma y los marcadores cardiacos cada 8 h durante las primeras 24 h y 1 vez al día a partir de entonces, como parte de nuestro protocolo estándar de TAVI. El tratamiento antitrombótico después del TAVI consistió en ácido acetilsalicílico (indefinidamente) junto con clopidogrel (3-6 meses), salvo que estuviera contraindicado. En el caso de que estuviera indicada la anticoagulación por alguna otra razón, se administró tratamiento anticoagulante oral (con o sin tratamiento antiagregante plaquetario con un solo fármaco). Todos los pacientes dieron su consentimiento informado para la intervención y el seguimiento.
Análisis angiográficoUn cardiólogo intervencionista experto en la evaluación de la PS-I que no conocía los resultados clínicos de los pacientes analizó en el laboratorio central de angiografía de nuestro centro todas las angiografías previas a la intervención16. La EC se definió como la presencia de 1 o varias lesiones de las arterias coronarias epicárdicas con estenosis ≥ 50% del diámetro en los vasos de diámetro ≥ 1,5mm17. La PS-I se calculó con el algoritmo de la PS-I17. En los pacientes con lesiones que ya se habían revascularizado con anterioridad y continuaban siendo permeables en el momento de la coronariografía previa al TAVI, estas lesiones se consideraron no relevantes en el cálculo de la PS-I, pero se incluyó a estos pacientes en el grupo de EC. Cuando la revascularización previa había sido quirúrgica, la PS-I se calculó mediante la PS para la CABG18. Se calculó la PS residual de los pacientes sometidos a ICP antes del TAVI19. La PS-II de todos los pacientes se calculó con el algoritmo de PS-II8, que incluye la PS-I anatómica y variables clínicas basales como edad, sexo, aclaramiento de creatinina, fracción de eyección del ventrículo izquierdo, afección de la coronaria principal izquierda, enfermedad pulmonar obstructiva crónica y enfermedad vascular periférica. Para los pacientes sometidos a ICP en los 30 días previos al TAVI, se utilizó la PS-I previa a la ICP, y a los pacientes sin lesiones coronarias, se les asignó un valor de PS-I de 0.
Variables de valoración y definiciones del estudioLos objetivos principales de este estudio fueron la mortalidad por cualquier causa y los eventos adversos cardiovasculares mayores, un parámetro combinado de muerte por cualquier causa, evento cerebrovascular no mortal e infarto de miocardio no mortal al año. Los objetivos secundarios fueron los componentes individuales del objetivo principal a 1 año, así como la muerte de causa cardiovascular. Los eventos adversos cardiovasculares mayores y sus componentes se evaluaron a los 30 días, al año y a los 4 años. La muerte por cualquier causa se definió como cualquier muerte de causa cardiaca o de causa desconocida, todas las muertes relacionadas con la intervención (que se definieron como la mortalidad por cualquier causa a los 30 días o durante la hospitalización de la intervención índice si había sido > 30 días) y las muertes debidas a enfermedad cerebrovascular, embolia pulmonar o enfermedad vascular20. Los eventos cerebrovasculares incluyeron el accidente isquémico transitorio y el ictus, definidos según la duración de los síntomas, la presencia de una disfunción neurológica persistente o los signos de infarto cerebral en las exploraciones de imagen20. La lesión miocárdica se definió como la presencia de signos de ondas Q de nueva aparición en el electrocardiograma o de anomalías en el movimiento de la pared regional de nueva aparición en la ecocardiografía. Los marcadores bioquímicos de lesión miocárdica se definieron como un aumento de la troponina > 35 sobre el límite superior de la normalidad (LSN) o un valor de isoenzima MB de la creatincinasa > 5 LSN.
Seguimiento clínicoSe evaluaron los eventos adversos en el hospital y en el seguimiento clínico. Las características clínicas basales y de la intervención, así como los eventos adversos, se introdujeron prospectivamente en la base de datos dedicada del centro. Los pacientes fueron objeto de seguimiento al mes, a los 6 meses y al año de la intervención y 1 vez al año a partir de entonces.
Análisis estadísticoDado que la PS-II proporciona estimaciones de la mortalidad tanto en la ICP como en la CABG, se calculó el estadístico C para la mortalidad a 30 días y a 1 año mediante análisis de regresión logística binaria. Se crearon curvas de características operativas del receptor (ROC) y se realizaron comparaciones por pares de las curvas ROC correspondientes a las PS-I y PS-II para la ICP y PS-II para la CABG, con objeto de determinar cuál era la mejor puntuación para identificar el objetivo principal. Asimismo, se elaboraron curvas ROC dependientes del tiempo para los datos de supervivencia censurados para el análisis estadístico, con objeto de determinar el valor predictivo de la PS-II en la ICP y de la PS-II en la CABG en cuanto a la mortalidad a 1 año21. La PS-II para la ICP fue la que mostró mejor ajuste, por lo que todos los análisis ulteriores se realizaron con esa puntuación. Se estratificó a los pacientes en 3 grupos según los terciles de la PS-II para la ICP. Se compararon las características iniciales y los resultados clínicos de los distintos grupos. Las variables discretas se resumen en forma de número y frecuencia y las continuas, como media±desviación estándar o mediana [intervalo intercuartílico] cuando la distribución no era normal según lo indicado por la prueba de Shapiro-Wilk. Los resultados clínicos a 30 días, 1 año y 4 años se expresan en forma de número o tasa de incidencia utilizando análisis de Kaplan-Meier, y se compararon los de los pacientes que se encontraban en los terciles 1, 2 y 3 de la PS-II. Se realizaron también análisis de los pacientes con y sin EC, según los terciles de la PS-II para la ICP. Se consideraron estadísticamente significativos los valores de p<0,05. Los análisis se realizaron con los programas informáticos SPSS 19.0 para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos) y R versión 3.3.2 (R Foundation for Statistical Computing; Viena, Austria).
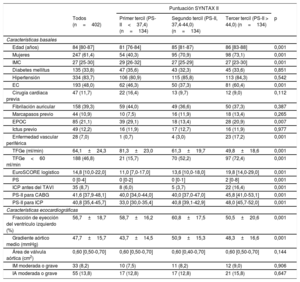
RESULTADOSCaracterísticas iniciales y de la intervenciónLas características clínicas basales se resumen en la tabla 1. La mediana de edad era 84 [80-87] años, con altas prevalencias de diabetes (34%), fibrilación auricular (39%) e insuficiencia renal (47%). Un total de 193 (48,0%) pacientes tenían EC, con medianas de PS-I y PS-I residual de 4 [0-9] y 2 [0-7] respectivamente. Las áreas bajo la curva (ABC) ROC para la PS-I y la PS-I residual fueron 0,520 (intervalo de confianza del 95% [IC95%], 0,404-0,636; p=0,732) y 0,510 (IC95%, 0,398-0,623; p=0,856) para la mortalidad a 30 días y 0,551 (IC95%, 0,473-0,629; p=0,185) y 0,524 (IC95%, 0,448-0,601; p=0,527) para la mortalidad a 1 año. Las medianas generales de la PS-II para la ICP y la PS-II para la CABG fueron 40,8 [35,4-45,7] y 41,6 [37,9-48,1] respectivamente. La PS-II para la ICP mostró mejor ajuste que la PS-II para la CABG tanto en la mortalidad a los 30 días (estadístico C=0,632; IC95%, 0,524-0,740; p=0,022; y estadístico C=0,480; IC95%, 0,380-0,580; p=0,728; para la comparación de las dos curvas ROC, p=0,032) como para la mortalidad a 1 año (C=0,625; IC95%, 0,552-0,699; p=0,001; y C=0,539; IC95%, 0,466-0,612; p=0,309; para la comparación de las dos curvas ROC, p=0,075) (). El ABC dependiente del tiempo también mostró mejor ajuste con la PS-II para la ICP que con la PS-II para la CABG al año (). En consecuencia, los demás análisis se realizaron empleando la PS-II para la ICP, según sus terciles: primer tercil de la PS-II (< 37,4), segundo tercil (37,4-44,0) y tercer tercil (> 44).
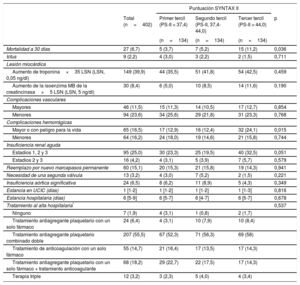
Características clínicas y ecocardiográficas basales según los terciles de la puntuación SYNTAX II
| Puntuación SYNTAX II | |||||
|---|---|---|---|---|---|
| Todos (n=402) | Primer tercil (PS-II<37,4) (n=134) | Segundo tercil (PS-II, 37,4-44,0) (n=134) | Tercer tercil (PS-II > 44,0) (n=134) | p | |
| Características basales | |||||
| Edad (años) | 84 [80-87] | 81 [76-84] | 85 [81-87) | 86 [83-88] | 0,001 |
| Mujeres | 247 (61,4) | 54 (40,3) | 95 (70,9) | 98 (73,1) | 0,001 |
| IMC | 27 [25-30] | 29 [26-32] | 27 [25-29] | 27 [23-30] | 0,001 |
| Diabetes mellitus | 135 (33,8) | 47 (35,6) | 43 (32,3) | 45 (33,6) | 0,851 |
| Hipertensión | 334 (83,7) | 106 (80,9) | 115 (85,8) | 113 (84,3) | 0,542 |
| EC | 193 (48,0) | 62 (46,3) | 50 (37,3) | 81 (60,4) | 0,001 |
| Cirugía cardiaca previa | 47 (11,7) | 22 (16,4) | 13 (9,7) | 12 (9,0) | 0,112 |
| Fibrilación auricular | 158 (39,3) | 59 (44,0) | 49 (36,6) | 50 (37,3) | 0,387 |
| Marcapasos previo | 44 (10,9) | 10 (7,5) | 16 (11,9) | 18 (13,4) | 0,265 |
| EPOC | 85 (21,1) | 39 (29,1) | 18 (13,4) | 28 (20,9) | 0,007 |
| Ictus previo | 49 (12,2) | 16 (11,9) | 17 (12,7) | 16 (11,9) | 0,977 |
| Enfermedad vascular periférica | 28 (7,0) | 1 (0,7) | 4 (3,0) | 23 (17,2) | 0,001 |
| TFGe (ml/min) | 64,1±24,3 | 81,3±23,0 | 61,3±19,7 | 49,8±18,6 | 0,001 |
| TFGe<60 ml/min | 188 (46,8) | 21 (15,7) | 70 (52,2) | 97 (72,4) | 0,001 |
| EuroSCORE logístico | 14,8 [10,0-22,0] | 11,0 [7,0-17,0] | 13,6 [10,0-18,0] | 19,8 [14,0-29,0] | 0,001 |
| PS | 0 [0-4] | 0 [0-2] | 0 [0-1] | 2 [0-8] | 0,001 |
| ICP antes del TAVI | 35 (8,7) | 8 (6,0) | 5 (3,7) | 22 (16,4) | 0,001 |
| PS-II para CABG | 41,6 [37,9-48,1] | 40,0 [34,0-44,0] | 40,0 [37,0-47,0] | 45,8 [41,0-53,1] | 0,001 |
| PS-II para ICP | 40,8 [35,4-45,7] | 33,0 [30,0-35,4] | 40,8 [39,1-42,9] | 48,0 [45,7-52,0] | 0,001 |
| Características ecocardiográficas | |||||
| Fracción de eyección del ventrículo izquierdo (%) | 56,7±18,7 | 58,7±16,2 | 60,8±17,5 | 50,5±20,6 | 0,001 |
| Gradiente aórtico medio (mmHg) | 47,7±15,7 | 43,7±14,5 | 50,9±15,3 | 48,3±16,6 | 0,001 |
| Área de válvula aórtica (cm2) | 0,60 [0,50-0,70] | 0,60 [0,50-0,70] | 0,60 [0,40-0,70] | 0,60 [0,50-0,70] | 0,144 |
| IM moderada o grave | 33 (8,2) | 10 (7,5) | 11 (8,2) | 12 (9,0) | 0,906 |
| IA moderada o grave | 55 (13,8) | 17 (12,8) | 17 (12,8) | 21 (15,8) | 0,647 |
CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; IA: insuficiencia aórtica; ICP: intervención coronaria percutánea; IM: insuficiencia mitral; IMC: índice de masa corporal; PS-II: puntuación SYNTAX II; TAVI: implante percutáneo de válvula aórtica; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
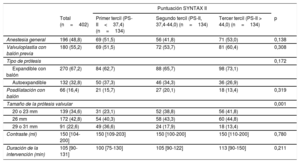
Todas las características clínicas iniciales incluidas en la PS-II fueron más frecuentes en su tercer tercil (p<0,001), excepto la enfermedad pulmonar crónica (p<0,007), que fue más frecuente en los pacientes del primer tercil. Por consiguiente, los pacientes con una PS-II más alta eran de más edad, en mayor proporción mujeres, con más enfermedad vascular periférica y peores función renal y función del ventrículo izquierdo, así como una revascularización menos completa antes del TAVI (PS-I residual más alta) (p<0,001 para todas las comparaciones). Otras variables clínicas no incluidas en la PS-II, como la diabetes, la fibrilación auricular, el ictus previo y la hipertensión, mostraron una distribución similar en los diversos terciles de la PS-II. El EuroSCORE logístico (primer tercil, 13,58±8,4; segundo tercil, 15,84±8,99; tercer tercil, 22,05±10,59; p<0,001) fue mayor con los valores de la PS-II más altos. Las características de la intervención fueron similares en todos los grupos (tabla 2).
Características de la intervención según los terciles de la puntuación SYNTAX II
| Puntuación SYNTAX II | |||||
|---|---|---|---|---|---|
| Total (n=402) | Primer tercil (PS-II<37,4) (n=134) | Segundo tercil (PS-II, 37,4-44,0) (n=134) | Tercer tercil (PS-II > 44,0) (n=134) | p | |
| Anestesia general | 196 (48,8) | 69 (51,5) | 56 (41,8) | 71 (53,0) | 0,138 |
| Valvuloplastia con balón previa | 180 (55,2) | 69 (51,5) | 72 (53,7) | 81 (60,4) | 0,308 |
| Tipo de prótesis | 0,172 | ||||
| Expandible con balón | 270 (67,2) | 84 (62,7) | 88 (65,7) | 98 (73,1) | |
| Autoexpandible | 132 (32,8) | 50 (37,3) | 46 (34,3) | 36 (26,9) | |
| Posdilatación con balón | 66 (16,4) | 21 (15,7) | 27 (20,1) | 18 (13,4) | 0,319 |
| Tamaño de la prótesis valvular | 0,001 | ||||
| 20 o 23 mm | 139 (34,6) | 31 (23,1) | 52 (38,8) | 56 (41,8) | |
| 26 mm | 172 (42,8) | 54 (40,3) | 58 (43,3) | 60 (44,8) | |
| 29 o 31 mm | 91 (22,6) | 49 (36,6) | 24 (17,9) | 18 (13,4) | |
| Contraste (ml) | 150 [104-200] | 150 [109-203] | 150 [100-200] | 150 [110-200] | 0,780 |
| Duración de la intervención (min) | 105 [90-131] | 100 [75-130] | 105 [90-122] | 113 [90-150] | 0,211 |
PS-II: puntuación SYNTAX II.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Los resultados clínicos durante la hospitalización tras el TAVI se presentan en la tabla 3. El aumento de la PS-II se asoció con mayor mortalidad a los 30 días (primer tercil, 5 [3,7%]; segundo tercil, 7 [5,2%]; tercer tercil: 15 [11,2%]; p=0,036) y mayor frecuencia de complicaciones hemorrágicas mayores o con peligro para la vida (p=0,015). Hubo una tendencia a un aumento de las insuficiencias renales agudas en el tercil superior (primer tercil, 30 [23,3]; segundo tercil, 25 [19,5]; tercer tercil, 40 [32,5]; p=0,051). La presencia de EC por sí sola no tuvo repercusión alguna en la tasa de eventos del objetivo principal combinado ni en la mortalidad por cualquier causa a los 30 días y al año.
Resultados clínicos hospitalarios según los terciles de la puntuación SYNTAX II
| Puntuación SYNTAX II | |||||
|---|---|---|---|---|---|
| Total (n=402) | Primer tercil (PS-II < 37,4) | Segundo tercil (PS-II, 37,4-44,0) | Tercer tercil (PS-II > 44,0) | p | |
| (n=134) | (n=134) | (n=134) | |||
| Mortalidad a 30 días | 27 (6,7) | 5 (3,7) | 7 (5,2) | 15 (11,2) | 0,036 |
| Ictus | 9 (2,2) | 4 (3,0) | 3 (2,2) | 2 (1,5) | 0,711 |
| Lesión miocárdica | |||||
| Aumento de troponina×35 LSN (LSN, 0,05 ng/dl) | 149 (39,9) | 44 (35,5) | 51 (41,8) | 54 (42,5) | 0,459 |
| Aumento de la isoenzima MB de la creatincinasa×5 LSN (LSN, 5 ng/dl) | 30 (8,4) | 6 (5,0) | 10 (8,5) | 14 (11,6) | 0,190 |
| Complicaciones vasculares | |||||
| Mayores | 46 (11,5) | 15 (11,3) | 14 (10,5) | 17 (12,7) | 0,854 |
| Menores | 94 (23,6) | 34 (25,6) | 29 (21,8) | 31 (23,3) | 0,768 |
| Complicaciones hemorrágicas | |||||
| Mayor o con peligro para la vida | 65 (16,5) | 17 (12,9) | 16 (12,4) | 32 (24,1) | 0,015 |
| Menores | 64 (16,2) | 24 (18,0) | 19 (14,6) | 21 (15,8) | 0,744 |
| Insuficiencia renal aguda | |||||
| Estadios 1, 2 y 3 | 95 (25,0) | 30 (23,3) | 25 (19,5) | 40 (32,5) | 0,051 |
| Estadios 2 y 3 | 16 (4,2) | 4 (3,1) | 5 (3,9) | 7 (5,7) | 0,579 |
| Reemplazo por nuevo marcapasos permanente | 60 (15,1) | 20 (15,3) | 21 (15,8) | 19 (14,3) | 0,941 |
| Necesidad de una segunda válvula | 13 (3,2) | 4 (3,0) | 7 (5,2) | 2 (1,5) | 0,221 |
| Insuficiencia aórtica significativa | 24 (6,5) | 8 (6,2) | 11 (8,9) | 5 (4,3) | 0,349 |
| Estancia en UCIC (días) | 1 [1-2] | 1 [1-2] | 1 [1-2] | 1 [1-3] | 0,816 |
| Estancia hospitalaria (días) | 6 [5-9] | 6 [5-7] | 6 [4-7] | 6 [5-7] | 0,678 |
| Tratamiento al alta hospitalaria* | 0,537 | ||||
| Ninguno | 7 (1,9) | 4 (3,1) | 1 (0,8) | 2 (1,7) | |
| Tratamiento antiagregante plaquetario con un solo fármaco | 24 (6,4) | 4 (3,1) | 10 (7,9) | 10 (8,4) | |
| Tratamiento antiagregante plaquetario combinado doble | 207 (55,5) | 67 (52,3) | 71 (56,3) | 69 (58) | |
| Tratamiento de anticoagulación con un solo fármaco | 55 (14,7) | 21 (16,4) | 17 (13,5) | 17 (14,3) | |
| Tratamiento antiagregante plaquetario con un solo fármaco + tratamiento anticoagulante | 68 (18,2) | 29 (22,7) | 22 (17,5) | 17 (14,3) | |
| Terapia triple | 12 (3,2) | 3 (2,3) | 5 (4,0) | 4 (3,4) | |
LSN: límite superior de la normalidad; PS-II: puntuación SYNTAX II; UCIC: unidad de cuidados intensivos coronarios.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
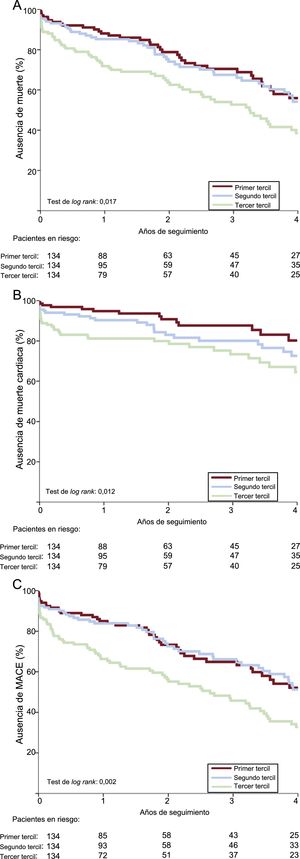
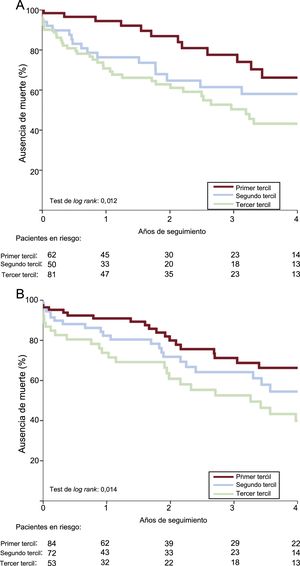
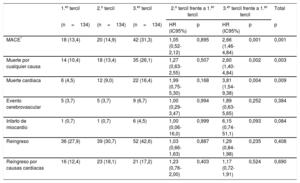
Como se indica en la tabla 4, los riesgos de eventos adversos cardiovasculares mayores al año, mortalidad por cualquier causa y mortalidad de causa cardiaca de los pacientes del tercer tercil de la PS-II fueron mayores (respectivamente, hazard ratio [HR]=2,66; IC95%, 1,46-4,84; p<0,001; HR=2,60; IC95%, 1,40-4,84; p=0,002; HR=3,81; IC95%, 1,54-9,38; p=0,004) y los de los pacientes del segundo tercil, similares (HR=1,05; IC95%, 0,52-2,12; p=0,895; HR=1,27; IC95%, 0,63-2,55; p=0,507; HR=1,99; IC95%, 0,75-5,30; p=0,168) a los de los pacientes del primer tercil. No hubo entre los grupos diferencias significativas en el riesgo de reingreso o el reingreso cardiaco. A los 4 años, los valores altos de la PS-II se asociaron con mayores tasas de mortalidad por cualquier causa (p=0,017), mortalidad cardiaca (p=0,012) y eventos adversos cardiovasculares mayores (p=0,002) (figura 1). En el análisis multivariable, el tercer tercil de la PS-II fue un factor independiente predictivo de mortalidad y eventos adversos cardiovasculares mayores a los 4 años (tabla 5). Al estratificar la población en pacientes con y sin EC, el tercil superior de la PS-II continuó mostrando asociación con la mortalidad a largo plazo (figura 2).
Resultados clínicos al año según los terciles de la puntuación SYNTAX II
| 1.er tercil | 2.o tercil | 3.er tercil | 2.o tercil frente a 1.er tercil | 3.er tercil frente a 1.er tercil | Total | |||
|---|---|---|---|---|---|---|---|---|
| (n=134) | (n=134) | (n=134) | HR (IC95%) | p | HR (IC95%) | p | p | |
| MACE* | 18 (13,4) | 20 (14,9) | 42 (31,3) | 1,05 (0,52-2,12) | 0,895 | 2,66 (1,46-4,84) | 0,001 | 0,001 |
| Muerte por cualquier causa | 14 (10,4) | 18 (13,4) | 35 (26,1) | 1,27 (0,63-2,55) | 0,507 | 2,60 (1,40-4,84) | 0,002 | 0,003 |
| Muerte cardiaca | 6 (4,5) | 12 (9,0) | 22 (16,4) | 1,99 (0,75-5,30) | 0,168 | 3,81 (1,54-9,38) | 0,004 | 0,009 |
| Evento cerebrovascular | 5 (3,7) | 5 (3,7) | 9 (6,7) | 1,00 (0,29-3,47) | 0,994 | 1,89 (0,63-5,65) | 0,252 | 0,384 |
| Infarto de miocardio | 1 (0,7) | 1 (0,7) | 6 (4,5) | 1,00 (0,06-16,0) | 0,999 | 6,15 (0,74-51,1) | 0,093 | 0,084 |
| Reingreso | 36 (27,9) | 39 (30,7) | 52 (42,6) | 1,03 (0,66-1,63) | 0,887 | 1,29 (0,84-1,98) | 0,235 | 0,408 |
| Reingreso por causas cardiacas | 16 (12,4) | 23 (18,1) | 21 (17,2) | 1,23 (0,76-2,00) | 0,403 | 1,17 (0,72-1,91) | 0,524 | 0,690 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores.
Salvo otra indicación, los valores expresan n (%).
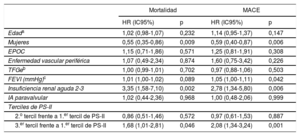
Factores multivariables predictivos de la mortalidad por cualquier causa y los eventos adversos cardiovasculares mayores a los 4 años del implante percutáneo de válvula aórtica
| Mortalidad | MACE | |||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edada | 1,02 (0,98-1,07) | 0,232 | 1,14 (0,95-1,37) | 0,147 |
| Mujeres | 0,55 (0,35-0,86) | 0,009 | 0,59 (0,40-0,87) | 0,006 |
| EPOC | 1,15 (0,71-1,86) | 0,571 | 1,25 (0,81-1,91) | 0,308 |
| Enfermedad vascular periférica | 1,07 (0,49-2,34) | 0,874 | 1,60 (0,75-3,42) | 0,226 |
| TFGeb | 1,00 (0,99-1,01) | 0,702 | 0,97 (0,88-1,06) | 0,503 |
| FEVI (mmHg)c | 1,01 (1,00-1,02) | 0,089 | 1,05 (1,00-1,11) | 0,042 |
| Insuficiencia renal aguda 2-3 | 3,35 (1,58-7,10) | 0,002 | 2,78 (1,34-5,80) | 0,006 |
| IA paravalvular | 1,02 (0,44-2,36) | 0,968 | 1,00 (0,48-2,06) | 0,999 |
| Terciles de PS-II | ||||
| 2.o tercil frente a 1.er tercil de PS-II | 0,86 (0,51-1,46) | 0,572 | 0,97 (0,61-1,53) | 0,887 |
| 3.er tercil frente a 1.er tercil de PS-II | 1,68 (1,01-2,81) | 0,046 | 2,08 (1,34-3,24) | 0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IA: insuficiencia aórtica; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores; PS-II: puntuación SYNTAX II; TFGe: tasa de filtrado glomerular estimada.
En este estudio se analizó por primera vez la influencia de la PS-II en los resultados clínicos de los pacientes con estenosis aórtica sintomática grave tratados con TAVI. La PS-II, que agrega variables clínicas a las de la extensión de la EC cuantificada mediante la PS-I angiográfica, fue superior a esta en la predicción de la mortalidad a los 30 días y al año de los pacientes con estenosis aórtica tratados con TAVI. Los valores crecientes de la PS-II se asociaron con un aumento de los eventos adversos cardiovasculares mayores, la mortalidad por cualquier causa y la muerte cardiaca en la población tratada con TAVI, tuvieran EC o no. En los pacientes con PS-II > 44, se observó un aumento independiente de ∼2 veces en los riesgos de eventos adversos cardiovasculares mayores y de mortalidad por cualquier causa al año y a los 4 años en comparación con los pacientes con PS-II<37,4.
La presencia de EC y la necesidad de CABG concomitante en los pacientes tratados con reemplazo quirúrgico de la válvula aórtica se han asociado con un aumento de las tasas de infarto de miocardio periintervención y de mortalidad posoperatoria temprana22,23. La EC concomitante en la población tratada con TAVI, habitualmente anciana, es frecuente y alcanza un 60%6,24–27. Sin embargo, en este contexto, la evidencia existente sobre la influencia de la EC preexistente en los resultados de la intervención y en la supervivencia a largo plazo tras el TAVI no es concluyente24,26. Aunque algunos estudios han descrito una repercusión significativa en la mortalidad27,28, en otros no se ha observado ningún efecto en los resultados7,25,29. En un metanálisis de 7 estudios en los que participaron 2.472 pacientes, se observó que la presencia de EC no aumenta el riesgo de muerte (odds ratio [OR]=1,0; IC95%, 0,67-1,5)30. La PS-I anatómica ha resultado útil como instrumento para predecir los resultados clínicos de los pacientes sometidos a revascularización, y varios ensayos aleatorizados tanto de ICP como de TAVI se basan en la PS-I o la incluyen en sus algoritmos8,30, entre ellos los ensayos PARTNER-231 y SURTAVI32. Se ha descrito más en detalle la complejidad de la EC de los pacientes tratados con TAVI empleando la PS-I en vez de la simple dicotomía sobre la presencia de EC6,7. Aunque en un estudio unicéntrico se observó que una PS-I > 9 predijo la mortalidad de los pacientes sometidos a TAVI con la válvula Edwards SAPIEN7, Stefanini et al.6 demostraron que los pacientes con PS-I > 22 tenían mayor riesgo de muerte de causa cardiovascular, ictus e infarto de miocardio. Además, el grado y la complejidad de la EC evaluada con la PS-I mostraron asociación con los perfiles de riesgo basales tanto en la población tratada con TAVI como en la tratada con un reemplazo quirúrgico de la válvula aórtica6,31. La PS-II se desarrolló combinando las variables anatómicas (PS-I anatómica y la presencia de enfermedad del tronco coronario izquierdo no protegido) con variables clínicas: edad, aclaramiento de creatinina, fracción de eyección del ventrículo izquierdo, enfermedad vascular periférica, sexo femenino y enfermedad pulmonar obstructiva crónica. La ulterior validación en los registros DELTA32 y CREDO-Kyoto33 puso de manifiesto que la PS-II puede orientar la toma de decisiones mejor que la PS-I original en los pacientes con EC. Dado que la presencia de EC es tan solo un componente de la PS-II y puesto que la EC y la estenosis aórtica tienen fisiopatologías similares1,2, la PS-II podría ser un instrumento útil para predecir los resultados incluso en los pacientes sin EC. En nuestro estudio, se observó mayor valor predictivo de la PS-II, en comparación con la PS-I y la PS-I residual, en cuanto a la mortalidad a los 30 días y al año en los pacientes tratados con TAVI. Esto puede explicarse por el hecho de que todas las variables clínicas incluidas en la PS-II son factores importantes en los resultados obtenidos tras el TAVI34,35, y tienen mayor repercusión en los resultados que la presencia o ausencia de EC. La mala función renal, la fracción de eyección del ventrículo izquierdo baja, la edad, la enfermedad pulmonar obstructiva crónica y la enfermedad vascular periférica se han asociado con peor resultado en la población tratada con TAVI. El sexo femenino es la única variable contradictoria, y es un factor protector tanto en los estudios de la PS-II en la CABG y el TAVI («paradoja de las mujeres») y un factor predictivo de aumento del riesgo en la PS-II para la ICP. Parece que, en esta población anciana, las comorbilidades pueden desempeñar un papel más importante que el grado de EC por lo que respecta a los resultados clínicos. Al evaluar los objetivos en los pacientes con y sin EC utilizando la PS-II, no hubo diferencias significativas entre los grupos, lo cual indica que puede utilizarse en toda la población tratada con TAVI, tenga EC o no. En futuros estudios con la extensión del TAVI a pacientes con un perfil de riesgo inferior, se determinará si el grado y la complejidad de la EC desempeñan un papel más importante en los resultados clínicos en ese contexto.
La PS-II se desarrolló para facilitar el proceso de toma de decisiones para la revascularización coronaria de los pacientes con EC multivaso, por lo que genera una probabilidad de mortalidad en la ICP y la CABG. En nuestro estudio, la PS-II para la ICP predijo mejor la mortalidad a los 30 días y al año. Serán necesarios nuevos análisis para demostrar si este efecto persiste con seguimientos más largos. En el presente estudio, la PS-II para la ICP proporcionó una estratificación de los pacientes tratados con TAVI útil en la predicción de las complicaciones a corto plazo. Es importante señalar que en el tercer tercil hubo unas tasas significativamente elevadas de mortalidad a los 30 días, hemorragias e insuficiencia renal aguda (un ∼12, un 24 y un 32% respectivamente), y ello puede clasificar a estos pacientes en el grupo para el que la intervención se considera inútil. Esto aporta un instrumento adicional para analizar el riesgo y los beneficios de la intervención. Además, la PS-II para la ICP permitió diferenciar a los pacientes del tercil superior con mayor riesgo de eventos adversos cardiovasculares mayores, mortalidad por cualquier causa y mortalidad de causa cardiovascular a los 4 años. Esta estratificación continuó siendo relevante tras introducir un ajuste respecto a otras diferencias significativas en la situación inicial y los factores conocidos que predicen la mortalidad de la población con TAVI.
En la práctica clínica diaria, se utilizan varias puntuaciones de riesgo quirúrgico (en especial la puntuación de la Society of Thoracic Surgeons y el EUROSCORE) para la evaluación del riesgo de los pacientes candidatos a TAVI36. Aunque se emplean en el debate en el seno del Equipo Cardiaco, estas puntuaciones son subóptimas para la evaluación de los pacientes con alto riesgo y enfermedad valvular37–39. Se han elaborado también nuevas puntuaciones de riesgo específicas para TAVI, que tienen poca capacidad pronóstica40–43 y menos penetración que las puntuaciones de riesgo quirúrgico tradicionales en la práctica clínica actual36. Así pues, no se ha desarrollado aún la puntuación óptima para los pacientes tratados con TAVI. En el presente estudio, la capacidad predictiva de la PS-II para la ICP en cuanto a la mortalidad a los 30 días y al año obtuvo ABC de 0,632 y 0,619 respectivamente (p<0,05). Silaschi et al.38 describieron un ABC no significativa para varios factores de riesgo quirúrgicos en una cohorte de 457 pacientes tratados con TAVI. Aunque en nuestro estudio la asociación fue estadísticamente significativa, el valor predictivo continuó siendo discreto y deberán hacerse nuevos intentos para mejorar la evaluación del riesgo clínico en esta población especial. Además, será preciso abordar en ensayos clínicos aleatorizados las repercusiones y el tratamiento de la EC de los pacientes que se someten a TAVI. Mientras tanto, la evaluación clínica, la predicción del riesgo y la estrategia de revascularización antes del TAVI deberán individualizarse en cada paciente. La PS-II es un instrumento adicional, de fácil acceso y útil para predecir los resultados clínicos en los pacientes con estenosis aórtica a los que se practica un TAVI.
LimitacionesEste es un estudio observacional de un solo centro en el que se incluyó únicamente el abordaje transfemoral. En consecuencia, nuestros resultados deberán confirmarse en futuros estudios multicéntricos más amplios y con diferentes abordajes. No obstante, el cálculo de la PS-II en una cohorte de la práctica clínica real podría permitir la extrapolación de los resultados a otras cohortes. La revascularización coronaria se realizó según la decisión del Equipo Cardiaco, y ello puede introducir un sesgo en el análisis y en los resultados. La PS-II se desarrolló en una población de pacientes totalmente diferente de la sometida a TAVI, y no se diseñó específicamente para evaluar los resultados en este contexto, lo cual constituye una limitación para el análisis. Sin embargo, la mayor parte de las puntuaciones de riesgo actualmente utilizadas no se han diseñado para pacientes candidatos a TAVI.
CONCLUSIONESLa PS-II ICP parece ser un instrumento útil para predecir los resultados tras el TAVI. Un aumento de la PS-II se asoció con peor resultado clínico al año y a los 4 años del TAVI. Los pacientes con PS-II > 44 tienen más riesgo de muerte de causa cardiovascular, ictus o infarto de miocardio que los pacientes con PS-II<44, independientemente de la presencia de EC.
CONFLICTO DE INTERESESL. Nombela-Franco es proctor de Abbott.
- –
A menudo la estenosis aórtica coexiste con la EC, y el reemplazo quirúrgico de la válvula aórtica combinada con CABG aumenta la mortalidad y la morbilidad periintervención. No hay datos concluyentes sobre las repercusiones de la EC en los pacientes sometidos a TAVI. Se ha investigado la puntuación SYNTAX anatómica como posible instrumento para predecir los eventos adversos cardiovasculares mayores en los pacientes sometidos a TAVI, pero su valor predictivo es muy escaso.
- –
La PS-II, que agrega variables clínicas a las de la gravedad de la EC cuantificada mediante angiografía, fue superior a la PS en la predicción de la mortalidad a los 30 días y al año en los pacientes con estenosis aórtica tratados con TAVI. Los valores crecientes de la PS-II se asociaron con un aumento de los eventos adversos cardiovasculares mayores, la mortalidad por cualquier causa y la muerte cardiaca en la población tratada con TAVI, independientemente de la presencia de EC. En los pacientes con PS-II > 44, se observó un aumento independiente de ∼2 veces en el riesgo de eventos adversos cardiovasculares mayores y de mortalidad por cualquier causa al año y a los 4 años, en comparación con los pacientes con PS-II<37,4. La PS-II es un parámetro de fácil acceso y sencillo de calcular que puede ser una adición útil para la evaluación del riesgo de los pacientes que se someten a TAVI.