El oxigenador extracorpóreo de membrana (ECMO) ha demostrado ser una terapia eficaz que proporciona asistencia pulmonar y circulatoria de emergencia a pacientes en shock cardiogénico refractario a terapia intensiva convencional o insuficiencia respiratoria hipóxica-hipercápnica resistente a estrategias de ventilación avanzadas1,2.
Actualmente, esta terapia está limitada a algunos centros terciarios especializados con posibilidades para implantar sistemas de ECMO y experiencia en su manejo. En hospitales sin cirugía cardiaca ni posibilidades de ECMO, el tratamiento de pacientes en shock cardiogénico refractario es muy difícil. El traslado a centros con más dotación técnica sería su única alternativa, pero esta opción a menudo se considera inviable debido a su inestabilidad hemodinámica. Experiencias recientes confirman que la creación de unidades móviles de cirugía cardiaca que implanten una asistencia al paciente in situ, seguida de estabilización y transporte a un centro especializado, permite ofrecer una posibilidad de supervivencia a estos pacientes críticos3–5.
El objetivo del presente estudio es evaluar la factibilidad y la seguridad de un programa de transporte interhospitalario de pacientes críticos con soporte de ECMO. Se describen los problemas logísticos, las indicaciones, las complicaciones y la evolución de los pacientes incluidos.
El Servicio de Cirugía Cardio-Torácica del Hospital Universitario J.W. Goethe de Frankfurt desarrolló una Unidad de Asistencia Cardiaca a Distancia, para facilitar el soporte circulatorio con ECMO a instituciones del área de Hessen que carecían de dicha posibilidad terapéutica. La unidad se creó en diciembre de 2011 y está compuesta por un perfusionista y un cirujano cardiaco de guardia ininterrumpida que mantienen contacto directo con unidades de críticos de hospitales secundarios.
La indicación para el implante de asistencias venoarteriales se realizó en casos de shock cardiogénico refractario al tratamiento convencional de cuidados críticos (presión arterial sistólica menor que 80 mmHg, empleo de al menos 2 agentes inotrópicos y/o balón de contrapulsación y signos de perfusión inadecuada)1,2. El soporte con ECMO venovenoso se indicó en casos de insuficiencia respiratoria hipóxica-hipercápnica resistente a estrategias de ventilación avanzadas (síndrome de distrés respiratorio)1,6.
El sistema extracorpóreo empleado fue el PLS System (Maquet AG; Alemania) y constaba de un circuito cerrado de polivinilo, un oxigenador de membrana y una bomba centrífuga. Para su conexión al paciente, se utilizaron cánulas percutáneas venosas (17-25 Fr) y cánulas arteriales (18-21 Fr). En los casos de insuficiencia respiratoria sola, el ECMO venovenoso se estableció mediante la inserción según técnica de Seldinger de sendas cánulas en ambas venas femorales, alojándose una cánula en aurícula derecha (flujo de salida) y otra en cava inferior (flujo de entrada). En los casos de shock cardiogénico el ECMO venoarterial se implantó mediante abordaje quirúrgico en el surco deltopectoral accediendo a la arteria axilar para conectar la línea arterial y una cánula venosa insertada percutáneamente en cava inferior. Los procedimientos se realizaron con anestesia general en la misma cama de la unidad de cuidados intensivos y tras administrar 10.000 U de heparina.
De diciembre de 2011 a abril de 2013, 10 pacientes en estado crítico (8 varones, 2 mujeres), con una media de edad de 46,7 ± 15,3 (intervalo, 18-61) años, requirieron el soporte con ECMO en hospitales secundarios de Hessen, a los que se trasladó a nuestro centro tras el implante. El trasporte interhospitalario fue realizado en todos los casos por vía terrestre en unidad móvil de cuidados intensivos. El tiempo de preparación del equipo de asistencia cardiaca fue 25 min y entre llamada e implante, 90 min.
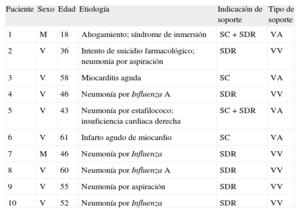
Las características demográficas de los pacientes y las causas que generaron la necesidad de soporte cardiopulmonar se resumen en la tabla 1; 6 pacientes presentaban solo insuficiencia pulmonar grave, y en ellos se implantó un ECMO venovenoso; 2 pacientes estaban en insuficiencia cardiopulmonar y se los trató mediante implante de ECMO venoarterial, y se asistió a 2 pacientes en shock cardiogénico con ECMO venoarterial. Después de establecer la indicación de soporte y tipo de asistencia, los pacientes fueron conectados al circuito ECMO. La canulación percutánea venosa se realizó sin incidentes en todos los casos; en 4 pacientes se precisó abordaje quirúrgico de la arteria axilar, sin observarse complicaciones.
Características demográficas de los pacientes incluidos. Causas de la insuficiencia cardiorrespiratoria. Indicaciones de ECMO y tipo de soporte con ECMO
| Paciente | Sexo | Edad | Etiología | Indicación de soporte | Tipo de soporte |
| 1 | M | 18 | Ahogamiento; síndrome de inmersión | SC + SDR | VA |
| 2 | V | 36 | Intento de suicidio farmacológico; neumonía por aspiración | SDR | VV |
| 3 | V | 58 | Miocarditis aguda | SC | VA |
| 4 | V | 46 | Neumonía por Influenza A | SDR | VV |
| 5 | V | 43 | Neumonía por estafilococo; insuficiencia cardiaca derecha | SC + SDR | VA |
| 6 | V | 61 | Infarto agudo de miocardio | SC | VA |
| 7 | M | 46 | Neumonía por Influenza | SDR | VV |
| 8 | V | 60 | Neumonía por Influenza A | SDR | VV |
| 9 | V | 55 | Neumonía por aspiración | SDR | VV |
| 10 | V | 52 | Neumonía por Influenza | SDR | VV |
ECMO: oxigenador extracorpóreo de membrana; M: mujer; SC: shock cardiogénico; SDR: síndrome de distrés respiratorio; V: varón; VA: ECMO venoarterial; VV: ECMO venovenoso.
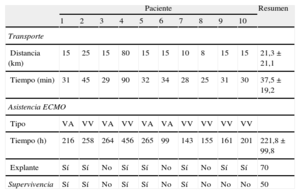
Según se expone en la tabla 2, la media de distancia de transporte fue 21 (8-80) km y la del tiempo de transporte de unidad a unidad, 37 (25-90) min. No hubo complicaciones logísticas o técnicas relacionadas con el dispositivo durante el implante o el traslado. Los pacientes no sufrieron complicaciones ni morbimortalidad relacionada con el transporte.
Distancias y tiempos del transporte interhospitalario de pacientes críticos en soporte con ECMO. Tipo de asistencia con ECMO implantada y duración de la asistencia. Evolución postoperatoria de los pacientes
| Paciente | Resumen | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| Transporte | |||||||||||
| Distancia (km) | 15 | 25 | 15 | 80 | 15 | 15 | 10 | 8 | 15 | 15 | 21,3 ± 21,1 |
| Tiempo (min) | 31 | 45 | 29 | 90 | 32 | 34 | 28 | 25 | 31 | 30 | 37,5 ± 19,2 |
| Asistencia ECMO | |||||||||||
| Tipo | VA | VV | VA | VV | VA | VA | VV | VV | VV | VV | |
| Tiempo (h) | 216 | 258 | 264 | 456 | 265 | 99 | 143 | 155 | 161 | 201 | 221,8 ± 99,8 |
| Explante | Sí | Sí | No | Sí | Sí | No | Sí | No | Sí | Sí | 70 |
| Supervivencia | Sí | Sí | No | Sí | Sí | No | Sí | No | No | No | 50 |
ECMO: oxigenador extracorpóreo de membrana; VA: ECMO venoarterial; VV: ECMO venovenoso.
Los datos expresan % o media ± desviación estándar.
La evolución postoperatoria de los pacientes se resume en la tabla 2. El sistema ECMO se pudo explantar después de una media de apoyo de 9,7 (4-19) días. La tasa de «destete» con éxito fue del 70% (7/10) y la supervivencia al alta hospitalaria, del 50%. La mortalidad hospitalaria fue similar a la observada en 119 pacientes que recibieron un ECMO en nuestro centro durante el mismo periodo (51%).
Podemos concluir que, en nuestra experiencia, el implante de emergencia de asistencia cardiopulmonar tipo ECMO en instituciones externas y el posterior traslado de estos pacientes a centros de referencia regionales son factibles en la práctica, con resultados razonables a medio plazo.