Los inhibidores del cotransportador de sodio-glucosa 2 (iSGLT2) y los agonistas del receptor del péptido 1 similar al glucagón (GLP1ra) reducen los eventos cardiovasculares a través de diferentes mecanismos. Sin embargo, se necesita esclarecer su asociación con cáncer. Nuestro objetivo consiste en comparar el tratamiento combinado (SGLT2i y GLP1ra) con la monoterapia (SGLT2i o GLP1ra) en cuanto a hospitalización o muerte por cáncer en una población general y un subgrupo de pacientes con enfermedad cardiovascular (ECV).
MétodosEstudio observacional prospectivo no concurrente de pacientes a quienes se prescribió iSGLT2, GLP1ra o ambos. Se obtuvo la puntuación de propensión multinomial de toda la población y de un subgrupo de pacientes con ECV. El análisis multivariado de regresión de Cox determinó la tasa de riesgos (HR) de edad, sexo, factores de riesgo y tratamiento para cada resultado.
ResultadosSe incluyó a 14.709 pacientes (11.366 con iSGLT2, 1.016 con GLP1ra y 2.327 con ambos tratamientos) desde el inicio del tratamiento. El 97% de los pacientes eran diabéticos. El subgrupo con ECV incluyó a 4.957 (33,7%) pacientes. Después de una mediana de seguimiento de 33 meses, el riesgo de eventos adversos de cáncer fue similar entre los pacientes con y sin ECV (el 3,4 y el 3,7% respectivamente). El sexo (varones) y la edad fueron los principales factores de riesgo de mortalidad por cáncer. El tratamiento combinado y su duración habían reducido el riesgo de mortalidad por cáncer con respecto a la monoterapia con iSGLT2 o GLP1ra en todas las poblaciones (HR=0,2216; IC95%, 0,1106-0,4659; p<0,001; y HR=0,1928; IC95%, 0,071-0,5219; p=0,001) y en el subgrupo de pacientes con ECV (HR=0,2879; IC95%, 0,0878-0,994; p<0,049; y HR=0,1329; IC95%, 0,024-0,6768; p=0,014).
ConclusionesEl inicio del tratamiento combinado (iSGLT2 y GLP1ra) frente a monoterapia con iSGLT2 o GLP1ra se asoció con una menor tasa de riesgo de mortalidad por cáncer, principalmente en pacientes diabéticos con o sin ECV. Aunque se necesitan ensayos clínicos, los mecanismos complementarios antiproliferativos, antiinflamatorios y metabólicos de estos fármacos podrían explicar estos resultados. Futuros ensayos clínicos y estudios mecanísticos aclararán el posible papel de estos fármacos en la carcinogénesis.
Palabras clave
La obesidad es un factor de riesgo de varios cánceres importantes, como los de mama, aparato digestivo, riñón y aparato urinario. Un alto contenido de grasa corporal puede aumentar el riesgo de mortalidad por cáncer1 en un 17% a través de mecanismos como la inflamación crónica, el estrés oxidativo, la resistencia a la insulina, la actividad de adipocinas, la transición epitelio-mesénquima y el estrés del retículo endoplásmico2,3. Estos mecanismos son comunes a los de la diabetes, la cual puede incrementar también la mortalidad por cáncer4.
Los agonistas del receptor 1 del péptido similar al glucagón (GLP1ra) y los inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2) han mostrado reducciones del tejido adiposo5,6 y mejoras en el metabolismo, incluida una normalización de la glucemia7.
Algunos estudios observacionales han confirmado que, en comparación con otros fármacos antidiabéticos, los GLP1ra reducen los eventos hepáticos8 en los pacientes con diabetes y reducen el riesgo de cáncer colorrectal9 y de próstata10 en los pacientes con obesidad o sobrepeso. A través de la transducción de señal de PI3K/Akt/mTOR, los GLP1ra pueden inducir una apoptosis de las células cancerosas e inhibir su proliferación y migración11. Se ha descrito una actividad antiproliferativa similar de los iSGLT212,13 y los GLP1ra14. Su papel en la reducción de la captación de glucosa por las células cancerosas indicaba mecanismos atractivos y protectores frente a la proliferación de estas15. Los estudios observacionales de pacientes diabéticos con cáncer y tratamiento con iSGLT2 han mostrado también mejoras de la supervivencia global16. Los iSGLT2 pueden reducir los eventos clínicos en los pacientes con una disfunción cardiaca causada por el tratamiento oncológico17. Aunque estos resultados indican un mecanismo de daño de las células cancerosas, es posible que un mecanismo protector mejore la supervivencia de las células cardiacas frente a los tratamientos antineoplásicos.
Un estudio de cohorte en la práctica clínica real indica un mayor riesgo de cáncer de tiroides en los pacientes tratados con GLP1ra18 y mayor riesgo de cáncer de vejiga en los tratados con iSGLT219. Estos datos contradictorios podrían explicarse por factores de confusión20.
Los 2 tratamientos son complementarios. Mientras que los GLP1ra aumentan la secreción de insulina y la actividad de esta, los iSGLT2 reducen la reabsorción de la glucosa plasmática en el túbulo proximal21. La enfermedad cardiovascular (ECV) y el cáncer son las principales causas de muerte en todo el mundo, y el metabolismo de la glucosa y la obesidad desempeñan un papel importante en ello. Nuestros datos previos apuntaban a un efecto beneficioso del tratamiento combinado con iSGLT2 y GLP1ra en la insuficiencia cardiaca (IC) y en la mortalidad por cualquier causa22. Sin embargo, no hay evidencia disponible respecto a los eventos adversos de cáncer.
MÉTODOSOrígenes de los datosLos registros utilizados se codificaron sin incluir ningún dato personal, y no fue necesario un consentimiento informado tras la aprobación del estudio por el Comité Ético de Investigación Clínica de Galicia (código: 2023/239) según lo establecido en el Reglamento General de Protección de Datos.
La base de datos se diseñó utilizando los registros de atención primaria y hospitalaria que proporcionan una cobertura de asistencia sanitaria a un total de 446.603 habitantes. Los datos se obtuvieron mediante tecnologías de big data a partir de las historias clínicas electrónicas de la población, según lo ya descrito23.
Los criterios de inclusión fueron los de todos los pacientes de nuestra área de salud, de edad igual o superior a 18 años que estuvieran siendo tratados con iSGLT2, GLP1ra o ambos tipos de fármacos al mismo tiempo, entre enero de 2018 y el 30 de junio de 2022, y que hubieran sido objeto de seguimiento hasta octubre de 2022.
Los criterios de exclusión fueron los antecedentes de cualquier cáncer o los registros electrónicos externos al sistema de salud pública.
Las variables clínicas fueron los datos demográficos (sexo y edad), los antecedentes clínicos personales, incluidos los factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, dislipemia, obesidad o sobrepeso), los trastornos de ECV como fibrilación auricular (FA), IC, enfermedad coronaria (EC), enfermedad arterial periférica o ictus, y la duración del tratamiento. Todas las enfermedades se clasificaron según la Clasificación Internacional de Enfermedades, 10.a Revisión (CIE-10).
La clasificación del cáncer se definió según los órganos y sistemas: sangre y hematología, cerebro y sistema nervioso, mama, digestivos, endocrinos, cabeza y cuello, aparato locomotor, renales y genitourinarios, respiratorios, cutáneos. Los cánceres raros que no encajaban en estas clasificaciones se incluyeron en la categoría de «otros».
Diseño del estudioEste estudio observacional, no concurrente, incluyó a pacientes de una sola área de salud de España (Santiago de Compostela-Barbanza), que consta de 4 hospitales públicos y 75 centros de asistencia sanitaria. Se llevó a cabo un seguimiento de los pacientes desde la fecha índice de inicio del tratamiento con un fármaco hipoglucemiante (FHG) hasta el 31 de octubre de 2022 o la muerte del paciente (figura 1), con independencia de que la causa de la muerte fuera o no un cáncer, según lo recomendado en un estudio estadístico previo24.
ObjetivosLos 3 objetivos principales fueron: a) hospitalización por cualquier cáncer, b) muerte por cualquier cáncer, y c) hospitalización o muerte por cualquier cáncer, según los códigos de la CIE-10 en la población incluida y en el subgrupo de pacientes con ECV. La hospitalización por cáncer incluyó todas las hospitalizaciones relacionadas con cualquier cáncer, incluido el primer diagnóstico de cáncer y las hospitalizaciones urgentes o programadas; no se tuvieron en cuenta las hospitalizaciones cuya causa principal fueran otros diagnósticos (p. ej., hemorragia digestiva) sin ningún riesgo competidor. La mortalidad por cualquier causa incluyó la mortalidad tanto hospitalaria como extrahospitalaria relacionada con cualquier cáncer. Los eventos de cáncer incluyeron cualquiera de los 3 objetivos principales.
Los datos epidemiológicos y administrativos se obtuvieron de la base de datos de asistencia sanitaria y de las historias clínicas electrónicas, utilizando los códigos de la CIE-10 para la información relativa al cáncer y las hospitalizaciones, y los códigos de la Clasificación Internacional de Atención Primaria (CIAP-2) para los antecedentes patológicos personales. Las causas de mortalidad se incorporaron a la base de datos de asistencia sanitaria a partir de los registros de mortalidad hospitalaria y extrahospitalaria. La información sobre el cáncer se obtuvo de las historias clínicas electrónicas documentadas con los códigos de la CIAP-2 en la atención primaria o los códigos de la CIE-10 para los pacientes hospitalizados, así como de la asistencia ambulatoria de los departamentos de oncología y radioterapia25.
Análisis estadísticoDatos descriptivosLas variables discretas se presentan en forma de porcentajes (%) y las cuantitativas, en forma de mediana [intervalo intercuartílico] o media±desviación estándar, en función de la normalidad de su distribución, que se verificó con la prueba de Kolmogorov-Smirnov.
Diferencias entre los gruposDespués de dividir la población según el tratamiento con FHG (iSGLT2 y GLP1ra), se determinaron las diferencias en las principales variables incluidas mediante la prueba de F o la prueba de Wilcoxon en las variables discretas o continuas respectivamente.
Puntuación de propensión y factores predictivos de los eventosUtilizamos Toolkit para la ponderación y el análisis de los grupos no equivalentes, y específicamente TWANG versión 2.6 en R para realizar una ponderación con puntuación de propensión multinomial para el manejo de los 3 grupos de tratamiento (iSGLT2, GLP1ra y ambos tratamientos). El ajuste incluyó las siguientes variables en los tres grupos: sexo, edad, obesidad, diabetes mellitus, hipertensión arterial, dislipemia, EC, IC, FA e ictus.
Se evaluaron los estadígrafos de equilibrio mediante la diferencia media estandarizada, también denominada sesgo estandarizado absoluto o magnitud del efecto, y con el estadígrafo de Kolmogorov-Smirnov. Se consideró un valor umbral de 0,1 para la diferencia media estandarizada para evaluar el equilibrio entre los grupos26. Esta metodología se aplicó de modo similar a los pacientes con ECV.
Supervivencia sin eventosSe utilizó un análisis de regresión de Cox multivariante para evaluar la repercusión de varias variables en la hospitalización o la muerte por cualquier cáncer. Las variables incluidas en el análisis fueron las siguientes: sexo, edad, obesidad, diabetes mellitus, hipertensión arterial, dislipemia, EC, IC, FA, ictus, tipo de tratamiento y duración del tratamiento. Se calcularon los valores de hazard ratio (HR) y sus correspondientes intervalos de confianza del 95% (IC95%) para cuantificar el efecto de cada variable. Estos resultados se visualizaron mediante gráficos de bosque y gráficos de supervivencia.
Los análisis se llevaron a cabo con el paquete estadístico R versión 4.2.3. Se aplicó la misma metodología para analizar a los pacientes con ECV, asegurando la evaluación completa de las repercusiones de estas variables en los diferentes grupos de pacientes.
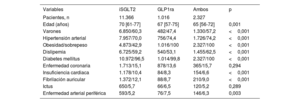
RESULTADOSCaracterísticas clínicas de los pacientes incluidosDe los 15.549 pacientes tratados con iSGLT2, GLP1ra o ambos tipos de fármacos, 14.709 no tenían antecedentes de cáncer. La población era predominantemente masculina (58,9%), con altas prevalencias de obesidad (55,9%), hipertensión arterial (71%), dislipemia (59,3%) y diabetes mellitus (97,3%). Además, un 15,1% tenía EC; un 9,6%, IC; un 11,4%, FA; un 5,7% había sufrido un ictus, y un 5,5% tenía una enfermedad arterial periférica (EAP). La mediana de edad de la población era 69 [60-76] años, y la mediana de duración del tratamiento, 14 [5-35] meses. En un 33,7% (n=4.957) de los pacientes incluidos había alguna forma de ECV (EC, IC, FA, ictus o EAP).
Se llevó a cabo un análisis de puntuación de propensión multinomial tras verificar la ausencia de diferencias estadísticamente significativas en las características clínicas entre los grupos de tratamiento (tabla 1). Los iSGLT2 fueron la medicación prescrita con más frecuencia (78,7%), seguidos del tratamiento combinado de iSGLT2 y GLP1ra (14,9%) y de los GLP1ra solos (6,4%). La media de duración del seguimiento fue de 33 meses.
Características clínicas según el tratamiento
| Variables | iSGLT2 | GLP1ra | Ambos | p |
|---|---|---|---|---|
| Pacientes, n | 11.366 | 1.016 | 2.327 | |
| Edad (años) | 70 [61-77] | 67 [57-75] | 65 [56-72] | 0,001 |
| Varones | 6.850/60,3 | 482/47,4 | 1.330/57,2 | <0,001 |
| Hipertensión arterial | 7.957/70,0 | 756/74,4 | 1.726/74,2 | <0,001 |
| Obesidad/sobrepeso | 4.873/42,9 | 1.016/100 | 2.327/100 | <0,001 |
| Dislipemia | 6.725/59,2 | 540/53,1 | 1.455/62,5 | <0,001 |
| Diabetes mellitus | 10.972/96,5 | 1.014/99,8 | 2.327/100 | <0,001 |
| Enfermedad coronaria | 1.713/15,1 | 878/13,6 | 365/15,7 | 0,294 |
| Insuficiencia cardiaca | 1.178/10,4 | 84/8,3 | 154/6,6 | <0,001 |
| Fibrilación auricular | 1.372/12,1 | 88/8,7 | 210/9,0 | <0,001 |
| Ictus | 650/5,7 | 66/6,5 | 120/5,2 | 0,289 |
| Enfermedad arterial periférica | 593/5,2 | 76/7,5 | 146/6,3 | 0,003 |
GLP1ra: agonistas del receptor 1 del péptido similar al glucagón; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
Los valores expresan n/% o mediana [intervalo intercuartílico].
Los iSGLT2 prescritos con más frecuencia fueron empagliflozina (n=6.056), dapagliflozina (n=5.802) y canagliflozina (n=1.778). Tan solo 24 pacientes fueron tratados con ertugliflozina. De entre los GLP1ra, los más prevalentes fueron la dulaglutida (n=1.864), la semaglutida (n=934), la liraglutida (n=400) y la exenatida (n=214). Tan solo 24 pacientes fueron tratados con lixisenatida.
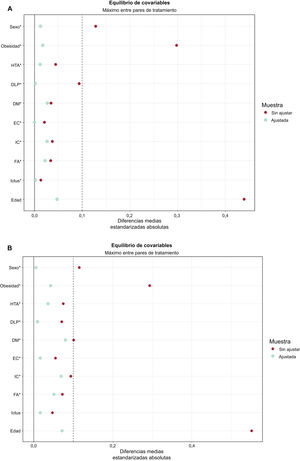
Puntuación de propensión multinomialLos valores de media, desviación estándar y magnitud del efecto estandarizada estaban bien equilibrados en los grupos emparejados. La diferencia media absoluta de todas las variables incluidas fue <0,1. Se presentó el equilibrio de las covariables antes y después del ajuste en gráficos de amor (love plots) para todos los pacientes incluidos y para los pacientes con ECV (figuras 2A y B respectivamente).
Los gráficos de amor (love plots) muestran las diferencias medias estandarizadas para todas las covariables en la población (A) o en los pacientes con ECV (B), antes y después de un ajuste mediante puntuación de propensión multinomial. DLP: dislipemia; DM: diabetes mellitus; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FA: fibrilación auricular; HTA: hipertensión arterial; IC: insuficiencia cardiaca.
Se registraron eventos adversos de cáncer, incluidos los de hospitalización por cáncer, los de mortalidad por cáncer y los eventos combinados, en 514 de un total de 14.709 pacientes (3,5%). Los tipos de cáncer más prevalentes fueron los digestivos (38%) y los renales-genitourinarios (24%). El cáncer del aparato respiratorio supuso un 11%, el cáncer de mama, un 6% y otros tipos fueron menos frecuentes.
Concretamente, la hospitalización por cáncer se produjo en el 3,2, el 3,9 y el 3,1% de los pacientes tratados con iSGLT2, GLP1ra o un tratamiento combinado respectivamente. Las tasas de mortalidad por cáncer fueron del 0,9, el 1,0 y el 0,4%. La combinación de hospitalización o muerte por cáncer se produjo en el 3,5, el 3,9 y el 3,2%.
Al considerar únicamente a los pacientes con antecedentes de ECV, los porcentajes de los objetivos observados fueron: el 3,3, el 4,1 y el 3,2% en hospitalización por cáncer; el 0,8, el 1,6 y el 0,4% en mortalidad por cáncer, y el 3,8, el 4,1 y el 3,2% en la combinación de hospitalización o muerte por cáncer de los pacientes tratados con iSGLT2, GLP1ra o un tratamiento combinado respectivamente.
El porcentaje de eventos de cáncer fue similar entre los pacientes con y sin ECV (el 3,4 y el 3,7%).
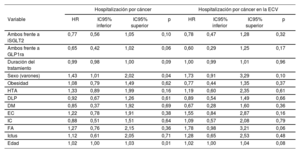
El análisis de regresión de Cox multivariante reveló que el sexo masculino y la edad se asocian con un aumento del riesgo de hospitalización por cáncer (hazard ratio [HR]=1,4439; intervalo de confianza del 95% [IC95%], 1,193-1,735; y HR=1,0329; IC95%, 1,020-1,0438). Sin embargo, el tratamiento combinado y su duración mostraron reducción del riesgo, aunque sin significación estadística (tabla 2). Estas asociaciones no se observaron en el subgrupo de pacientes con ECV.
Análisis de regresión de Cox multivariante. Hospitalización por cáncer
| Hospitalización por cáncer | Hospitalización por cáncer en la ECV | |||||||
|---|---|---|---|---|---|---|---|---|
| Variable | HR | IC95% inferior | IC95% superior | p | HR | IC95% inferior | IC95% superior | p |
| Ambos frente a iSGLT2 | 0,77 | 0,56 | 1,05 | 0,10 | 0,78 | 0,47 | 1,28 | 0,32 |
| Ambos frente a GLP1ra | 0,65 | 0,42 | 1,02 | 0,06 | 0,60 | 0,29 | 1,25 | 0,17 |
| Duración del tratamiento | 0,99 | 0,98 | 1,00 | 0,09 | 1,00 | 0,99 | 1,01 | 0,96 |
| Sexo (varones) | 1,43 | 1,01 | 2,02 | 0,04 | 1,73 | 0,91 | 3,29 | 0,10 |
| Obesidad | 1,08 | 0,79 | 1,49 | 0,62 | 0,77 | 0,44 | 1,35 | 0,37 |
| HTA | 1,33 | 0,89 | 1,99 | 0,16 | 1,19 | 0,60 | 2,35 | 0,61 |
| DLP | 0,92 | 0,67 | 1,26 | 0,61 | 0,89 | 0,54 | 1,49 | 0,66 |
| DM | 0,85 | 0,37 | 1,92 | 0,69 | 0,67 | 0,28 | 1,60 | 0,36 |
| EC | 1,22 | 0,78 | 1,91 | 0,38 | 1,55 | 0,84 | 2,87 | 0,16 |
| IC | 0,88 | 0,51 | 1,51 | 0,64 | 1,09 | 0,57 | 2,08 | 0,79 |
| FA | 1,27 | 0,76 | 2,15 | 0,36 | 1,78 | 0,98 | 3,21 | 0,06 |
| Ictus | 1,12 | 0,61 | 2,05 | 0,71 | 1,28 | 0,65 | 2,53 | 0,48 |
| Edad | 1,02 | 1,00 | 1,03 | 0,01 | 1,02 | 1,00 | 1,04 | 0,08 |
DLP: dislipemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FA: fibrilación auricular; GLP1ra: agonistas del receptor 1 de péptido similar al glucagón; HR: hazard ratio; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
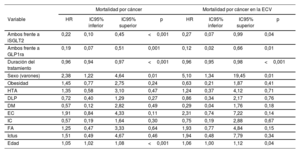
Por lo que respecta a la mortalidad por cáncer, el sexo masculino y la edad se identificaron también como factores de riesgo significativos (HR=2,3488; IC95%, 1,2327-4,645; y HR=1,054; IC95%, 1,024-1,085). En cambio, se observó un riesgo inferior con el tratamiento combinado y su duración en comparación con los iSGLT2 o los GLP1ra solos (tabla 3) en la población total (HR=0,222; IC95%, 0,1106-0,4596; p<0,001; y HR=0,193; IC95%, 0,071-0,5219; p=0,001) y en el subgrupo de pacientes con ECV (HR = 0,2879; IC95%, 0,0878-0,994; p<0,049; y HR=0,1329; IC95%, 0,024-0,6768; p=0,014). Se observaron resultados similares por lo que respecta a la hospitalización y a la muerte por cualquier causa oncológica (tabla 4).
Análisis de regresión de Cox multivariante. Mortalidad por cáncer
| Mortalidad por cáncer | Mortalidad por cáncer en la ECV | |||||||
|---|---|---|---|---|---|---|---|---|
| Variable | HR | IC95% inferior | IC95% superior | p | HR | IC95% inferior | IC95% superior | p |
| Ambos frente a iSGLT2 | 0,22 | 0,10 | 0,45 | <0,001 | 0,27 | 0,07 | 0,99 | 0,04 |
| Ambos frente a GLP1ra | 0,19 | 0,07 | 0,51 | 0,001 | 0,12 | 0,02 | 0,66 | 0,01 |
| Duración del tratamiento | 0,96 | 0,94 | 0,97 | <0,001 | 0,96 | 0,95 | 0,98 | <0,001 |
| Sexo (varones) | 2,38 | 1,22 | 4,64 | 0,01 | 5,10 | 1,34 | 19,45 | 0,01 |
| Obesidad | 1,45 | 0,77 | 2,75 | 0,24 | 0,63 | 0,21 | 1,87 | 0,41 |
| HTA | 1,35 | 0,58 | 3,10 | 0,47 | 1,24 | 0,37 | 4,12 | 0,71 |
| DLP | 0,72 | 0,40 | 1,29 | 0,27 | 0,86 | 0,34 | 2,17 | 0,76 |
| DM | 0,57 | 0,12 | 2,82 | 0,49 | 0,29 | 0,04 | 1,76 | 0,18 |
| EC | 1,91 | 0,84 | 4,33 | 0,11 | 2,31 | 0,74 | 7,22 | 0,14 |
| IC | 0,57 | 0,19 | 1,64 | 0,30 | 0,75 | 0,19 | 2,88 | 0,67 |
| FA | 1,25 | 0,47 | 3,33 | 0,64 | 1,93 | 0,77 | 4,84 | 0,15 |
| Ictus | 1,51 | 0,49 | 4,67 | 0,46 | 1,94 | 0,48 | 7,79 | 0,34 |
| Edad | 1,05 | 1,02 | 1,08 | <0,001 | 1,06 | 1,00 | 1,12 | 0,04 |
DLP: dislipemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FA: fibrilación auricular; GLP1ra: agonistas del receptor 1 de péptido similar al glucagón; HR: hazard ratio; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
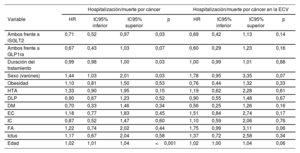
Análisis de regresión de Cox multivariante. Hospitalización y mortalidad por cáncer
| Hospitalización/muerte por cáncer | Hospitalización/muerte por cáncer en la ECV | |||||||
|---|---|---|---|---|---|---|---|---|
| Variable | HR | IC95% inferior | IC95% superior | p | HR | IC95% inferior | IC95% superior | p |
| Ambos frente a iSGLT2 | 0,71 | 0,52 | 0,97 | 0,03 | 0,69 | 0,42 | 1,13 | 0,14 |
| Ambos frente a GLP1ra | 0,67 | 0,43 | 1,03 | 0,07 | 0,60 | 0,29 | 1,23 | 0,16 |
| Duración del tratamiento | 0,99 | 0,98 | 1,00 | 0,03 | 1,00 | 0,99 | 1,01 | 0,88 |
| Sexo (varones) | 1,44 | 1,03 | 2,01 | 0,03 | 1,78 | 0,95 | 3,35 | 0,07 |
| Obesidad | 1,10 | 0,81 | 1,50 | 0,53 | 0,76 | 0,44 | 1,32 | 0,33 |
| HTA | 1,33 | 0,90 | 1,95 | 0,15 | 1,19 | 0,62 | 2,28 | 0,61 |
| DLP | 0,90 | 0,67 | 1,23 | 0,52 | 0,90 | 0,55 | 1,48 | 0,67 |
| DM | 0,70 | 0,33 | 1,46 | 0,34 | 0,56 | 0,25 | 1,26 | 0,16 |
| EC | 1,18 | 0,77 | 1,83 | 0,45 | 1,51 | 0,84 | 2,74 | 0,17 |
| IC | 0,87 | 0,52 | 1,47 | 0,60 | 1,10 | 0,59 | 2,06 | 0,76 |
| FA | 1,22 | 0,74 | 2,02 | 0,44 | 1,75 | 0,99 | 3,11 | 0,06 |
| Ictus | 1,17 | 0,67 | 2,04 | 0,58 | 1,37 | 0,72 | 2,58 | 0,34 |
| Edad | 1,02 | 1,01 | 1,04 | <0,001 | 1,02 | 1,00 | 1,04 | 0,06 |
DLP: dislipemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FA: fibrilación auricular; GLP1ra: agonistas del receptor 1 de péptido similar al glucagón; HR: hazard ratio; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
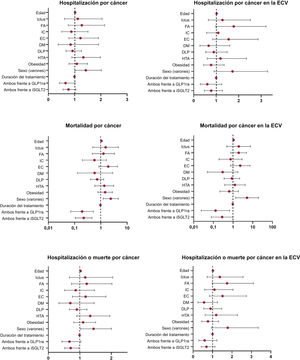
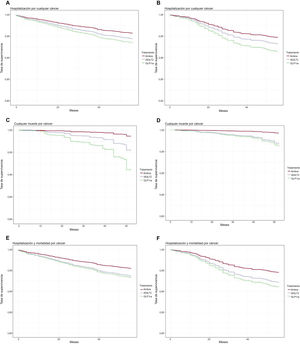
Los resultados del análisis de regresión de Cox multivariante se visualizaron con gráficos de bosque (figura 3). El análisis de la supervivencia indicó que no hubo una reducción significativa en la tasa de hospitalizaciones por cualquier cáncer entre los pacientes de la población total que recibieron el tratamiento combinado en comparación con los tratados con iSGLT2 o GLP1ra solos (figura 4A) ni tampoco en el subgrupo de pacientes con ictus (figura 4B).
Los gráficos de bosque (forest plots) muestran los valores de hazard ratio y su intervalo de confianza del 95% de cada factor para la hospitalización por cáncer en la población total (A) y los pacientes con ECV (B), para la mortalidad por cáncer en la población total (C) y los pacientes con ECV (D) y para la hospitalización o muerte por cáncer en la población total (E) y los pacientes con ECV (F). DLP: dislipemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FA: fibrilación auricular; GLP1ra: agonistas del receptor 1 del péptido similar al glucagón; HR: hazard ratio; HTA: hipertensión arterial; IC: insuficiencia cardiaca; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
Curva de supervivencia de la regresión de Cox en los grupos de tratamiento con iSGLT2, con GLP1ra y tratamiento combinado, para la hospitalización por cáncer en la población total (A) y los pacientes con ECV (B), para la mortalidad por cáncer en la población total (C) y los pacientes con ECV (D) y para la hospitalización o la muerte por cáncer en la población total (E) y los pacientes con ECV (F). GLP1ra: agonistas del receptor 1 del péptido similar al glucagón; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
Sin embargo, se observó una tasa de supervivencia por cualquier cáncer superior entre los pacientes que recibieron el tratamiento combinado en comparación con los tratados con iSGLT2 o GLP1ra solos, tanto en la población total (figura 4C) como en el subgrupo de pacientes con ECV (figura 4D).
Además, se observó un riesgo inferior de hospitalización o muerte por cualquier cáncer entre los pacientes que recibieron el tratamiento combinado en comparación con los tratados con iSGLT2 solos de la población total (figura 4E). Este efecto no se observó en el subgrupo de pacientes con ECV (figura 4G).
DISCUSIÓNResultados principalesEn este amplio registro poblacional de la práctica clínica real, de pacientes sin antecedentes de cáncer que fueron tratados con iSGLT2, GLP1ra o ambos tratamientos, tras una mediana de seguimiento de 33 meses el tratamiento combinado con iSGLT2 o GLP1ra se asoció con una reducción del riesgo de mortalidad por cáncer tanto en la población total como en el subgrupo de pacientes con ECV, que suponía un 33,7% de la población total. La incidencia de eventos adversos de cáncer con estos tratamientos fue del 3,5%.
Los cánceres gastrointestinales fueron los que mostraron la máxima mortalidad (45%), seguidos de los cánceres respiratorios (22%) y los renales y genitourinarios (14%), sin que se observaran diferencias significativas entre los grupos de tratamiento. Los cánceres digestivos fueron la principal causa de muerte de los pacientes tratados con iSGLT2 (46%), GLP1ra (30%) y tratamiento combinado (50%).
Dado que la dapagliflozina, la empagliflozina y la canagliflozina fueron los iSGLT2 utilizados con más frecuencia y la dulaglutida y la semaglutida, los GLP1ra predominantes, es posible que haya un efecto de clase. Sin embargo, serán necesarios nuevos estudios para esclarecer esta observación.
Consecuencias clínicasHasta donde nosotros sabemos, este es el primer estudio en el que se describe una asociación entre el tratamiento combinado de iSGLT2 y GLP1ra y una reducción del riesgo de mortalidad por cáncer en un registro de la práctica clínica real. Este resultado tiene consecuencias para los futuros ensayos clínicos realizados para investigar las relaciones entre estos tratamientos y la incidencia y el pronóstico del cáncer.
Riesgo de cáncer en los ensayos clínicos de iSGLT2Las causas principales de mortalidad en todo el mundo son la ECV y el cáncer. En nuestra población, el 97% de los pacientes tenían diabetes, y los cánceres más prevalentes fueron los digestivos, los renales y los genitourinarios. La diabetes es un factor de riesgo conocido para el cáncer, posiblemente en relación con la disfunción metabólica y la hiperglucemia. Estos factores pueden potenciar vías oncogénicas e inflamatorias27. En consecuencia, la mayor excreción de glucosa con el tratamiento con iSGLT2 podría reducir su disponibilidad en las células cancerosas, su fuente de energía28 y su crecimiento. Este mecanismo podría explicar el menor riesgo de cáncer en los ensayos clínicos de los iSGLT2 en comparación con los de otros tratamientos antidiabéticos29,30. Sin embargo, la tasa superior de cáncer genitourinario en el grupo de iSGLT231,32 desencadenó una alerta que se resolvió más tarde en un metanálisis específico19. Además, la normalización de la glucosa reduciría las infecciones vesicales33 y, por consiguiente, el riesgo de cáncer. En estudios de observación se ha puesto de manifiesto un riesgo superior de cáncer en los pacientes con una ECV aterogénica34 o con IC35, que podría explicarse por el envejecimiento, la obesidad, la hiperactividad del sistema angiotensina-renina o la inflamación36. La modulación de estos factores mediante fármacos podría reducir el riesgo de cáncer. La tasa de mortalidad por cáncer inferior en nuestra población podría deberse al tratamiento con iSGLT2, que regula la presión arterial, el metabolismo de la grasa epicárdica7, la natriuresis, la glucemia, la función vascular, etc.37.
Riesgo de cáncer en los ensayos clínicos de GLP1raEl síndrome metabólico es un factor de riesgo de varios cánceres, como los digestivos y los genitourinarios38. La obesidad se asocia con un aumento de la adiposidad, que conduce a la resistencia a la insulina y la hiperinsulinemia. La vía de insulina/IGF-1 contribuye a la transición epitelio-mesénquima, el inicio de los tumores y su propagación. Las altas concentraciones de glucosa también aumentan el efecto Warburg, la captación de glucosa, la producción de lactato y la acidificación39.
Este proceso contribuye a producir fenotipos agresivos de los tumores. El receptor de GLP1 se expresa en muchos órganos y fue aprobado por la Food and Drug Administration para el tratamiento de la obesidad debido a sus efectos en la reducción del peso y la adiposidad40,41. Sin embargo, actúa en el sistema nervioso simpático42,43, mientras que la angiogénesis podría aumentar las metástasis. Se llevaron a cabo varios ensayos clínicos aleatorizados o metanálisis para poner de manifiesto los problemas de seguridad de los GLP1ra10,43,44 y su posible reducción del riesgo de cáncer de páncreas45. La tasa de cáncer de colon inferior en las poblaciones con diabetes, con o sin obesidad y tratamiento con GLP1ra, indica un efecto beneficioso por un mecanismo independiente de la reducción del peso9. Sin embargo, en algunos estudios de observación se ha descrito una discreta incidencia de cáncer de tiroides en pacientes tratados con GLP1ra46, lo que podría estar relacionado con factores de confusión.
Tratamiento combinado con iSGLT2 y GLP1ra y riesgo de cáncerNuestros resultados pusieron de manifiesto un riesgo de mortalidad por cáncer inferior en los pacientes que recibieron el tratamiento combinado. Estos resultados podrían explicarse por mecanismos complementarios. Mientras que los iSGLT2 aumentan la excreción urinaria de glucosa, los GLP1ra mejoran la respuesta a la insulina, modulan la adiposidad y reducen los marcadores proinflamatorios47. Además, ambos fármacos tienen un efecto antiinflamatorio a través de la modulación de la vía de NF-κB y el fenotipo proinflamatorio de los macrófagos48,49. En estudios previos se han identificado ya estos mecanismos como marcadores de un mal pronóstico en el cáncer49. En otros estudios se ha demostrado también que un aumento de los factores inflamatorios eleva el riesgo de cáncer en los pacientes con ECV50, que podría ser modulado por el tratamiento combinado.
La corta duración del tratamiento en estos pacientes indica una actividad rápida de esos mecanismos, como ya se describió en un metanálisis de ensayos clínicos51. La falta de significación estadística por lo que respecta a la hospitalización podría apuntar a un mayor beneficio del tratamiento combinado en los pacientes que se encuentran en estadios más avanzados. Sin embargo, serán necesarios más estudios para esclarecer esta cuestión. Dado que las causas de mortalidad no cancerosas podrían ser un riesgo en competencia24, se intentó abordar esta cuestión excluyendo a los pacientes que fallecieron por causas distintas del cáncer. Los resultados se confirmaron en una población equilibrada con puntuaciones de propensión multinomiales tras la verificación de los supuestos de riesgos proporcionales52 para este modelo, y la observación de que había una relación no significativa entre los residuos y el tiempo ().
LimitacionesReconocemos que el diseño de nuestro estudio no permitió establecer de manera definitiva un efecto de causalidad directa. Serán necesarios nuevos ensayos clínicos aleatorizados para confirmar estos resultados. Además, en otros registros de la práctica clínica real se podrían investigar estas asociaciones en poblaciones diversas tratadas con estas medicaciones.
Por lo que respecta al sesgo de información, fue imposible determinar la causa exacta de la muerte en algunos casos, y ello puede haber influido en algunos de nuestros resultados. Además, no dispusimos de datos de los prestadores de asistencia sanitaria privados, aunque estos representan un porcentaje pequeño en nuestra región. Nuestro estudio incluyó una cohorte amplia de pacientes con una información demográfica, clínica y pronóstica detallada. Nuestra población no se comparó con controles no tratados con FHG o nuevos tratamientos, ya que el objetivo principal fue comparar el efecto del tratamiento combinado con el de iSGLT2 o GLP1ra sobre la hospitalización y la muerte por cáncer.
Se incluyó a un número bajo de pacientes en el grupo de GLP1ra; sin embargo, se utilizó una puntuación de propensión multinomial para un ajuste de los 3 grupos de estudio. Algunas variables no se registraron en esta cohorte: genética, hormonas, tabaquismo, consumo de alcohol, anemia, insuficiencia renal, exposiciones a agentes físicos y químicos, factores de estilo de vida y reducción de peso tras el tratamiento, aunque sí se incluyeron los factores de riesgo cardiometabólico del cáncer más prevalentes. Tan solo se consideraron los eventos adversos de cáncer que requirieron hospitalización o fueron causa de mortalidad. Por consiguiente, no se incluyó a los pacientes con un cáncer asintomático ni a los diagnosticados sin hospitalización. No pudo documentarse el estado clínico de los pacientes con cáncer (p. ej., en tratamiento, estables o con cuidados paliativos) ni el uso de tratamientos quirúrgicos previos.
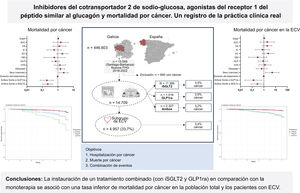
CONCLUSIONESEl tratamiento combinado (con iSGLT2 y GLP1ra) redujo el riesgo de mortalidad por cáncer en comparación con el tratamiento con iSGLT2 o GLP1ra solos, en especial en los pacientes diabéticos, ya que el 97% de los participantes tenían diabetes (figura 5).
- –
Los iSGLT2 y los GLP1ra reducen los eventos cardiovasculares a través de diferentes mecanismos; sin embargo, su asociación con el cáncer continúa sin estar clara.
- –
Este estudio es el primero en mostrar, en un registro de la práctica clínica real, una tasa de mortalidad por cáncer inferior con el tratamiento combinado (con iSGLT2 y GLP1ra) en comparación con el tratamiento con iSGLT2 o GLP1ra solos, tanto en la población general como en los pacientes con ECV. Es posible que estos resultados sean útiles para el diseño de futuros ensayos clínicos y estudios de mecanismos básicos destinados a determinar el posible papel de esos fármacos en la carcinogénesis.
Figura central. Resumen breve del diseño y los resultados. El tratamiento combinado (con iSGLT2 y GLP1ra) redujo el riesgo de mortalidad por cáncer en comparación con el tratamiento solo con iSGLT2 o con GLP1ra, principalmente en pacientes diabéticos, ya que el 97% de los participantes lo eran. GLP1ra: agonistas del receptor 1 del péptido similar al glucagón; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa.
En este manuscrito han participado las siguientes instituciones: CIBERCV (código: CB16/11/00226); Área Sanitaria de Compostela-Barbanza (SERGAS); Universidad de Santiago de Compostela; Instituto de Investigación Sanitaria de Santiago de Compostela (IDIS); Fundación IDIS; Xunta de Galicia (GAIN: IN607B-2022-04).
CONSIDERACIONES ÉTICASLos registros se anonimizaron y no fue necesario un consentimiento informado tras la aprobación del Comité Ético de Investigación Clínica de Galicia (código: 2023/239) según el Reglamento General de Protección de Datos. Se siguieron las directrices sobre equidad de género según las normas SAGER.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALRecogimos y analizamos todos los datos sin ninguna utilización de programas de inteligencia artificial (por ejemplo, ChatGPT u otros programas informáticos similares).
CONTRIBUCIÓN DE LOS AUTORESD. García-Vega y S. Eiras concibieron la idea presentada. D. García-Vega, S. Eiras y S. Cinza-Sanjurjo desarrollaron la metodología. S. Cinza-Sanjurjo y J.R. González-Juanatey supervisaron el diseño y la metodología. Todos los autores examinaron los resultados y contribuyeron en la elaboración del manuscrito final. Todos los autores aportaron comentarios críticos y colaboraron en dar forma a la investigación, el análisis y el manuscrito. Todos los autores han leído y aprobado la versión publicada del manuscrito.
CONFLICTO DE INTERESESNingún conflicto de intereses.
Damos las gracias al Hospital Clínico Universitario y al personal del centro por proporcionar la base de datos seudoanonimizada y a todos los profesionales de la salud y pacientes que participaron en el registro electrónico de pacientes.