En los últimos años se ha establecido que el vínculo entre la cantidad de grasa corporal y la enfermedad cardiovascular está más directamente relacionado con la distribución central de la grasa corporal que con la adiposidad total. La obesidad central se asocia a una respuesta inflamatoria crónica caracterizada por un aumento de las concentraciones plasmáticas de factores proinflamatorios y reactivos de fase aguda y unas concentraciones plasmáticas bajas de adiponectina. La generación de la respuesta inflamatoria ante la expansión adiposa comporta cambios de la composición celular y una interrelación activa entre los diferentes tipos celulares presentes en el tejido adiposo. Además, el patrón de adipocinas que se genera da lugar a una expansión adicional del proceso inflamatorio a nivel hepático. Se ha demostrado que la adiponectina, una adipocina específica del tejido adiposo, participa en los pasos clave de la formación y estabilidad de la placa aterosclerótica. Globalmente, la respuesta inflamatoria puede constituir la base que tienen en común la obesidad central y la aterotrombosis. La reducción del peso puede mejorar el proceso inflamatorio y debe considerarse un instrumento importante de prevención de la enfermedad cardiovascular en los individuos obesos.
Palabras clave
La obesidad se ha considerado desde hace mucho tiempo un factor de riesgo cardiovascular importante. No obstante, en los últimos años se ha establecido que el vínculo existente entre la cantidad de grasa corporal y la enfermedad cardiovascular está más directamente relacionado con la distribución central de la grasa corporal que con la adiposidad total. El estudio INTERHEART identificó la distribución de grasa central como uno de los nueve factores de riesgo modificables que explicaban hasta un 90% del riesgo de infarto de miocardio (IM)1. En ese estudio concreto, el riesgo atribuible poblacional de IM asociado a la obesidad central fue del 20%. Es importante destacar que la distribución de grasa central se asoció a un aumento del riesgo de IM, con independencia de la grasa corporal total estimada a partir del índice de masa corporal2. De igual modo, la grasa corporal central contribuía al riesgo de IM con independencia de la edad, el sexo, el hábito tabáquico o la presencia de diabetes mellitus tipo 2 o hipertensión. Dadas las proporciones epidémicas que ha alcanzado la obesidad en muchos países occidentali- zados y en vías de desarrollo, el conocimiento de los mecanismos que subyacen en la asociación entre obesidad y enfermedad cardiovascular constituye una prioridad científica. El estudio INTERHEART fue un avance importante para aclarar la relación epidemiológica entre las dos enfermedades. En este artículo comentamos la contribución de muchos grupos para aclarar algunos de los mecanismos que podrían intervenir en el riesgo cardiovascular asociado a la obesidad.
TEJIDO ADIPOSO Y REGULACIÓN METABÓLICA NORMALLa obesidad tiene relaciones epidemiológicas estrechas con algunos factores de riesgo cardiovascular convencionales3. Varios estudios han demostrado que la obesidad es el principal factor contribuyente a la hipertensión y a la actual epidemia de diabetes mellitus tipo 2. En cambio, son pocos los datos que indican que en la obesidad se den modificaciones de la concentración plasmática del principal factor de riesgo cardiovascular relacionado con los lípidos (colesterol de li- poproteínas de baja densidad ([C-LDL]). Sin embargo, se ha demostrado que la obesidad se asocia a otras alteraciones lipídicas que también aumentan el riesgo de enfermedad cardiovascular. El perfil lipídico existente en la obesidad se caracteriza por un aumento de las concentraciones de colesterol de lipoproteínas de muy baja densidad (VLDL), colesterol, triglicéridos y la proporción de partículas LDL pequeñas y densas, así como por concentraciones inferiores de colesterol de lipoproteínas de alta densidad (C-HDL). Es importante señalar que la relación entre estas alteraciones metabólicas y la obesidad va más allá de una asociación estadística. Los estudios realizados en modelos animales de lipoatrofia4 y en pacientes con lipodistrofia5 han puesto de manifiesto que la integridad funcional del tejido adiposo es importante en el mantenimiento de la homeostasis metabólica. Los ratones que carecen de tejido adiposo presentan una intolerancia a la glucosa, dislipidemia y resistencia a la insulina. Se ha descrito un perfil metabólico similar en pacientes con lipodistrofia generalizada congénita. En los ratones con poco tejido adiposo, el trasplante de grasa procedente de ratones de tipo natural restablece en parte los déficit metabólicos4. En los pacientes con lipodistrofia generalizada congénita, el tratamiento con leptina (una importante hormona derivada del tejido adiposo) se asoció a mejoras notables del metabolismo de la glucosa y los lípidos5. En consecuencia, cabe pensar que los mecanismos que subyacen en la relación entre obesidad, alteraciones metabólicas y enfermedad cardiovascular estén relacionados con una pérdida de la regulación de la función del tejido adiposo.
EL TEJIDO ADIPOSO COMO ÓRGANO ENDOCRINOIndudablemente, el tejido adiposo desempeña un papel importante en la homeostasis metabólica, al almacenar y tamponar de manera efectiva los lípidos plasmáticos. No obstante, en los últimos años se ha apreciado que el tejido adiposo actúa también como órgano endocrino activo6. La actividad secretora del tejido adiposo incluye un gran número de productos (a los que se denomina a menudo adipocinas) que participan conjuntamente en la regulación metabólica, aunque sus efectos no se limitan a ello (tabla 1). El origen celular de las adipocinas es heterogéneo7. El tejido adiposo está formado por adipocitos y por otros tipos de células como las endoteliales, los pericitos y los macrófagos. Estudios recientes han puesto de manifiesto que no sólo los adipocitos, sino también las células de la fracción de estroma del tejido adiposo, desempeñan un papel importante en el patrón de secreción de adipocinas. De hecho, a este respecto, podrían considerarse dos tipos de adipocinas. Las que son específicas del tejido adiposo (es decir, adiponecti- na y leptina) y las que son secretadas de manera abundante, pero no específica, por el tejido adiposo (es decir, TNFα, IL-6 y PCR). Es importante señalar que las dos localizaciones principales de la producción de adipocinas no son mutuamente excluyentes. La tasa de producción de una adipocina concreta es determinada no sólo por el tipo de célula en la que se origina sino también por la interrelación muy activa entre diferentes tipos de célula existentes en el tejido adiposo. Así, se ha demostrado que el cultivo conjunto de células 3T3-L1 con macrófagos conduce a un aumento de la secreción de MCP-1 y TNFa, en comparación con lo observado en ausencia de macrófagos8.
Tipos principales de adipocinas derivadas del tejido adiposo
| Adiponectina | Factor de necrosis tumoral-a (TNF-α) |
| Leptina | Proteína quimioatrayente monocitaria −1 |
| (MCP-1) | |
| Resistina | Factor inhibitorio de la migración de macrófagos |
| (MIF) | |
| Visfatina | Inhibidor del activador de plasminógeno (PAI-1) |
| Apelina | Factor tisular (TF) |
| Interleucina-6 | Proteína C reactiva (CRP) |
| Interleucina-1 | Amiloide A sérico (SAA) |
| Interleucina-18 | Angiotensinógeno, angiotensina II |
En la actualidad está claramente establecido que la obesidad se asocia a una respuesta inflamatoria crónica caracterizada por un aumento de la concentración plasmática de factores proinflamatorios y reactivos de fase aguda y unas concentraciones plasmáticas bajas de adiponectina9. Sin embargo, hay cuestiones fundamentales que no se conocen bien todavía, como por qué y cómo se produce una inflamación de bajo grado en la obesidad.
Parece plausible que con la acumulación de grasa haya más de un mecanismo que participe en la activación de las vías proinflamatorias JNK y IKKβ en el tejido adiposo10. Los datos obtenidos en modelos experimentales indican que el estrés en el retículo endoplásmico es importante para la puesta en marcha de la inflamación en la obesidad11. La expansión de la grasa corporal supondría un reto para la función y la capacidad del retículo endoplásmico y conduciría a la activación de vías inflamatorias. Por otra parte, los marcadores sisté- micos del aumento del estrés oxidativo aumentan con la adiposidad, y se ha demostrado que este tipo de estrés celular conduce también a la activación de vías inflamatorias de JNK y NF-κβ. Por último, se ha sugerido que puede fomentarse la síntesis de ceramida y pueden activarse los receptores toll-like por el efecto de los ácidos grasos saturados, lo cual podría contribuir pues a la estimulación de vías inflamatorias. Es importante señalar que, una vez activada la inflamación, ésta se perpetuaría a través de una ulterior activación de vías inflamatorias por parte de factores derivados del tejido adiposo, como TNFα e IL-6.
La inflamación de bajo grado en la obesidad parece asociarse a cambios de la composición celular del tejido adiposo12. Se ha sugerido que a medida que se acumula la grasa los adipocitos podrían empezar a producir señales quimiotácticas que conducirían a un reclutamiento en el tejido adiposo de macrófagos procedentes de la médula ósea. Existen numerosas citocinas quimioatrayentes que podrían intervenir en este proceso. Sin embargo, la MCP-1 parece ser crucial a este respecto, puesto que los ratones que carecen del receptor de MCP-1 denominado CCR2 presentan una reducción de la infiltración macrofágica en el tejido adiposo13. No se conoce bien el papel fisiológico exacto que desempeña la infiltración macrofágica del tejido adiposo en la obesidad. Los estudios morfológicos han puesto de manifiesto una agregación de los macrófagos alrededor de los adipocitos necróticos, lo cual sugiere que una de las funciones de su presencia consiste en eliminar los adipocitos muertos del tejido adiposo14. Sin embargo, sea cual sea la finalidad fisiológica que pudiera tener la infiltración macrofágica en el tejido adiposo, una vez los macrófagos están presentes en él, contribuyen de manera importante a la alteración del patrón de adipocinas proinflamatorias que caracteriza a la obesidad. Estudios recientes del tejido adiposo en la obesidad han revelado que el aumento de la expresión de citocinas inflamatorias por parte del tejido adiposo es paralelo a un aumento del contenido de macrófagos de dicho tejido15. Además, pudo reproducirse in vitro una regulación positiva de las citocinas proinflamatorias y una regulación negativa de la adiponectina, tal como se observa en la obesidad, mediante el cultivo conjunto de adipocitos 3T3-L1 diferenciados y macrófagos8. Así pues, se está prestando más atención a la composición celular de los depósitos de tejido adiposo como modo de conocer mejor las consecuencias que tiene la obesidad para la salud.
DISTRIBUCIÓN DE LA GRASA CORPORAL E INFLAMACIÓN SISTÉMICA DE BAJO GRADOComo se ha señalado en la introducción, se ha identificado que la distribución de grasa central (evaluada clínicamente mediante el perímetro de cintura o el cociente cintura-cadera) constituye un factor de riesgo para las enfermedades cardiovasculares y también para otras enfermedades metabólicas asociadas a la obesidad. Así pues, una importante cuestión a abordar es la de cuál es la contribución específica de la grasa visceral a las anomalías cardiometabólicas que se dan con frecuencia en los individuos obesos.
Está claramente establecido que los compartimentos de tejido adiposo visceral y subcutáneo difieren en el manejo que hacen de los ácidos grasos libre no esterificados (NEFA)16. La grasa visceral es más resistente a los efectos antilipolíticos de la insulina, y es más sensible a los efectos prolipolíticos de las catecolaminas y los glucocorticoides, en comparación con la grasa del compartimento subcutáneo. Así pues, se ha propuesto que un exceso de liberación de NEFA de la grasa intraabdominal es un factor contribuyente importante en la patogenia de la resistencia a la insulina y sus consecuencias cardiometabólicas.
Se ha avanzado también en la identificación de diferencias en la producción de adipocinas entre los compartimentos de grasa subcutánea y visceral17. Varios estudios han puesto de relieve que la leptina es secretada preferentemente por el tejido adiposo subcutáneo, mientras que el PAI-1 y la IL-6 son más importantes en los depósitos adiposos viscerales. En un estudio muy reciente, Fontana et al18 determinaron las concentraciones de varias adipocinas en el plasma procedente de la vena porta y de arterias periféricas en individuos con obesidad extrema y resistencia a la insulina que presentaban grandes cantidades de grasa visceral. Las concentraciones plasmáticas de IL-6 fueron mucho más altas en la sangre de la vena porta que en la de arterias periféricas, lo cual ponía de manifiesto que la grasa visceral es un origen importante de producción de IL-6 en los individuos obesos. En cambio, las concentraciones plasmáticas de leptina fueron más bajas en la vena porta que en la sangre arterial periférica, lo cual concuerda con el hecho de que la grasa no visceral sea el principal origen del producto del gen ob. Aunque no se ha establecido un patrón regional claro de producción de adipocinas, un análisis de correlación ha demostrado que las concentraciones plasmáticas de adiponectina están más estrechamente relacionadas con el compartimento de grasa intraabdominal19. De forma análoga, se ha identificado una relación positiva del grado de expresión génica de TNFα, IL-6 y PAI-1 en el tejido adiposo abdominal con la resistencia a la insulina y otros factores de riesgo cardiovascular9. Por consiguiente, el concepto actualmente más aceptado es que el tejido adiposo visceral está involucrado en las acciones endocrinas en mayor medida que el compartimento adiposo subcutáneo.
La mayor actividad endocrina del compartimento visceral en comparación con la grasa subcutánea parece estar relacionada, al menos en parte, con diferencias de composición celular entre los dos compartimentos de tejido adiposo en los individuos obesos. Cancello et al15 obtuvieron muestras de biopsia apareadas de grasa subcutánea e intraabdominal de individuos con obesidad mórbida durante la realización de intervenciones de cirugía bariátrica. Su estudio puso de relieve la presencia de mayor número de macrófagos en la grasa visceral en comparación con la subcutánea. Es de destacar que la composición celular del tejido adiposo parecía tener influencia en las alteraciones metabólicas. Tras introducir un ajuste respecto a la edad, la infiltración de macrófagos en la grasa visceral presentaba una correlación significativa con los valores de glucemia en ayunas, la sensibilidad a la insulina y las enzimas hepática. Por el momento se desconoce cuáles son los verdaderos factores responsables del mayor reclutamiento de macrófagos en el tejido epiploico que en los tejidos subcutáneos.
ADIPONECTINA, LEPTINA Y ENFERMEDAD CARDIOVASCULARDe entre las diferentes adipocinas producidas en el tejido adiposo, la adiponectina y la leptina podrían ser consideradas sustancias de especial interés en el análisis de la contribución específica que tiene la obesidad en la enfermedad cardiovascular. La adiponectina tiene unas características únicas por cuanto es la única adipocina que parece ser sintetizada exclusivamente en el tejido adiposo7. Por otra parte, la adiponectina y la leptina son las únicas adipocinas que proceden de los adipocitos y no de otros tipos celulares no específicos del tejido adiposo7.
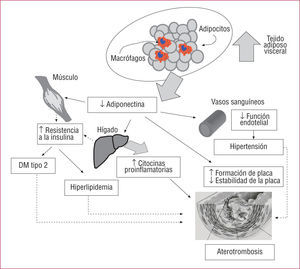
AdiponectinaLa adiponectina es una sustancia derivada de los adipocitos y específica del tejido adiposo, que se identificó por primera vez a mediados de los noventa20. Se trata de una proteína de 30kDa que pertenece estructuralmente a la familia del complemento 1q, es el transcripto más abundante en el tejido adiposo y se encuentra en el plasma circulante a concentraciones del orden de 5 a 20mg/ml21. Como se ha mencionado antes, las concentraciones plasmáticas de adiponectina están reducidas en los individuos obesos, sobre todo en los que presentan obesidad visceral. Es interesante señalar que los ratones con déficit de adiponectina presentan algunas de las alteraciones metabólicas que caracterizan a la obesidad abdominal en el ser humano, como la intolerancia a la glucosa, la hiperlipidemia y la hipertensión. De igual modo, en el ser humano, las concentraciones plasmáticas bajas de adiponectina están relacionadas con la resistencia a la insulina, y son menores aún en los individuos con diabetes mellitus tipo 2 o hipertensión. Por último, las concentraciones plasmáticas más bajas de adiponectina se han asociado a valores plasmáticos inferiores de las partículas HDL grandes que tienen efectos cardioprotectores y a concentraciones plasmáticas más altas de las partículas de LDL pequeñas que son más proaterogénicas22. Los datos obtenidos en modelos animales sugieren que los efectos beneficiosos metabólicos de la adiponectina se producen a través de varios mecanismos, principalmente en el hígado y el músculo21. La administración de adiponectina activa la utilización de glucosa por parte del músculo e induce la oxidación de los ácidos grasos musculares y hepáticos, dando lugar a una disminución del contenido de triglicéridos y un descenso de la producción hepática de glucosa. Además, la vasorreactividad dependiente del endotelio sufre un deterioro en los individuos con concentraciones plasmáticas bajas de adiponectina, que puede intervenir en la patogenia de la hipertensión en los individuos obesos23. En consecuencia, podría argumentarse que las concentraciones bajas de adiponectina puedan desempeñar un papel en la enfermedad cardiovascular asociada a la obesidad, al menos en parte mediante una facilitación de la aparición de los factores de riesgo cardiovascular convencionales (fig. 1).
Mecanismos propuestos para la relación entre adiponectina y aterotrombosis. La expansión del tejido adiposo visceral se asocia a una infiltración del tejido adiposo por macrófagos y a una disminución de la concentración plasmática de adiponectina. La reducción de los efectos de la adiponectina se asocia a la resistencia a la insulina a nivel muscular y hepático, y a una alteración de la función endotelial a nivel vascular. Puede producirse, pues, hiperlipidemia, diabetes tipo 2 e hipertensión. Las concentraciones plasmáticas bajas de adiponectina facilitan también una expansión de la inflamación sistémica de bajo grado a través de la acción hepática. Estos factores, junto con un efecto directo sobre la formación e inestabilidad de la placa como consecuencia de los valores bajos de adiponectina facilitan la aterotrombosis en los individuos obesos. DM: diabetes mellitus.
Se ha descrito también que la adiponectina produce unos efectos beneficiosos cardiovasculares directos al interferir en algunos de los mecanismos involucrados en la formación y la estabilidad de la placa aterosclerótica (fig. 1). Se ha demostrado que los ratones knockout para la adiponectina presentan un engrosamiento de la íntima inducido por la lesión endotelial que es más intenso que el observado en los ratones de tipo natural24. Además, la sobreexpresión de adiponectina plasmática provocada a través de adenovirus atenuó significativamente la progresión de las lesiones ateroscleróticas en ratones knockout para apoE, que constituyen un modelo murino en el que se produce una hiperlipidemia y lesiones vasculares similares a las de la aterosclerosis humana25. Por último, se ha descrito que las concentraciones plasmáticas de adiponectina son más bajas en los individuos con enfermedad coronaria que en los individuos de control, incluso tras la introducción de un ajuste para el índice de masa corporal y la edad26. Se ha propuesto que, cuando la barrera endotelial es dañada por los factores desencadenantes de la aterosclerosis (es decir, lipoproteínas de baja densidad oxidadas), la adiponectina circulante se acumula en el espacio subendotelial de las paredes vasculares. Por consiguiente, la adiponectina inhibe la fijación monocitaria a las células del endotelio vascular, reduce la formación de células espumosas y atenúa la proliferación del músculo liso vascular inducida por los factores de crecimiento27. La inhibición de la expresión de las moléculas de adhesión junto con una inhibición de la activación de NFIβ inducida por el TNFα se consideran los mecanismos moleculares clave de la inhibición de la adhesión monocitaria a las células endoteliales que se produce por la acción de la adiponectina. La reducción causada por la adiponectina de la acumulación lipídica en macrófagos derivados de los monocitos parece producirse a través de la inhibición de las actividades de fijación y captación derivadas de la expresión del receptor eliminador macrofágico A. Además, los estudios realizados con cultivos de células de músculo liso han puesto de manifiesto que la síntesis de DNA inducida por los factores de crecimiento es atenuada con la adición de adiponectina a los medios de cultivo. Por último, se ha sugerido que la adiponectina puede modular la estabilidad de la placa aterosclerótica mediante la modulación del equilibrio entre las metaloproteinasas de matriz (MMP) y el inhibidor tisular de metaloproteinasas (TIMP) secretado por los macrófagos28. En general se acepta que el equilibrio entre estos dos factores desempeña un papel crucial en las alteraciones de la placa que conducen a los síndromes coronarios agudos. Se observó que la adición de adiponectina a los medios de cultivo provocaba un aumento de la expresión de mRNA y de la producción proteica de TIMP, dependiente de la dosis, en los macrófagos de origen monocitario humanos, sin que hubiera cambios en la expresión o la producción de MMP.
Adiponectina y enfermedad coronariaTeniendo en cuenta los efectos protectores propuestos para la adiponectina frente a la enfermedad cardiovascular, varios estudios han evaluado la concentración de adiponectina como posible biomarcador de la enfermedad coronaria (EC). Es interesante señalar que en el Health Professionals Follow-up Study, las concentraciones plasmáticas elevadas de adiponectina presentaron una asociación positiva con un menor riesgo de infarto de miocardio en los varones29. Esta relación, basada en 266 casos incidentes de IM, continuaba siendo significativa aun después de introducir un ajuste respecto a múltiples factores de confusión. Sin embargo, estas observaciones iniciales han sido puestas en duda en estudios posteriores y en un metaanálisis reciente30. Basándose en los datos de 7 estudios prospectivos publicados sobre la relación entre la adiponectina y la EC (con un total de 1.313 casos incidentes de enfermedad coronaria), dicho metaanálisis indicó una odds ratio no significativa de 0,84 (IC del 95%, 0,70-1,01) para la EC incidente al comparar las concentraciones plasmáticas de adiponectina situadas en los terciles más alto y más bajo. Los datos del metaanálisis establecen claramente que la magnitud de la asociación entre las concentraciones de adiponectina circulante y el riesgo de EC es más débil de lo que se había pensado, y ello pone en duda la posibilidad de utilizar la adiponectina total como biomarcador del riesgo de enfermedad cardiovascular. No obstante, nuestros avances en el conocimiento de la biología de la adiponectina parecen sugerir que pueden ser necesarios nuevos estudios de esta asociación. En el suero humano, la adiponectina circula en una amplia gama de formas que van desde los agregados de adiponectina de bajo peso molecular (BPM) hasta los de alto peso molecular (APM)27. En general, los estudios realizados indican que la cantidad de adiponectina APM está mejor correlacionada con la sensibilidad a la insulina y los parámetros del metabolismo de la glucosa y los lípidos que la adiponectina total22. Tiene interés la reciente observación de Aso et al31 de un cociente de concentraciones plasmáticas de adiponectina APM respecto a la adiponectina total más bajo en los individuos con diabetes tipo 2 que presentaban EC. De forma análoga, Kobayashi et al32 han observado que el cociente de adiponectina APM respecto a adiponectina total, pero no así la adiponectina BPM, es significativamente menor en los pacientes obesos con EC en comparación con los individuos de control. Además, en ese estudio se demostró que la forma de APM de la adiponectina interviene de manera específica en el efecto beneficioso producido por la adiponectina sobre la supervivencia de las células endoteliales macrovasculares. La apoptosis de las células endoteliales puede deteriorar la función de la barrera endotelial y aumentar la vulnerabilidad a la trombosis coronaria. Así pues, la valoración de la adiponectina APM podría ser importante para evaluar los efectos protectores vasculares de la adiponectina y su posible utilidad como marcador del riesgo cardiovascular.
LeptinaLa leptina es una proteína de 16-kDa, secretada principalmente por los adipocitos, que desempeña un importante papel en el control del balance energético33. Además, se están acumulando datos que indican que la leptina puede intervenir en algunos de los trastornos metabólicos asociados a la obesidad. En los pacientes con lipodistrofia congénita generalizada, los suplementos de leptina revierten en parte la resistencia a la insulina, la intolerancia a la glucosa, la dislipidemia y la acumulación de grasa en el hígado5. Por otra parte, se ha sugerido, que las concentraciones elevadas de leptina en plasma contribuyen a activar el sistema nervioso autónomo y por tanto la elevación de la presión arterial34. Es de destacar que, como ha ocurrido con la adiponectina, la leptina se ha relacionado también más directamente con la aterotrombosis. Se sabe que la leptina tiene efectos inmunomoduladores35. Se ha propuesto que unas concentraciones de leptina más altas pueden causar un sesgo en los leucocitos T hacia un predominio del fenotipo Th1 más proinflamatorio y proaterogénico. De igual modo, se ha sugerido que la leptina aumenta la agregación plaquetaria, deteriora la distensibilidad arterial de manera independiente de otras alteraciones metabólicas e inflamatorias, y fomenta la proliferación y migración de las células de músculo liso vascular36. Sin embargo, debe resaltarse que, a pesar de todos estos datos favorables a un posible papel de la leptina en el riesgo cardiovascular, continúa sin estar clara la contribución de la leptina en la patogenia de la aterotrombosis.
HÍGADO Y EXPANSIÓN DE LA INFLAMACIÓN ASOCIADA A LA OBESIDADLa hepatopatía grasa no alcohólica (HGNA) está presente con frecuencia en los individuos con adiposidad visceral37. Se ha comprobado que un aumento del contenido de grasa del hígado constituye un factor predictivo independiente para la diabetes tipo 2 y que se asocia a una dislipidemia. El espectro patológico de la HGNA va de la esteatosis simple a la cirrosis, y está claro que la inflamación desempeña un papel clave en la progresión de la enfermedad. La acumulación ectópica de lípidos en los hepatocitos podría inducir una respuesta inflamatoria en el hígado similar a la que se produce en el adipocito con el aumento de la grasa. Sin embargo, se ha sugerido que un patrón de adipocinas en vena porta caracterizado por un aumento de factores proinflamatorios y una adiponectina baja, como ocurre en la obesidad abdominal, podría contribuir a iniciar la inflamación en el hígado38. De hecho, se han observado las concentraciones más bajas de adiponectina en los individuos con HGNA. Además, el hecho de que las concentraciones de IL-6 en vena porta estuvieran correlacionadas directamente con las concentraciones de PCR arteriales en una cohorte de individuos con obesidad grave constituye una evidencia clara en favor de un posible vínculo mecanicista entre la masa adiposa visceral y la inflamación hepática en el ser humano18. Una vez desencadenada la inflamación, el hígado actuará como un origen importante de reactivos de fase aguda, como la PCR, y de factores relacionados con la trombólisis como el PAI-139. En consecuencia, podría plantearse la hipótesis de que el aumento de la concentración plasmática de factores inflamatorios asociados a la obesidad pudiera tener su origen no sólo en el tejido adiposo sino también en una mayor expansión a nivel hepático.
Cai et al40 han demostrado elegantemente que la inflamación en el hígado es importante para algunas de las manifestaciones que se dan con frecuencia en los individuos con obesidad visceral40. Estos autores generaron ratones que presentaban una sobreexpresión de IKKβ específicamente en el hígado. La activación resultante de la vía proinflamatoria específica hepática del NF-κβ se asoció de manera dependiente de la dosis a la resistencia sistémica a la insulina. Y a la inversa, la resistencia a la insulina se atenuó cuando se generaron ratones doblemente transgénicos que sobreexpresaban simultáneamente el IKKβ y el supresor de IKKβ. No obstante, los datos obtenidos en el ser humano sugieren que la obesidad es un factor determinante importante de algunos factores inflamatorios derivados predominantemente del hígado, como la PCR. En pacientes con diabetes tipo 2 moderadamente obesos, la asociación entre la PCR y el número de componentes del síndrome metabólico desaparecía tras un ajuste respecto al índice de masa corporal41. De forma análoga, se observaron concentraciones plasmáticas de PCR elevadas en pacientes con obesidad grave, independientemente de la presencia o ausencia de SM, diabetes o esteatohepatitis no alcohólica42.
REDUCCIÓN DE PESO Y PREVENCIÓN DE LA ENFERMEDAD CARDIOVASCULARVarios estudios han puesto de manifiesto que el proceso inflamatorio de bajo grado que se ha descrito puede constituir una base común para la obesidad y la aterotrombosis, que mejora de manera considerable con la reducción del peso43. Existen numerosos datos que indican que la reducción del consumo energético y el aumento de la actividad física pueden ser eficaces para reducir la PCR, el TNFα, la IL-6 y el PAI-1 y aumentar las concentraciones plasmáticas de adiponectina. De igual modo, se ha demostrado que, tras una reducción de peso modesta mediante una dieta muy baja en calorías, el perfil de expresión génica proinflamatorio del tejido subcutáneo de los individuos obesos se atenúa y pasa a estar más próximo al de los individuos de control no obesos44. Además, el análisis morfológico de biopsias de tejido adiposo subcutáneo previas y posteriores a la cirugía bariátrica en individuos con obesidad mórbida ha mostrado una notable reducción de la infiltración macrofágica en el tejido adiposo45. Por último, se ha observado que el contenido de grasa hepático puede reducirse con la pérdida de peso46. Aunque no disponemos todavía de datos definitivos sobre el efecto de la reducción de peso en las variables de valoración de la enfermedad cardiovascular, en la actualidad varios estudios han establecido claramente que una reducción de peso modesta, como la obtenida tras la aplicación de un programa estructurado de modificación del estilo de vida, es muy eficaz para prevenir la diabetes tipo 2 y para tratar otros componentes del síndrome metabólico47,48. Así pues, podría considerarse que se han sentado las bases científicas para poder contemplar la reducción de peso como un instrumento importante en la prevención de la enfermedad cardiovascular en los individuos obesos.
CONCLUSIONESEn la actualidad está bien establecido que la obesidad no es tan sólo un factor contribuyente crucial que subyace en los principales factores de riesgo cardiovascular, sino también un factor de riesgo independiente trascendente para la enfermedad cardiovascular. Cada vez es mayor la evidencia que sugiere que el mecanismo que subyace en la relación entre la obesidad, las alteraciones metabólicas y la enfermedad cardiovascular está relacionado con una alteración de la regulación de la función del tejido adiposo. La activación de las vías proinflamatorias de JNK e IKKβ, en especial en el tejido adiposo visceral, daría lugar a cambios en la composición celular de dicho tejido, y a una sobreproducción de adipocinas proinflamatorias, así como a una regulación negativa de la adiponectina. Las concentraciones plasmáticas bajas de adiponectina producirían alteraciones del metabolismo de la glucosa y los lípidos, facilitarían la acumulación de grasa en el hígado (con la consiguiente expansión adicional del proceso inflamatorio) y facilitarían la formación y la inestabilidad de la placa aterosclerótica. Así pues, la respuesta inflamatoria crónica puede representar el terreno común entre la obesidad central y la aterotrombosis. Es importante señalar que la pérdida de peso puede mejorar el proceso inflamatorio y debe considerarse un instrumento importante de prevención de la enfermedad cardiovascular en los individuos obesos.
AGRADECIMIENTOSEste trabajo fue financiado mediante subvenciones del Fondo de Investigaciones Sanitarias del Instituto de Salud Carlos III (PI060157 y REDIMET RD06/0015) Madrid, España.