La embolia pulmonar (EP) es la principal causa de muerte hospitalaria y la tercera causa más frecuente de muerte cardiovascular. Tradicionalmente, el tratamiento ha involucrado anticoagulación, trombolisis o cirugía; sin embargo, se han desarrollado las intervenciones dirigidas por catéter (IDC) para pacientes con EP de riesgo intermedio o alto, que incluyen trombolisis dirigida por catéter y trombectomía por aspiración. Estas opciones pueden mejorar rápidamente la función ventricular derecha, la situación hemodinámica y la mortalidad de ciertos pacientes, aunque falta suficiente evidencia de ensayos controlados y aleatorizados.
Este documento, elaborado por la Asociación de Cardiología Intervencionista, la Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares y el Grupo de Trabajo de Hipertensión Pulmonar de la Sociedad Española de Cardiología (SEC), revisa las recomendaciones actuales y la evidencia disponible para el abordaje de la EP, destacando la importancia de los equipos de respuesta rápida, la estratificación del riesgo y la monitorización inicial de los pacientes para decidir quiénes son candidatos a reperfusión. Partiendo de la evidencia clínica sobre la IDC, se discuten los escenarios clínicos y la selección de pacientes para estas técnicas para ayudar en la toma de decisiones en situaciones de incertidumbre por falta de evidencia. Por último, se describe el soporte periprocedimiento poniendo en valor el necesario enfoque multidisciplinario para mejorar los resultados y reducir la morbimortalidad de los pacientes con EP.
Palabras clave
La embolia pulmonar (EP), tercer gran síndrome trombótico tras el infarto de miocardio y el ictus, es la primera causa prevenible de muerte de pacientes hospitalizados. La obstrucción aguda de las arterias pulmonares causa una sobrecarga de la presión del ventrículo derecho que puede llegar al shock y la muerte si no se trata. En casos graves, las nuevas técnicas de intervención dirigida por catéter (IDC) están revolucionando el tratamiento como alternativa a la trombolisis sistémica (TS).
La EP requiere un enfoque multidisciplinario en el que la cardiología es crucial para el diagnóstico, la estratificación del riesgo (electrocardiograma, ecocardiograma), la estabilización hemodinámica (unidades de cuidados intensivos cardiológicos [UCIC], oxigenador extracorpóreo de membrana [ECMO]), IDC y el seguimiento (enfermedad tromboembólica pulmonar crónica [ETEC] y angioplastia de arterias pulmonares).
Este documento revisa las recomendaciones actuales basadas en la evidencia y en aporta la opinión del panel de expertos sobre los puntos sin la suficiente evidencia (tabla 1). Se centra en la estratificación y la evaluación del riesgo-beneficio para la selección de candidatos a IDC, además de dar recomendaciones sobre el apoyo periprocedimiento. El propósito es promover el abordaje por equipos de respuesta rápida para la EP (PERT), con el correspondiente ingreso en unidades especializadas para el uso de terapias avanzadas que puedan reducir la morbimortalidad de la EP.
Resumen de las definiciones y recomendaciones del panel de expertos en situaciones con escasez de evidencia
| Definición de reperfusión | Se entiende como reperfusión el tratamiento dirigido a restaurar rápidamente el flujo pulmonar mediante la reducción de la carga trombótica que está causando la sobrecarga de presión del VD, habitualmente en situaciones de shock obstructivoComprende tratamiento farmacológico (TS), percutáneo (IDC) y quirúrgico (EQ) |
| IDC en EP-AR | En caso de no realizarse TS en situación de EP-AR por contraindicaciones o alto riesgo de sangrado, se recomienda la IDC si se puede realizar en un tiempo <60 min o <90 min si requiere trasladoEn caso de IDC en EP-AR, se recomienda TM sobre TLEn caso de IDC en EP-AR, se puede usar TL si no hay disponibilidad de TM y el paciente conserva cierta estabilidad que permita concluir la terapia (hipotensión persistente) |
| IDC electiva en la EP-IAR | El abordaje inicial de los pacientes con EP-IAR incluye monitorización en cuidados intensivos o intermedios durante 24-48 h y anticoagulaciónEn este periodo, para pacientes seleccionados con EP-IAR, se debe valorar la IDC electiva si se acumulan varios factores de mal pronóstico, para prevenir el deterioro clínico o hemodinámico. Esta decisión se debería tomar en las primeras 24 hEn pacientes con EP-IAR y deterioro clínico o hemodinámico según las guías de la ESC, se recomienda la IDC sobre la TS por su mejor perfil de seguridad |
| Criterios de finalización de TM | No hay definidos criterios para dar por finalizado un procedimiento de TMNo se recomienda intentar eliminar la totalidad de la carga trombótica para no prolongar el procedimiento y evitar potenciales complicaciones mecánicasEl objetivo debería ser la mejoría clínica de los pacientes con IAR y la estabilidad hemodinámica de los pacientes con EP-AR. Son parámetros objetivos la reducción del soporte vasoactivo, incremento de la PAS, reducción de la FC, mejoría de PAFI o mejoría de saturación venosaOtros criterios de finalización serían: extracción de todo el trombo de arterias proximales, trombo crónico o muy organizado, limitación anatómica para alcanzar el trombo o balance extracción de trombo o sangre desfavorable (extracción >400-500 ml) |
| Requisitos del centro experto en EP | Equipo PERT disponible las 24 h del díaIDC (idealmente tanto TL como TM) disponible las 24 h del díaECMO disponible las 24 h del díaLa necesidad de cirugía cardiaca es controvertida, dado que la EQ como modalidad de reperfusión está en desuso, si bien puede ser útil en el trombo a través de foramen oval, el ECMO o, junto con la cirugía vascular, en la resolución de complicacionesEn centros sin cirugía cardiotorácica se debería contar con un centro de referencia que pueda atender casos emergentes (trabajo en red) |
| Tiempos | Desde el diagnóstico de EP, se debería establecer una primera estrategia terapéutica en los primeros 30-60 min (comprende la estratificación del riesgo y consulta PERT)En EP-IAR se recomienda su monitorización en unidad de intermedios o intensivos durante 48 h desde el diagnósticoEn EP-IAR se recomienda la evaluación de factores de mal pronóstico (tabla 2) en las primeras 6 h de ingreso para valorar candidatos a IDC electivaSi se decide IDC electiva en EP-IAR, se debería realizar en 24 h o menos desde la decisiónSi se decide IDC electiva en EP-AR, se debería realizar en 4 h o menos desde la decisiónTras la reperfusión, se recomienda monitorizar 24 h las EP-IAR y 48 h las EP-AR |
| Éxito de la reperfusión en EP-AR | Se considera éxito de la reperfusión si se recupera una PAS >90 sin vasopresoresEsta evaluación debería realizarse 2-4 h tras la administración de TS o del final de la IDC |
ECMO: oxigenador extracorpóreo de membrana; EP-AR: embolia pulmonar de alto riesgo; EP-IAR: embolia pulmonar de riesgo intermedio-alto; TM: trombectomía mecánica; EQ: embolectomía quirúrgica; ESC: Sociedad Europea de Cardiología; FC: frecuencia cardiaca; IDC: intervención dirigida por catéter; PAFI: cociente entre la presión arterial de oxígeno y la fracción inspirada de oxígeno; PAS: presión arterial sistólica; PERT: equipo de respuesta a la embolia de pulmón; TL: trombolisis local; TS: trombolisis sistémica.
Los PERT para el abordaje y tratamiento de la EP de alto riesgo (EP-AR) y de riesgo intermedio-alto (EP-IAR) surgen en Estados Unidos en 2012 y actualmente tienen un grado de recomendación IIa en las guías europeas (nivel de evidencia C)8.
Compuestos por diferentes especialistas (cardiología, neumología, medicina interna, urgencias, hematología, cirugía vascular, anestesiología, cuidados intensivos, cirugía cardiaca o radiología intervencionista), los equipos se reúnen para evaluar al paciente desde diversas perspectivas, consensuar un plan de tratamiento individualizado y activar recursos locales o el traslado a un centro de referencia para garantizar el nivel de cuidados necesario9.
Aunque hay variabilidad en su organización, la frecuencia de activación, la composición (que puede comprender una red de hospitales) y los recursos disponibles, son aspectos fundamentales su creación, su desarrollo y su auditoría periódica, junto con el acceso preferente a servicios clínicos clave (urgencias, ecocardiografía, radiología, cuidados intensivos, intervenciones percutáneas y cirugía cardiotorácica)9. La evidencia indica que los centros con mayor volumen de pacientes con EP tienen menos mortalidad a 30 días, y la activación del PERT se asocia con menores tasas de mortalidad y reingresos10. Además, implementar un PERT se asocia con mayor uso de reperfusión e IDC11–14.
La cardiología es crucial en el abordaje de la EP, implicada en todas las fases diagnóstico-terapéuticas. Su participación en los PERT es vital en el tratamiento del shock obstructivo por insuficiencia hemodinámica del ventrículo derecho. Además, trabaja habitualmente en equipos para la toma de decisiones (Heart Team), con aplicación en el shock cardiogénico, el trasplante o las intervenciones en cardiopatía isquémica o valvular, optimizando la valoración de riesgos y beneficios de las alternativas terapéuticas.
ABORDAJE INICIAL Y ESTRATIFICACIÓN DEL RIESGOEstratificación del riesgoSegún las guías europeas8 se clasifica a los pacientes en función de su estabilidad hemodinámica, las puntuaciones clínicas (índice de gravedad de la EP [PESI] o PESI simplificado [sPESI]), la disfunción o dilatación del ventrículo derecho (VD) y los biomarcadores (tabla 2), en las siguientes categorías: a) EP de alto riesgo: define a los pacientes con afección del VD observada por imagen (ecocardiografía o tomografía computarizada), elevación de biomarcadores (troponina, propéptido natriurético cerebral [proBNP]) e inestabilidad hemodinámica (que comprende tres subcategorías: hipotensión persistente, shock obstructivo y parada cardiaca)8; aproximadamente el 4% de los pacientes tienen EP-AR, con mortalidad a corto plazo de hasta un 27% dentro de las primeras 24 h y hasta el 49% en 72 h; b) EP de riesgo intermedio: a diferencia de la anterior, debe haber estabilidad hemodinámica; se subdivide, a su vez, en 2 categorías: EP-IAR, en presencia de afección del VD por imagen y elevación de algún biomarcador, y EP de riesgo intermedio-bajo, en presencia de solo 1 o ninguno de los anteriores criterios (pero PESI III-V o sPESI ≥ 1); el conjunto de este grupo representa el 55% de los pacientes; aunque la mayoría mejora con anticoagulación, el subgrupo EP-IAR deberá ser estrechamente monitorizado por el riesgo de sufrir deterioro clínico, respiratorio o hemodinámico; c) EP de bajo riesgo: son los pacientes que se encuentran hemodinámicamente estables, con PESI I-II o sPESI = 0, sin compromiso del VD por imagen y sin elevación de biomarcadores, y representan aproximadamente un 40% del total.
Criterios clínicos, de imagen y de laboratorio que indican gravedad de los pacientes con EP de riesgo intermedio-altoa
| Clínicos | Imagen | Laboratorio |
|---|---|---|
| SíncopebFC ≥ 110 lpmbPAS <100 mmHgbSaturación arterial <90%Frecuencia respiratoria >30 rpmEdadSexo masculinoCáncerInsuficiencia cardiaca crónicaEnfermedad pulmonar crónicaTemperatura <36°CEstado mental alterado | Relación VD/VI >1cTAPSE <16 mmDilatación de cava inferiorVelocidad pico sistólica del anillo tricuspídeo (< 9,5 cm/s)ITV del TSVD <9,5 cmSigno 60/60 (tiempo de aceleración pulmonar <60 ms con PSAP <60 mmHg) | Troponina elevadacLactato >2 mmol/lb (otro punto de corte validado es >3,3 mmol/l)NT-proBNP >600 pg/ml |
| Escalas |
|---|
| BOVA score2. Incluye FC, PAS, biomarcadores y disfunción del VD por ecocardiografía. El BOVA ampliado añade el lactato y permite identificar a los pacientes con un riesgo del 24% de sufrir deterioro hemodinámico a los 7 días |
| Escala TELOS3. Incluye, además de la disfunción del VD y la troponina, la elevación de lactato; estos pacientes tienen un riesgo de muerte o colapso hemodinámico del 21,1% a los 7 días |
| Escala SHIELD4. Es un modelo que incluye el shock index (FC/PAS) ≥ 1, hipoxemia, lactato elevado y signos de disfunción del VD (biomarcadores o por imagen) |
| Puntuación FAST5. Incluye 3 parámetros: troponina cardiaca elevada, síncope y FC ≥ 100 |
| Escala NEWS26. Se recomienda para monitorizar la detección del deterioro clínico y la necesidad de reperfusión y se ha recomendado en un documento de consenso europeo para su uso en EP-IAR. Incluye 6 parámetros: FR, saturación de oxígeno, temperatura, PAS, FC y nivel de conciencia |
| Score aditivo de Bangalore et al7. Con parámetros clínicos y de imagen, permite predecir el shock normotensivo (PAS ≥ 90 con índice cardiaco <2,2 l/min/m2) en pacientes con EP-IAR |
| PESI8. Clase I: ≤ 65 puntos; Clase II: 66-85 puntos; Clase III: 86-105 puntos; Clase IV: 106-125 puntos; Clase V: >125 puntos. Puntuación: edad en años, 1 punto por cada año de edad; sexo masculino, 10; cáncer, 30; insuficiencia cardiaca crónica, 10; enfermedad pulmonar crónica, 10; FC ≥ 110 lpm, 20; PAS <100 mmHg, 30; FR >30 rpm, 20; temperatura <36°C, 20; estado mental alterado, 60; saturación arterial <90%, 20 |
| sPESI8. 1 punto si cumple cualquiera de los siguientes parámetros: edad >80 años, cáncer, insuficiencia cardiaca crónica, PAS <100 mmHg, saturación arterial <90% |
EP-IAR: embolia pulmonar de riesgo intermedio-alto; FC: frecuencia cardiaca; FR: frecuencia respiratoria; ITV: integral tiempo velocidad; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PAS: presión arterial sistólica; PSAP: presión sistólica de la arteria pulmonar; TAPSE: desplazamiento sistólico del anillo tricuspídeo; TSVD: tracto de salida del VD; VD: ventrículo derecho; VI: ventrículo izquierdo.
En las últimas décadas se han realizado esfuerzos para identificar dentro de la EP-IAR a un subgrupo de pacientes en riesgo de deterioro hemodinámico a corto plazo. Si bien la terapia recomendada por las guías es la anticoagulación, para los pacientes con riesgo de muerte ≥ 10% según las diferentes escalas y marcadores, este grupo de expertos recomienda valorar el IDC de forma electiva porque asocia una mortalidad ≤ 3% en varios estudios, principalmente observacionales15–20. Se han propuesto una serie de marcadores y escalas pronósticas con base en parámetros observables al ingreso (tabla 2) para identificar a este subgrupo.
Monitorización y ubicación de ingresoLos pacientes con riesgo intermedio-bajo pueden ingresar en una planta de hospitalización convencional. Aquellos con EP-IAR requieren monitorización estrecha para poder detectar signos de deterioro precoz, por lo que es conveniente que ingresen en unidades de cuidados intermedios o UCIC. Los pacientes con alto riesgo deben ingresar en una UCIC.
TRATAMIENTO DE LA EMBOLIA PULMONARAnticoagulaciónEs el pilar del tratamiento de la EP. Se recomienda el tratamiento con heparina de bajo peso molecular o fondaparinux en vez de con heparina no fraccionada (HNF), pues alcanza más rápido concentraciones terapéuticas y conlleva menos riesgo de trombocitopenia inducida por heparina. Un metanálisis demostró que las EP tratadas inicialmente con heparina de bajo peso molecular tuvieron una reducción de las complicaciones trombóticas, un mejor perfil de seguridad y menor mortalidad que la HNF21. La HNF es de elección para pacientes con insuficiencia renal grave (aclaramiento <30ml/min), alto riesgo hemorrágico, obesidad mórbida, alto riesgo de deterioro hemodinámico o candidatos a IDC. En contraindicación absoluta se puede valorar el filtro de vena cava ().
ReperfusiónDefinido como el tratamiento dirigido a restaurar rápidamente el flujo pulmonar mediante la reducción de la carga trombótica causante de la sobrecarga de presión del VD, habitualmente en situaciones de shock obstructivo (tabla 1). Este documento parte de las indicaciones de las guías europeas, aunque describimos las principales recomendaciones internacionales en la , y resume los tratamientos más habituales, que se exponen a continuación.
Trombolisis sistémicaLas guías recomiendan el tratamiento de reperfusión con TS para pacientes con EP-AR, y también como tratamiento de rescate para pacientes con EP-IAR que presentan deterioro hemodinámico una vez anticoagulados. Esta recomendación proviene de estudios antiguos que mezclaban pacientes con EP-AR y EP-IAR y de metanálisis de los mencionados estudios (nivel de evidencia B)8,22.
El fármaco de elección es el activador tisular del plasminógeno recombinante (rtPA) (alteplasa), con estreptocinasa y urocinasa como alternativas. La dosis de alteplasa es de 100 mg en perfusión durante 2 h. Se puede emplear en pacientes muy graves una dosis en bolo de 0,6mg/kg en 15min (máximo 50mg). Si el peso es <65kg, la dosis máxima es de 1,5mg/kg. Las contraindicaciones se resumen en la . Existen pautas de TS a dosis reducidas (habitualmente rtPA 0,6 mg/kg, con máximo de 50 mg) que se asocian a un riesgo de sangrado intermedio entre anticoagulación y dosis completa de TS, y están siendo evaluadas prospectivamente en el estudio PEITHO-323,24.
Se puede administrar la HNF durante la trombolisis con alteplasa, pero si se produce coagulopatía, debe suspenderse y reiniciarse tan pronto como el tiempo de tromboplastina parcial activada sea <2 s y el fibrinógeno, >100mg/dl. En el caso de haberse administrado heparina de bajo peso molecular, la perfusión de HNF no se debe reiniciar hasta pasadas 12 h de la última dosis.
Los criterios de fracaso de la trombolisis25 son la persistencia o empeoramiento de la inestabilidad hemodinámica tras 2-4 h de su administración1. En este caso, se deben valorar otros tratamientos de reperfusión de rescate, como la trombectomía mecánica (TM).
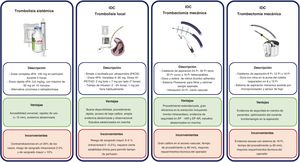
Intervención dirigida por catéterEl uso de técnicas percutáneas para el tratamiento de la EP ha crecido significativamente en los últimos 10 años14,26,27. Se dividen en 2 grupos, la trombolisis local (TL) y la TM, y se resumen en la figura 1.
En ambos grupos la punción ecoguiada es imprescindible para optimizar la seguridad y descartar una trombosis venosa. Se recomienda navegar hasta la arteria pulmonar mediante catéter de Swan-Ganz o pigtail para un paso central por la válvula tricúspide. Se propone un registro de presiones que incluya la aurícula derecha (valoración de precarga) y la arteria pulmonar, además de saturación inicial y final (o pre-post en TL). Se pueden realizar angiografías de las arterias pulmonares para confirmar el diagnóstico y valorar la anatomía. Se puede considerar una línea arterial para gasometría y control invasivo de la presión arterial, especialmente en pacientes inestables.
Trombolisis local o intrapulmonarLa TS, que es el tratamiento estándar en la EP-AR, se infrautiliza aun en ausencia de contraindicaciones por el alto riesgo de sangrado que conlleva (> 10% de sangrado mayor, incluyendo 2-3% de hemorragia intracraneal). La TL pulmonar, que permite dosis de trombolítico mucho menores y tiempos de infusión más espaciados, se comenzó a usar por la sencillez de la técnica y la menor tasa de sangrados, que permite incluso utilizarla en contraindicaciones relativas de TS28.
DispositivosLa TL puede administrarse a través de cualquier catéter multiperforado, como el pigtail, o catéteres de perfusión, como el Cragg-McNamara (Medtronic, Estados Unidos), que es un catéter multiperforado diseñado para trombolisis periférica que se ha aplicado en EP24. El catéter Bashir (Thrombolex, Estados Unidos) es un dispositivo con cesta distal de nitinol que se expande en el interior del trombo para fisurarlo, mientras se administra trombolítico a bajas dosis. El catéter EKOS Endovascular System (Boston Scientific, Estados Unidos) es un sistema de infusión de trombolítico que incorpora transductores que generan pulsos de ultrasonidos de alta frecuencia y baja energía para cavitar el trombo y aumentar la superficie de contacto del trombolítico29. Cuenta con mayor nivel de evidencia que sus competidores (ensayos clínicos aleatorizados), si bien no hay suficiente evidencia de superioridad frente a los convencionales24.
Detalles técnicos y evidencia en la literaturaLa TL es un procedimiento técnicamente sencillo y accesible. Se pueden posicionar 1 o 2 catéteres en la arteria pulmonar principal o en ambas ramas (lobares inferiores en caso de sistema EKOS)18. Aunque se han utilizado varios agentes trombolíticos, el rtPA es de elección. Existen diversos regímenes de dosis y tiempo de infusión (dosis absoluta desde 8 a 24mg administrados entre 4 y 24h)29–32, y todos ellos han mostrado mejoría de los parámetros de sobrecarga de VD respecto a la situación basal32. No hay evidencia sobre la dosis ideal, por lo que puede ser razonable usar mayores dosis a más carga trombótica y menores dosis a mayor riesgo de sangrado32. El estudio en marcha HI-PEITHO analiza si la TL asistida por ultrasonidos es superior a la anticoagulación en EP-IAR33.
Se puede valorar repetir el estudio hemodinámico y la angiografía en las primeras 24 h y retirar el sistema mediante vendaje compresivo. Muy raramente es necesario prolongar la infusión de trombolítico. Se recomienda administrar HNF (300-600 UI/h con bolo previo) antes del procedimiento y mantenerla hasta 4 h después de la finalización de la TL, con objetivo de tiempo de tromboplastina parcial activada <60 s o tiempo de coagulación activada <200 s.
La tabla 3 resume las características de los candidatos ideales, precauciones y contraindicaciones para estas técnicas. La evidencia relacionada con la TL se muestra en la tabla 4.
Características de los pacientes con embolia pulmonar candidatos a tratamiento de trombolisis local o intrapulmonar
| Buenos candidatos | ||
|---|---|---|
| EP-AR | EP-IAR (de rescate) | EP-IAR (electivo) |
| • Contraindicación relativa para TS• Contraindicación absoluta para TS si no hay otra opción de tratamiento• Siempre que pueda permitirse demora suficiente para que la TL haga efecto (categoría hipotensión persistente) | • Deterioro clínico o hemodinámico según las guías de la ESC con anticoagulación, como alternativa a TS por su mejor perfil de seguridad | • Valorar, en pacientes seleccionados con EP-IAR, la IDC electiva si se acumulan varios factores de mal pronóstico (tabla 2), para prevenir el deterioro clínico o hemodinámico• Sin contraindicación absoluta para TS (ajustando dosis y duración en función del riesgo de sangrado) |
| Precauciones |
|---|
| • Anomalías de vena cava inferior y vena cava superior• Presencia de prótesis biológicas de válvula tricúspide o pulmonar• Presencia de cables de estimulación del VD• Cardiopatías congénitas del lado derecho• Reanimación cardiopulmonar prolongada• Síncope (considere la posibilidad de traumatismo craneal) |
| Contraindicaciones |
|---|
| • Ausencia de acceso venoso• Presencia de prótesis mecánicas de válvula tricúspide o pulmonar• Traumatismo craneal• Sangrado activo• Antecedentes de hemorragia cerebral o neoplasia cerebral activa• Inestabilidad hemodinámica que no permita finalizar el tratamiento con seguridad |
EP-AR: embolia de pulmón de riesgo alto; EP-IAR: embolia de pulmón de riesgo intermedio-alto; ESC: Sociedad Europea de Cardiología; TL: trombolisis local; TS: trombolisis sistémica; VD: ventrículo derecho.
Evidencia de los dispositivos de trombolisis local o intrapulmonar y diferentes técnicas de intervención dirigida por catéter
| Estudio | Población | tOP | Intervención | Eficacia (OP) | Seguridad | NCT |
|---|---|---|---|---|---|---|
| Estudios aleatorizados | ||||||
| ULTIMA29 | EP-IAR,59 pacientes | 24 h | USAT frente a heparina | Reducción VD/VI0,30 frente a 0,03 (p<0,001) | 0 muerte0 HM | NCT01166997 |
| Kroupa et al.30 | EP-IAR23 pacientes | 48 h | TL frente a heparina | Reducción VD/VI0,88 frente a 1,42 (p=0,01) | 0 muerte0 HM | – |
| CANARY31 | EP-IAR94 pacientes* | 3 meses | TL frente a heparina | Reducción VD/VI0,7 frente a 0,8 (p=0,01) | 3 muertes (heparina)1 HM (TL) | NCT05172115 |
| SUNSET sPE34 | EP-IAR82 pacientes | 48 h | USAT frente a TL convencional | Reducción de trombo por TC (sin diferencias, p=0,76) | 1 muerte (USAT)2 HM (USAT) | NCT02758574 |
| HI-PEITHO33 | EP-IAR406 pacientes | 7 d | USAT frente a heparina | MAE | Inclusión activa de pacientes | NCT04790370 |
| Estudios observacionales | ||||||
|---|---|---|---|---|---|---|
| Seattle II35 | EP-AR (21%)EP-IAR (79%)150 pacientes | 48 h | USAT | Reducción VD/VI 0,42±0,36 | 2,7% muerte 30 días10% HM 30 días | NCT01513759 |
| Registro Español de IDC26 | EP-AR (37%)EP-IAR (63%)253 pacientes | Ingreso | TL 71%TM 53%Ambas 23% | Éxito del procedimiento 91% | Mortalidad37,6% EP-AR2,5% EP-IAR | NCT06348459 |
| Portero et al.18 | EP-AR (11%)EP-IAR (89%)65 pacientes | 48 h | TL+aspiración+fragmentación(estrategia farmacomecánica) | Éxito del procedimiento 90% | 2 muertes2 HM | – |
| Knocout PE15 | EP-IAR489 pacientes | 72 h | USAT | – | 1% muerte 30 días1,7% HM 72 h | – |
| Metanálisis | ||||||
|---|---|---|---|---|---|---|
| Zhang et al.36 | EP-IARy EP-AR81 705 pacientes | – | Metanálisis heparina, TS, TL | TL menos mortalidad que con heparinaOR=0,55 (IC95%, 0,39-0,80)TS >mortalidad que TLOR=2,05 (IC95%, 1,46-2,89) | TL=HIC que heparinaOR=1,51 (IC95%, 0,75-3,04)ST >HIC que TLOR=1,50 (IC95%, 1,13-1,99) | – |
EP-AR: embolia de pulmón de riesgo alto; EP-IAR: embolia de pulmón de riesgo intermedio-alto; HIC: hemorragia intracraneal; HM: hemorragia mayor; IDC: intervención dirigida por catéter; MAE: eventos adversos mayores; NCT: identificador en clinicaltrials.gov; TC: tomografía computarizada; tOP: tiempo a la evaluación del objetivo principal (OP); TL: trombolisis local; USAT: trombolisis local asistida por ultrasonidos; VD/VI: cociente de los diámetros del ventrículo derecho y el ventrículo izquierdo.
Es el procedimiento percutáneo que permite la extracción de los trombos de la circulación pulmonar mediante aspiración, y tiene como objetivo restaurar el flujo en las arterias pulmonares y disminuir la sobrecarga del VD de forma menos invasiva que la embolectomía quirúrgica (EQ).
Dispositivos dedicadosLos sistemas de TM disponibles en la actualidad son principalmente dos. El sistema FlowTriever (Inari Medical, Estados Unidos), con varios catéteres de hasta 24 Fr, un sistema de recuperación, filtrado y retorno de sangre y 2 sistemas autoexpandibles de nitinol que facilitan la extracción de trombo organizado. Se avanza coaxialmente sobre una guía de alto soporte que debe posicionarse lo más distal posible en lobares inferiores. Los sistemas de 8 y 12 Fr Lightning Indigo y de 16 Fr Lightning Flash (Penumbra, Estados Unidos) se conectan a una bomba de succión con un sensor de flujo que permite optimizar la eficacia de aspiración reduciendo la pérdida de sangre. El sistema se moviliza libremente en la anatomía arterial pulmonar. En la figura 1 se describen estos sistemas. La tabla 5 resume las características de los candidatos ideales, las precauciones y las contraindicaciones para esta técnica y en la tabla 6, el resumen de la evidencia sobre TM.
Características de los pacientes con embolia pulmonar candidatos a tratamiento de trombectomía mecánica o con catéter
| Buenos candidatos | ||
|---|---|---|
| EP-AR | EP-IAR (de rescate) | EP-IAR (electivo) |
| • Contraindicación para TS• Sin contraindicación para TS, pero con alto riesgo de sangrado con TS (escala BACS37)• TS o TL fallida | • Deterioro clínico o hemodinámico según las guías de la ESC en anticoagulación como alternativa a TS por su mejor perfil de seguridad | • Valorar, en pacientes seleccionados con EP-IAR, la IDC electiva si se acumulan varios factores de mal pronóstico (tabla 2) para prevenir el deterioro clínico o hemodinámico |
| Precauciones |
|---|
| • Anomalías en vena cava inferior y vena cava superior• Presencia de prótesis biológicas de válvula tricúspide o pulmonar• Radiación torácica previa (mayor riesgo de perforación)• Presencia de cables de estimulación del VD• Cardiopatías congénitas del lado derecho• Hipertensión pulmonar tromboembólica crónica (trombo agudo sobre crónico)• Presencia de filtro de cava inferior• Trombo en tránsito y foramen oval permeable• Evitar acceso a ramas distales con dispositivos de gran calibre• Vigilar la cantidad de sangre durante la extracción. Solicitar pruebas cruzadas |
| Contraindicaciones |
|---|
| • Ausencia de acceso venoso• Presencia de prótesis mecánicas de válvula tricúspide o pulmonar• Metástasis pulmonares diseminadas• Sangrado activo que contraindique anticoagulación con heparina sódica durante el procedimiento• Trombo de localización periférica |
EP-AR: embolia de pulmón de riesgo alto; EP-IAR: embolia de pulmón de riesgo intermedio-alto; ESC: Sociedad Europea de Cardiología; TL: trombolisis local; TS: trombolisis sistémica; VD: ventrículo derecho.
Evidencia sobre los dispositivos de trombectomía mecánica percutánea
| Estudio | Población | tOP | Descripción | Eficacia | Seguridad | NCT |
|---|---|---|---|---|---|---|
| FlowTriever | ||||||
| FLARE19 | EP-IR106 pacientes | 48 h | Estudio brazo únicoFibrinolisis 2% | Reducción VD/VI 0,38 | 3,8% MAE1% HM0% HIC | NCT02692586 |
| FLAME38 | EP-AR115 pacientes | Ingreso | Observacional.FlowTriever frente a médico (TS 68,9%) frente a performance goal | Combinado MAE17 frente a 32% (p<0,01)Flowtriever frente a performance goal | Mortalidad, 1,9% Flowtriever 29,5% Médico | NCT04795167 |
| FLASH16 | EP-AR (8%)EP-IAR (77%)800 pacientes | 48 h | Observacional.Fibrinolisis 2,3% | Reducción PAP 7,6 mmHgReducción VD/VI 0,25 | 1,8% MAE 48 h0,3% Muerte 48 h | NCT03761173 |
| PEERLESS | EP-IR550 pacientes | 7 días | AleatorizadoFlowTriever frente a TL | Combinado MAE 7 días | Completada la inclusión | NCT05111613 |
| PEERLESS 2 | EP-IAR1.200 pacientes | 30 días | AleatorizadoFlowTriever frente a heparina | Combinado MAE 30 días | Inclusión activa de pacientes | NCT06055920 |
| Indigo Penumbra | ||||||
|---|---|---|---|---|---|---|
| EXTRACT-PE20 | EP-IR119 pacientes | 48 h | Estudio brazo únicoIndigo 8 Fr | Reducción VD/VI 0,43 | 1,7% MAE 48 h0,8% Muerte 48 h | NCT03218566 |
| STORM-PE | EP-IAR100 pacientes | 48 h | AleatorizadoIndigo 12 Fr frente a heparina | Reducción VD/VI | Inclusión activa de pacientes | NCT05684796 |
| STRIKE-PE | EP-IAR600 pacientes | 48 h | Estudio brazo únicoLightning 12 y 16 Fr frente a heparina | Reducción VD/VI | Inclusión activa de pacientes | NCT04798261 |
EP-AR: embolia de pulmón de riesgo alto; EP-IAR: embolia de pulmón de riesgo intermedio-alto; EP-IR: embolia de pulmón de riesgo intermedio; HIC: hemorragia intracraneal; HM: hemorragia mayor; MAE: eventos adversos mayores; NCT: identificador en www.clinicaltrials.gov; PAP: presión media de arteria pulmonar; tOP: tiempo a la evaluación del objetivo principal (OP); TS: trombolisis local; VD/VI: cociente de los diámetros del ventrículo derecho y el ventrículo izquierdo.
Los dispositivos no dedicados y otros sistemas de trombectomía periférica aplicados a EP se describen en la .
Detalles técnicosEl acceso vascular para todos estos procedimientos será una vena femoral, excepto si estuviera trombosada o si el paciente fuera portador de un filtro de vena cava. Una vez obtenido el acceso, se recomienda mantener anticoagulación con HNF para tiempo de coagulación activada 250-300 s.
No existen criterios estandarizados para finalizar el procedimiento de TM. El objetivo de la TM debe ser clínico-hemodinámico, de manera que generalmente no es necesaria una desaparición completa del trombo para conseguir una situación estable. En la tabla 1 se proponen objetivos que se pueden conseguir en muchas ocasiones solo con una recanalización anatómica parcial. El cierre vascular puede realizarse con Perclose Prostyle o FemoStop (Abbott, Estados Unidos), sutura en Z o en 8, o con el sistema FlowStasis incluido con Flowtriever.
Combinación de técnicas. Se pueden usar en secuencia técnicas mecánicas (fragmentación o TM) y farmacológicas (TL). No hay mucha evidencia sistemática más allá de registros39 sobre tratamiento combinado y los ensayos aleatorizados o comparación entre técnicas. Hay registros de TM con un uso residual de trombolíticos (el 2,3% en FLASH)16. Sin embargo, en el registro español se usaron en un 23,3% de los casos26. Teóricamente, la combinación de técnicas sería complementaria, de modo que la TM podría conseguir una mejoría hemodinámica y respiratoria inmediata, al eliminar trombos proximales de gran tamaño, mientras que la TL buscaría la resolución total del trombo, actuando en las ramas de menor calibre. Sin embargo, esta estrategia podría incrementar el riesgo de sangrado al combinar un acceso vascular de gran calibre con terapia trombolítica. En los casos en que se utilice (especialmente en la TM como rescate de TL o TS), es crucial la seguridad del acceso vascular (punción ecoguiada, micropunción).
Actualmente, el tratamiento combinado no es de elección en la IDC, sino que se reserva como rescate. Es fundamental seleccionar de inicio la técnica adecuada de manera individualizada para maximizar el beneficio y minimizar las complicaciones, teniendo en cuenta la experiencia y los recursos locales (figura 1 y figura 2).
Embolectomía quirúrgicaLos resultados de la EQ dependen de la situación del paciente y de la experiencia del centro; la mortalidad hospitalaria varía del 0 al 8% de los pacientes con hipotensión y del 22 al 44% de los pacientes con parada cardiaca40,41. No hay estudios aleatorizados, pero llama la atención que las guías establezcan la EQ como la primera alternativa de reperfusión para pacientes con contraindicación o fallo de la fibrinolisis, con una recomendación de clase I C si se dispone del recurso y los equipos son expertos. En la mayoría de los centros terciarios no existen condiciones óptimas para la EQ urgente las 24 h del día, mientras que sí las hay para el IDC de la EP aguda26,28, que es la alternativa real a la TS. La EQ puede considerarse un tratamiento de rescate, tanto en la EP-AR como en la EP-IAR en caso de deterioro hemodinámico y contraindicación o fracaso de otras alternativas8,24,28 y, quizás, en presencia de trombo en tránsito que involucren el foramen oval permeable ().
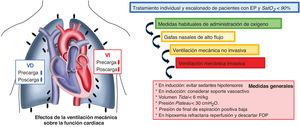
SOPORTE PERIPROCEDIMIENTOSoporte respiratorioSe debe realizar una monitorización continua de la saturación de oxígeno mediante pulsioximetría. Se debe mantener una oxemia adecuada (presión arterial de oxígeno >80mmHg y saturación de oxígeno >90%) mediante gafas nasales, reservorio, cánulas nasales de alto flujo y ventilación mecánica no invasiva o invasiva, según las recomendaciones de la tabla 7 y la figura 3.27,42,43
Asistencia respiratoria y hemodinámica periprocedimiento y en las unidades de cuidados intensivos de los pacientes con embolia pulmonar
| Medida | Indicación | Objetivo | Riesgos | Uso práctico |
|---|---|---|---|---|
| Asistencia respiratoria | • Hipoxemia, hipercapnia y acidosis producen de manera independiente vasoconstricción pulmonar, y si coexisten, su efecto es sinérgico | • Saturación de oxígeno >90%• Presión arterial de oxígeno >80 mmHg | El abordaje de los pacientes con deterioro respiratorio debe ser gradual evitando la ventilación con presión positiva, que conlleva 3 veces más mortalidad | Oxigenoterapia convencional (gafas nasales, oxígeno reservorio)Gafas nasales de alto flujo: hasta 60 l/min y FiO2 100%. Conserva la precarga del ventrículo derechoVentilación mecánica no invasiva. Conserva la precarga del ventrículo derechoVentilación mecánica invasiva (figura 3) |
| Soporte farmacológico | • Evitar el fallo multiorgánico en caso de hipotensión | • Presión arterial media ≥ 65 mmHg• Lactato <2 mmol/l | Los pacientes que requieren soporte farmacológico tienen más mortalidad hospitalaria | Véase la figura 4 y la |
| Asistencia circulatoria | • Shock con deterioro hemodinámico grave• Parada cardiorrespiratoria | El determinante más importante para obtener buenos resultados en caso de que los pacientes requieran asistencia mecánica es elegir el momento apropiado para evitar un daño orgánico irreversible | Las complicaciones más frecuentes suelen ser las hemorrágicas del acceso vascular, sobre todo en caso de fibrinolisis previa | La evidencia sobre el ECMO venoarterial proviene de casos y estudios observacionalesVéase la |
ECMO: oxigenador extracorpóreo de membrana; FiO2: fracción inspirada de oxígeno.
Abordaje de la hipoxemia en los pacientes con embolia pulmonar ingresados en la unidad de cuidados intensivos y efectos de la ventilación mecánica en la función cardiaca. Modificado de Arrigo et al.42. EP: embolia pulmonar; FOP: foramen oval permeable; SatO2: saturación de oxígeno; VD: ventrículo derecho; VI: ventrículo izquierdo.
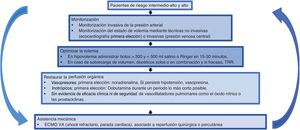
Se debe realizar una monitorización continua de constantes vitales (presión arterial, frecuencia cardiaca y electrocardiograma), además de los parámetros del cateterismo derecho. Tras el procedimiento es recomendable mantener la monitorización al menos 24 h en EP-IAR y 48 h en EP-AR. Se aconseja realizar un ecocardiograma inmediatamente después del procedimiento y a las 24 h. En caso de hipotensión, se recomiendan las medidas incluidas en la tabla 7, la y la figura 4.8,42,44,45
Abordaje de las complicaciones específicas del procedimientoAunque la IDC es un procedimiento seguro en comparación con la TS, no está exento de complicaciones46. Las más frecuentes son las complicaciones hemorrágicas, generalmente leves, relacionadas con el acceso vascular en el contexto de anticoagulación. En el infrecuente caso de perforación iatrogénica del árbol arterial pulmonar, puede haber desde expectoración hemoptoica leve y autolimitada hasta hemoptisis masiva con deterioro hemodinámico y respiratorio. El tratamiento de estos pacientes exige revertir la anticoagulación, ocluir la rama afectada con balón y localizar mediante angiografía pulmonar el punto de sangrado para hacer hemostasia mecánica intravascular (inflados prolongados de balón, embolización, etc.). En casos amenazantes, será necesaria la intubación orotraqueal con tubo de doble luz para aislar el pulmón sangrante y permitir la completa ventilación del pulmón contralateral.
Otras complicaciones muy infrecuentes pero graves son la perforación del VD, el daño de la válvula tricúspide y la embolia paradójica en pacientes con foramen oval.
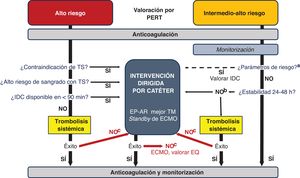
ALGORITMO DE ABORDAJE DE LA EMBOLIA PULMONAR GRAVELas guías de práctica clínica recomiendan que el tratamiento de la EP aguda se base en la estratificación inicial del riesgo8, que debe llevar a cabo un PERT. Es recomendable la existencia de protocolos locales y regionales para la toma de decisiones. La figura 5 muestra el algoritmo de abordaje integrado propuesto, basado en la evidencia y el consenso del panel de expertos, que representa la práctica clínica actual en nuestros centros. La describe el abordaje de situaciones especiales (embarazo, parada cardiaca, posoperatorio, paciente oncológico y trombo en cavidades derechas).
Figura central. Algoritmo de abordaje de la embolia pulmonar según el consenso de expertos. ECMO: oxigenador extracorpóreo de membrana; EP-AR: embolia pulmonar de alto riesgo; EQ: embolectomía quirúrgica; IDC: intervención dirigida por catéter; PERT: equipo de respuesta a la embolia pulmonar; TM: trombectomía mecánica; TS: trombolisis sistémica.
aParámetros asociados con shock normotensivo o mortalidad ≥ 10% (tabla 2).
bValorar, como en EP-AR: contraindicación de TS, alto riesgo de sangrado con TS y disponibilidad de IDC.
cEvaluar en 2-4h.
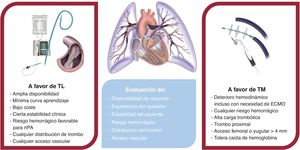
La mortalidad precoz relacionada con la EP-AR supera el 15%, concentrada en las primeras horas de ingreso47. Por ello, el tratamiento de reperfusión urgente está recomendado, con TS como tratamiento de elección8, aunque la evidencia es escasa. La TM es una técnica en auge por su seguridad y eficacia (la TM fue mejor que el brazo de control de tratamiento médico incluyendo TS, con mortalidad hospitalaria del 1,9% en el estudio FLAME38). Actualmente la TM está indicada por contraindicación, o tras el fracaso, de la fibrinolisis8, si bien la opinión del panel de expertos es que podría tener relevancia también en casos de alto riesgo de sangrado con TS, valorado mediante la escala BACS37. Si se indica la TM en este contexto, es razonable realizarla en un máximo de 60 min desde la decisión si el paciente se encuentra en un centro con posibilidad de TM o en 90 min si es necesario el traslado a un centro de referencia (tabla 1)1. Además, se debe asegurar el adecuado soporte respiratorio y hemodinámico en todo momento. La TL podría recomendarse en casos seleccionados si no se dispone de TM (tabla 3).
Riesgo intermedio-altoEn la EP-IAR la anticoagulación sin tratamiento de reperfusión es suficiente para la mayoría de los pacientes, aunque los normotensos con elevado riesgo de deterioro hemodinámico requieren una monitorización estrecha8, ya que un porcentaje tendrá deterioro hemodinámico y requerirá reperfusión (mortalidad aproximada del 10% con tratamiento médico). Con los datos actuales, la mortalidad asociada a IDC en este escenario es <3%15–20,26, por lo que este panel de expertos propone valorar, para pacientes seleccionados con EP-IAR, la IDC electiva si se acumulan varios factores de mal pronóstico para prevenir este deterioro clínico. Los pacientes con EP-IAR candidatos a reperfusión electiva serían los que cumplen varios criterios de la tabla 2; de especial relevancia son el síncope, el lactato elevado, la presión arterial límite y la frecuencia cardiaca elevada.
En estos pacientes, el primer tratamiento será la anticoagulación, y la terapia de reperfusión electiva se valorará durante las primeras 24-48 h (tabla 1). El PERT debe hacer un plan individualizado que considere el tratamiento inicial, las alternativas y la logística necesaria para la reperfusión, incluida la IDC47.
SEGUIMIENTO AL ALTA DE LA EP AGUDAEstudio de comorbilidades protrombóticasLa distinción entre comorbilidades transitorias y permanentes, mayores y menores, condiciona el riesgo de recurrencia y la necesidad de anticoagulación oral crónica tras una EP ()8,48.
Tras una EP se debe mantener la anticoagulación un mínimo de 3 meses. A partir de ese momento, el tratamiento depende del riesgo de recurrencia, el riesgo de sangrado y las preferencias del paciente. Las recomendaciones aceptadas (independientes de un eventual diagnóstico de trombofilia)48, son:
- •
Suspender la anticoagulación 3 meses tras un primer episodio de EP provocada por un factor de riesgo transitorio mayor y resuelto.
- •
Anticoagulación indefinidamente en caso de un factor de riesgo permanente mayor.
- •
Anticoagulación indefinidamente para los varones con EP idiopática, por riesgo de recurrencia intermedio entre los grupos anteriores.
- •
Estudios adicionales () para decidir si se mantiene la anticoagulación en: mujeres con EP idiopática, EP secundaria a un factor de riesgo transitorio, menor y resuelto, pacientes que desean suspender la anticoagulación y pacientes con relación riesgo/beneficio incierta para una anticoagulación por tiempo indefinido.
Muchos pacientes presentan disnea persistente a los 3 meses de una anticoagulación tras EP49. El cribado de ETEC e hipertensión pulmonar tromboembólica crónica (HPTEC) tiene implicaciones pronósticas y terapéuticas.
La ETEC se caracteriza por disnea de esfuerzo, defectos de perfusión persistentes en la gammagrafía de ventilación/perfusión, presiones pulmonares normales en reposo e hipertensión pulmonar al esfuerzo. Su incidencia real no se conoce. El cribado debe incluir prueba de esfuerzo cardiopulmonar, además de ecocardiograma y gammagrafía pulmonar. La confirmación requiere cateterismo de reposo y esfuerzo49,50.
La HPTEC exige, además, hipertensión arterial pulmonar confirmada en cateterismo cardiaco derecho de reposo. Obliga a anticoagulación de por vida. El tratamiento consiste en trombendarterectomía pulmonar o angioplastia de arterias pulmonares, además de tratamiento vasodilatador pulmonar específico50.
¿Influye la reperfusión en la enfermedad tromboembólica pulmonar crónica?La incidencia de HPTEC tras EP aguda varía entre el 2 y el 5% según estudios observacionales, y se desconoce el porcentaje de pacientes en que se desarrolla ETEC tras una EP aguda. Aunque estudios pequeños apuntan a que la TS puede reducir el riesgo de HPTEC, el seguimiento a 3 años de 706 pacientes del estudio PEITHO demostró tasas similares de HPTEC entre TS y anticoagulación (el 2,1 frente al 3,2%; p=0,79)51. Los estudios con TL han demostrado mayor reducción a corto plazo de la presión sistólica pulmonar35,39, igualándose con el grupo de anticoagulación en el seguimiento. No hay estudios aleatorizados que comparen la presión pulmonar en el seguimiento de pacientes que persisten sintomáticos tras EP aguda sometidos a TS o IDC. Por tanto, no hay evidencia suficiente para afirmar que la reperfusión reduce el riesgo de HPTEC en pacientes con EP aguda comparada con la anticoagulación.
CARACTERÍSTICAS DEL CENTRO Y OPERADOR EXPERTO EN EMBOLIA PULMONARSe requiere coordinación entre los actores mediante un PERT con protocolos adaptados a los recursos locales para estratificar el riesgo y un tratamiento personalizado, con necesidad de servicios ininterrumpidos todo el año. La utilidad de la cirugía cardiaca está en debate; se ha propuesto tener un centro de referencia con cirugía cardiotorácica disponible para derivaciones urgentes desde un PERT sin este recurso. Se propone extender modelos regionales como Código Infarto o Ictus a la EP, para mejorar la atención coordinada y eficaz (tabla 1).
Requisitos del operadorLa IDC en pacientes con EP no está exenta de riesgos; la pericia del cardiólogo intervencionista en el acceso vascular seguro, la navegación en el corazón derecho y el implante de ECMO es crucial. El conocimiento del paciente agudo, las opciones terapéuticas y los dispositivos específicos son esenciales. La concentración inicial de experiencia en pocos operadores y estandarizar el procedimiento pueden mejorar los resultados, aunque se recomienda difundir esta experiencia en el equipo para ocasionales situaciones de emergencia.
CONCLUSIONESEste documento resume los aspectos más relevantes del abordaje de la EP-AR y EP-IAR desde el punto de vista de la cardiología y con especial atención a las técnicas percutáneas y de soporte periprocedimiento. Donde la evidencia clínica es escasa se aporta la opinión del panel de expertos. Un protocolo diagnóstico-terapéutico multidisciplinario, el abordaje sistemático con estratificación del riesgo, la anticoagulación precoz y una monitorización adecuada, así como la implementación de nuevas estrategias terapéuticas basadas en la evidencia, contribuirán a mejorar el pronóstico de los pacientes con embolia de pulmón.
FINANCIACIÓNNingún autor recibió financiación por su contribución a la redacción del manuscrito. Las ilustraciones se realizaron gracias a una beca no condicionada de Palex Medical.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se han utilizado programas de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESP. Salinas: administración del proyecto, conceptualización, metodología, supervisión, redacción de manuscrito original, revisión del manuscrito. R. Martín-Asenjo: supervisión, administración del proyecto, redacción de manuscrito original, revisión del manuscrito. A.B. Cid Álvarez, J. Martín Moreiras: administración del proyecto, adquisición de fondos, redacción de manuscrito original, revisión del manuscrito. P. Jorge Pérez, A. Viana-Tejedor: administración del proyecto, redacción de manuscrito original, revisión del manuscrito. M.E. Vázquez-Álvarez, A. Jurado-Román, M. Juárez, M. Corbi-Pascual, M. Velázquez Martín, J. Jiménez-Mazuecos, S.O. Rosillo Rodríguez, V. Ruiz Quevedo y M. Lázaro: redacción del manuscrito original y revisión del manuscrito.
CONFLICTO DE INTERESESP. Salinas declara honorarios por conferencias y gastos de viajes a conferencias de Inari Medical y Mercé Electromedicina y honorarios por conferencias de Boston Scientific. Los demás autores no declaran conflictos de intereses.
.
Agradecemos el diseño de las ilustraciones al Dr. Manuel Díaz y las imágenes proporcionadas por la Dra. Antonia Delgado en la