Palabras clave
INTRODUCCION
Los episodios tromboembólicos son complicaciones frecuentes de pacientes con disfunción del ventrículo izquierdo, siendo la fracción de eyección el factor predictivo independiente más importante en pacientes que han sufrido un infarto agudo de miocardio1. Mientras que ha sido demostrada la importancia del tratamiento con inhibidores de la enzima conversora de la angiotensina2 y de la espironolactona3 en el pronóstico de los pacientes con insuficiencia cardíaca, principalmente aquellos con dilatación del ventrículo izquierdo y con disfunción sistólica (DS), apenas se ha incidido en la necesidad del tratamiento anticoagulante. Hasta la actualidad no existe ningún ensayo clínico publicado que ponga de manifiesto la conveniencia de anticoagular o no a estos pacientes. Por otro lado, las cifras de la incidencia de episodios tromboembólicos que se barajan son también contradictorias, cifrándose entre el 2 y 3%4,5 en la mayoría de los estudios, pero pueden alcanzar una frecuencia del 80%6, ya que muchos de los episodios pasan desapercibidos. Esto plantea la posibilidad de que estos pacientes formen un grupo de alto riesgo embolígeno7, a pesar de que actualmente no se recomiende de forma generalizada el uso de anticoagulantes orales en la insuficiencia cardíaca8,9.
En términos fisiopatológicos, en el proceso trombótico se han implicado una serie de factores, clásicamente resumidos en la triada de Virchow: a) estasis y alteración en el flujo sanguíneo; b) lesión del endotelio, y c) marcadores protrombóticos. Parece claro que los pacientes con DS participan del primer brazo, ya que la dilatación de las cámaras y la disminución de la contractilidad condicionan tanto la estasis sanguínea como alteraciones en el flujo10. El objetivo del presente trabajo ha sido demostrar un estado protrombótico y/o daño endotelial en pacientes con DS de origen isquémico en ritmo sinusal, en un intento de completar los tres brazos. Previamente, nuestro grupo ha demostrado un estado de hipofibrinólisis en pacientes con miocardiopatía dilatada11.
PACIENTES Y MÉTODOS
Pacientes
Se incluyeron 82 pacientes consecutivos (80 varones y 2 mujeres, de 49,1 ± 7,2 años de edad) con cardiopatía isquémica demostrada, en ritmo sinusal, atendidos en una consulta externa hospitalaria de prevención secundaria de enfermedad coronaria. Todos los pacientes se encontraban estables desde el punto de vista hemodinámico. Así mismo, se seleccionó un grupo control compuesto por 32 sujetos sanos, de similar edad y sexo.
Los criterios de exclusión fueron: a) edad superior a 70 años; b) trombosis venosa o historia de embolismo sistémico; c) cirugía, infección aguda o enfermedad inflamatoria en los últimos 3 meses; d) enfermedad neoplásica; e) haber recibido tratamiento anticoagulante en el último año; f) angina, inestabilidad hemodinámica o deterioro de la clase funcional en los 3 meses previos al estudio; g) infarto de miocardio o revascularización coronaria en el año previo al estudio; g) fibrilación auricular crónica o paroxística, y h) valvulopatía con severidad superior a ligera.
Métodos
Estudios analíticos
La extracción venosa se realizó a primera hora de la mañana, tras 12 h de ayuno, con un reposo previo del paciente de al menos 20 min. Las muestras fueron extraídas sin traumatismo ni estasis, con jeringas precargadas con citrato trisódico (0,011 mol/l de concentración final) por personal especializado. El plasma fue obtenido mediante centrifugación a 4 ºC y 2.200 g, durante 15 min y almacenado a -20 ºC para un procesamiento posterior.
Como marcador de daño endotelial determinamos la concentración plasmática de factor von Willebrand (VW), mediante técnica inmunológica automatizada en coagulómetro STA4 (LIA-VW test, Boehringen-Manheim, Alemania). Como marcadores protrombóticos se analizaron los valores plasmáticos de fibrinógeno (FIB), según método von Claus (Boehringer-Manheim, Alemania) y de dímero D (DD), por técnica inmunológica (LIA-DD test, Boehringen-Manheim, Alemania), ambos de forma automatizada en coagulómetro STA4.
Estudio ecocardiográfico
Se practicó un estudio ecocardiográfico estándar completo (Sonos 2500, Hewlett Packard, EEUU) con análisis en modos M y bidimensional, determinándose el diámetro diastólico ventricular izquierdo (DDVI), diámetro de la aurícula izquierda y fracción de acortamiento (FAC). Se calculó la fracción de eyección por medio del método de área-longitud. También se analizó la existencia de anomalías estructurales cardíacas o valvulares. Mediante Doppler color se valoró la presencia de valvulopatía significativa. Debido a que 12 pacientes no presentaban una suficiente calidad de imagen para la adecuada delimitación del endocardio, no se pudo calcular en ellos la fracción de eyección. Por ello, con el objeto de que estos pacientes no fueran excluidos del análisis utilizamos la FAC para identificar aquellos pacientes con disfunción sistólica. Definimos como DS cuando la FAC era < 29%.
Análisis estadístico
Los resultados se expresan mediante media ± desviación estándar. El análisis estadístico se realizó mediante pruebas paramétricas (t de Student y χ 2 ). La correlación entre variables cuantitativas se realizó por la prueba de Pearson. Un valor de p < 0,05 fue considerado como significativo.
RESULTADOS
De los 82 pacientes estudiados, 26 cumplieron criterios de DS. Los datos demográficos, clínicos y ecocardiográficos de los pacientes se resumen en la tabla 1. En el subgrupo de pacientes con DS, 15 habían presentado clínica de insuficiencia cardíaca y todos ellos se encontraban en el momento de realizar el estudio en clase funcional I o II de la NYHA. En el subgrupo sin DS, sólo 6 pacientes habían presentado insuficiencia cardíaca en algún momento de su evolución. En ningún paciente se evidenciaron trombos intracavitarios en la ecocardiografía transtorácica. De los pacientes estudiados, 79 recibían tratamiento antiagregante. Así mismo, 49 de los 52 pacientes con dislipemia estaban en tratamiento continuado con estatinas.
Respecto al grupo control, ninguno de los sujetos estudiados tenía antecedentes de cardiopatía isquémica o accidente cerebrovascular. Tenían hábito tabáquico 12 de ellos, ocho eran hipertensos y 13 presentaban dislipemia. Ninguno era diabético.
El global de los pacientes con cardiopatía isquémica evidenció unos valores estadísticamente superiores de VW (109,2 ± 31,9 frente a 85,5 ± 32,6; p < 0,01) respecto al grupo control, pero no de DD ni FIB (tabla 2). La comparación entre los marcadores trombóticos en los pacientes con cardiopatía isquémica, según la presencia o no de DS, se refleja en la tabla 3. Los pacientes con DS presentaron valores superiores de DD y FIB (p < 0,05).
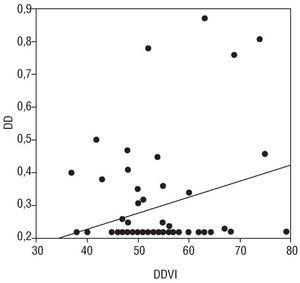
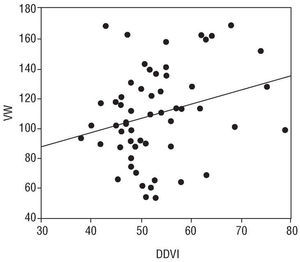
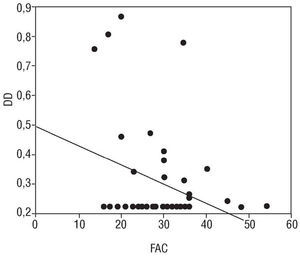
Encontramos una correlación positiva entre el VW y DD y el DDVI (r: 0,27; p < 0,05 y r: 0,28; p < 0,05, respectivamente), y una correlación negativa entre el DD y la FAC (r: 0,20; p < 0,05) (figs. 1-3).
Fig. 1. Se observa una correlación estadísticamente significativa, aunque débil, entre los valores de dímero D (DD) y el diámetro diastólico del ventrículo izquierdo (DDVI), r: 0,28; p < 0,05.
Fig. 2. Se observa una correlación significativa, aunque igualmente débil, entre los valores del factor von Willebrand (VWF) y el diámetro diastólico del ventrículo izquierdo (DDVI), r: 0,27, p < 0,05
Fig. 3. Se aprecia una correlación negativa entre la concentración de dímero D (DD) y la fracción de acortamiento (FAC), r: 0,20, p < 0,05.
No hubo ninguna asociación entre los factores de riesgo cardiovascular o presencia de aneurisma ventricular y los marcadores hemostáticos, aunque sí se encontró una asociación entre la presencia de diabetes y la DS (p < 0,01). Los valores hemostáticos no pusieron de manifiesto una correlación significativa con el diámetro auricular izquierdo.
DISCUSION
Se ha cifrado que existe un incremento del 18% de riesgo embolígeno por cada 5% de reducción de la fracción de eyección11 en pacientes con DS del ventrículo izquierdo, por lo que el riesgo tromboembólico en estos pacientes es un aspecto a tener en cuenta. Sin embargo, en la mayoría de los estudios clínicos sobre insuficiencia cardíaca, los episodios tromboembólicos son objetivos secundarios si se comparan con la mortalidad o el reingreso10. Dicha infraestimación del problema ha repercutido en la indicación del tratamiento anticoagulante de estos pacientes, y en la actualidad no está recomendado en pacientes en ritmo sinusal, sin episodio tromboembólico previo u otro factor de riesgo8,9.
Al igual que en la fibrilación auricular crónica, la dilatación del ventrículo izquierdo con DS parece participar de los tres aspectos fisiopatológicos del proceso trombótico. En el caso de la fibrilación auricular se resumen en: a) disminución del gasto cardíaco y estasis en la orejuela12; b) alteraciones en el endotelio13, y c) alteraciones hemostásicas14,15. Se puede observar cómo la presencia de insuficiencia cardíaca y fracción eyección deprimida constituyen factores de riesgo trombótico independientes en la fibrilación auricular crónica16. Por otra parte, se ha reconocido que la fibrilación auricular constituye un marcador de riesgo en los pacientes con insuficiencia cardíaca17.
De igual modo, los pacientes con dilatación del ventrículo izquierdo y DS podrían participar de los mismos mecanismos fisiopatológicos. El deterioro de la contractilidad y la dilatación de las cavidades contribuyen a una alteración en el flujo, que puede predisponer a la formación de un trombo y la consecuente embolización18. Este fenómeno per se podría generar un estado de hipercoagulabilidad, como ya se ha observado en aquellos pacientes con fibrilación auricular que presentan trombos en la orejuela19. Por otro lado, nuestro grupo ha comprobado que, incluso en pacientes con estenosis mitral en ritmo sinusal, se produce una activación de la coagulación, lo que sugiere que la dilatación auricular genera una situación de estasis y alteración del flujo, independiente de la existencia o no de fibrilación auricular20.
El objetivo de nuestro trabajo fue estudiar los otros dos brazos de la clásica triada. Títulos aumentados de FIB pueden incrementar la formación de fibrina y la agregación plaquetaria, y además parecen afectar la viscosidad sanguínea y la agregación de los hematíes. La elevación de los valores plasmáticos de FIB se ha asociado con una mayor morbimortalidad cardiovascular21. La concentración de DD refleja fielmente la formación y destrucción de fibrina22. Valores aumentados de DD se encuentran en situaciones donde existe una activación de la coagulación, como la coagulación intravascular diseminada o la trombosis venosa profunda; además, se ha sugerido que concentraciones elevadas de DD podrían predecir acontecimientos coronarios23. Por otra parte, el VW es un marcador de daño endotelial que se ha asociado tanto a la presencia de enfermedad vascular como a un peor pronóstico en pacientes con cardiopatía isquémica24.
Respecto a los marcadores hemostáticos del presente estudio, los pacientes con DS presentaron valores significativamente más elevados de DD y FIB, aunque no existían entre el global de los pacientes y el grupo control. Estudios previos han demostrado cómo los pacientes con insuficiencia cardíaca presentan títulos más elevados de DD y FIB25,26, concretamente pacientes isquémicos con insuficiencia cardíaca presentaban valores de DD más elevados que aquellos con cardiopatía isquémica sin insuficiencia cardíaca27. Como máxima expresión de estasis parece esperable que se encuentren valores de DD y FIB significativamente más elevados en pacientes coronarios con aneurisma del ventrículo izquierdo respecto a aquellos con un ventrículo normal28. Se ha observado que el valor de DD se correlaciona de forma negativa con la fracción de eyección del ventrículo izquierdo29. En nuestro caso, el DD correlaciona con la FAC y con el DDVI, lo cual puede reflejar que, a menor contractilidad y mayor dilatación, mayores son las alteraciones reológicas y, por tanto, la activación de la coagulación.
El brazo del daño endotelial se ha estudiado con los valores de VW. Así, el global de nuestros pacientes presentó valores significativamente más elevados de VW respecto al grupo control. Son numerosas las series que demuestran la presencia de daño endotelial en los pacientes con cardiopatía isquémica30, encontrándose una elevación tanto de VW como del activador tisular del plasminógeno31-34. La mayor elevación del VW se ha descrito en aquellos pacientes isquémicos con aneurisma de ventrículo izquierdo, lo que podría reflejar que la zona aneurismática tiene un mayor daño endotelial y que, por otra parte, la formación de los aneurismas es más frecuente en aquellos pacientes con cardiopatía isquémica más severa28. En nuestro caso, las diferencias de los valores de VW entre pacientes con DS y sin ella estaban en el límite de la significación estadística. No obstante, la correlación entre el DDVI y la concentración del VW hace pensar que a mayor dilatación, mayor daño endotelial, hecho también descrito previamente en pacientes con aneurisma ventricular28. La baja incidencia de aneurisma ventricular izquierdo probablemente ha influido en que en nuestra serie no hubiera diferencias significativas en este subgrupo.
Debemos de reseñar que, si bien las diferencias en los parámetros estudiados fueron estadísticamente significativas, la debilidad en los coeficientes de correlación y la importante dispersión de los valores invita a tomar con cautela los datos presentados. Así, aunque desde el punto fisiopatológico en los pacientes con DS parecen cumplirse los tres brazos de la triada de Virchow (alteraciones en el flujo sanguíneo, en la pared del vaso y en los constituyentes sanguíneos), lo cual sugeriría un efecto beneficioso del tratamiento anticoagulante prolongado, resultados preliminares del estudio HELAS (Heart Failure Long Term Antithrombotic Study) y de Guazzoti et al, presentados ambos recientemente35,36, no conceden tal beneficio en la evolución de los pacientes. Por tanto, aunque en estos pacientes se detecta una activación de la coagulación, que incluso parece mejorar al introducir el tratamiento anticoagulante, con la reducción de los marcadores hemostáticos25,28, dicho tratamiento no ha demostrado una reducción de la morbimortalidad de estos pacientes, pudiendo por otro lado verse incrementadas las complicaciones hemorrágicas4,5,37. Haciendo un símil con la fibrilación auricular, serían necesarios estudios para identificar dentro de los pacientes con insuficiencia cardíaca, cuales serían los portadores de un número de factores de riesgo tales que los haga subsidiarios de recibir tratamiento anticoagulante.
AGRADECIMIENTOS
Debemos agradecer a D. José Llorca su ayud a en el procesamiento técnico de las muestras y a Dña. Maria Dolores Pérez, Dña. Carmen Giménez y Dña. Sara Molina su colaboración en la extracción de las muestras de los pacientes.
Correspondencia: Dr. F. Marín Ortuño. Servicio de Cardiología. Hospital General Universitario de Alicante. Pintor Baeza, s/n. 03002 Alicante.
Correo electrónico: fr.marino@coma.es Recibido el 16 de noviembre de 2000. Aceptado para su publicación el 16 de marzo de 2001.