La prevención del ictus tras la ablación con catéter de la fibrilación auricular sigue siendo un tema controvertido. La anticoagulación oral se asocia con una reducción significativa del riesgo de ictus en la población general con fibrilación auricular; sin embargo, puede asociarse con mayor riesgo de hemorragia grave, por lo que debe tenerse en cuenta la relación riesgo-beneficio. La mejora en el éxito de la ablación con catéter y el uso generalizado de dispositivos de monitorización cardiaca permitirían nuevas estrategias de anticoagulación en algunos subgrupos de pacientes con fibrilación auricular, que pueden ayudar en la prevención de accidentes cerebrovasculares y minimizar el riesgo de hemorragia. En esta revisión, se analiza el riesgo de ictus en la fibrilación auricular y los efectos en el riesgo tromboembólico de una ablación con catéter exitosa. También se profundiza en las estrategias novedosas para la prevención del ictus tras una ablación con catéter exitosa.
Palabras clave
La fibrilación auricular (FA) se caracteriza por un ritmo cardiaco irregular que se asocia con mayor riesgo de ictus, eventos adversos cardiovasculares mayores, insuficiencia cardiaca y mortalidad1. Los 3 pilares del tratamiento de la FA son: a) prevención del ictus; b) mejor control de los síntomas con control del ritmo o de la frecuencia basado en los síntomas y centrado en el paciente, y c) abordaje de los factores de riesgo cardiovascular y el estilo de vida2. Este enfoque holístico, al que se denomina vía de «mejor asistencia para la fibrilación auricular» (MAFA), se ha asociado con mejor resultado clínico en diversas cohortes de ensayos retrospectivos y prospectivos3,4.
Aunque los anticoagulantes orales (ACO) son la piedra angular de la prevención del ictus5,6, el control del ritmo mediante la ablación con catéter se ha asociado también con reducción del riesgo de ictus7. Las guías vigentes recomiendan la prescripción de ACO en función de la puntuación CHA2DS2-VASc8-10, pero no está claro si este enfoque encaja bien con la cohorte moderna de pacientes con FA tras ablación de la FA, en especial aquellos cuya carga de FA se ha reducido mucho.
En consecuencia, es importante considerar si los ACO a largo plazo (aunque en general son seguros, en algunos casos pueden llevar a una hemorragia con peligro para la vida11,12) están justificados después de una ablación realizada con éxito. En esta revisión descriptiva se comentan 3 abordajes novedosos de la prevención del ictus.
FIBRILACIÓN AURICULAR, RIESGO DE ICTUS Y EFECTO DE LA ABLACIÓN CON CATÉTERAntes de examinar enfoques específicos para la prevención del ictus, es importante describir la situación. En primer lugar se examina la asociación entre la FA y el ictus, los efectos del control del ritmo y las recomendaciones actuales de las guías.
FIBRILACIÓN AURICULAR Y RIESGO PROTROMBÓTICOLa FA conlleva un aumento del riesgo trombótico, puesto que cumple los 3 aspectos de la tríada de Virchow de la trombosis. Se produce estasis del flujo sanguíneo debida a que la FA impide la contracción auricular. Esto afecta en especial a la orejuela izquierda, donde se estima que se forma el 90% de los trombos relacionados con FA13. Además, tanto los biomarcadores que reflejan la protrombosis como los que indican una lesión endotelial están elevados en la FA13.
Mientras que las comorbilidades cardiovasculares se asocian con alto riesgo protrombótico, la presencia de FA aumenta por sí sola este riesgo13. Se ha observado que los pacientes con FA y sin factores de riesgo tromboembólico tienen mayores cifras de biomarcadores protrombóticos que los controles de iguales características14-16. Los pacientes con FA paroxística pueden presentar una activación de la cascada de la coagulación y signos de lesión endotelial a las pocas horas de iniciarse la arritmia; se ha observado que estos cambios dependen de la duración de la FA paroxística, pero no de la edad, el sexo, el índice de masa corporal ni la puntuación CHA2DS2-VASc17.
Además, el restablecimiento del ritmo sinusal por medio de cardioversión puede reducir la actividad plaquetaria en un plazo de 4 semanas18, y el mantenimiento del ritmo sinusal mediante ablación con catéter puede mejorar la situación trombótica general con un aumento de la fibrinolisis; este cambio no se ha observado en los pacientes con una recaída de la FA19.
CARGA DE ARRITMIA, ICTUS Y ABLACIÓN CON CATÉTERDurante la última década ha crecido el uso de la monitorización cardiaca y los dispositivos cardiacos implantables, con lo que se ha introducido el concepto de «carga de FA», el porcentaje del tiempo que una persona pasa en FA. La carga de FA es un marcador importante de los riesgos de ictus y de mortalidad aunque con frecuencia los pacientes estén asintomáticos20-22. Un análisis combinado de 5 estudios prospectivos observó que la carga de FA detectada mediante dispositivos estaba relacionada con el aumento del riesgo de ictus isquémico a lo largo de 24 meses de seguimiento23. En el estudio KP-RHYTHM, realizado en 1.965 pacientes no anticoagulados con FA paroxística, los del tercil superior de carga de FA mostraron una tasa ajustada de tromboembolia 3 veces superior a la observada en el conjunto de los 2 terciles inferiores24. Más recientemente se han observado resultados distintos en 2 grandes ensayos controlados y aleatorizados sobre los efectos de la anticoagulación para la FA detectada mediante dispositivos y de una duración ≥ 6 min25,26. No obstante, en un metanálisis de datos de estudio de estos ensayos se demostró que los ACO edoxabán y apixabán reducen el riesgo de ictus y aumentan el riesgo de hemorragia de los pacientes con FA detectada por dispositivos27.
Se ha demostrado que, comparada con el tratamiento médico, la ablación con catéter reduce la carga de FA de los pacientes con FA paroxística28,29 o persistente30,31, y que es superior al tratamiento con fármacos antiarrítmicos para reducir la reaparición de la FA32. Además, la ablación también retrasa la progresión de la FA de paroxística a persistente, que de producirse elevaría el riesgo de ictus33,34. Por ejemplo, en un estudio controlado y aleatorizado de 225 pacientes, se observó que el 2,4% de los tratados con ablación presentaron una progresión de la FA paroxística a persistente, en comparación con el 17,5% de los pacientes tratados con fármacos antiarrítmicos (p=0,0009)35. Asimismo, en el ensayo EARLY-AF, el 1,9% de los 303 pacientes tratados inicialmente mediante ablación con criobalón presentaron un episodio de FA persistente, en comparación con el 7,4% de los que recibieron tratamiento médico (hazard ratio [HR] = 0,25; intervalo de confianza del 95% [IC95%], 0,09-0,70)36. Se observaron resultados similares en los pacientes que requirieron una nueva ablación37.
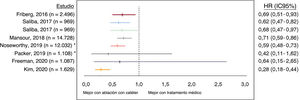
RIESGO DE ICTUS DESPUÉS DE LA ABLACIÓN CON CATÉTEREn estudios recientes se ha señalado que la ablación con catéter puede ser eficaz para reducir el riesgo de ictus (figura 1). En un estudio con emparejamiento por puntuación de propensión de 8.145 pacientes (en proporción 1:2:2 de las cohortes de ablación de la FA, tratamiento médico y participantes sin FA), la tasa de incidencia (cada 100 años-persona) de ictus isquémico fue significativamente inferior en los pacientes tratados con ablación con catéter que en los que recibieron tratamiento médico (el 0,3 frente al 1,09%; p<0,001) y fue similar a la de los pacientes sin FA (0,34%; p=0,673 en comparación con la ablación)38. Además, los pacientes que permanecieron en ritmo sinusal después de la ablación con catéter presentaron un riesgo de ictus inferior al de los pacientes con recaídas de la FA, lo cual indica que la calidad del control de la FA es importante. En un estudio retrospectivo de una amplia base de datos de 183.760 pacientes con FA, se observó que la ablación con catéter se asocia con una reducción significativa del riesgo de ictus isquémico (HR = 0,59; IC95%, 0,48-0,73; p<0,001)39. Se han descrito resultados similares en otros estudios de observación sobre ablación con catéter o medicación antiarrítmica7,40,41, lo cual indica que el mantenimiento del rimo sinusal influye en la reducción del riesgo de ictus, en especial cuando el control del ritmo se inicia precozmente (<3 meses).
Estudios que demuestran el efecto de la ablación con catéter en comparación con el tratamiento médico en el riesgo de ictus. HR: hazard ratio; IC95%: intervalo de confianza del 95%. *HR sin ajustar. Reproducido con permiso de Ding et al.7
Hasta la fecha, no hay ensayos controlados y aleatorizados con potencia estadística suficiente en los que se hayan investigado los efectos de la ablación con catéter en el riesgo de ictus por FA. En el ensayo en curso OCEAN, del que está previsto que termine a finales de 2025, se evalúa el empleo de rivaroxabán en comparación con ácido acetilsalicílico en pacientes sin recaída de la FA 12 meses después de la ablación, y es posible que esto sea útil para orientar las estrategias futuras42.
GUÍAS ACTUALES PARA LA ANTICOAGULACIÓNEn las guías vigentes no se establecen distinciones entre pacientes con FA no tratada con ablación y pacientes en ritmo sinusal tras la ablación. Aunque difieren, casi con seguridad, por lo que respecta al riesgo de ictus, continúa sin estar claro dónde debe situarse el umbral para el tratamiento con ACO.
También, la mayoría de los estudios sobre ablación con catéter presentan los resultados a 1 o 2 años, y la evidencia respecto al mantenimiento del ritmo sinusal a más largo plazo es escasa. Las tasas de éxito de la ablación en el contexto de la FA persistente son discretas43, por lo que existe la preocupación de que las recaídas de la FA no detectadas puedan aumentar el riesgo de ictus de manera inadvertida44.
En consecuencia, las guías son razonablemente cautelosas y no recomiendan el cese de los ACO a largo plazo a pesar de una ablación con catéter realizada con éxito en los pacientes con mayor riesgo45. Sin embargo, esta decisión no está exenta de peligros, ya que el tratamientocon ACO implica un riesgo de hemorragia mayor que puede poner en peligro la vida del paciente46-50.
NUEVAS ESTRATEGIAS PARA LA PREVENCIÓN DEL ICTUSInterrupción de la anticoagulación después de una ablación con catéter realizada con éxitoLa primera estrategia novedosa puede consistir en suspender por completo los ACO después de una ablación con catéter exitosa. Esto reduce al mínimo el riesgo de hemorragia y es posible que mejore la calidad de vida al reducir la ansiedad, la cantidad de comprimidos tomados y la preocupación en relación con las intervenciones invasivas. Muchos electrofisiólogos están aplicando ya este enfoque51-53. Por ejemplo, en un estudio retrospectivo de 21.595 pacientes del registro ORBIT-AF, se observó que alrededor de 1 de cada 4 pacientes con una puntuación CHA2DS2-VASc ≥ 2 suspendieron el tratamiento con ACO, en su mayoría 2 meses después de la ablación52. ¿Hasta qué punto la evidencia actual respalda esta estrategia?
En 2 metanálisis no se observó ninguna diferencia en las tromboembolias entre los pacientes que suspendieron los ACO y los que continuaron después de una ablación con catéter exitosa54,55, ni siquiera cuando se aplicó una estratificación por puntuación CHA2DS2-VASc55. Yang et al.56 llegaron a la conclusión de que era seguro suspender los ACO después de la ablación, manteniendo una vigilancia estrecha, si no había recaída de la FA, antecedentes de ictus o embolia sistémica ni diabetes mellitus. Estos estudios deben interpretarse con precaución. En los 3 casos, las estimaciones puntuales indicaban una tendencia a la reducción del riesgo de ictus al suspender los ACO. Es probable que esto se explique por un sesgo en las poblaciones estudiadas: tanto en los metanálisis como en el estudio de Yang et al.56, los factores de riesgo fueron mayores en los grupos que continuaron los ACO, lo cual probablemente refleje la preferencia de los médicos por continuar con los ACO en los pacientes con un riesgo tromboembólico más alto. De hecho, en otros 2 metanálisis se observó que continuar con los ACO a largo plazo reduce de manera significativa el riesgo tromboembólico de los pacientes con CHA2DS2-VASc ≥ 257,58. Todos esos estudios mostraron resultados coherentes por lo que respecta al riesgo de hemorragia, que se redujo significativamente al suspender los ACO, lo cual resalta nuevamente las posibles consecuencias en cuanto a la seguridad.
Una cuestión importante que tener en cuenta es cómo abordar la recaída de la arritmia tras la ablación. Esto no tiene trascendencia en el periodo inmediato tras la ablación durante el que la anticoagulación es obligatoria. Sin embargo, en los pacientes que han suspendido la anticoagulación y tienen recaídas de la arritmia muy sintomáticas y pueden requerir cardioversión, puede ser necesaria una ecocardiografía transesofágica o una exploración de imagen transversal con exposición a rayos X para descartar un trombo en la orejuela. Por fortuna, esta es una situación muy poco frecuente y no es necesaria para los pacientes que acuden en las 48h siguientes a la recaída de la arritmia.
Teniendo en cuenta los metanálisis con resultados contradictorios y la ausencia de ensayos controlados y aleatorizados de gran calidad, la base de evidencia para una suspensión generalizada y no dirigida de los ACO tras la ablación con catéter parece dudosa. Sin embargo, la suspensión completa no es la única forma de gestionar los ACO después del control del ritmo.
ANTICOAGULACIÓN INTERMITENTE («COMPRIMIDO EN EL BOLSILLO»)Una estrategia intermedia entre la continuación a largo plazo y la suspensión completa es la anticoagulación intermitente. Como se ha descrito antes, los biomarcadores protrombóticos están aumentados temprano tras el inicio de la FA. Si puede realizarse una vigilancia fiable de la recaída de la FA después de la ablación, esto brinda la posibilidad de un abordaje de autotratamiento a demanda («comprimido en el bolsillo»). Se utiliza a menudo un enfoque de este tipo con antiarrítmicos como la flecainida, de tal manera que el paciente simplemente toma una dosis cuando aparecen los síntomas. Esta no es una estrategia habitual para la anticoagulación en la práctica clínica actual, aunque tiene algunos defensores59.
Un enfoque de este tipo depende de diversos factores, y en especial de los siguientes: a) ¿de qué modo se puede realizar una vigilancia fiable de la reaparición de la FA en el contexto ambulatorio?; b) ¿qué evidencia hay de una asociación temporal entre el inicio de la FA y el ictus?, y c) ¿cuál es el umbral óptimo para iniciar o suspender los ACO? A continuación se abordan estos aspectos.
VIGILANCIA DE LA RECAÍDA: DISPOSITIVOS INTELIGENTES PORTÁTILESCon la introducción y la aceptación generalizada de los dispositivos inteligentes portátiles, se dispone de mejores sistemas de vigilancia para permitir la detección de la recaída asintomática de la FA después de la ablación60. Muchas de estas tecnologías tienen sistemas integrados para determinar la carga de la FA. En el Apple Heart Study, el uso de un enfoque de vigilancia mediante un reloj inteligente resultó eficaz para detectar la FA en una cohorte no seleccionada de pacientes sin diagnóstico previo del trastorno61. También se han publicado estudios de gran tamaño con otras tecnologías, como la pulsera o el reloj de pulsera de Huawei62 o los dispositivos Fitbit63 para la detección de la FA. Es posible que esos dispositivos permitan una detección temprana de la recaída de la FA después de la ablación y pueden aportar información útil para la reintroducción del tratamiento con ACO.
No obstante, estos dispositivos tienen varias limitaciones59,64. En primer lugar, no proporcionan una monitorización cardiaca pasiva continua, si no que realizan verificaciones intermitentes para detectar la irregularidad del pulso y, cuando se alcanzan determinados umbrales, lo notifican al usuario. Esto puede hacer que no se detecten los episodios de FA de menor duración, aunque hay controversia sobre su trascendencia. En segundo lugar, dado que los dispositivos se llevan durante la vida cotidiana, se ven afectados a menudo por artefactos de movimiento, es decir, muchos de ellos suspenden el análisis cuando se detecta un artefacto excesivo. Por último, estos dispositivos requieren la adherencia del paciente a largo plazo para detectar la FA de manera fiable, y es posible que esto no sea apropiado en todos los casos.
LA ASOCIACIÓN TEMPORAL ENTRE LA FIBRILACIÓN AURICULAR Y EL ICTUSAunque, como ya se ha descrito, los biomarcadores protrombóticos aumentan poco después de iniciarse, la FA en sí no siempre precede al ictus de una forma lógica. En un estudio de 51 pacientes portadores de dispositivos implantables que sufrieron ictus o embolia sistémica, en el 92% no se detectó una FA en los 30 días previos al evento65. No se realizó una subclasificación de esos ictus, por lo que la incidencia real del ictus cardioembólico es incierta. En 2 estudios más grandes con monitorización cardiaca continua, se observó que, si bien un episodio de FA ≥ 5,5h implicó un aumento transitorio del riesgo de ictus, en la mayoría de los pacientes (aproximadamente 3 de cada 4) no hubo signos de FA ≥ 6min en los 120 días anteriores al ictus isquémico66,67.
Además, un ensayo controlado y aleatorizado en el que se investigó una estrategia de inicio temprano e interrupción del tratamiento con ACO basándose en la FA detectada a distancia, se interrumpió prematuramente al no observarse una mejora de los resultados en comparación con el tratamiento convencional, debido en parte a la disociación en el tiempo entre los eventos de FA y de ictus68. Sin embargo, ese estudio se basó en gran medida en el empleo de anticoagulantes antagonistas de la vitamina K, que tienen inicio y finalización de la acción más prolongados que los de los modernos anticoagulantes orales no antagonistas de la vitamina K (NACO). En estudios piloto se ha mostrado la viabilidad de una administración de los NACO guiada por dispositivos de monitorización implantables69,70, pero no se han demostrado aún la seguridad y la eficacia de este enfoque.
El ensayo aleatorizado de no inferioridad REACT-AF (NCT05836987) iniciará este año el reclutamiento de 5.350 pacientes en Estados Unidos59. En este ensayo se comparará el tratamiento con un NACO guiado por un reloj inteligente frente al uso de un NACO a largo plazo, y es de esperar que se obtengan más datos para respaldar este concepto.
UMBRALES PARA LA ANTICOAGULACIÓN INTERMITENTEPara que la estrategia de «comprimido en el bolsillo» sea eficaz, debe haber un umbral definido para iniciar la anticoagulación transitoria. En varios estudios se ha utilizado un umbral de 5,5 h sobre la base de los resultados del estudio TRENDS71. En este estudio se observó que el riesgo de ictus aumentaba a aproximadamente el doble en los pacientes con una carga de FA ≥ 5,5h en un periodo dado de 30 días, aunque debe señalarse que no se alcanzó la significación estadística tradicional (HR=2,20; IC95%, 0,96-5,05; p=0,06). Además, el valor de 5,5 h fue la mediana de carga de los pacientes que tuvieron una carga de arritmia no nula, y se eligió a causa de la falta de evidencia previa con que dicotomizar las cohortes en pacientes de carga baja y alta. Por otra parte, la carga de FA varía a lo largo del tiempo y ello puede estar relacionado con la progresión a una FA manifiesta72.
Para que un enfoque de «comprimido en el bolsillo» sea útil en la práctica clínica, puede ser necesario un umbral más bajo. Esto se haría en parte para optimizar el beneficio en la prevención del ictus, aceptando que esto constituye una falsa dicotomía de una escala continua, pero también principalmente para reducir al mínimo la intensidad de la monitorización necesaria para la detección. Cuanto más alto sea el umbral, más molesta será la monitorización necesaria, y ello puede afectar negativamente a la adherencia.
Sería necesario también un umbral para suspender la anticoagulación transitoria. Los estudios realizados indican que, en los pacientes con una FA previa a un ictus isquémico, el riesgo tromboembólico aumenta de manera significativa en los primeros 5-10 días66. En consecuencia, es posible que 10 días de anticoagulación después de un episodio de FA de una duración de, tal vez, 2 h sea razonable. Sería necesario un ensayo prospectivo y aleatorizado de gran calidad para demostrar el beneficio aportado por un enfoque de este tipo. En la actualidad, hay muchas preguntas pendientes de respuesta que impiden recomendar la anticoagulación intermitente para los pacientes con FA.
COMBINACIÓN DE LA ABLACIÓN CON CATÉTER Y CIERRE DE LA OREJUELA IZQUIERDAUna tercera estrategia novedosa, que podría obviar la necesidad de decidir entre la anticoagulación a largo plazo y la anticoagulación intermitente para determinados pacientes seleccionados, es abordar el riesgo de ictus durante la ablación utilizando el cierre de la orejuela izquierda (COI). Esto se basa en la observación de que la mayoría de los trombos cardioembólicos que se observan en la FA se forman en la orejuela izquierda; por consiguiente, aislar esta estructura debería prevenir la migración del trombo al resto del organismo.
En la comunidad de la electrofisiología hay un interés creciente en realizar la ablación de la FA y el COI como una intervención combinada. Los motivos de preocupación expresados anteriormente respecto a este enfoque fueron la prolongación del tiempo de permanencia en la aurícula izquierda asociado con las técnicas de ablación antiguas y el aumento del riesgo trombótico inicial a causa de la lesión endotelial producida por la ablación y de la exposición de la sangre al dispositivo. Con la aparición de la ablación de campo pulsado, que es más rápida y segura que las técnicas de radiofrecuencia o de criobalón, es posible que la intervención combinada sea más viable que nunca antes73. Además, la intervención combinada reduce también el riesgo que conllevan el acceso femoral y la punción transeptal, que tendrían que realizarse 2 veces si las intervenciones se llevaran a cabo por separado. También es posible que los costes puedan reducirse al disminuir al mínimo el tiempo total de la intervención en comparación con el de 2 intervenciones separadas.
Otra ventaja de este abordaje en una sola sesión es que permite abordar perfectamente las mencionadas preocupaciones acerca de la disociación temporal entre la FA y el ictus. Sea cual fuere la cronología, el lugar donde se produce la formación del trombo sigue siendo probablemente la orejuela; por consiguiente, mediante el COI y el restablecimiento del ritmo sinusal, es posible que pueda reducirse al mínimo el riesgo de ictus con una sola intervención. Esto puede permitir también la suspensión de la anticoagulación a largo plazo74, con lo que se reduce al mínimo el riesgo de hemorragia. Otro beneficio es que la monitorización intermitente con dispositivos portátiles inteligentes pasaría a ser innecesaria, con lo que se reduciría la carga para el paciente y se mejoraría su calidad de vida.
Un enfoque de este tipo requeriría un ensayo controlado y aleatorizado de gran tamaño para demostrar el beneficio y la relación coste-eficacia favorable antes de que se pueda recomendarlo. Esto se debe a que el COI implica un riesgo adicional en comparación con el la ablación sola, por ejemplo por la embolización del dispositivo o la trombosis relacionada con este. No obstante, parte de este riesgo se contrarresta al combinar las 2 intervenciones, en especial por lo que respecta al riesgo de lesión vascular femoral y las complicaciones transeptales, ya que ambas técnicas son necesarias para la ablación incluso si no se lleva a cabo el COI.
LIMITACIONES Y ASISTENCIA INDIVIDUALIZADADel mismo modo que no todos los pacientes son aptos para la anticoagulación a largo plazo, es lógico pensar que no todos los pacientes serán aptos para las estrategias novedosas comentadas. A algunos pacientes, la monitorización a largo plazo con un dispositivo portátil inteligente les puede resultar molesta o es posible que no sean capaces de usar las tecnologías necesarias. Es posible que algunos pacientes prefieran continuar con los ACO debido al riesgo de ictus percibido, mientras que otros podrían preferir la suspensión de la anticoagulación a largo plazo debido al riesgo de hemorragia percibido. En algunos casos la anatomía de la orejuela izquierda puede no ser apropiada para el COI.
Además, la FA es un marcador de una miocardiopatía auricular subyacente que confiere, de por sí, un aumento del riesgo de ictus, incluso en ausencia de FA75-77. Esto está respaldado por la evidencia que indica que un valor alto de CHA2DS2-VASc puede predecir el ictus isquémico en las personas a las que no se ha diagnosticado una FA78. Por este motivo, algunos médicos prefieren continuar con la anticoagulación cuando se logra controlar el ritmo en la práctica clínica actual. De hecho, es posible que la FA sea más un factor de riesgo de ictus que su causa primaria. Aunque este factor no debe impedir la realización de estudios a gran escala para evaluar nuevas estrategias de anticoagulación, sí es una razón plausible por la que estos abordajes puedan no dar resultado y podría explicar la mencionada disociación temporal.
Así pues, es posible que haya un umbral a partir del cual deba recomendarse la anticoagulación a largo plazo en vez de las nuevas estrategias, incluso en caso de que se demuestre la eficacia de estas en ensayos clínicos. Lo mismo ocurre en el caso de los pacientes con una carga de FA elevada después de una ablación no exitosa. Es posible que estas limitaciones sean menos aplicables a la intervención combinada de ablación + COI, pero aún no existe una base de evidencia al respecto. También es posible que las técnicas de imagen cardiacas puedan desempeñar un papel en la identificación de los pacientes que tienen el máximo riesgo.
La toma de decisiones compartida e individualizada continúa siendo clave. Para que los nuevos enfoques de prevención del ictus resulten beneficiosos, será crucial identificar a los pacientes apropiados y asesorarles respecto a las opciones disponibles. Es importante señalar que la mayor parte de la base de evidencia corresponde al tipo de FA denominado «FA no valvular», es decir, una FA que no se asocia con estenosis mitral de moderada a grave. Es posible que las nuevas estrategias de anticoagulación no sean aplicables a los pacientes con una FA «valvular». Esta revisión resalta el hecho de que se dispone de numerosas estrategias individualizables a pacientes específicos.
En términos generales, existen razones lógicas para prever que el riesgo de ictus continúe siendo alto a pesar de que se tenga éxito en el control del ritmo en la FA. De igual modo, aunque el control del ritmo, en especial con la ablación con catéter, es muy eficaz a corto y medio plazo, no es posible realizar un seguimiento a muy largo plazo en ensayos controlados y aleatorizados, y deben tenerse en cuenta las recaídas décadas después de haber obtenido el control del ritmo. Estos factores, junto con la falta de evidencia de gran calidad tanto sobre la reducción del riesgo de ictus mediante ablación con catéter como sobre los nuevos enfoques descritos aquí, hacen difícil recomendar cambios radicales en la práctica clínica. Sin embargo, otra cuestión que tener en cuenta es que continúa sin haberse demostrado el efecto beneficioso de la anticoagulación a largo plazo en la cohorte de pacientes sometidos con éxito a ablación con catéter para la FA.
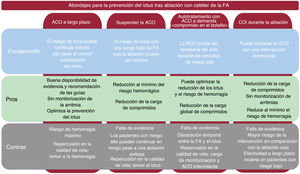
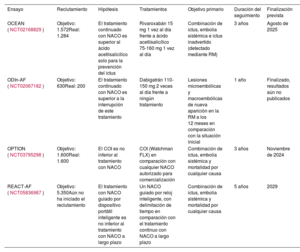
Está claro que la situación es propicia para la realización de estudios controlados y aleatorizados de alta calidad. En la tabla 1 se resumen 4 de estos ensayos actualmente en curso. En la figura 2 se indican los pros y contras de diferentes estrategias de prevención del ictus.
Estudios en curso de nuevos enfoques de prevención del ictus tras la ablación con catéter de la FA
| Ensayo | Reclutamiento | Hipótesis | Tratamientos | Objetivo primario | Duración del seguimiento | Finalización prevista |
|---|---|---|---|---|---|---|
| OCEAN (NCT02168829) | Objetivo: 1.572Real: 1.284 | El tratamiento continuado con NACO es superior al ácido acetilsalicílico solo para la prevención del ictus | Rivaroxabán 15 mg 1 vez al día frente a ácido acetilsalicílico 75-160 mg 1 vez al día | Combinación de ictus, embolia sistémica e ictus inadvertido (detectado mediante RM) | 3 años | Agosto de 2025 |
| ODIn-AF (NCT02067182) | Objetivo: 630Real: 200 | El tratamiento continuado con NACO es superior a la interrupción de este tratamiento | Dabigatrán 110-150 mg 2 veces al día frente a ningún tratamiento | Lesiones microembólicas y macroembólicas de nueva aparición en la RM a los 12 meses en comparación con la situación inicial | 1 año | Finalizado, resultados aún no publicados |
| OPTION (NCT03795298) | Objetivo: 1.600Real: 1.600 | El COI es no inferior al tratamiento con NACO | COI (Watchman FLX) en comparación con cualquier NACO autorizado para comercialización | Combinación de ictus, embolia sistémica y mortalidad por cualquier causa | 3 años | Noviembre de 2024 |
| REACT-AF (NCT05836987) | Objetivo: 5.350Aún no ha iniciado el reclutamiento | El tratamiento con NACO guiado por dispositivo portátil inteligente es no inferior al tratamiento con NACO a largo plazo | Un NACO guiado por reloj inteligente, con delimitación de tiempo en comparación con el tratamiento continuo con NACO a largo plazo | Combinación de ictus, embolia sistémica y mortalidad por cualquier causa | 5 años | 2029 |
FA: fibrilación auricular; NACO: anticoagulante oral no antagonista de la vitamina K; RM: resonancia magnética.
La prevención del ictus es un aspecto clave del éxito en el abordaje de la FA. Las guías actuales son relativamente unidimensionales y recomiendan una anticoagulación continua a largo plazo para los pacientes con puntuación CHA2DS2-VASc elevada, cualquiera sea la carga de FA residual tras alcanzar un control eficaz del ritmo. Entre los enfoques novedosos para abordarlo se encuentran los siguientes: a) interrupción de la anticoagulación después de una ablación con catéter exitosa; b) anticoagulación con «comprimido en el bolsillo» y dispositivos portátiles inteligentes para detectar la FA, o c) un abordaje en una sesión que combine la ablación con catéter y el COI. Serán necesarios ensayos controlados y aleatorizados de gran calidad para investigar estos enfoques.
FINANCIACIÓNNo se recibió financiación alguna para realizar este trabajo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha utilizado inteligencia artificial en la preparación de este trabajo.
CONTRIBUCIÓN DE LOS AUTORESW.Y. Ding y P. Calvert contribuyeron por igual en este trabajo. W.Y. Ding y P. Calvert realizaron la revisión de la literatura, interpretaron los datos, redactaron la propuesta de manuscrito y revisaron el manuscrito. G.Y.H. Lip revisó el manuscrito. D. Gupta participó en la concepción del estudio y revisó el manuscrito. G.Y.H. Lip y D. Gupta actúan conjuntamente como autores sénior.
CONFLICTO DE INTERESESG.Y.H. Lip declara pagos por consultoría y conferencias de BMS/Pfizer, Boehringer Ingelheim y Daiichi-Sankyo. No ha recibido pagos personales directos. D. Gupta declara pagos por conferencias de Boehringer Ingelheim, Biosense Webster y Boston Scientific, ha sido mentor para Abbott y ha recibido subvenciones de investigación de Medtronic, Biosense Webster y Boston Scientific. Los demás autores no declaran ningún conflicto de intereses.