La trombocitopenia es una complicación frecuente tras el implante percutáneo de válvula aórtica (TAVI). Sin embargo, hay poca información sobre sus causas y sus implicaciones clínicas. El objetivo de este estudio es analizar la incidencia, el impacto clínico y los factores predictores.
MétodosRegistro multicéntrico de 3.913 pacientes con recuento plaquetario basal ≥100*109/l sometidos a TAVI. La trombocitopenia adquirida se definió como una reducción del recuento plaquetario ≥50% (nadir precoz ≤3.er y tardío ≥4.o día) tras el TAVI. El objetivo primario fue la mortalidad a 30 días y los objetivos secundarios, la seguridad del procedimiento y mortalidad a 2 años.
ResultadosLa incidencia de trombocitopenia fue del 14,8% (nadir precoz: 61,5%, nadir tardío: 38,5%). La mortalidad a los 30 días fue del 3,0%, significativamente mayor en los pacientes con trombocitopenia (el 8,5 frente al 2,0%; OR ajustada=2,3; IC95%, 1,3-4,2). La ausencia de seguridad del procedimiento y la mortalidad a los 2 años también fueron mayores en los pacientes con trombocitopenia (el 47,9 frente al 33,0%; p <0,001, y el 30,2 frente al 16,8%; HR=2,2; IC95%, 1,3-2,7) especialmente en aquellos con nadir tardío (el 54,2 frente al 45,5%, p=0,056, y el 38,6 frente al 23,8%; HR=2,1; IC95%, 1,5-2,9). Los predictores independientes de trombocitopenia incluyeron características basales y del procedimiento (área de superficie corporal, peor función renal, ausencia de diabetes, vasculopatía periférica, procedimientos realizados antes de 2015, acceso no transfemoral, complicaciones vasculares y tipo de válvula para TAVI).
ConclusionesLa trombocitopenia adquirida fue frecuente (15%) tras el TAVI, con mayor mortalidad a corto y medio plazo y menor seguridad del procedimiento. Además, la trombocitopenia tardía en comparación con la temprana se asoció a peores resultados clínicos. Sin embargo, son necesarias investigaciones futuras para dilucidar el mecanismo etiológico de estos hallazgos.
Palabras clave
La trombocitopenia es un hallazgo frecuente (∼50%) tras la cirugía cardiaca y un marcador de mal pronóstico, pues aumentan la mortalidad y la duración de la hospitalización1,2. El implante percutáneo de válvula aórtica (TAVI) ha surgido como una alternativa mínimamente invasiva a la cirugía para los pacientes con estenosis aórtica grave, que ofrece un menor riesgo hemorrágico, estancias en la unidad de cuidados intensivos y hospitalaria más breves y una recuperación más rápida3. Dado el carácter menos invasivo del TAVI, con mínimas pérdidas de sangre y una menor respuesta inflamatoria, sería de prever una menor disminución en el recuento de plaquetas. Sin embargo, hasta un 35% de los pacientes tratados mediante TAVI sufren trombocitopenia, que se asocia con peor resultado clínico a corto y medio plazo4,5. Sin embargo, la mayor parte de la evidencia al respecto procede de estudios unicéntricos y con escaso número de pacientes, lo cual podría limitar su potencia y condicionar sesgos relacionados con la utilización de estrategias específicas en la intervención o el tratamiento periprocedimiento en cada centro. El objetivo de este estudio es analizar la incidencia, la cronología, los factores predictores y la repercusión clínica de la trombocitopenia adquirida en una cohorte multicéntrica amplia de pacientes sometidos a TAVI.
MÉTODOSDiseño del estudio, características de la intervención y obtención de datosEn este registro multicéntrico observacional se incluyó a pacientes consecutivos con estenosis aórtica grave sintomática tratados con TAVI en 8 centros entre 2008 y 2021. Se excluyó del análisis a los pacientes con trombocitopenia (<100×109/l) basal, recuento de plaquetas no disponible (antes o después del TAVI) o muerte durante la intervención. El equipo cardiológico de cada uno de los centros determinó la aptitud para el TAVI y el tratamiento tras la intervención. La decisión respecto al tipo y el tamaño de la válvula cardiaca percutánea (VCP), la vía de acceso y la técnica de implante se dejó al criterio del operador que llevaba a cabo el TAVI. Para la anticoagulación durante la intervención se emplearon bolos de heparina no fraccionada, empezando con 70-100 U/kg al inicio de la intervención y ajustando la dosis para mantener un tiempo de coagulación activado >250s. El tratamiento antiagregante plaquetario periintervención se administró según el protocolo de cada centro. Las características basales de los pacientes, los detalles de la intervención, los resultados clínicos y los datos de seguimiento se recogieron de manera prospectiva y se centralizaron en una base de datos específica para este estudio en el centro coordinador. Los datos del recuento de plaquetas se obtuvieron retrospectivamente a partir de los resultados de los análisis de sangre disponibles en las historias clínicas electrónicas. Todos los pacientes dieron su consentimiento informado antes de la intervención, y el estudio se llevó a cabo de acuerdo con los requisitos indicados por el comité de ética de investigación de cada centro participante. Esta investigación se llevó a cabo sin intervención directa de los pacientes; no se invitó a los pacientes a comentar el diseño del estudio, definir los resultados de interés para el paciente ni interpretar los resultados. No hubo ninguna financiación específica para este estudio.
DefinicionesLa trombocitopenia tras la intervención se definió como una disminución ≥50% en el recuento de plaquetas en comparación con el valor basal dentro de los 0-10 días después del TAVI6. La disminución porcentual del recuento de plaquetas (DRP) se calculó de la siguiente manera: [(recuento de plaquetas al inicio – nadir del recuento de plaquetas) / recuento de plaquetas al inicio]×100]. El nadir temprano del recuento de plaquetas se definió como el valor más bajo del recuento de plaquetas en los 3 días posteriores al TAVI y el nadir tardío, como el producido del día 4 en adelante4. Los resultados clínicos se definieron según los criterios del Valve Academic Research Consortium (VARC-2). Para determinar el posible desajuste entre la prótesis valvular y el paciente, se usaron los valores definidos previamente del área efectiva del orificio valvular predicha para cada tipo y tamaño de válvula, aplicando una indexación respecto a la superficie corporal7,8. El objetivo principal del estudio fue la mortalidad por cualquier causa a 30 días y los objetivos secundarios, la seguridad de la intervención y la mortalidad por cualquier causa a 2 años.
Análisis estadísticoLos valores se presentan como media±desviación estándar para las variables continuas o número y porcentaje para las variables discretas. Se clasificó a todos los pacientes según la presencia o ausencia de trombocitopenia tras la intervención, y se llevó a cabo una comparación mediante prueba de la t de Student bilateral para las variables continuas y prueba de la X2 para las variables discretas, según procediera.
Se realizó un subanálisis para evaluar la repercusión de la dinámica del recuento de plaquetas. Se clasificó a los pacientes en 3 grupos: grupo 1 sin trombocitopenia, grupo 2 con trombocitopenia de nadir temprano y grupo 3 con trombocitopenia de nadir tardío. A fin de evitar un sesgo de selección, en este subanálisis se incluyó tan solo a los pacientes con estancia hospitalaria ≥4 días (y con hemograma posterior al día 3 disponible) y a los que presentaron un aumento del recuento de plaquetas después del TAVI.
El análisis de la supervivencia se llevó a cabo con la función de supervivencia de Kaplan-Meier, y las curvas se compararon mediante log-rank test. Se usó regresión logística para evaluar los factores predictores de la trombocitopenia y la mortalidad a 30 días. Las variables asociadas con estos objetivos en el análisis univariante (p<0,100) se incluyeron en el modelo logístico multivariable. Además, se realizó un análisis con emparejamiento mediante puntuación de propensión para obtener 2 grupos emparejados, con y sin trombocitopenia, con un ajuste respecto a las características basales y de la intervención. Los objetivos principal y secundarios se analizaron en esta cohorte emparejada con objeto de evaluar la repercusión clínica de la trombocitopenia. Puede consultarse información detallada sobre el método de emparejamiento mediante puntuación de propensión en el .
Se llevó a cabo un análisis por subgrupos para evaluar la repercusión de la trombocitopenia en los objetivos principal y secundarios en los subgrupos definidos según el sexo (varones y mujeres), el tipo de acceso (transfemoral y no transfemoral), los diferentes tipos de VCP y las intervenciones de TAVI realizadas antes y después de 2015. Se eligió este año porque se corresponde con el punto medio del periodo de inclusión. Como consecuencia de los avances en la técnica y los datos procedentes de estudios aleatorizados grandes, los pacientes posteriores a 2015 constituyen una población más comparable con la práctica clínica actual en el TAVI, lo cual justifica el empleo de este análisis de subgrupos.
Se consideraron estadísticamente significativos los valores de p<0,05. Todos los datos se analizaron con el programa Stata 14 (StataCorp, Estados Unidos).
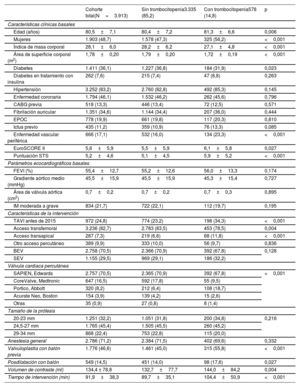
RESULTADOSDe los 4.580 pacientes sometidos a TAVI, se consideró aptos para el estudio a 3.913. Las principales razones para la exclusión fueron la trombocitopenia basal (<100×109/l) en 128 pacientes, la falta de recuento basal de plaquetas en 503 y la falta de recuento de plaquetas tras la intervención en 36. En la tabla 1 se presentan las características basales y de la intervención de la cohorte total, así como en función de la aparición de trombocitopenia adquirida. La media de edad fue 80,5±7,1 años y la media del riesgo de mortalidad de la Society of Thoracic Surgeons (STS), del 5,2%±4,6%. Se utilizó la vía de acceso transfemoral en 3.236 pacientes (82,7%). Los pacientes con trombocitopenia adquirida tenían una edad ligeramente superior, eran con mayor probabilidad mujeres, tenían una superficie corporal menor y una mayor puntuación de riesgo quirúrgico y con mayor probabilidad acceso transapical (tabla 1).
Características basales y de la intervención
| Cohorte total(N=3.913) | Sin trombocitopenia3.335 (85,2) | Con trombocitopenia578 (14,8) | p | |
|---|---|---|---|---|
| Características clínicas basales | ||||
| Edad (años) | 80,5±7,1 | 80,4±7,2 | 81,3±6,6 | 0,006 |
| Mujeres | 1.903 (48,7) | 1.578 (47,3) | 325 (56,2) | <0,001 |
| Índice de masa corporal | 28,1±6,0 | 28,2±6,2 | 27,1±4,8 | <0,001 |
| Área de superficie corporal (m2) | 1,78±0,20 | 1,79±0,20 | 1,72±0,19 | <0,001 |
| Diabetes | 1.411 (36,1) | 1.227 (36,8) | 184 (31,9) | 0,023 |
| Diabetes en tratamiento con insulina | 262 (7,6) | 215 (7,4) | 47 (8,8) | 0,263 |
| Hipertensión | 3.252 (83,2) | 2.760 (82,8) | 492 (85,3) | 0,145 |
| Enfermedad coronaria | 1.794 (46,1) | 1.532 (46,2) | 262 (45,6) | 0,796 |
| CABG previa | 518 (13,3) | 446 (13,4) | 72 (12,5) | 0,571 |
| Fibrilación auricular | 1.351 (34,6) | 1.144 (34,4) | 207 (36,0) | 0,444 |
| EPOC | 778 (19,9) | 661 (19,8) | 117 (20,3) | 0,810 |
| Ictus previo | 435 (11,2) | 359 (10,9) | 76 (13,3) | 0,085 |
| Enfermedad vascular periférica | 666 (17,1) | 532 (16,0) | 134 (23,3) | <0,001 |
| EuroSCORE II | 5,6±5,9 | 5,5±5,9 | 6,1±5,8 | 0,027 |
| Puntuación STS | 5,2±4,6 | 5,1±4,5 | 5,9±5,2 | <0,001 |
| Parámetros ecocardiográficos basales | ||||
| FEVI (%) | 55,4±12,7 | 55,2±12,6 | 56,0±13,3 | 0,174 |
| Gradiente aórtico medio (mmHg) | 45,5±15,9 | 45,5±15,9 | 45,3±15,4 | 0,727 |
| Área de válvula aórtica (cm2) | 0,7±0,2 | 0,7±0,2 | 0,7±0,3 | 0,895 |
| IM moderada a grave | 834 (21,7) | 722 (22,1) | 112 (19,7) | 0,195 |
| Características de la intervención | ||||
| TAVI antes de 2015 | 972 (24,8) | 774 (23,2) | 198 (34,3) | <0,001 |
| Acceso transfemoral | 3.236 (82,7) | 2.783 (83,5) | 453 (78,5) | 0,004 |
| Acceso transapical | 287 (7,3) | 219 (6,6) | 68 (11,8) | <0,001 |
| Otro acceso percutáneo | 389 (9,9) | 333 (10,0) | 56 (9,7) | 0,836 |
| BEV | 2.758 (70,5) | 2.366 (70,9) | 392 (67,8) | 0,128 |
| SEV | 1.155 (29,5) | 969 (29,1) | 186 (32,2) | |
| Válvula cardiaca percutánea | ||||
| SAPIEN, Edwards | 2.757 (70,5) | 2.365 (70,9) | 392 (67,8) | <0,001 |
| CoreValve, Medtronic | 647 (16,5) | 592 (17,8) | 55 (9,5) | |
| Portico, Abbott | 320 (8,2) | 212 (6,4) | 108 (18,7) | |
| Acurate Neo, Boston | 154 (3,9) | 139 (4,2) | 15 (2,6) | |
| Otras | 35 (0,9) | 27 (0,8) | 8 (1,4) | |
| Tamaño de la prótesis | ||||
| 20-23 mm | 1.251 (32,2) | 1.051 (31,8) | 200 (34,8) | 0,216 |
| 24,5-27 mm | 1.765 (45,4) | 1.505 (45,5) | 260 (45,2) | |
| 29-34 mm | 868 (22,4) | 753 (22,8) | 115 (20,0) | |
| Anestesia general | 2.786 (71,2) | 2.384 (71,5) | 402 (69,6) | 0,332 |
| Valvuloplastia con balón previa | 1.776 (46,6) | 1.461 (45,0) | 315 (55,8) | <0,001 |
| Posdilatación con balón | 549 (14,5) | 451 (14,0) | 98 (17,6) | 0,027 |
| Volumen de contraste (ml) | 134,4 ± 78,8 | 132,7±77,7 | 144,0±84,2 | 0,004 |
| Tiempo de intervención (min) | 91,9±38,3 | 89,7±35,1 | 104,4±50,9 | <0,001 |
BEV: válvula expandible con balón; CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; SEV: válvula autoexpandible; STS: Society of Thoracic Surgeons.
Los valores expresan n (%) o media±desviación estándar.
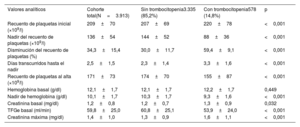
Los resultados de los análisis de laboratorio se presentan en la tabla 2. La media del recuento basal de plaquetas fue 209±70×109/l y la media del nadir tras el TAVI fue 136±54×109/l y se produjo a los 2,5±1,5 días de la intervención. La DRP fue del 34,3%±15,4%. Se produjo trombocitopenia tras la intervención (es decir, una disminución ≥50% respecto a la situación basal) en 578 pacientes (14,8%). Se observó un posterior aumento del recuento de plaquetas en 2.461 pacientes (63,0%) al cabo de 4,2±1,8 días tras el TAVI. El aumento del recuento de plaquetas se observó en el 78,8% de los pacientes con estancia hospitalaria >4 días. La media del recuento de plaquetas al alta fue de 171±73×109/l y la DRP al alta respecto al valor basal fue del 16,4%±29,0%. Tan solo el 19,6% de los pacientes alcanzaron un recuento de plaquetas igual o superior al basal.
Valores analíticos basales y tras la intervención
| Valores analíticos | Cohorte total(N=3.913) | Sin trombocitopenia3.335 (85,2%) | Con trombocitopenia578 (14,8%) | p |
|---|---|---|---|---|
| Recuento de plaquetas inicial (×109/l) | 209±70 | 207±69 | 220±78 | <0,001 |
| Nadir del recuento de plaquetas (×109/l) | 136±54 | 144±52 | 88±36 | <0,001 |
| Disminución del recuento de plaquetas (%) | 34,3±15,4 | 30,0±11,7 | 59,4±9,1 | <0,001 |
| Días transcurridos hasta el nadir | 2,5±1,5 | 2,3±1,4 | 3,3±1,6 | <0,001 |
| Recuento de plaquetas al alta (×109/l) | 171±73 | 174±70 | 155±87 | <0,001 |
| Hemoglobina basal (g/dl) | 12,1±1,7 | 12,1±1,7 | 12,2±1,7 | 0,449 |
| Nadir de hemoglobina (g/dl) | 10,1±1,7 | 10,3±1,7 | 9,3±1,6 | <0,001 |
| Creatinina basal (mg/dl) | 1,2±0,8 | 1,2±0,7 | 1,3±0,9 | 0,032 |
| TFGe basal (ml/min) | 59,8±25,0 | 60,8±25,1 | 53,9±24,0 | <0,001 |
| Creatinina máxima (mg/dl) | 1,4±1,0 | 1,3±0,9 | 1,6±1,1 | <0,001 |
TFGe: tasa de filtrado glomerular estimada.
Los valores expresan media±desviación estándar.
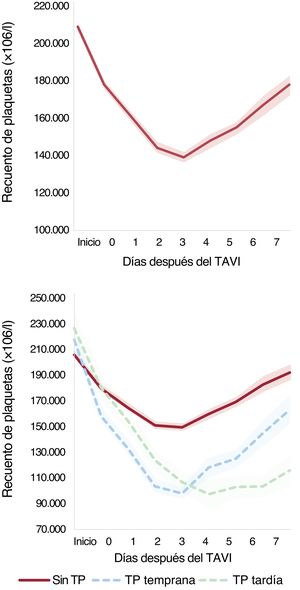
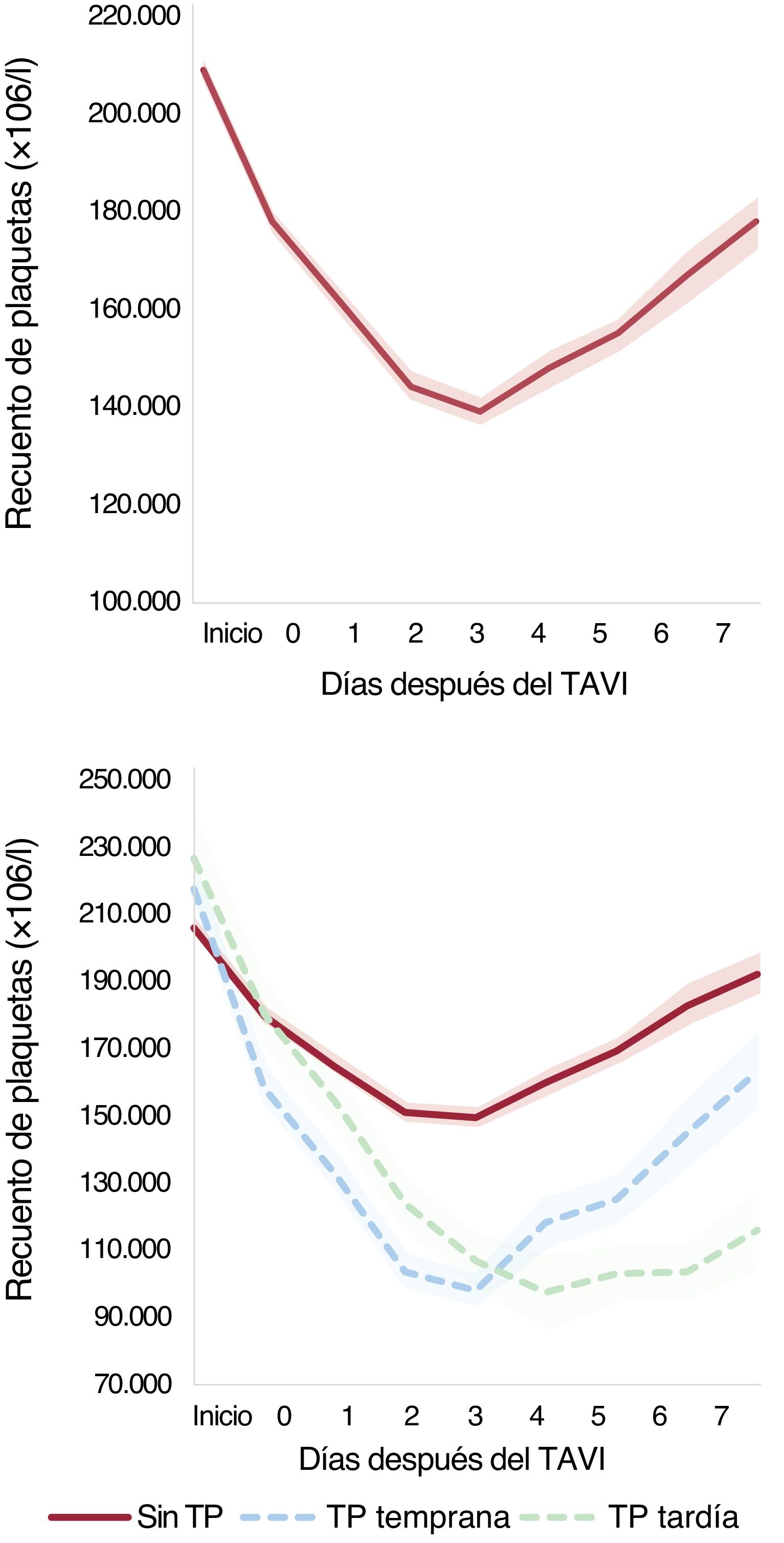
Un total de 3.041 pacientes cumplieron el criterio de estancia hospitalaria ≥4 días (n=2.853) o un aumento del recuento de plaquetas después del nadir durante una hospitalización <4 días (n=188). En esta población, tuvieron trombocitopenia temprana 323 pacientes (62,7%) y un nadir tardío 192 (37,3%). En la figura 1 y la figura 2 se presenta la dinámica del recuento de plaquetas. A los 3 meses de la intervención se obtuvo un recuento de plaquetas de 2.049 pacientes (54,9%), con una media del recuento de plaquetas de 200±73×109/l. En este periodo de seguimiento se observó trombocitopenia en solo 41 pacientes (2%). De los pacientes con trombocitopenia tras la intervención, solo 14 (4,7%) mostraron una trombocitopenia persistente en el seguimiento.
Dinámica del recuento de plaquetas después del implante percutáneo de válvula aórtica. Cambio del recuento de plaquetas en los 7 días siguientes al TAVI, globalmente (A) y en función de que el nadir fuera temprano o tardío (B). TAVI, implante percutáneo de válvula aórtica; TP, trombocitopenia.
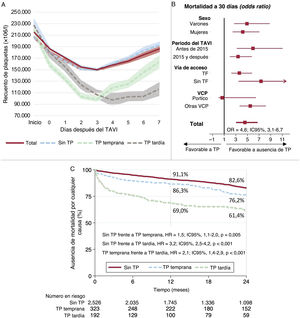
Figura central. Patrón del recuento de plaquetas después del TAVI y repercusión clínica de la trombocitopenia adquirida. A: dinámica del recuento de plaquetas en los 7 días siguientes al TAVI, en general y en función de que el nadir fuera temprano o tardío. B: repercusión de la trombocitopenia en la mortalidad a 30 días, por subgrupos. C: mortalidad a 2 años por cualquier causa en función de que la trombocitopenia fuera temprana o tardía. TF: transfemoral; TP: trombocitopenia; VCP: válvula cardiaca percutánea.
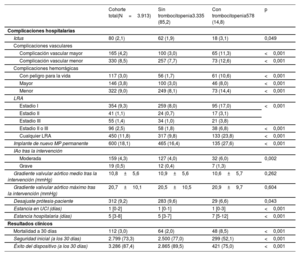
En la tabla 3 se presentan las complicaciones periintervención y los resultados clínicos relacionados con la aparición de trombocitopenia. La mortalidad total a los 30 días fue mayor entre los pacientes con trombocitopenia (el 2,0 frente al 8,5%; odds ratio [OR]=4,6; intervalo de confianza del 95% [IC95%], 3,1-6,7; p<0,001). Otras variables asociadas con la mortalidad a 30 días fueron la edad, la puntuación STS, las complicaciones vasculares mayores, la hemorragia mayor o con peligro para la vida, la lesión renal aguda, el ictus periintervención y la insuficiencia aórtica aguda. La OR ajustada (ORa) de mortalidad a 30 días asociada con la trombocitopenia fue 2,3 (IC95%, 1,3-4,2; p=0,004) (). La seguridad temprana y el éxito del dispositivo a 30 días fueron significativamente mayores en el grupo sin trombocitopenia (el 77 frente al 52,1%; p<0,001; y el 89,5 frente al 75%; p<0,001).
Complicaciones hospitalarias y resultados clínicos
| Cohorte total(N=3.913) | Sin trombocitopenia3.335 (85,2) | Con trombocitopenia578 (14,8) | p | |
|---|---|---|---|---|
| Complicaciones hospitalarias | ||||
| Ictus | 80 (2,1) | 62 (1,9) | 18 (3,1) | 0,049 |
| Complicaciones vasculares | ||||
| Complicación vascular mayor | 165 (4,2) | 100 (3,0) | 65 (11,3) | <0,001 |
| Complicación vascular menor | 330 (8,5) | 257 (7,7) | 73 (12,6) | <0,001 |
| Complicaciones hemorrágicas | ||||
| Con peligro para la vida | 117 (3,0) | 56 (1,7) | 61 (10,6) | <0,001 |
| Mayor | 146 (3,8) | 100 (3,0) | 46 (8,0) | <0,001 |
| Menor | 322 (9,0) | 249 (8,1) | 73 (14,4) | <0,001 |
| LRA | ||||
| Estadio I | 354 (9,3) | 259 (8,0) | 95 (17,0) | <0,001 |
| Estadio II | 41 (1,1) | 24 (0,7) | 17 (3,1) | |
| Estadio III | 55 (1,4) | 34 (1,0) | 21 (3,8) | |
| Estadio II o III | 96 (2,5) | 58 (1,8) | 38 (6,8) | <0,001 |
| Cualquier LRA | 450 (11,8) | 317 (9,8) | 133 (23,8) | <0,001 |
| Implante de nuevo MP permanente | 600 (18,1) | 465 (16,4) | 135 (27,6) | <0,001 |
| IAo tras la intervención | ||||
| Moderada | 159 (4,3) | 127 (4,0) | 32 (6,0) | 0,002 |
| Grave | 19 (0,5) | 12 (0,4) | 7 (1,3) | |
| Gradiente valvular aórtico medio tras la intervención (mmHg) | 10,8±5,6 | 10,9±5,6 | 10,6±5,7 | 0,262 |
| Gradiente valvular aórtico máximo tras la intervención (mmHg) | 20,7±10,1 | 20,5±10,5 | 20,9±9,7 | 0,604 |
| Desajuste prótesis-paciente | 312 (9,2) | 283 (9,6) | 29 (6,6) | 0,043 |
| Estancia en UCI (días) | 1 [0-2] | 1 [0-1] | 1 [0-3] | <0,001 |
| Estancia hospitalaria (días) | 5 [3-8] | 5 [3-7] | 7 [5-12] | <0,001 |
| Resultados clínicos | ||||
| Mortalidad a 30 días | 112 (3,0) | 64 (2,0) | 48 (8,5) | <0,001 |
| Seguridad inicial (a los 30 días) | 2.799 (73,3) | 2.500 (77,0) | 299 (52,1) | <0,001 |
| Éxito del dispositivo (a los 30 días) | 3.286 (87,4) | 2.865 (89,5) | 421 (75,0) | <0,001 |
IAo: insuficiencia aórtica; LRA: lesión renal aguda; MP: marcapasos; UCI: unidad de cuidados intensivos.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
La trombocitopenia tanto temprana como tardía se asociaron con peores resultados clínicos a los 30 días () y aumentaron la mortalidad a 30 días en comparación con la ausencia de trombocitopenia (ORa=2,1; IC95%, 1,0-4,2; p=0,041; y ORa=5,4; IC95%, 2,9-10,0; p<0,001).
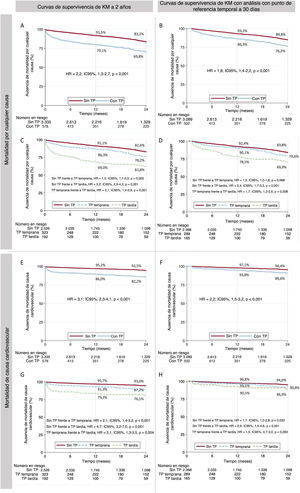
Resultados a medio plazoSe dispuso del seguimiento de 3.775 pacientes (96,5%) con una media de 28,5±25,5 meses. La mortalidad por cualquier causa a 2 años fue del 18,9% (pacientes con y sin trombocitopenia, el 30,2 frente al 16,8%; hazard ratio [HR]=2,2; IC95%, 1,8-2,7; p<0,001) (figura 3A). Después de un análisis con punto de referencia temporal a 30 días, esta diferencia continuaba siendo significativa (el 23,8 frente al 15,2%; HR=1,8; IC95%, 1,4-2,2; p<0,001) (figura 3B). La mortalidad de causa cardiovascular a 2 años fue también mayor en los pacientes con trombocitopenia antes y después del análisis con punto de referencia temporal a 30 días (figura 3E,F).
Mortalidad a 2 años por cualquier causa y por causa cardiovascular. Gráfico de Kaplan-Meier de la mortalidad a 2 años por cualquier causa y después de un análisis con punto de referencia temporal a 30 días, según la trombocitopenia (A y B) y en función de que el nadir fuera temprano o tardío (C y D). Mortalidad a 2 años de causa cardiovascular y después de un análisis con punto de referencia temporal a 30 días, según la trombocitopenia y en función de que el nadir fuera temprano o tardío (E-H). CV: cardiovascular; KM: Kaplan-Meier; TP: trombocitopenia.
La mortalidad a 2 años de los pacientes con trombocitopenia fue significativamente mayor con nadir tardío que con nadir temprano (el 38,6 frente al 23,8%; p<0,001) (figura 3C y figura 2, figura central). Esta diferencia continuó siendo superior después del análisis landmark a 30 días (el 20,4 frente al 30,1%; p=0,008) (figura 3D). En comparación con el nadir temprano, el tardío se asoció con un aumento de la mortalidad por causas cardiovasculares a 2 años (figura 3G), y la diferencia se observó principalmente en los primeros 30 días (figura 3H).
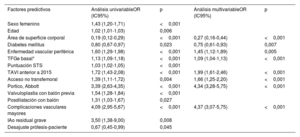
Factores asociados con la trombocitopeniaLos factores asociados con la trombocitopenia de manera independiente se presentan en la tabla 4. Las características basales que aumentan el riesgo de trombocitopenia son la superficie corporal, la ausencia de diabetes, la enfermedad vascular periférica y valores bajos en la tasa de filtrado glomerular estimada (TFGe). Otros factores asociados de manera independiente con la trombocitopenia son ciertos aspectos de la intervención, como el TAVI en la primera mitad del estudio (antes de 2015), la vía de acceso distinta de la transfemoral, el uso de la VCP Portico (Abbott, Estados Unidos) y los resultados adversos de la intervención, como las complicaciones vasculares mayores.
Factores independientes predictivos de trombocitopenia
| Factores predictivos | Análisis univariableOR (IC95%) | p | Análisis multivariableOR (IC95%) | p |
|---|---|---|---|---|
| Sexo femenino | 1,43 (1,20-1,71) | <0,001 | ||
| Edad | 1,02 (1,01-1,03) | 0,006 | ||
| Área de superficie corporal | 0,19 (0,12-0,29) | <0,001 | 0,27 (0,16-0,44) | <0,001 |
| Diabetes mellitus | 0,80 (0,67-0,97) | 0,023 | 0,75 (0,61-0,93) | 0,007 |
| Enfermedad vascular periférica | 1,60 (1,29-1,98) | <0,001 | 1,45 (1,12-1,89) | 0,005 |
| TFGe basal* | 1,13 (1,09-1,18) | <0,001 | 1,09 (1,04-1,13) | <0,001 |
| Puntuación STS | 1,03 (1,02-1,05) | <0,001 | ||
| TAVI anterior a 2015 | 1,72 (1,43-2,08) | <0,001 | 1,99 (1,61-2,46) | <0,001 |
| Acceso no transfemoral | 1,39 (1,11-1,72) | 0,004 | 1,66 (1,25-2,20) | <0,001 |
| Portico, Abbott | 3,39 (2,63-4,35) | <0,001 | 4,34 (3,28-5,75) | <0,001 |
| Valvuloplastia con balón previa | 1,54 (1,28-1,84) | <0,001 | ||
| Posdilatación con balón | 1,31 (1,03-1,67) | 0,027 | ||
| Complicaciones vasculares mayores | 4,09 (2,95-5,67) | <0,001 | 4,37 (3,07-5,75) | <0,001 |
| IAo residual grave | 3,50 (1,38-9,00) | 0,008 | ||
| Desajuste prótesis-paciente | 0,67 (0,45-0,99) | 0,045 |
ASC: área de superficie corporal; IAo: insuficiencia aórtica; OR: odds ratio; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; TFGe: tasa de filtrado glomerular estimada.
Por lo que respecta al tipo de VCP, no se observaron diferencias significativas entre los dispositivos autoexpandibles (SEV) y los expandibles con balón (BEV). Sin embargo, los pacientes a los que se implantó una VCP CoreValve (Medtronic, Estados Unidos) o Acurate Neo (Boston Scientific, Estados Unidos) fueron los que presentaron las tasas más bajas de trombocitopenia (el 8,5 y el 9,7%), mientras que aquellos a los que se implantó una válvula SAPIEN (Edwards System, Estados Unidos) tuvieron una tasa intermedia (14,2%) y los tratados con una válvula Portico sufrieron trombocitopenia con mayor frecuencia (33,8%) (). Tanto la trombocitopenia temprana como la tardía fueron significativamente superiores entre los pacientes tratados con la válvula Portico que con otras VCP (temprana, el 21,3 frente al 9,7%; p<0,001; tardía, el 18,3 frente al 5,3%; p<0,001).
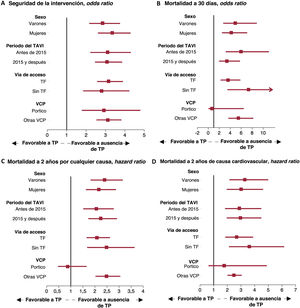
Por lo que respecta a los resultados clínicos, la trombocitopenia no tuvo una repercusión significativa en la mortalidad por cualquier causa y la mortalidad de causa cardiovascular a los 30 días y a los 2 años en los pacientes que recibieron la válvula Portico (figura 4).
Repercusión de la trombocitopenia después del TAVI en los resultados clínicos en un análisis por subgrupos. Gráfico de bosque que muestra la repercusión clínica de la trombocitopenia en la seguridad de la intervención (A), la mortalidad a 30 días (B) y la mortalidad a 2 años por cualquier causa (C) y de causa cardiovascular (D) en diferentes subgrupos. TAVI: implante percutáneo de válvula aórtica; TF: transfemoral; TP: trombocitopenia; VCP: válvula cardiaca percutánea.
La trombocitopenia tardía se asoció con un aumento del riesgo quirúrgico, evaluado mediante la puntuación STS, y complicaciones tras la intervención como hemorragia mayor o de riesgo vital, insuficiencia aórtica moderada o grave y lesión renal aguda (LRA) en estadio 2 o 3 ().
Análisis con emparejamiento por puntuación de propensiónTras el análisis con emparejamiento por puntuación de propensión, se obtuvieron 2 grupos emparejados con 543 pacientes en cada grupo, con y sin trombocitopenia. Las características basales y de la intervención estuvieron bien equilibradas en ambos grupos ( y ). La mortalidad por cualquier causa a 30 días y la seguridad de la intervención continuaron mostrando una diferencia estadísticamente significativa entre los grupos con y sin trombocitopenia emparejados: 39 (7,3%) y 13 (2,5%; p<0,001) y 289 (53,6%) y 379 (71,4%; p<0,001) ().
Además, la mortalidad por cualquier causa y la de causa cardiovascular a los 2 años fueron significativamente mayores en el grupo de emparejamiento por puntuación de propensión con trombocitopenia (el 29,2 frente al 16,7%; HR=2,0; IC95%, 1,5-2,7; p<0,001) que en el grupo sin trombocitopenia (el 16,5 frente al 7,2%; HR=2,7; IC95%, 1,7-4,4; p<0,001) ( y ).
Análisis por subgruposLa repercusión negativa de la trombocitopenia en la seguridad de la intervención, la mortalidad a 30 días y la mortalidad por cualquier causa y de causa cardiovascular a 2 años se observó de manera uniforme en todos los subgrupos definidos por sexo, año del TAVI y vía de acceso. No obstante, en el grupo de la VCP Portico, no se observó una repercusión significativa de la trombocitopenia en la mortalidad a corto y medio plazo (figura 4).
DISCUSIÓNEn este amplio registro multicéntrico con 3.913 pacientes sometidos a TAVI por estenosis valvular aórtica, el objetivo fue evaluar los factores de riesgo y la repercusión clínica de la trombocitopenia tras la intervención. Los resultados principales fueron una DRP de aproximadamente el 35% el día 3 después del TAVI, con una incidencia de trombocitopenia (DRP ≥50%) de alrededor de un 15% (temprana, ∼60%; tardía, ∼40%). Se produjo un aumento posterior del recuento de plaquetas en un 63% del total de pacientes y el 79% de aquellos con estancia hospitalaria ≥4 días, lo cual indica que se trata de un fenómeno transitorio para la mayoría de los pacientes.
La trombocitopenia se asoció con un aumento de las complicaciones periintervención, la mortalidad a 30 días y la mortalidad a 2 años, tanto antes como después del análisis de emparejamiento por puntuación de propensión. Tanto la trombocitopenia temprana como la tardía mostraron una asociación independiente con la mortalidad a 30 días. Sin embargo, solo la trombocitopenia tardía se asoció con la mortalidad a medio plazo en el análisis a partir de 30 días. Los factores independientes asociados con la trombocitopenia fueron: características basales (área de superficie corporal, ausencia de diabetes mellitus, TFGe inferior y enfermedad vascular periférica) y factores de la intervención (TAVI antes de 2015, acceso distinto del transfemoral, complicaciones vasculares y tipo de VCP).
La incidencia de trombocitopenia después del TAVI se había descrito anteriormente entre el 25 y el 65%4,5,9-11. Sin embargo, la definición de la trombocitopenia difiere considerablemente entre los distintos estudios, con criterios como un nadir del recuento de plaquetas <150 o <100×109/l y unos umbrales de DRP ≥50%, ≥46% o ≥30%. En un metanálisis de 9 estudios con 2.278 pacientes, se observó una incidencia de trombocitopenia >44,9%12 empleando de varias definiciones (DRP ≥30%, DRP ≥50%, nadir del recuento de plaquetas <100×109/l, y segundo o tercer tercil de la DRP). Se ha señalado que la DRP es un factor predictivo más potente de la supervivencia a corto plazo y los eventos adversos cardiovasculares mayores que el nadir del recuento de plaquetas5,10. En consecuencia, en nuestro estudio se utilizó una DRP ≥50% como definitoria de trombocitopenia, y se confirmó que la trombocitopenia no solo es una complicación frecuente, sino que también se asocia claramente con peor resultado clínico.
La incidencia de trombocitopenia en nuestra cohorte fue similar a la observada en la cirugía valvular aórtica13, a pesar de que las intervenciones de TAVI no implican bypass cardiopulmonar y se asocian menores hemodilución o hemorragia, con menor consumo de plaquetas. Los mecanismos que podrían estar relacionados con trombocitopenia tras el TAVI incluyen el daño endotelial, la alteración del estrés parietal, la exposición a la superficie del stent de la prótesis valvular, con la posible activación del sistema inmunitario y consumo de plaquetas, y la escasa capacidad de regeneración plaquetaria, particularmente en los pacientes de edad avanzada. La trombocitopenia inducida por heparina podría relacionarse con una DRP significativa, aunque se ha descrito en menos del 1% de los pacientes tratados con TAVI14. Además, en los casos más invasivos y/o complejos (por ejemplo, abordaje transapical, mayor uso de medios de contraste y complicaciones vasculares) podría producirse una mayor activación plaquetaria, lo cual podría explicar la asociación entre esos factores y la trombocitopenia observada en nuestra cohorte.
En estudios previos se ha descrito una mayor incidencia de trombocitopenia con prótesis BEV que con las SEV11,15. Sin embargo, estas observaciones no se confirmaron en nuestro amplio estudio multicéntrico. Lo que sí se observa son diferencias en la incidencia de trombocitopenia en función del tipo de VCP, mayor con Portico. Se ha señalado que los productos utilizados para la conservación de las válvulas o los sistemas anticalcificación pueden hacer parte de la etiopatogenia de la trombocitopenia16, lo que podría explicar estas diferencias entre los diferentes tipos de VCP. Cabe destacar que la mayor trombocitopenia en el grupo con Portico no se asoció con peores resultados hospitalarios.
Según lo indicado por estudios previos, la asociación entre la trombocitopenia y los resultados clínicos es una cuestión controvertida. En 2 estudios realizados con BEV (más del 30% de accesos transapicales), no se observó una repercusión importante de la trombocitopenia en la mortalidad a corto plazo9,17. En cambio, otros 2 estudios unicéntricos de pequeño tamaño describieron un aumento de la mortalidad a 30 días y a 1 año entre los pacientes con trombocitopenia grave después de TAVI4,11. El metanálisis antes mencionado observó también un riesgo superior de mortalidad a 30 días en los pacientes con trombocitopenia12.
Nuestra cohorte incluyó una población superior y más contemporánea de TAVI, con un mayor uso del acceso transfemoral y SEV, y mostró también un riesgo superior de mortalidad por cualquier causa a 30 días y a 2 años entre los pacientes con trombocitopenia. Esta asociación persistió incluso después de aplicar un emparejamiento por puntuación de propensión, lo cual indica que la trombocitopenia adquirida es un factor predictivo independiente. El mayor riesgo de complicaciones hemorrágicas e isquémicas periintervención, así como de LRA, también es motivo de preocupación con los pacientes con trombocitopenia tras la intervención.
Existe una fuerte asociación entre las complicaciones hemorrágicas y la trombocitopenia12,18; sin embargo, resulta difícil establecer la relación causa-efecto en todos los casos. En cuanto a la LRA, se ha propuesto que la trombocitopenia podría estar relacionada con la formación de microagregados de plaquetas activadas, células endoteliales y leucocitos que pueden taponar los capilares glomerulares e inducir luego una LRA19. Este mecanismo podría intervenir también en otras lesiones isquémicas, como el ictus.
La dinámica temporal del recuento de plaquetas es un factor predictivo de resultados clínicos en los pacientes de cuidados intensivos. En nuestra cohorte, los pacientes con un nadir tardío presentaron un mayor riesgo de mortalidad por cualquier causa y de mortalidad cardiovascular a 30 días y a 2 años.
Un nadir temprano con una pronta recuperación de las plaquetas probablemente represente la conducta «prevista» del recuento de plaquetas, y probablemente se deba a la hemodilución y el consumo de plaquetas en el contexto de una intervención invasiva. En cambio, es posible que la trombocitopenia tardía sea consecuencia de una etiología destructiva, como una trombocitopenia inmunitaria, una infección tardía u otra complicación tardía. También es posible que refleje un fallo de la recuperación plaquetaria en los pacientes de edad avanzada con otras comorbilidades y/o una mayor fragilidad, lo cual explicaría su peor repercusión pronóstica.
Por último, serán necesarios nuevos estudios para explorar las causas subyacentes y los posibles tratamientos dirigidos para esta complicación con objeto de mejorar los resultados en los pacientes con trombocitopenia adquirida después de TAVI.
LimitacionesSe reconocen varias limitaciones de este estudio, que se deben en parte a su diseño retrospectivo. En primer lugar, no se realizaron pruebas complementarias adicionales para esclarecer la etiología de la trombocitopenia, en especial en los casos de trombocitopenia tardía o trombocitopenia inducida por heparina. En segundo lugar, a pesar de los análisis multivariantes y los análisis con emparejamiento por puntuación de propensión, no puede descartarse por completo la presencia de factores de confusión relacionados con el largo periodo de inclusión, los métodos de intervención y las complicaciones periintervención. En tercer lugar, las infecciones hospitalarias y la sepsis no se registraron de forma prospectiva, por lo que no pudieron analizarse como posibles factores que contribuyeran a producir la trombocitopenia adquirida. En cuarto lugar, la estancia hospitalaria más corta de los pacientes sometidos a TAVI mínimamente invasivo puede haber causado un sesgo debido a la ausencia de determinaciones del recuento de plaquetas después del alta. Por último, el diseño multicéntrico y el largo periodo de inclusión introdujeron cierta variabilidad en los métodos técnicos y los tratamientos farmacológicos, incluidas las pautas de medicación antitrombótica. Sin embargo, esto potencia también la validez externa de nuestros resultados, ya que los centros participantes se atuvieron a las guías de las sociedades de cardiología de Estados Unidos y Europa.
CONCLUSIONESLa trombocitopenia adquirida después del TAVI fue relativamente frecuente y se asoció con un mayor riesgo de complicaciones periintervención, así como mortalidad a corto y medio plazo. De entre los pacientes con trombocitopenia, los que presentaron un nadir tardío mostraron un riesgo de mortalidad superior que con nadir temprano. La aparición de trombocitopenia se asoció con las comorbilidades presentes en la situación basal, factores de la intervención como la vía de acceso para el TAVI, el tipo de VCP y las complicaciones de la intervención. Las diferencias observadas en las tasas de trombocitopenia entre las diversas VCP justifican más investigación en futuros estudios.
- –
La trombocitopenia adquirida tras el TAVI es una complicación frecuente pero poco comprendida y continúa sin estar clara su repercusión en la supervivencia a corto y medio plazo.
- –
Es posible que el patrón de evolución temporal del recuento de plaquetas después del TAVI se asocie con diferentes resultados clínicos.
- –
Se produjo trombocitopenia adquirida tras el TAVI en casi el 15% de los pacientes. El nadir del recuento de plaquetas se observó el día 3 después de la intervención, y hubo recuperación en hasta el 78% de los pacientes después de 4 o más días.
- –
La trombocitopenia se asoció con disminución de la seguridad de la intervención y a mayor riesgo de mortalidad tanto a 30 días como a 2 años.
- –
La trombocitopenia tardía, en comparación con la temprana, se asoció con reducción de la supervivencia a corto y medio plazo.
- –
Los factores independientes predictivos de la trombocitopenia fueron el área de superficie corporal, la función renal, la vía de acceso distinta de la transfemoral, el tipo de válvula y las complicaciones vasculares.
- –
La trombocitopenia después del TAVI debe considerarse un factor predictivo de un peor resultado clínico. Serán necesarias nuevas investigaciones para explorar su etiología, prevención y tratamiento.
No hubo ninguna financiación específica para este estudio.
CONSIDERACIONES ÉTICASTodos los pacientes dieron su consentimiento informado antes de la intervención, y el estudio se llevó a cabo de acuerdo con lo indicado por el comité de ética de investigación de cada centro participante. La investigación se atuvo estrictamente a lo establecido por las directrices SAGER (Sex and Gender Equity in Research) para abordar los posibles sesgos por sexo o género. Este estudio se llevó a cabo sin intervención directa de los pacientes; no se invitó a los pacientes a comentar el diseño del estudio ni se les consultó sobre la determinación de objetivos relevantes para los pacientes o la interpretación de los resultados.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALEn esta investigación no se utilizaron tecnologías ni instrumentos de inteligencia artificial en ninguna fase. El equipo de investigación realizó manualmente la totalidad de la obtención, el análisis y la interpretación de los datos, lo cual garantiza la integridad y la exactitud de los resultados.
CONTRIBUCIÓN DE LOS AUTORESG. Tirado-Conte y L. Nombela-Franco: participaron de manera sustancial en la concepción o el diseño del trabajo, la obtención, el análisis o la interpretación de los datos, la redacción de la versión preliminar del trabajo o la revisión respecto a contenido intelectual importante y la aprobación final de la versión a publicar y acordaron aceptar la responsabilidad de todos los aspectos del trabajo, asegurando que las cuestiones relativas a la exactitud e integridad de cualquiera de las partes del trabajo se han investigado y resuelto de la forma apropiada.
Los demás autores se ocuparon de la versión inicial del trabajo o la revisión crítica en cuanto a contenido intelectual importante y la aprobación final de la versión a publicar.