Se reseña la rara asociación de interrupción del istmo aórtico tipo B y ventana aortopulmonar tipo II en un neonato a quien se efectuó corrección primaria de ambas lesiones a los 20 días de vida sin circulación extracorpórea mediante anastomosis entre arteria carótida izquierda y aorta descendente, y oclusión de la ventana con clip metálico, respectivamente. Asimismo, se describe la ausencia total de flujo circulatorio en la rama pulmonar derecha detectada por eco 2-D doppler color en el postoperatorio inmediato, debido a una malposición del clip metálico, que requirió una rápida y eficaz reintervención para restituir la circulación sanguínea en la rama afectada. A 8 meses de la reparación operatoria, el «neoarco aórtico» crece armónicamente con la superficie corporal del enfermo sin que se hayan registrado gradientes significativos en ninguna localización; del mismo modo, no se encontraron signos de déficit circulatorio cerebral.
Palabras clave
Defectos cardíacos congénitos
Ecocardiografía
Cirugía
Pediatría
INTRODUCCIÓN
La asociación de interrupción del arco aórtico (IAA) con ventana aortopulmonar (VAP) es una rara aunque reconocida combinación patológica cuya historia natural se caracteriza por una presentación clínica grave en el período neonatal inmediato. Sin tratamiento quirúrgico la mortalidad es muy elevada y los supervivientes desarrollan con mucha frecuencia una irreversible arteriopatía pulmonar hipertensiva. Aun cuando la cirugía debe ser precoz, el riesgo operatorio es elevado debido a los efectos deletéreos que producen las técnicas de circulación extracorpórea (CEC), hipotermia profunda, parada circulatoria o bajo flujo en un neonato con manifiesto deterioro hemodinámico 1-4.
Presentamos un caso con IAA + VAP sin comunicación interventricular (CIV) operado con éxito mediante corrección total primaria de ambas lesiones sin CEC usando técnicas antiguas como la anastomosis de vasos supraaórticos para corregir la IAA y el cierre directo de la VAP. Asimismo, destacamos la trascendencia del estudio ecocardiográfico 2-D Doppler color que detectó una inusual complicación en el postoperatorio inmediato cuya solución definitiva precisó de rápida intervención.
CASO CLÍNICO
Recién nacido a término que ingresó en nuestro servicio a los 4 días de vida con severo deterioro hemodinámico y metabólico. A la exploración, presenta un mal estado general, cianosis y distrés respiratorio; se palpaba un ventrículo derecho predominante, siendo los pulsos femorales débiles, con ausencia del braquial izquierdo. La auscultación reflejó un segundo ruido intenso y un soplo sistólico corto en precordio. En la radiografía de tórax se observaba cardiomegalia e incremento de la vasculatura pulmonar, mientras que en el ECG era evidente el crecimiento ventricular derecho.
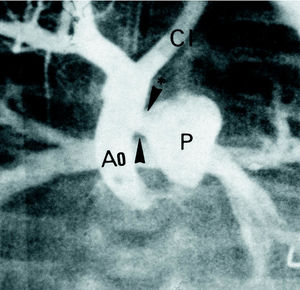
La exploración ecocardiográfica definió la distribución segmentaria cardiovascular como normal, sin evidencia de defectos septales. Las cavidades derechas estaban dilatadas y las izquierdas eran algo pequeñas; la vía de salida de ambos ventrículos y el origen y/o distribución de las arterias coronarias eran normales. En el arco aórtico se visualizaba una IAA tipo B con continuidad ductus-aorta descendente; la carótida izquierda tenía un buen tamaño y la subclavia izquierda era muy pequeña. Se objetivó también un vaso anómalo cercano al origen del tronco innominado cuya interpretación es dudosa, motivo por el cual se realizó un estudio hemodinámico-angiográfico (fig. 1) que confirmó el diagnóstico de IAA tipo B, y demostró la existencia de una VAP tipo II (alejada de la válvula sigmoidea y cercana a la rama pulmonar derecha) de morfología tubular, con un diámetro de 3 mm 5,6.
Fig. 1. Aortograma que demuestra la interrupción del istmo aórtico tipo B (asterisco), y la ventana aortopulmonar «alta» tipo II (flechas). Ao: aorta; P: arteria pulmonar; CI: carótida izquierda.
A las 48 h del ingreso el paciente presentó parada cardiorrespiratoria por fibrilación ventricular, de la que se recuperó tras largas maniobras de resucitación. Tras un prolongado período de recuperación en UVI con infusión de prostaglandina e inotrópicos, corrección de la acidosis metabólica y asistencia respiratoria mecánica con modalidad ventilatoria destinada a elevar la pCO 2 para restringir el flujo pulmonar, se realizó intervención quirúrgica a los 20 días de vida en presencia de una mala situación clínica y con 2.400 g de peso.
Por toracotomía izquierda, cuarto espacio intercostal, se disecó ampliamente la aorta descendente, el ductus y el arco aórtico con las arterias subclavia y carótida izquierda. La separación entre el arco aórtico y la aorta descendente era extensa, por lo que se descartó una anastomosis término-terminal. Asimismo, la arteria subclavia era pequeña (2 mm de diámetro) y no útil para realizar anastomosis, por lo que se decidió usar la arteria carótida izquierda cuyo diámetro era de unos 4 mm. Este vaso se disecó distalmente, se ocluyó su cabo distal, mientras que el proximal se anastomosó término-lateralmente a la aorta descendente; con anterioridad se ocluyó el ductus con un clip metálico. A continuación se abrió el pericardio paralelamente y anterior al nervio frénico, se disecaron los grandes vasos y se reconoció una VAP distal, muy cercana a la arteria pulmonar derecha, de unos 4 mm de diámetro; su disección fue fácil y se cerró con un hemaclip, todo ello sin el uso de CEC.
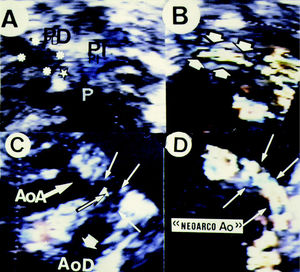
Un ecocardiograma de rutina realizado a las pocas horas de la operación objetivó una adecuada conexión carótida-aorta descendente sin gradiente de presiones y la ausencia de cortocircuito residual en la ventana. Sin embargo, se visualizó con Doppler color una ausencia total de flujo pulmonar en la arteria pulmonar derecha, que se confirmó con un estudio de perfusión pulmonar (fig. 2A). De nuevo en quirófano se reconoce la obstrucción en el origen de la arteria pulmonar derecha por inadecuada posición del clip metálico que ocluye la ventana, el mismo se reposiciona con distinta orientación a fin de no comprimir aquel vaso, observándose la inmediata reaparición de flujo circulatorio en dicha rama mediante un eco 2-D Doppler color intraquirófano (fig. 2B).
Fig. 2. A: Eco 2-D Doppler color (eje corto de grandes vasos) en el que se aprecia una ausencia total de flujo en arteria pulmonar derecha (PD, asteriscos), mientras que está conservado en la izquierda (PI, coloreada en azul). B: exploración en el propio quirófano al finalizar la reoperación para modificar la posición del clip en la ventana aortopulmonar; es evidente la restitución del flujo en dicha rama. C: se observa desde un corte paraesternal derecho alto el «neoarco aórtico» logrado con arteria carótida izquierda que restituye la continuidad entre aorta ascendente (AoA) y descendente (AoD); con Doppler color se ratifica la presencia de flujo a ese nivel (D).
Aunque la evolución postoperatoria fue tórpida con infección respiratoria y fallo multisistémico, la lenta y progresiva recuperación clínica del enfermo posibilitó el alta hospitalaria 40 días después de su ingreso. La revisión clínica y ecocardiográfica realizada 8 meses después de la cirugía demostró: a) una buena función biventricular con normalización de la dimensión de ventrículo derecho; b) la permeabilidad de la anastomosis carótida-aorta descendente con un gradiente máximo Doppler de 15 mmHg, y c) arteria pulmonar derecha permeable con leve aceleración proximal en la que se registraba un gradiente de 11 mmHg. La función pulmonar era normal; del mismo modo que lo eran la exploración neurológica, eco cerebral, EEG y TAC cerebral. La morfometría ecográfica del arco aórtico demostró los siguientes diámetros: aorta ascendente de 9 mm; arteria carótida izquierda conectada a aorta descendente («neoarco aórtico distal») de 6 mm, y aorta descendente de 8 mm (figs. 2C y D). DISCUSIÓN
La combinación IAA + VAP -sin comunicación interventricular- es muy infrecuente pero de constante aparición bibliográfica como casos aislados o incluidas en series reducidas con pocos enfermos, los neonatos con estas anomalías combinadas sin tratamiento quirúrgico precoz fallecen en su mayoría. Aun cuando el diagnóstico detallado con eco 2-D Doppler color es posible, en el presente caso, la inusual asociación -IAA tipo B y VAP tipo II-, impidió su reconocimiento (es más habitual que sean los tipos A y I, respectivamente) 1,7.
La corrección de IAA + VAP en el período neonatal se realiza con diferentes técnicas de soporte circulatorio; aunque la mayoría de cirujanos corrigen la VAP con parche a través de la aorta y la IAA con anastomosis directa arco aórtico-aorta descendente, la propia CEC y en especial la isquemia aórtica, parada circulatoria y/o bajo flujo con hipotermia profunda no están exentas de riesgo hemodinámico, neurológico y/o multiorgánico en neonatos con gran deterioro clínico. Esta última condición en nuestro caso, la normalidad de la arteria pulmonar derecha, y el buen tamaño de la arteria carótida, nos inclinaron a evitar la CEC y la parada circulatoria sin renunciar a la corrección total y definitiva de la cardiopatía de forma rápida, eficaz y poco lesiva para el niño 8,9.
Dietl y Hakimi han demostrado que con la anastomosis carótida izquierda-aorta descendente se logra una reparación adecuada de la IAA sin gradientes de presión significativos, el «neoarco» crece de forma armónica con la superficie corporal y demás estructuras cardiovasculares sin inducir lesiones neurológicas. En este sentido, el estudio multihospitalario sobre el uso de circulación con oxigenación de membrana en más de 7.000 casos no detectó lesiones neurológicas derivadas de la ligadura posterior de la arteria carótida derecha. Nuestro caso confirma estas apreciaciones, a los 8 meses no se detectaron lesiones neurológicas, el «neoarco aórtico» se desarrolla proporcionalmente con la superficie corporal del enfermo, y no se registró gradiente significativo a su nivel 10-12.
Por otro lado, la oclusión de la ventana con técnica cerrada, con ligadura, entre clanes suturando cabos, ha sido abandonada en favor de técnicas abiertas con la ayuda de la CEC al conferir ésta más seguridad en la oclusión y garantía en evitar daños a estructuras vecinas. Sin embargo, la anatomía tubular de la VAP en este caso, sin lesiones en las arterias coronarias o la rama pulmonar derecha, nos ha permitido su cierre con clip metálico de manera fácil y rápida; esta intervención, por otra parte, también fue comunicada por Kawata en un neonato pretérmino de muy bajo peso 13.
El dispositivo metálico es seguro y lo utilizamos electivamente para la oclusión ductal quirúrgica en la cirugía abierta combinada con otras lesiones, o en la cirugía cerrada de aquellos conductos no aptos para su cierre en cateterismo; no hemos constatado hasta la actualidad cortocircuito residual alguno con esta intervención.
Así pues, técnicas antiguas renovadas pueden ser útiles en casos concretos como el presente, proporcionando una reparación precoz, completa y segura en un enfermo con importante deterioro hemodinámico. El ecocardiograma de rutina en el postoperatorio precoz permitió corregir de inmediato una complicación inusual debido a inadecuada posición del clip metálico.
La asociación de interrupción del arco aórtico (IAA) con ventana aortopulmonar (VAP) es una rara aunque reconocida combinación patológica cuya historia natural se caracteriza por una presentación clínica grave en el período neonatal inmediato. Sin tratamiento quirúrgico la mortalidad es muy elevada y los supervivientes desarrollan con mucha frecuencia una irreversible arteriopatía pulmonar hipertensiva. Aun cuando la cirugía debe ser precoz, el riesgo operatorio es elevado debido a los efectos deletéreos que producen las técnicas de circulación extracorpórea (CEC), hipotermia profunda, parada circulatoria o bajo flujo en un neonato con manifiesto deterioro hemodinámico 1-4.
Presentamos un caso con IAA + VAP sin comunicación interventricular (CIV) operado con éxito mediante corrección total primaria de ambas lesiones sin CEC usando técnicas antiguas como la anastomosis de vasos supraaórticos para corregir la IAA y el cierre directo de la VAP. Asimismo, destacamos la trascendencia del estudio ecocardiográfico 2-D Doppler color que detectó una inusual complicación en el postoperatorio inmediato cuya solución definitiva precisó de rápida intervención.
CASO CLÍNICO
Recién nacido a término que ingresó en nuestro servicio a los 4 días de vida con severo deterioro hemodinámico y metabólico. A la exploración, presenta un mal estado general, cianosis y distrés respiratorio; se palpaba un ventrículo derecho predominante, siendo los pulsos femorales débiles, con ausencia del braquial izquierdo. La auscultación reflejó un segundo ruido intenso y un soplo sistólico corto en precordio. En la radiografía de tórax se observaba cardiomegalia e incremento de la vasculatura pulmonar, mientras que en el ECG era evidente el crecimiento ventricular derecho.
La exploración ecocardiográfica definió la distribución segmentaria cardiovascular como normal, sin evidencia de defectos septales. Las cavidades derechas estaban dilatadas y las izquierdas eran algo pequeñas; la vía de salida de ambos ventrículos y el origen y/o distribución de las arterias coronarias eran normales. En el arco aórtico se visualizaba una IAA tipo B con continuidad ductus-aorta descendente; la carótida izquierda tenía un buen tamaño y la subclavia izquierda era muy pequeña. Se objetivó también un vaso anómalo cercano al origen del tronco innominado cuya interpretación es dudosa, motivo por el cual se realizó un estudio hemodinámico-angiográfico (fig. 1) que confirmó el diagnóstico de IAA tipo B, y demostró la existencia de una VAP tipo II (alejada de la válvula sigmoidea y cercana a la rama pulmonar derecha) de morfología tubular, con un diámetro de 3 mm 5,6.
Fig. 1. Aortograma que demuestra la interrupción del istmo aórtico tipo B (asterisco), y la ventana aortopulmonar «alta» tipo II (flechas). Ao: aorta; P: arteria pulmonar; CI: carótida izquierda.
A las 48 h del ingreso el paciente presentó parada cardiorrespiratoria por fibrilación ventricular, de la que se recuperó tras largas maniobras de resucitación. Tras un prolongado período de recuperación en UVI con infusión de prostaglandina e inotrópicos, corrección de la acidosis metabólica y asistencia respiratoria mecánica con modalidad ventilatoria destinada a elevar la pCO 2 para restringir el flujo pulmonar, se realizó intervención quirúrgica a los 20 días de vida en presencia de una mala situación clínica y con 2.400 g de peso.
Por toracotomía izquierda, cuarto espacio intercostal, se disecó ampliamente la aorta descendente, el ductus y el arco aórtico con las arterias subclavia y carótida izquierda. La separación entre el arco aórtico y la aorta descendente era extensa, por lo que se descartó una anastomosis término-terminal. Asimismo, la arteria subclavia era pequeña (2 mm de diámetro) y no útil para realizar anastomosis, por lo que se decidió usar la arteria carótida izquierda cuyo diámetro era de unos 4 mm. Este vaso se disecó distalmente, se ocluyó su cabo distal, mientras que el proximal se anastomosó término-lateralmente a la aorta descendente; con anterioridad se ocluyó el ductus con un clip metálico. A continuación se abrió el pericardio paralelamente y anterior al nervio frénico, se disecaron los grandes vasos y se reconoció una VAP distal, muy cercana a la arteria pulmonar derecha, de unos 4 mm de diámetro; su disección fue fácil y se cerró con un hemaclip, todo ello sin el uso de CEC.
Un ecocardiograma de rutina realizado a las pocas horas de la operación objetivó una adecuada conexión carótida-aorta descendente sin gradiente de presiones y la ausencia de cortocircuito residual en la ventana. Sin embargo, se visualizó con Doppler color una ausencia total de flujo pulmonar en la arteria pulmonar derecha, que se confirmó con un estudio de perfusión pulmonar (fig. 2A). De nuevo en quirófano se reconoce la obstrucción en el origen de la arteria pulmonar derecha por inadecuada posición del clip metálico que ocluye la ventana, el mismo se reposiciona con distinta orientación a fin de no comprimir aquel vaso, observándose la inmediata reaparición de flujo circulatorio en dicha rama mediante un eco 2-D Doppler color intraquirófano (fig. 2B).
Fig. 2. A: Eco 2-D Doppler color (eje corto de grandes vasos) en el que se aprecia una ausencia total de flujo en arteria pulmonar derecha (PD, asteriscos), mientras que está conservado en la izquierda (PI, coloreada en azul). B: exploración en el propio quirófano al finalizar la reoperación para modificar la posición del clip en la ventana aortopulmonar; es evidente la restitución del flujo en dicha rama. C: se observa desde un corte paraesternal derecho alto el «neoarco aórtico» logrado con arteria carótida izquierda que restituye la continuidad entre aorta ascendente (AoA) y descendente (AoD); con Doppler color se ratifica la presencia de flujo a ese nivel (D).
Aunque la evolución postoperatoria fue tórpida con infección respiratoria y fallo multisistémico, la lenta y progresiva recuperación clínica del enfermo posibilitó el alta hospitalaria 40 días después de su ingreso. La revisión clínica y ecocardiográfica realizada 8 meses después de la cirugía demostró: a) una buena función biventricular con normalización de la dimensión de ventrículo derecho; b) la permeabilidad de la anastomosis carótida-aorta descendente con un gradiente máximo Doppler de 15 mmHg, y c) arteria pulmonar derecha permeable con leve aceleración proximal en la que se registraba un gradiente de 11 mmHg. La función pulmonar era normal; del mismo modo que lo eran la exploración neurológica, eco cerebral, EEG y TAC cerebral. La morfometría ecográfica del arco aórtico demostró los siguientes diámetros: aorta ascendente de 9 mm; arteria carótida izquierda conectada a aorta descendente («neoarco aórtico distal») de 6 mm, y aorta descendente de 8 mm (figs. 2C y D). DISCUSIÓN
La combinación IAA + VAP -sin comunicación interventricular- es muy infrecuente pero de constante aparición bibliográfica como casos aislados o incluidas en series reducidas con pocos enfermos, los neonatos con estas anomalías combinadas sin tratamiento quirúrgico precoz fallecen en su mayoría. Aun cuando el diagnóstico detallado con eco 2-D Doppler color es posible, en el presente caso, la inusual asociación -IAA tipo B y VAP tipo II-, impidió su reconocimiento (es más habitual que sean los tipos A y I, respectivamente) 1,7.
La corrección de IAA + VAP en el período neonatal se realiza con diferentes técnicas de soporte circulatorio; aunque la mayoría de cirujanos corrigen la VAP con parche a través de la aorta y la IAA con anastomosis directa arco aórtico-aorta descendente, la propia CEC y en especial la isquemia aórtica, parada circulatoria y/o bajo flujo con hipotermia profunda no están exentas de riesgo hemodinámico, neurológico y/o multiorgánico en neonatos con gran deterioro clínico. Esta última condición en nuestro caso, la normalidad de la arteria pulmonar derecha, y el buen tamaño de la arteria carótida, nos inclinaron a evitar la CEC y la parada circulatoria sin renunciar a la corrección total y definitiva de la cardiopatía de forma rápida, eficaz y poco lesiva para el niño 8,9.
Dietl y Hakimi han demostrado que con la anastomosis carótida izquierda-aorta descendente se logra una reparación adecuada de la IAA sin gradientes de presión significativos, el «neoarco» crece de forma armónica con la superficie corporal y demás estructuras cardiovasculares sin inducir lesiones neurológicas. En este sentido, el estudio multihospitalario sobre el uso de circulación con oxigenación de membrana en más de 7.000 casos no detectó lesiones neurológicas derivadas de la ligadura posterior de la arteria carótida derecha. Nuestro caso confirma estas apreciaciones, a los 8 meses no se detectaron lesiones neurológicas, el «neoarco aórtico» se desarrolla proporcionalmente con la superficie corporal del enfermo, y no se registró gradiente significativo a su nivel 10-12.
Por otro lado, la oclusión de la ventana con técnica cerrada, con ligadura, entre clanes suturando cabos, ha sido abandonada en favor de técnicas abiertas con la ayuda de la CEC al conferir ésta más seguridad en la oclusión y garantía en evitar daños a estructuras vecinas. Sin embargo, la anatomía tubular de la VAP en este caso, sin lesiones en las arterias coronarias o la rama pulmonar derecha, nos ha permitido su cierre con clip metálico de manera fácil y rápida; esta intervención, por otra parte, también fue comunicada por Kawata en un neonato pretérmino de muy bajo peso 13.
El dispositivo metálico es seguro y lo utilizamos electivamente para la oclusión ductal quirúrgica en la cirugía abierta combinada con otras lesiones, o en la cirugía cerrada de aquellos conductos no aptos para su cierre en cateterismo; no hemos constatado hasta la actualidad cortocircuito residual alguno con esta intervención.
Así pues, técnicas antiguas renovadas pueden ser útiles en casos concretos como el presente, proporcionando una reparación precoz, completa y segura en un enfermo con importante deterioro hemodinámico. El ecocardiograma de rutina en el postoperatorio precoz permitió corregir de inmediato una complicación inusual debido a inadecuada posición del clip metálico.
Bibliografía
[1]
Interruption of aortic arch with aorticopulmonary septal defect. Pediatric Cardiology 1982; 3: 329-335.
[2]
Interrupted aortic arch and aortopulmonary window: One stage repair in the first week of life. Ann Thorac Surg 1993; 56: 554-556.
[3]
Total one stage repair of interrupted aortic arch associated with aortic septal defect and patent ductus arteriosus. J Thorac Cardiovasc Surg 1977; 74: 913-917.
[4]
Repair of interrupted aortic arch: Ten year experience. J Thorac Cardiovasc Surg 1996; 112: 1150-1160.
[5]
Congenital absence of the aortic arch. Am Heart J 1959; 58: 407-413.
[6]
Interruption of the aortic arch: anatomic patterns and associated cardiac malformations. AJR 1965; 95: 557-572.
[7]
Echocardiographic diagnosis of interrupted aortic arch and aortopulmonary communications. Int J Cardiol 1989; 24: 238-241.
[8]
One-stage repair of interrupted aortic arch and aortopulmonary window. Ann Thorac Surg 1998; 65: 829-831.
[9]
Early and late results after repair of aortopulmonary septal defect and associated anomalies in infants < 6 months of age. Am J Cardiol 1998; 81: 195-201.
[10]
Repair of interrupted aortic arch with an augmented aortic anastomosis. Ann Thorac Surg 1993; 56: 4-6, 142-148.
[11]
Arch growth after staged repair of interrupted aortic arch using carotid artery interposition. Ann Thorac Surg 1997; 64: 503-507.
[12]
Complications of neonatal extracorporeal membrane oxigenation. Collective Experience form the Extracorporeal Life Support Organization. J Thorac Cardiovasc Surg 1994; 107: 838-848.
[13]
Repair of aortopulmonary window in a infant with extremely low birth weight. Ann Thorac Surg 1996; 62: 1843-1845.