La mejora en la supervivencia de los pacientes con cáncer ha puesto de manifiesto el impacto clínico que la cardiotoxicidad tiene en el pronóstico tanto cardiovascular como onco-hematológico, sobre todo cuando motiva la interrupción de terapias antitumorales altamente eficaces. La fibrilación auricular es una complicación frecuente en pacientes con cáncer activo y su tratamiento supone un gran reto. Estos pacientes tienen mayores riesgos tromboembólico y hemorrágico y, sin embargo, no se dispone de escalas específicas para guiar la atención clínica. El objetivo de este documento promovido por los grupos de Cardio-Onco-Hematología y Trombosis de la Sociedad Española de Cardiología y elaborado de manera conjunta con las diferentes áreas de conocimiento de la Sociedad Española de Cardiología y con expertos de la Sociedad Española de Oncología Médica, la Sociedad Española de Oncología Radioterápica y la Sociedad Española de Hematología y Hemoterapia, es proporcionar un enfoque multidisciplinario y práctico para la prevención y el tratamiento de la fibrilación auricular de pacientes con cáncer activo y basado en el consenso de expertos.
Palabras clave
En las últimas décadas, los avances en el diagnóstico y el tratamiento precoz de los pacientes con cáncer han dado lugar a un notable aumento de la supervivencia. Paralelamente, ante la preocupación por el impacto clínico que los antitumorales tienen en el sistema cardiovascular (CV)1, surge la necesidad de estructurar un abordaje multidisciplinario de estos pacientes. Los equipos de Cardio-Onco-Hematología (COH) están dirigidos a facilitar el tratamiento onco-hematológico (TOH) estableciendo estrategias de prevención y tratamiento precoz de las diferentes manifestaciones de cardiotoxicidad2. El objetivo de este documento es proporcionar un enfoque consensuado y práctico para la prevención, la monitorización y el tratamiento de la fibrilación auricular (FA) en pacientes con cáncer activo, definición que engloba a pacientes en TOH activo y aquellos con un diagnóstico de cáncer en el año previo o con enfermedad metastásica. La metodología se presenta en la primera parte del adicional y en la se relacionan los expertos que han participado y certifican el documento de consenso y las sociedades científicas a las que pertenecen.
EPIDEMIOLOGÍA DE LA FIBRILACIÓN AURICULAR EN PACIENTES CON CÁNCERLa mejora en el pronóstico del cáncer y el uso de terapias dirigidas han aumentado drásticamente la prevalencia de arritmias cardiacas en onco-hematolología, aunque su incidencia está subestimada en la literatura, ya que los ensayos clínicos han excluido a los pacientes con cardiopatía1,3,4. Los mecanismos por los cuales algunos TOH desencadenan arritmias no están completamente esclarecidos, pero el riesgo individual de presentarlas depende tanto del TOH como de las características clínicas del paciente y de los cambios metabólicos e inflamatorios inducidos por el propio tumor5,6. Este riesgo es mayor para los pacientes de más de 65 años, casi 2 de cada 3 pacientes onco-hematológicos, o con enfermedad cardiovascular (ECV) previa (el 30% de los pacientes con cáncer)1,3,7.
La FA es la arritmia mantenida más frecuente en la población general8 y su incidencia es sustancialmente mayor en pacientes con cáncer1,3,6. La prevalencia de FA es muy variable en las diferentes publicaciones en función de si incluyen solo a pacientes con cáncer activo o con antecedentes de enfermedad onco-hematológica o hacen referencia a la FA en cirugía oncológica1,3. En el estudio REGARDS9, que incluyó a 15.428 pacientes, aquellos con cáncer (2.314; 15%) presentaron un riesgo de contraer una FA un 20% superior que la población sin cáncer, incluso en ausencia de TOH y tras ajustar por edad, ECV y otros factores de riesgo de FA. A pesar de ello, la presencia de FA, los antecedentes de FA o la posibilidad de presentarla no contraindican el uso de ningún TOH, aunque sí implican la necesidad de un abordaje multidisciplinario por COH2. De hecho, la aparición de FA durante el TOH activo (un 2-16% según las series) duplica el riesgo tromboembólico y multiplica por 6 el riesgo de insuficiencia cardiaca1,3,6,10.
TRATAMIENTOS FARMACOLÓGICOS ONCO-HEMATOLÓGICOS RELACIONADOS CON UN AUMENTO EN EL RIESGO DE FIBRILACIÓN AURICULAREn la tabla 1 se incluyen los fármacos antitumorales que se asocian con la aparición de FA. En la se encuentra la clasificación de los fármacos antitumorales; la recopila las principales reacciones adversas que producen, y la muestra las interacciones medicamentosas descritas en el momento de publicarse este documento11,12. Se puede consultar actualizaciones de las interacciones en las páginas web de RxList13, Electronic Medicines Compendium14 y Centro de información online de medicamentos de la AEMPS15.
Fármacos antitumorales que inducen fibrilación auricular
| • Alcaloides de la vinca |
| • Alquilantes: cisplatino, ciclofosfamida, ifosfamida, melfalán |
| • Antagonistas de GnRH: degarelix |
| • Antraciclinas: doxorubicina, mitoxantrona |
| • Anticuerpos monoclonales: alemtuzumab, cetuximab, ipilimumab, obinutuzumab, ofatumumab, rituximab |
| • Antimetabolitos: azatioprina, capecitabina, 5-fluorouracilo, gemcitabina, metotrexato, pentostatina |
| • Inhibidores de la aromatasa |
| • Inhibidores de BCR-ABL: dasatinib |
| • Inhibidores de HER2: trastuzumab |
| • Inhibidores de histona deacetilasas: vorinostat |
| • Inhibidores del proteasoma: bortezomib |
| • Inhibidores de proteincinasas: ibrutinib |
| • Inhibidores de la síntesis de andrógenos: abiraterona |
| • Inhibidores de la topoisomerasa II: amsacrina, etopósido |
| • Inhibidores del VEGF: bevacizumab |
| • Interferones |
| • Interleucina 2 |
| • Taxanos: docetaxel, paclitaxel |
VEGF: factor de crecimiento endotelial vascular; VEGFR: receptor del factor de crecimiento endotelial vascular.
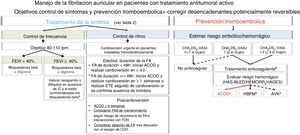
El tratamiento de la FA en el paciente con cáncer activo es similar al indicado para la población general e incluye la mejoría de los síntomas, el control de la arritmia y la prevención de accidentes cerebrovasculares y embolias sistémicas8. Es necesario recordar que las escalas habituales de estratificación de los riesgos hemorrágico y tromboembólico no están validadas para población con cáncer activo. En el documento se mantiene la distinción entre FA valvular (definida como la asociada con estenosis mitral reumática moderada-grave o prótesis valvulares mecánicas) y FA no valvular (FANV) marcada por la guía de la Sociedad Europea de Cardiología8 (figura 1).
Algoritmo de tratamiento de la fibrilación auricular de pacientes con tratamiento antitumoral activo. La línea discontinua señala situaciones con menos evidencia. ACOD: anticoagulantes orales directos; AVK: antagonistas de la vitamina K; HBPM: heparina de bajo peso molecular; COH: Cardio-Onco-Hematología; ETE: ecocardiografía transesofágica; FA: fibrilación auricular; FAA: fármacos antiarrítmicos; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; TOH: tratamiento onco-hematológico. aValórense las posibles interacciones. bConsidere el cierre percutáneo de la orejuela izquierda de pacientes con alto riesgo hemorrágico y/o contraindicación para el tratamiento anticoagulante y esperanza de vida> 1 año.
La decisión de optar por una estrategia de control del ritmo (CR) frente al control de la frecuencia cardiaca (CF) debe individualizarse con el objetivo de mejorar los síntomas, minimizar el riesgo de complicaciones CV, evitar interrupciones del TOH y reducir interacciones medicamentosas1,3,8. Para ello, el equipo de COH debe valorar la probabilidad de mantener al paciente en ritmo sinusal estable en función de su edad, la presencia de cardiopatía y el TOH activo1,16.
Para los pacientes inestables, debe considerarse una cardioversión eléctrica urgente8 (figura 1). En el contexto de FA de reciente comienzo, es necesario corregir desencadenantes potencialmente reversibles que permitan mantener un adecuado CR8.
En general, para el paciente estable se suele optar por el CF, por la escasa probabilidad de mantener ritmo sinusal con un TOH activo proarrítmico1,3. También se recomienda optar por el CF para los pacientes de edad avanzada, con ECV o aurícula izquierda muy dilatada y aquellos con buen control de síntomas, mal pronóstico onco-hematológico o en situación paliativa1,3. Un contexto especial es la FA posoperatoria6,17. En pacientes sin ECV y sin factores de riesgo CV, se debe valorar una estrategia de CR tras controlar sus posibles desencadenantes (insuficiencia cardiaca, anemia, infecciones, etc.), mientras que la estrategia de CF sería de primera elección para aquellos que acumulan factores de riesgo CV. La tabla 2 resume los principales puntos que tener en cuenta en la toma de decisiones.
Estrategia de control del ritmo frente a control de la frecuencia cardiaca
| Puntos que considerar en la toma de decisiones | Estabilidad hemodinámica |
| Control sintomático | |
| Probabilidad de recuperar y mantener el ritmo sinusal | |
| Cardiopatía concomitante | |
| Interacciones farmacológicas con el tratamiento oncológico | |
| La expectativa de vida y la fragilidad del paciente | |
| Priorizar una estrategia de control del ritmo | Inestabilidad hemodinámica: cardioversión urgente |
| Síntomas persistentes relacionados con la FA a pesar de un adecuado control de la respuesta ventricular | |
| Mal control de la frecuencia cardiaca±insuficiencia cardiaca | |
| FA secundaria a desencadenantes corregibles (infección, anemia, hipertiroidismo, etc.) | |
| Pacientes jóvenes sin cardiopatía estructural una vez completado el tratamiento antitumoral | |
| Priorizar una estrategia de control de la frecuencia | Necesidad de mantener el tratamiento antitumoral que ha precipitado la aparición de FA |
| Pacientes asintomáticos con buen control de la frecuencia cardiaca en tratamiento antitumoral activo | |
| Neoplasia avanzada o en situación paliativa | |
| Cardiopatía estructural que aumente el riesgo de FA (enfermedad valvular, insuficiencia cardiaca, dilatación grave de la aurícula izquierda) | |
| Paciente frágil | |
| Recurrencia de FA tras al menos 2 fármacos antiarrítmicos en pacientes con tratamiento antitumoral activo | |
| Recaída precoz (< 1 mes) tras la cardioversión de pacientes con tratamiento antiarrítmico y tratamiento antitumoral activo | |
| Interacciones farmacológicas mayores de los tratamientos antiarrítmico y antitumoral |
FA: fibrilación auricular.
El avance en las técnicas de ablación y la aparición de catéteres de nueva generación han contribuido a facilitar el procedimiento haciendo posible su aplicación a pacientes más complejos8. La decisión de realizar una ablación puede considerarse con el equipo de COH para pacientes muy seleccionados en los que hayan fracasado otras estrategias terapéuticas de CR o CF o cuando se prevean interacciones farmacológicas no controlables con el TOH y el pronóstico onco-hematológico no contraindique la intervención. Aunque la ablación con catéter es una alternativa eficaz en el tratamiento de la FA18, los resultados publicados sobre pacientes con cáncer son escasos. En el contexto de la FA posoperatoria, un estudio retrospectivo en 15 pacientes con FA refractaria tras una neumonectomía mostró que el procedimiento es seguro y eficaz (el 80% en ritmo sinusal al año)19. Es conveniente señalar que la ablación eficaz no evita la anticoagulación en los casos indicados.
Prevención del ictus y la embolia sistémicaValoración de los riesgos embólico y hemorrágicoAl igual que en la población general, es necesario estimar el riesgo de eventos tromboembólicos y hemorrágicos para determinar la necesidad de anticoagulación y el riesgo que conlleva1,3,8. La presencia de cáncer activo implica mayor riesgo tromboembólico y hemorrágico en relación con el tumor (localización, histología, estadio) y con los efectos secundarios del TOH20–23 (tabla 3). La liberación de agentes procoagulantes, fibrinolíticos y citocinas proinflamatorias aumenta las complicaciones tromboembólicas arteriales y venosas24. Por otro lado, tanto el propio tumor como la necesidad de intervenciones y la mielotoxicidad de los TOH aumentan el riesgo hemorrágico8,25.
Fármacos antitumorales asociados con riesgo aumentado de hemorragia o trombosis
| Hemorragias | • Alcaloides de la vinca, alquilantes, anticuerpos monoclonales (aflibercept, bevacizumab, ramurizumab, trastuzumab-emtansina), antiestrógenos, antimetabolitos (pentostatina), antraciclinas, bleomicina, campotectinas, carfilzomib, epipodofilotoxinas, ibrutinib, inhibidores de BCR-Abl, BRAF y VEGF/VEGFR, interleucinas, L-asparraginasa, ruxolitinib, taxanos, temozolomida• Ciclofosfamida, ifosfamida: cistitis hemorrágica• Megestrol, tamoxifeno: hemorragia uterina |
| Trombosis arterial | • Alquilantes (carboplatino, ciclofosfamida, cisplatino, estramustina, oxiplatino), anticuerpos monoclonales (aflibercept, bevacizumab), antraciclinas, antimetabolitos (capecitabina, 5-fluorouracilo, gemcitabina, metotrexato), inhibidores de EGFR (cetuximab), bleomicina, inhibidores de las proteincinasas (axitinib, lenvatinib, pazopanib, sorafenib, sunitinib), inhibidores del proteosoma (carfilzomib), inhibidores del VEGF (aflibercept, bevacizumab, ramucirumab), irinotecán, taxanos, tasonermina, tretinoína |
| Trombosis venosa | • Alquilantes (carboplatino, carmustina, ciclofosfamida, cisplatino, estramustina, oxiplatino, temozolomida), análogos de gonadoliberina, antiandrógenos, anticuerpos monoclonales (cetuximab, panitumumab), antiestrógenos, antimetabolitos (capecitabina, 5-fluorouracilo, gemcitabina, metotrexato, pentostatina), antraciclinas, eribulina, inmunomoduladores (lenalidomida, pomalidomida, talidomida), inhibidores de aromatasa, inhibidores de BCR-Abl (dasatinib, nilotinib, ponatinib), inhibidores de EGFR (erlotinib, gefitinib), inhibidores de mTOR, inhibidores del proteosoma (carfilzomib), inhibidores de cinasas dependientes de ciclinas (abemaciclib), inhibidores de cinasas intracelulares que participan en la angiogénesis (axitinib, pazopanib, regorafenib, sunitinib), irinotecán, megestrol, progestágenos, raloxifeno, tamoxifeno, tasonermina, tretinoína, vinflunina, vorinostat• Agentes estimuladores de la eritropoyesis y factores estimuladores de colonias de granulocitos |
BCR-Abl: proteína de fusión BCR-Abl (breakingpoint cluster region-ABeLson);BRAF: gen humano que codifica la proteína BRAF u homólogo B del oncogén viral del sarcoma murino proto-oncogénico; EGFR: receptor del factor de crecimiento epidérmico; mTOR: receptor de rapamicina en mamíferos; VEGF: factor de crecimiento endotelial vascular humano; VEGFR: receptor del VEGF.
A la espera de contar con escalas específicas, se recomienda estratificar y revaluar periódicamente los riesgos embólico y hemorrágico de la FANV con las escalas CHA2DS2-VASc y HAS-BLED1,3,8,26. Si no existen contraindicaciones absolutas, se recomienda anticoagular a los varones y las mujeres con CHA2DS2-VASc ≥ 1 y ≥ 2 respectivamente (figura 1)8. Para los pacientes con FA y cáncer, la probabilidad de eventos tromboembólicos es mayor que para los pacientes no oncológicos25, lo que obliga a considerar de manera individual el riesgo de pacientes sin indicación absoluta de anticoagulación. En casos complejos, el uso de otras escalas podría ayudar a estratificar el riesgo, como por ejemplo la escala ABC27 (A: edad, B: troponina T ultrasensible y NT-proBNP y C: ictus/accidente isquémico transitorio previos), o la escala HEMORR2HAGES28 (H: enfermedad renal o hepática, E: alcoholismo, M: cáncer; R: trombocitopenia, R: antecedentes de hemorragia, H: hipertensión, A: anemia, G: genética, E: caídas, S: ictus).
Tratamiento anticoagulanteA pesar de que la anticoagulación del paciente onco-hematológico requiere un abordaje riguroso, su prescripción a pacientes con FA y cáncer activo no es óptima. En registros de la vida real, 1/4 pacientes no recibió anticoagulantes y se trató a 1/3 con dosis infraterapéuticas de heparinas de bajo peso molecular (HBPM)29.
Aunque hay disponibles 3 grupos de anticoagulantes, la evidencia científica de todos ellos en pacientes con cáncer activo y FA es escasa. La elección de este tratamiento debe individualizarse considerando el pronóstico onco-hematológico, los riesgos tromboembólico y hemorrágico del paciente y el propio tumor, la farmacocinética del anticoagulante (), el TOH activo, sus posibles interacciones y los cambios que pueden producirse en la función renal y hepática durante el tratamiento. No se han descrito interacciones en pacientes tratados solo con radioterapia. En general, se recomienda evitar el uso de antiagregantes en pacientes anticoagulados con cáncer activo1,3,8.
Antagonistas de la vitamina KTanto la warfarina como el acenocumarol son fármacos difíciles de manejar en pacientes con FA y cáncer activo, ya que su seguridad y su eficacia dependen de un estrecho margen terapéutico y la posibilidad de conseguir un tiempo en rango terapéutico óptimo (> 65%)30,31 se reduce durante el TOH1,3,32,33. En los pacientes que reciben TOH y antagonistas de la vitamina K (AVK), se incrementan tanto el riesgo trombótico como el hemorrágico por las interacciones farmacológicas y las dificultades de mantener un tiempo en rango terapéutico adecuado (intervenciones frecuentes, desnutrición, vómitos, disfunción hepática o trombocitopenia)3,34. Por estos motivos, durante el TOH, los AVK quedarían reservados a los pacientes con FA valvular en los que se pueda asegurar un control adecuado de la razón internacional normalizada (INR).
Heparinas de bajo peso molecularAunque no hay evidencia científica que avale el uso de HBPM en la prevención de eventos tromboembólicos en cáncer y FA, ni se han estudiado sus posibles interacciones, su prescripción es frecuente durante la fase activa del TOH29. Su uso clínico a largo plazo está limitado tanto por el alto coste económico como por la pérdida de calidad de vida y las complicaciones derivadas de la administración subcutánea prolongada. El uso de HBPM puede considerarse para los pacientes que presenten graves interacciones del TOH con los anticoagulantes orales o cuando haya intolerancia oral3,6,24.
Anticoagulantes orales directosLos anticoagulantes orales directos (ACOD) son el tratamiento de elección para la población general con FANV, dados los beneficios demostrados en términos de eficacia, tolerancia y seguridad con respecto a los AVK8,35,36. Entre las ventajas más relevantes frente a otros anticoagulantes, destacan una farmacocinética más predecible que asegura una anticoagulación correcta sin necesidad de controles sistemáticos, inicio de acción rápido y vida media corta, administración oral, menor número de interacciones con alimentos y fármacos y la disponibilidad de agentes de reversión8,35 ().
Recientemente se han publicado 3 ensayos aleatorizados que comparan ACOD con la dalteparina en la enfermedad tromboembólica venosa en pacientes con cáncer: HOKUSAI-VTE37 con edoxabán, SELECT-D38 con rivaroxabán y ADAM-VTE39 con apixabán. Los ACOD se han mostrado seguros y eficaces comparados con la dalteparina en la prevención de recurrencias de enfermedad tromboembólica venosa. Por ese motivo, los últimos documentos de consenso recomiendan su uso, como alternativa a la dalteparina, en la enfermedad tromboembólica venosa en ausencia de interacciones y alto riesgo hemorrágico40-42.
La evidencia científica sobre la eficacia y la seguridad de los ACOD en la prevención del accidente cerebrovascular/embolia sistémica en pacientes con cáncer activo y FA es más escasa, ya que estos pacientes fueron excluidos de los ensayos esenciales8,35. El análisis post-hoc del estudio ARISTOTLE43 no mostró diferencias en la incidencia de eventos tromboembólicos o hemorrágicos mayores en pacientes con y sin cáncer, con un perfil favorable al apixabán frente a la warfarina en ambas poblaciones. Fanola et al.44 han analizado los 1.153 pacientes que, tras ser incluidos en el estudio ENGAGE-AF, fueron diagnosticados de cáncer, y concluyen que el edoxabán fue similar a la warfarina en la prevención de eventos embólicos, sin incrementar el riesgo hemorrágico. El beneficio del edoxabán sobre la warfarina fue mayor en los pacientes con cáncer para el objetivo compuesto de ictus isquémico/embolia sistémica/infarto de miocardio, con una reducción del riesgo del 46%, en comparación con la warfarina. Además, la concentración del fármaco y la actividad del factor Xa en los pacientes con neoplasias fueron similares a las registradas en pacientes sin cáncer44. Del mismo modo, diferentes estudios de la vida real (tabla 4) han constatado la eficacia y la seguridad de los ACOD frente a warfarina en la prevención del accidente cerebrovascular/embolia sistémica en pacientes con cáncer45–49.
Estudios publicados de pacientes con cáncer, fibrilación auricular y anticoagulantes orales de acción directa
| Eficacia (eventos tromboembólicos) | Seguridad (hemorragias mayores) | |
|---|---|---|
| Ording et al.46Registro danés 2010-2014 prospectivo (68.119 pacientes; 11.855 con cáncer) | Presencia frente a ausencia de cáncer con AVK (% de riesgo)Incidencia anual: el 6,5 frente al 5,8%Presencia frente a ausencia de cáncer con ACOD (% de riesgo)Incidencia anual: el 4,9 frente al 5,1% | Presencia frente a ausencia de cáncer con AVK (% de riesgo)Incidencia anual: el 5,4 frente al 4,3%Presencia frente a ausencia de cáncer con ACOD (% de riesgo)Incidencia anual: el 4,4 frente al 3,1% |
| Melloni et al.43ARISTOTLE post-hoc (1.236 pacientes con cáncer; 76 con cáncer activo y apixabán) | Cáncer: apixabán frente a warfarina; incidencia anual de ACV/ES: el 1,4 frente al 1,2% (HR=1,09)Sin cáncer, apixabán frente a warfarina; incidencia anual de ACV/ES: el 1,3 frente al 1,6% (HR=0,77) | Cáncer: apixabán frente a warfarina; incidencia anual: el 2,4 frente al 3,2% (HR=0,76)Sin cáncer: apixabán frente a warfarina; incidencia anual: el 2,1 frente al 3,1% (HR=0,69) |
| Laube et al.49Registro unicéntrico prospectivo (163 pacientes con FA, cáncer y rivaroxabán); seguimiento, 1 año | Incidencia anual: 1,4% | Incidencia anual: 1,2% |
| Russo et al.45Observacional unicéntrico (76 pacientes con FA, cáncer y ACOD) | Sin eventos tromboembólicos | Incidencia acumulada: 3,9%Incidencia anual: 1,4% |
| Fanola et al.44ENGAGE-AF (1.153 pacientes con cáncer activo); seguimiento, 2,8 años; el 85,9% con nuevo cáncer; el 14,1% de recurrencias (tumor previo> 5 años) | ICTUS/ES con edoxabán a dosis altas frente a AVK en cáncer: HR=0,60 (0,31-1,15)ICTUS isquémico/ES/IAM con edoxabán a dosis altas frente a AVK en cáncer: HR=0,54 (0,31-0,93) | Hemorragia mayor con edoxabán a dosis altas frente a AVK en cáncer: HR=0,98 (0,69-1,4) |
| Shah et al.47Retrospectivo (16.096 pacientes con cáncer; 6.075 con ACOD, 10.021 con AVK); seguimiento 12 meses | Ictus isquémico:Rivaroxabán frente a AVK: HR=0,74 (0,40-1,39)Dabigatrán frente a AVK: HR=0,89 (0,56-1,42)Apixabán frente a AVK: HR=0,71 (0,19-2,60)Tromboembolia venosa:Rivaroxabán frente a AVK: HR=0,51 (0,41-0,63)Dabigatrán frente a AVK: HR=0,28 (0,21-0,38)Apixabán frente a AVK: HR=0,14 (0,07-0,32) | Hemorragias mayoresRivaroxabán frente a AVK: HR=1,09 (0,79-1,39)Dabigatrán frente a AVK: HR=0,96 (0,72-1,27)Apixabán frente a AVK: HR=0,37 (0,17-0,79) |
| Vedovati et al.50Registro multicéntrico de FA y ACOD (289 pacientes con cáncer, el 12,6% de la serie) | Ictus isquémico, AIT o ES en cáncer frente a sin cáncer con ACOD: HR=2,60 (1,08-6,20) | Hemorragia mayor en cáncer frente a sin cáncer tratados con ACOD: HR=2,0 (1,25-3,30) |
| Kim et al.48Retrospectivo de FA y cáncer de reciente diagnóstico (2.568 pacientes; p <0,001 para todas las comparaciones, propensity score) | Tasa de ACV/ES en warfarina frente a ACOD: el 5,9 frente al 1,3%/año | Hemorragia mayor en warfarina frente a ACOD: el 5,1 frente al 1,2%/añoHemorragia digestiva en warfarina frente a ACOD: el 3,5 frente al 1,0%/añoHIC en warfarina frente a ACOD: el 1,1 frente al 0,2%/año |
ACOD: anticoagulantes orales de acción directa; AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; ES: embolia sistémica; HIC: hemorragia intracraneal; HR: hazard ratio.
Eficacia definida como la incidencia de ictus/embolia sistémica. Hemorragia mayor según la definición de la International Society on Thrombosis and Haemostasis: disminución de la concentración de hemoglobina ≥ 2 g/dl, trasfusión ≥ 2 concentrados de hematíes, hemorragia mortal o en un área crítica (intracraneal, intraespinal, intraocular, pericárdica, intraarticular, intramuscular con síndrome compartimental asociado o retroperitoneal).
Aunque no existen datos directos de pacientes con FANV, la evidencia científica disponible permite considerarlos una opción segura y eficaz para los pacientes con cáncer activo35. La elección del tipo de ACOD depende de las características clínicas que determinan su uso habitual (edad, peso, función renal, riesgo hemorrágico aumentado en tumores digestivos y genitourinarios no intervenidos, necesidad concomitante de antiagregación, etc.) y de la existencia de interacciones con el TOH (tabla 5)35,50. Al igual que en pacientes sin cáncer, el ajuste de dosis guiado por la función renal minimiza el aumento del riesgo embólico por infradosificación35,51,52. El tratamiento antitrombótico en relación con los procedimientos invasivos o las intervenciones debe seguir las mismas recomendaciones establecidas para la población sin cáncer53.
Interacciones farmacológicas entre fármacos antitumorales y anticoagulantes
| Antagonistas de la vitamina K | ||
|---|---|---|
| AcenocumarolWarfarina | Capecitabina, etopósido+carboplatino, 5–fluorouracilo, ifosfamida, imatinib, paclitaxel, tamaoxifeno, dabrafenib, ivosidenib | Contraindicado/no recomendado |
| Bicalutamida, carbozantinib, carboplatino, ceritinib, ciclofosfamida, citarabina, cisplatino, dasatinib, doxorrubicina, erlotinib, etopósido, gefitinib, ibritumomab, ibrutinib, imatinib, inhibidores del VEGF/VEGFR, interferones, ipilimumab, irinotecán, metotrexato, nintedanib, obinutuzumab, procarbazina, regorafenib, romidepsina, rucaparib, sorafenib, sunitinib, tegafur, tiotepa, vorinostat | Estos fármacos potencian el efecto anticoagulante | |
| Mercaptopurina, mitotano, nilotinib | Estos fármacos reducen el efecto anticoagulante | |
| Heparinas de bajo peso molecular | ||
|---|---|---|
| HBPM | Capecitabina | Contraindicado/no recomendado |
| Otros fármacos antineoplásicos | No se han descrito interacciones | |
| Anticoagulantes orales de acción directa | ||
|---|---|---|
| Apixabán | Abiraterona, aprepitant, crizotinib, doxorrubicina, enzalutamida, idelasilib, imatinib, sunitinib, sandetanib, vinblastina | Contraindicado/no recomendado |
| • Axitinib, ciclosporina, dexametasona, lapatinib, nilotinib, tacrolimus, tamoxifeno• Paclitaxel, pazopanib, prednisona, sirolimus, temsirolimus, vemurafenib• Anastrozol, bicalutamida, ciclofosfamida, dasatinib, docetaxel, etopósido, idarrubicina, ifosfamida, lomustina, vincristina, vinorelbina• Dasatinib, ibritumomab, nintedanib, obinutuzumab | Se requiere precaución en caso de polifarmacia o en presencia de 2 o más factores de riesgo hemorrágico | |
| • Alquilantes: bendamustina, busulfano, carmustina, cloranbucilo, complejos de platino, dacarbacina, lomustina, melfalán, procarbacina, temozolamida• Antimetabolitos: metotrexato• Antibióticos citotóxicos: bleomicina, daunorrubicina, mitomicina, mitoxantrona• Anticuerpos monoclonales: alemtuzumab, bevacizumab, brentuximab, cetuximab, ipilimumab, nivolumab, rituximab, trastuzumab• Camptotecinas: irinotecán, topotecán• Erlotinib, everolimus, flutamida, ibrutinib, letrozol, leuprolida, raloxifeno | No se prevé ninguna interacción farmacológica relevante | |
| Rivaroxabán | • Abiraterona, aprepitant, crizotinib, doxorrubicina, enzalutamida, idelasilib, imatinib, sunitinib, sandetanib, vinblastina | Contraindicado/no recomendado |
| • Paclitaxel, pazopanib, prednisona, sirolimus, temsirolimus, vermurafenib• Anastrozol, bicalutamida, ciclofosfamida, dasatinib, docetaxel, etopósido, idarubicina, ifosfamida, lomustina, vincristina, vinorelbina | Se requiere precaución en caso de polifarmacia o en presencia de 2 o más factores de riesgo hemorrágico | |
| • Crizotinib, imatinib, ribociclib | Evitar en insuficiencia renal avanzada | |
| • Dabrafenib, ivosidenib | Reducen la concentración plasmática de rivaroxabán | |
| • Alquilantes: bendamustina, busulfano, carmustina, clorambucilo, complejos de platino, dacarbacina, lomustina, melfalán, procarbacina, temozolamida• Antimetabolitos: metotrexato• Antibióticos citotóxicos: bleomicina, daunorrubicina, mitomicina, mitoxantrona• Anticuerpos monoclonales: alemtuzumab, bevacizumab, brentuximab, cetuximab, ipilimumab, nivolumab, rituximab, trastuzumab• Camptotecinas: irinotecán, topotecán• Erlotinib, everolimus, flutamida, ibrutinib, letrozol, leuprolida, ponatinib, raloxifeno | No se prevé ninguna interacción farmacológica relevante | |
| Edoxabán | • Abiraterona, aprepitant, crizotinib, doxorrubicina, enzalutamida, idelasilib, imatinib, sunitinib, sandetanib, vinblastina | Contraindicado/no recomendado |
| • Axitinib, crizotinib, lapatinib, neratinib, ponatinib, sunitinib, vandetanib | Con precaución | |
| • Alquilantes: bendamustina, busulfano, carmustina, clorambucilo, complejos de platino, dacarbacina, lomustina, melfalán, procarbazina, temozolamida• Antimetabolitos: metotrexato• Antibióticos citotóxicos: bleomicina, daunorrubicina, mitomicina, mitoxantrona• Anticuerpos monoclonales: alemtuzumab, bevacizumab, brentuximab, cetuximab, ipilimumab, nivolumab, rituximab, trastuzumab• Camptotecinas: irinotecán, topotecán• Erlotinib, everolimus, flutamida, ibrutinib, letrozol, leuprolida, raloxifeno• Alcaloides de la vinca: vincristina, vinorelbina• Alquilantes: ciclofosfamida, ifosfamida, lomustina, melfalán• Inhibidores de mTOR: sirolimus, temsirolimus• Taxanos: docetaxel, paclitaxel• Anastrozol, bicalutamida, dasatinib, etopósido, idarrubicina, pazopanib, prednisona, vemurafenib | No se prevé ninguna interacción farmacológica relevante | |
| Dabigatrán | • Abiraterona, crizotinib, ciclosporina, doxorrubicina, enzalutamida, ibrutinib, imatinib, lapatinib, lenvatinib, sunitinib, tacrolimus, vandetanib, vemurafenib, vimblastina | Contraindicado/no recomendado |
| • Axitinib, dexametasona, lapatinib, nilotinib, ponatinib, tamoxifeno, crizotinib | Se requiere precaución en caso de polifarmacia o en presencia de 2 o más factores de riesgo hemorrágico | |
| • Alcaloides de la vinca: vincristina, vinorelbina• Alquilantes: bendamustina, busulfano, carmustina, ciclofosfamida, clorambucilo, complejos de platino, dacarbacina, ifosfamida, lomustina, melfalán, procarbacina, temozolamida• Análogos de adenosina, pirimidinas y purinas• Antagonistas de receptores androgénicos: bicalutamida, flutamida• Antibióticos citotóxicos: bleomicina, daunorrubicina, idarrubicina, mitomicina, mitoxantrona• Anticuerpos monoclonales: alemtuzumab, bevacizumab, brentuximab, cetuximab, ipilimumab, nivolumab, rituximab, trastuzumab• Antimetabolitos: metotrexato• Campotectinas: irinotecán, topotecán• Inhibidores de aromatasa: anastrozol, letrozol• Inhibidores de mTOR: everolimus, sirolimus, temsirolimus• Taxanos: docetaxel, paclitaxel• Dasatinib, erlotinib, etopósido, leuprolida, pazopanib, prednisona, raloxifeno, vemurafenib | No se prevé ninguna interacción farmacológica relevante | |
VEGF: factor de crecimiento endotelial vascular; VEGFR: receptor del VEGF.
En las guías de práctica clínica, el cierre percutáneo de la orejuela izquierda se plantea como una alternativa eficaz y segura al tratamiento anticoagulante en pacientes con alto riesgo embólico y contraindicación para anticoagulación prolongada8,54. Puesto que los pacientes con cáncer tienen mayor riesgo hemorrágico, el cierre percutáneo de la orejuela izquierda podría considerarse para los pacientes con FANV, contraindicación para anticoagulación y pronóstico vital superior a 1 año, tras la valoración del equipo de COH55. Antes de la intervención es necesario considerar qué tratamiento antiagregante o anticoagulante se va a indicar en los primeros meses tras el procedimiento8.
ESTRATEGIAS DE PREVENCIÓN DE LA FIBRILACIÓN AURICULARUno de los objetivos más importantes de los equipos de COH es estratificar el riesgo basal de complicaciones CV relacionadas con los TOH e implementar estrategias de prevención. En el caso de los pacientes con riesgo de FA, dichas estrategias se centran en la prevención de posibles precipitantes CV y no CV para minimizar los efectos proarrítmicos del TOH1,3,6,8.
Estrategias de prevención de la fibrilación auricular en pacientes con alto riesgo cardiovascularAl igual que en pacientes sin cáncer, las medidas generales de salud CV son la principal estrategia de prevención8,24,56. Entre ellas destacan la abstención de tabaco y alcohol, la práctica diaria de ejercicio físico moderado y el control del peso57. Una pérdida de peso ≥ 10% y persistente en obesos aumenta 6 veces la probabilidad de supervivencia libre de arritmia; sin embargo, las fluctuaciones de peso> 5% duplican el riesgo de recurrencia de FA58. Del mismo modo, un control óptimo de las cifras de presión arterial59, en ocasiones descontrolada por el TOH, y la utilización de presión positiva continua en las vías respiratorias (continuous positive airway pressure [CPAP]) en pacientes con apnea del sueño ayudan a reducir la posibilidad de recidivas de FA8. El control del riesgo CV desde una perspectiva multidisciplinaria es clave en estos pacientes para mejorar la adherencia terapéutica y reducir las complicaciones tromboembólicas60.
Estrategias de prevención de la fibrilación auricular en pacientes con cardiopatía estructuralEl cáncer, la insuficiencia cardiaca y la cardiopatía isquémica son entidades íntimamente relacionadas entre sí y con la aparición de FA1,3,8,61,62. El paciente con FA tiene mayor riesgo de insuficiencia cardiaca y cardiopatía isquémica y ambas entidades aumentan el riesgo de FA63,64. En el caso concreto de los pacientes con cáncer activo, esta relación está potenciada por la toxicidad de los TOH y las comorbilidades asociadas con el proceso del cáncer1. En cuanto a las recomendaciones de prevención y tratamiento, se asumen las generales para pacientes no oncológicos, con algunas peculiaridades que se resumen en la tabla 6 y en el epígrafe de situaciones especiales8.
Recomendaciones para el tratamiento de la fibrilación auricular de pacientes con cáncer y cardiopatía
| 1. Tratar desencadenantes (fiebre, dolor, infección, hipoxemia, etc.) y hacer un primer intento de CF antes de plantear una estrategia de CR, ya que en ocasiones la reversión a sinusal es espontánea y se disminuye la posibilidad de recidiva precoz |
| 2. Antes de plantear una estrategia de CR frente a CF, se debe revisar las potenciales interacciones de los fármacos antiarrítmicos con el tratamiento antitumoral ( y tabla 5) |
| 3. Una evaluación ecocardiográfica precoz de los pacientes con cáncer, FA e IC puede ayudar a identificar eventuales desencadenantes: tromboembolia pulmonar, derrame pericárdico y taponamiento, valvulopatías, invasión tumoral, endocarditis, etc. |
| 4. En caso de que se documente disfunción ventricular en el contexto de FA rápida, es preciso repetir la ecocardiografía, con frecuencia cardiaca controlada, para evitar el sobrediagnóstico de disfunción ventricular por cardiotóxicos |
| 5. La aparición de IC es un importante factor de riesgo embólico y se debe plantear siempre la anticoagulación, independientemente de otros factores de la escala CHA2DS2-VASC, incluida la edad |
| 6. En el caso concreto de los inhibidores del sistema de control inmunitario (check-point inhibitors), la aparición de FA e IC puede ser la primera manifestación de una miocarditis inmunomediada, por lo que estos pacientes precisan una valoración por Cardio-Oncología preferente |
| 7. Revisar la indicación de antiagregantes para los pacientes que precisen inicio de anticoagulación |
CF: control de la frecuencia cardiaca; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años (doble), diabetes mellitus, ictus (doble), enfermedad vascular, edad 65-74 años y sexo (mujer); CR: control del ritmo; FA: fibrilación auricular; IC: insuficiencia cardiaca.
La FA posoperatoria es una complicación frecuente y reconocida de la cirugía oncológica, con una incidencia general del 20%6. Es más frecuente en el contexto de la cirugía torácica y en pacientes obesos, mayores de 65 años o con ECV o broncopatía previas. Su abordaje clínico es complejo por el mayor riesgo hemorrágico asociado con la intervención. El tratamiento profiláctico con metoprolol o losartán reduce su incidencia tras cirugía oncológica torácica en pacientes con NT-proBNP elevado17.
Ecocardiografía en la valoración del riesgo de fibrilación auricularLa valoración ecocardiográfica de pacientes en TOH activo permite mejorar la estratificación del riesgo de FA (mayor para los pacientes con dilatación de la aurícula izquierda> 34ml/m2, disfunción sistólica del ventrículo izquierdo, hipertensión pulmonar significativa, valvulopatías de grado moderado-grave y derrame pericárdico) y aporta información relevante sobre la probabilidad de mantener el ritmo sinusal en función de la presencia de cardiopatía65.
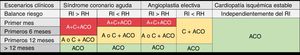
SITUACIONES ESPECIALES EN EL PACIENTE CON CÁNCER Y FIBRILACIÓN AURICULARPacientes con tratamiento antiagreganteLa cardiopatía isquémica es una de las principales indicaciones de tratamiento antiagregante, y es frecuente que coexista con la FANV. El uso combinado de anticoagulantes y antiagregantes en pacientes con cáncer y cardiopatía isquémica aumenta el riesgo de hemorragia, especialmente en sujetos con tumores digestivos, genitourinarios o del sistema nervioso central, por lo que es necesario minimizar la duración de las terapias combinadas (figura 2)66,67. Tras un síndrome coronario agudo, se considera el uso de un tratamiento triple un mínimo de 1 mes, que puede prolongarse hasta 3-6 meses para los pacientes con alto riesgo isquémico y bajo riesgo hemorrágico. En general, en tratamientos combinados, se favorece el uso del clopidogrel frente a otros inhibidores del P2Y12 con mayor riesgo hemorrágico. El uso de AVK requiere un control especialmente estricto de la INR (2-2,5), difícil de mantener durante el TOH, por lo que los ACOD suponen una buena alternativa. Los estudios PIONEER AF-PCI68, REDUAL PCI69 y AUGUSTUS70 respaldan el uso de rivaroxabán, dabigatrán y apixabán respectivamente como alternativas seguras en combinación con clopidogrel tras la angioplastia coronaria. Un año después de un síndrome coronario agudo o angioplastia electiva se puede mantener solo la anticoagulación oral. En todos los casos es fundamental individualizar la duración del tratamiento según el riesgo isquémico y hemorrágico de cada paciente (figura 2).
Tratamiento antiagregante para pacientes con cáncer activo y fibrilación auricular que precisan anticoagulación. RI alto: antecedentes de trombosis del stent, enfermedad multivaso o múltiples stents, diabetes mellitus, síndrome coronario agudo, angioplastia en lesiones bifurcadas u oclusiones crónicas; RH aumentado en pacientes con cáncer: HAS-BLED> 3, afección del SNC, GU o GI, enfermedad diseminada, hemorragias previas, trombocitopenia <50.000/μl, anemia significativa o necesidad de transfusión o tratamiento onco-hematológico concomitante que aumente el riesgo de hemorragia. AAS: ácido acetilsalicílico; ACO: anticoagulantes orales; C: clopidogrel; GI: gastrointestinal; GU: genitourinario; RH: riesgo hemorrágico; RI: riesgo isquémico; SNC: sistema nervioso central.
La trombocitopenia, definida como un recuento de plaquetas<100×109/l, es frecuente en pacientes con cáncer. Su causa principal es el TOH, aunque hay otros factores asociados que la favorecen, como la infiltración de la médula ósea por el tumor, el hiperesplenismo y la destrucción plaquetaria de etiología inmunitaria o no inmunitaria. El tratamiento anticoagulante de los pacientes con cáncer activo, FA y trombocitopenia es complejo, considerando que el riesgo trombótico no disminuye a pesar de un alto riesgo hemorrágico71. El empleo de AVK es problemático debido a su respuesta terapéutica impredecible y porque los estudios fundamentales de los ACOD excluyeron a los pacientes con recuentos plaquetarios <100×109/l (estudios RELY, ARISTOTLE y ENGAGE AF-TIMI 38) o 90×109/l (ROCKET AF)8,35.
Para los pacientes con CHA2DS2-VASc ≥ 2 y recuentos plaquetarios> 50×109/l, no existe una contraindicación absoluta para el uso de anticoagulantes. Los AVK constituyen una opción en la FA valvular si se mantiene una INR estable y no hay interacciones relevantes. El uso de HBPM puede considerarse como una alternativa por periodos cortos. Los ACOD pueden ser una opción en FANV en ausencia de interacciones con el TOH. Para los individuos con alto riesgo trombótico (prótesis valvulares mecánicas, estenosis mitral reumática, antecedentes de embolia sistémica y CHA2SD2-VASc ≥ 3) y recuento plaquetario de 25-50×109/l, se pueden plantear HBPM a dosis reducidas. Con cifras de plaquetas <25×109/l, el abordaje debe ser individualizado y consensuado por el equipo de COH (figura 3).
Anticoagulación de pacientes con cáncer, fibrilación auricular y trombocitopenia. ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitamina K; FAV: fibrilación auricular valvular; HBPM: heparina de bajo peso molecular; INR: razón internacional normalizada. aHAS-BLED> 3, decisión individualizada; para los pacientes con trombocitopenia leve y alto riesgo hemorrágico, se valora la indicación de cierre de la orejuela con el equipo de Cardio-Onco-Hematología. bSi se prevé una trombocitopenia transitoria. Revise las interacciones. cLos ACOD son una alternativa a la HBPM si no hay contraindicación y se prefiere la vía oral. Revise las interacciones. Utilice con precaución en pacientes con neoplasias gastrointestinales o genitourinarias y portadores de nefrostomía. No hay evidencia en pacientes con filtrado glomerular <15ml/min. Están contraindicados en la FAV. dAVK en caso de pacientes con FAV y controles estables de INR. Revise las interacciones.
La existencia de enfermedad renal crónica aumenta tanto el riesgo isquémico como el hemorrágico. Con filtrado glomerular> 30ml/min, con los ACOD se ha demostrado más eficacia y seguridad que con los AVK. Sin embargo, con filtrado glomerular <15ml/min o tratamiento renal sustitutivo, no existen ensayos clínicos que evalúen la eficacia y la seguridad de los diferentes anticoagulantes35,52. El ACOD con menor eliminación renal es el apixabán. En comparación con los AVK, a peor filtrado glomerular el apixabán reduce más los eventos hemorrágicos manteniendo el beneficio en cuanto a eventos trombóticos35. Por el contrario, el dabigatrán es el ACOD con mayor eliminación renal y el efecto en la reducción de eventos hemorrágicos se pierde con filtrado glomerular <50ml/min. El uso de ACOD en pacientes con FA, cáncer activo e insuficiencia renal debe ser individualizado, prestando especial atención a cambios en la situación clínica del paciente (deshidratación, infecciones intercurrentes, sepsis, hipotensión, nefrotoxicidad del TOH, etc.)3.
Pacientes con fibrilación auricular valvularActualmente el uso de ACOD está contraindicado para estos pacientes y la recomendación habitual es mantener los AVK con control estricto de la INR8. Las HBPM pueden utilizarse temporalmente, en presencia de interacciones graves o en caso de intolerancia oral durante el TOH. En estos casos se recomienda ajustar la dosis según peso y función renal y monitorizar la concentración de antagonistas del Xa (óptimo entre 0,5-1U/ml) siempre que estén disponible72.
Pacientes frágilesCon el progresivo envejecimiento de la población, el concepto de fragilidad ha ido ganando relevancia, dado su impacto pronóstico en las distintas situaciones clínicas de la ECV73. La escala mejor validada en la práctica es la Comprehensive Geriatric Assessment (valoración geriátrica integral), que incluye una valoración multidisciplinaria clínica, funcional, cognitiva, social y nutricional. La presencia de fragilidad empeora el pronóstico de la cirugía oncológica, la quimioterapia y la radioterapia74. La presencia de FA complica aún más el tratamiento de los pacientes, ya que conlleva mayor riesgo de eventos trombóticos o hemorrágicos e insuficiencia cardiaca. Todo ello se debe no solo al propio tumor o al tratamiento anticoagulante, sino a los cambios metabólicos en pacientes pluripatológicos, las interacciones medicamentosas, el aumento de las caídas por debilidad o la peor adherencia terapéutica en caso de deterioro cognitivo o escaso apoyo social3,34,73. El abordaje de la fragilidad ha de ser multidisciplinario. Los programas de rehabilitación física, ajuste de la polifarmacia, intervención nutricional y apoyo psicológico y social tienen potencial utilidad para estos pacientes73.
CONCLUSIONES Y RECOMENDACIONES FINALES- •
La identificación y el tratamiento de los factores de riesgo CV y las comorbilidades relacionadas con la FA son esenciales para reducir su incidencia en pacientes onco-hematológicos.
- •
La presencia de FA, los antecedentes de FA o la posibilidad de presentarla no contraindican el uso de ningún TOH, aunque sí implican la necesidad de un abordaje multidisciplinario por COH.
- •
Para los pacientes con FA preexistente, se recomienda una consulta de COH para optimizar el tratamiento de la FA antes y durante el TOH.
- •
El diagnóstico de una nueva FA debe ser motivo de una consulta prioritaria con COH para decidir la mejor estrategia de tratamiento y evitar interrupciones innecesarias del TOH.
- •
Durante el tratamiento activo se opta, para la mayoría de los pacientes, por una estrategia de CF, dado que el CR tiene poco éxito en este periodo.
- •
Con la actual ausencia de escalas específicas para la valoración del riesgo tromboembólico de la FA en pacientes con cáncer activo, el tratamiento antitrombótico debe guiarse por la puntuación CHA2DS2-VASc. Es necesario individualizar el tratamiento teniendo en cuenta el riesgo hemorrágico.
- •
En general, el uso de AVK es problemático durante el TOH activo debido a la dificultad de asegurar valores estables de INR y el riesgo de interacciones medicamentosas.
- •
Para los pacientes portadores de prótesis mecánicas cardiacas o con estenosis mitral reumática moderada-grave, la decisión de mantener AVK o cambiar a HBPM debe ser individualizada.
- •
Aunque no hay datos directos sobre pacientes con FANV, los ACOD representan una opción segura y eficaz y son, a nuestro entender, la opción preferente en este contexto.
- •
La selección del ACOD debe individualizarse según el potencial de interacciones farmacológicas y la presencia de comorbilidades.
- •
Debe promoverse el desarrollo de escalas de riesgo específicas para estimar de manera precisa los riesgos tromboembólico y hemorrágico de los pacientes con FA y cáncer activo.
- •
Son necesarios estudios aleatorizados que confirmen la eficacia y la seguridad de los ACOD en pacientes con FA y cáncer activo.
No se declara ninguno.