Se ha considerado al tejido adiposo como de almacenamiento energético y como un órgano endocrino; sin embargo, en las últimas décadas se lo ha considerado como una fuente abundante de células mesenquimales. Las células madre derivadas del tejido adiposo son de fácil obtención, presentan una gran capacidad de expansión ex vivo y gran plasticidad a otros tipos celulares, liberan gran variedad de factores angiogénicos y presentan propiedades inmunomoduladoras. Por ello, actualmente constituyen un foco de gran interés en la medicina regenerativa. En el contexto de enfermedad cardiaca coronaria, múltiples estudios experimentales han avalado la seguridad y la eficacia del uso de las células madre derivadas del tejido adiposo en el contexto de infarto de miocardio. Todo ello ha promovido, quizá precozmente, su uso clínico. De hecho, se ha demostrado que la presencia de factores de riesgo cardiovascular como hipertensión, enfermedad coronaria, diabetes mellitus u obesidad, altera y merma la funcionalidad de las células madre derivadas del tejido adiposo, lo que deja en entredicho la eficacia basada en el implante de células madre derivadas del tejido adiposo autólogas. En el siguiente artículo se describe el tejido adiposo blanco, se caracterizan las células madre que lo componen y se discute sobre su uso según los estudios preclínicos y clínicos realizados hasta el momento.
Palabras clave
El tejido adiposo es uno de los más abundantes del ser humano. Constituye entre el 15 y el 20% del peso corporal de los varones y un 20–25% del de las mujeres, y se encuentra ampliamente distribuido por distintas zonas del organismo. Es un tejido de origen mesenquimal especializado, constituido por el conjunto de tejido adiposo blanco (TAB) y tejido adiposo pardo o marrón, ambos con función, morfología y distribución diferentes. En ambos tejidos la célula principal es el adipocito, entre uno y dos tercios del total, y el resto del tejido está compuesto por diferentes tipos celulares que constituyen la fracción vascular estromal (FVE).
Tejido adiposo blancoEl TAB está distribuido por todo el organismo. Sus mayores depósitos se encuentran en la zona visceral o intraabdominal, como mecanismo de protección de posibles traumatismos, y a nivel subcutáneo, como sistema de almacenamiento de energía. Ambos tejidos presentan diferencias en el perfil de expresión de adipocinas1, las funciones metabólicas2, la densidad vascular y la inervación. De hecho, el tejido adiposo visceral presenta un mayor potencial angiogénico que el subcutáneo y un perfil inflamatorio más acentuado3. La acumulación del tejido adiposo subcutáneo representa la respuesta fisiológica a situaciones con exceso de ingesta y poco gasto energético (inactividad física), actuando como «sumidero de energía». Los individuos que presentan obesidad periférica (distribución subcutánea) no presentan las complicaciones médicas características de la obesidad. Contrariamente, el aumento del tejido adiposo visceral (obesidad central) se asocia con un estado de hiperglucemia, hiperinsulinemia, hipertrigliceridemia, hipercolesterolemia, disminución de lipoproteínas de alta densidad circulantes, disminución de la tolerancia a la glucosa, aumento de lipoproteínas ricas en apolipoproteína B y esteatosis hepática. Todas estas situaciones son características del síndrome de resistencia a la insulina, con el consiguiente riesgo de presentar diabetes mellitus tipo 24. Por ello, actualmente el tamaño de la cintura es un elemento importante en el diagnóstico del síndrome metabólico y se ha identificado como un factor de riesgo independiente de otras enfermedades, como las cardiovasculares, los accidentes cerebrovasculares, la hipertensión y la enfermedad del hígado graso no alcohólico5–7.
La función principal del TAB es regular la homeostasis energética del organismo controlada por los sistemas nervioso y endocrino. De este modo, en periodos de exceso calórico, el tejido adiposo almacena ácidos grasos en forma de triglicéridos, y en momentos de demanda energética, los libera a la circulación para que los usen como fuente energética otros tejidos, como hígado, riñones, músculo esquelético y miocardio8. Sin embargo, actualmente el TAB es reconocido como un órgano multifuncional ya que, además de su función energética, actúa como órgano endocrino y como reservorio de células madre mesenquimales (CMM).
Composición del tejido adiposo blancoEl tejido adiposo blanco está constituido por adipocitos maduros y el tejido intercelular o FVE. Los adipocitos son las células más abundantes del tejido adiposo y están formados por una gran vacuola citoplásmica única, la cual almacena principalmente triglicéridos y ésteres de colesterol. En función del estado nutricional, los adipocitos pueden modificar su tamaño entre 25 y 200μm. Los adipocitos contienen la maquinaria necesaria para el metabolismo de los lípidos (figura 1)9. Un aumento de peso puede derivar en la alteración de estas vías y desencadenar el síndrome de resistencia a la insulina. De hecho, los ácidos grasos no solo presentan una función energética, sino que también actúan como señales reguladoras de la expresión génica de proteínas implicadas en el metabolismo lipídico10, favorecen un estado protrombótico y se asocian con procesos inflamatorios11. Por ello el exceso de ácidos grasos circulantes (lipotoxicidad) es uno de los mayores vínculos entre la obesidad y el desarrollo de síndrome metabólico y/o enfermedad cardiovascular. En situaciones en que se da mayor consumo de calorías respecto a su gasto, se produce un estado metabólico en el que se promueve la hipertrofia (aumento del tamaño) y la hiperplasia (incremento del número) de los adipocitos12. Esto último implica la movilización de las células madre hacia el linaje adipocítico (adipogénesis). Los adipocitos nuevos o de pequeño tamaño son más sensibles a la insulina y presentan gran capacidad de captar ácidos grasos libres y triglicéridos presentes en el periodo posprandial4. A medida que los adipocitos aumentan de tamaño (hipertrofia), se vuelven disfuncionales, pierden su capacidad protectora contra la lipotoxicidad sistémica y la grasa empieza a acumularse ectópicamente. Estos adipocitos distendidos se hacen resistentes a la insulina, hiperlipolíticos y resistentes a las señales antilipolíticas de la insulina. Otra función muy importante llevada a cabo por los adipocitos es la de célula endocrina, que se detalla más adelante.
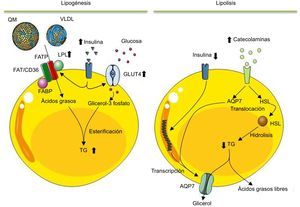
Esquema que ilustra los procesos de lipogénesis y lipolisis que se llevan a cabo en los adipocitos maduros. Después de una comida y un aumento de insulina en sangre, esta activa la lipogénesis en los adipocitos. En este proceso el adipocito, por medio de la lipoproteinlipasa, degrada los triglicéridos de los quilomicrones y de las lipoproteínas de muy baja densidad a ácidos grasos. Estos entran en el adipocito para ser esterificados con el glicerol-3 fosfato y sintetizar así los triglicéridos que se almacenarán en la vacuola lipídica. En el adipocito, la insulina no solo estimula la síntesis de lipoproteinlipasa, sino que también estimula la captación y el metabolismo de la glucosa a glicerol-3 fosfato. Contrariamente, durante la lipolisis los triglicéridos almacenados son movilizados para producir ácidos grasos libres y glicerol para cubrir las necesidades energéticas del organismo. Mediante hormonas catabólicas, secretadas en respuesta a baja concentración sanguínea de glucosa, se activa la síntesis y la movilización de la lipasa sensible a hormonas del citosol a la superficie de la vacuola lipídica, donde podrá hidrolizar los triglicéridos. Los ácidos grasos producidos son secretados como ácidos grasos libres a la circulación, donde serán transportados por la albúmina hasta los órganos de destino, donde serán oxidados para producir energía. Igualmente, el glicerol derivado de la lipolisis también es liberado a la circulación para ser utilizado por el hígado como fuente de carbono. AQP7: acuaporina-7; FABP: proteína de unión a los ácidos grasos; FAT/CD36: receptor translocador de ácidos grasos; FATP: proteína transportadora de ácidos grasos; GLUT4: proteína transportadora de glucosa 4; HSL: lipasa sensible a hormonas; LPL: lipoproteinlipasa; QM: quilomicrones; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad.
El otro componente de TAB es la FVE. Aunque las células que la forman no están del todo definidas, se sabe que incluyen células vasculares, sanguíneas y precursoras de adipocitos13. Los pericitos, junto con las células endoteliales y las células musculares lisas, forman la vasculatura del tejido adiposo. La extensión de esta red capilar y sus características son determinantes para procesos como el crecimiento, la funcionalidad y el desarrollo del tejido adiposo14. De hecho, la secreción de factores proangiogénicos por los adipocitos y otras células de la FVE contribuye a que el tejido esté generosamente irrigado. Se ha observado que el tejido adiposo ejerce gran control en el metabolismo del organismo a través de las células del sistema inmunitario residentes en él. En individuos delgados, estas células están implicadas en la eliminación de los adipocitos necróticos, el remodelado de la matriz extracelular, la angiogénesis, la adipogénesis y el mantenimiento de la sensibilidad a la insulina. Sin embargo, en individuos obesos el número de células del sistema inmunitario aumenta, estas adquieren un fenotipo proinflamatorio y liberan gran número de citocinas encargadas de reclutar y activar otras células del sistema inmunitario e inducir el síndrome de resistencia a la insulina en el tejido adiposo15. Los macrófagos son de las células que tienen un papel más importante en la adquisición del estado proinflamatorio crónico de bajo grado que caracteriza la obesidad. Durante la expansión del tejido adiposo, se produce un mayor reclutamiento de macrófagos tipo M1 (fenotipo proinflamatorio) que secretan la mayoría de las citocinas proinflamatorias que se hallan en el tejido adiposo obeso16, mientras que los macrófagos residentes de tipo M2 manifiestan un fenotipo antiinflamatorio17. Por último, en la FVE hay células madre derivadas del tejido adiposo (CMTA) y preadipocitos. Estas poblaciones celulares son las encargadas de mantener la renovación de la población de adipocitos en condiciones fisiológicas y desempeñan un papel importante en la expansión del tejido adiposo que se da en la obesidad. Las diferencias entre estos dos grupos celulares no están muy definidas. Tanto las CMTA como los preadipocitos presentan una morfología muy similar. Sin embargo, mientras que las CMTA pueden diferenciarse a otros linajes y presentar gran capacidad de autorrenovación, los preadipocitos han perdido estas capacidades de diferenciación y solo pueden dar lugar a adipocitos maduros18.
Factores secretados por el tejido adiposo blancoEl TAB secreta multitud de péptidos bioactivos, conocidos bajo el término común de adipocitocinas o adipocinas19,20 (tabla 1). Sin embargo, muchos de estos factores no los secreta solo el adipocito, sino también las células que componen la FVE, como los macrófagos o las CMTA. A través de todos estos factores secretados, el tejido adiposo participa en la regulación autocrina y paracrina del propio tejido y tiene efectos en la función de otros órganos. Además, el tejido adiposo se encarga de regular la homeostasis energética y el peso corporal, la sensibilidad a la insulina y varias de las funciones de los sistemas inmunitario, vascular y reproductor20. Esta función endocrina del tejido adiposo explica la relación fisiopatológica existente entre el exceso de grasa corporal y los estados patológicos que se le asocian, ya que la obesidad y/o el síndrome metabólico provocan una desregulación de la cantidad secretada de estas moléculas21.
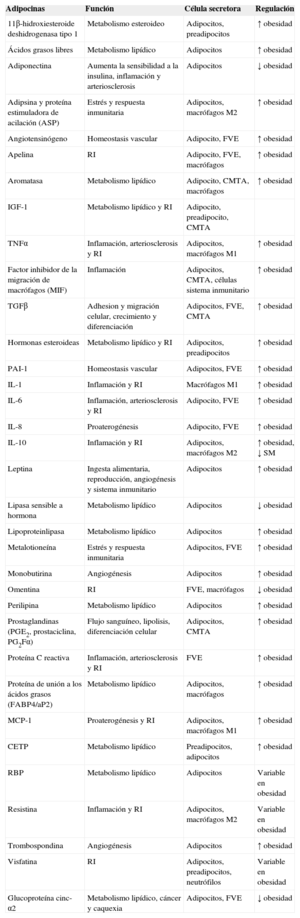
Factores secretados por el tejido adiposo
| Adipocinas | Función | Célula secretora | Regulación |
|---|---|---|---|
| 11β-hidroxiesteroide deshidrogenasa tipo 1 | Metabolismo esteroideo | Adipocitos, preadipocitos | ↑ obesidad |
| Ácidos grasos libres | Metabolismo lipídico | Adipocitos | ↑ obesidad |
| Adiponectina | Aumenta la sensibilidad a la insulina, inflamación y arteriosclerosis | Adipocitos | ↓ obesidad |
| Adipsina y proteína estimuladora de acilación (ASP) | Estrés y respuesta inmunitaria | Adipocitos, macrófagos M2 | ↑ obesidad |
| Angiotensinógeno | Homeostasis vascular | Adipocito, FVE | ↑ obesidad |
| Apelina | RI | Adipocito, FVE, macrófagos | ↑ obesidad |
| Aromatasa | Metabolismo lipídico | Adipocito, CMTA, macrófagos | ↑ obesidad |
| IGF-1 | Metabolismo lipídico y RI | Adipocito, preadipocito, CMTA | |
| TNFα | Inflamación, arteriosclerosis y RI | Adipocitos, macrófagos M1 | ↑ obesidad |
| Factor inhibidor de la migración de macrófagos (MIF) | Inflamación | Adipocitos, CMTA, células sistema inmunitario | ↑ obesidad |
| TGFβ | Adhesion y migración celular, crecimiento y diferenciación | Adipocitos, FVE, CMTA | ↑ obesidad |
| Hormonas esteroideas | Metabolismo lipídico y RI | Adipocitos, preadipocitos | ↑ obesidad |
| PAI-1 | Homeostasis vascular | Adipocitos, FVE | ↑ obesidad |
| IL-1 | Inflamación y RI | Macrófagos M1 | ↑ obesidad |
| IL-6 | Inflamación, arteriosclerosis y RI | Adipocito, FVE | ↑ obesidad |
| IL-8 | Proaterogénesis | Adipocito, FVE | ↑ obesidad |
| IL-10 | Inflamación y RI | Adipocitos, macrófagos M2 | ↑ obesidad, ↓ SM |
| Leptina | Ingesta alimentaria, reproducción, angiogénesis y sistema inmunitario | Adipocitos | ↑ obesidad |
| Lipasa sensible a hormona | Metabolismo lipídico | Adipocitos | ↓ obesidad |
| Lipoproteinlipasa | Metabolismo lipídico | Adipocitos | ↑ obesidad |
| Metalotioneína | Estrés y respuesta inmunitaria | Adipocitos, FVE | ↑ obesidad |
| Monobutirina | Angiogénesis | Adipocitos | ↑ obesidad |
| Omentina | RI | FVE, macrófagos | ↓ obesidad |
| Perilipina | Metabolismo lipídico | Adipocitos | ↑ obesidad |
| Prostaglandinas (PGE2, prostaciclina, PG2Fα) | Flujo sanguíneo, lipolisis, diferenciación celular | Adipocitos, CMTA | ↑ obesidad |
| Proteína C reactiva | Inflamación, arteriosclerosis y RI | FVE | ↑ obesidad |
| Proteína de unión a los ácidos grasos (FABP4/aP2) | Metabolismo lipídico | Adipocitos, macrófagos | ↑ obesidad |
| MCP-1 | Proaterogénesis y RI | Adipocitos, macrófagos M1 | ↑ obesidad |
| CETP | Metabolismo lipídico | Preadipocitos, adipocitos | ↑ obesidad |
| RBP | Metabolismo lipídico | Adipocitos | Variable en obesidad |
| Resistina | Inflamación y RI | Adipocitos, macrófagos M2 | Variable en obesidad |
| Trombospondina | Angiogénesis | Adipocitos | ↑ obesidad |
| Visfatina | RI | Adipocitos, preadipocitos, neutrófilos | Variable en obesidad |
| Glucoproteína cinc-α2 | Metabolismo lipídico, cáncer y caquexia | Adipocitos, FVE | ↓ obesidad |
CETP: proteína transportadora de ésteres de colesterol; CMTA: células madre derivadas del tejido adiposo; FVE: fracción vascular estromal; IGF-1: factor de crecimiento insulinoide tipo 1; IL: interleucina; MCP-1: proteína quimiotáctica de monocitos 1; PAI-1: inhibidor-1 del activador del plasminógeno; RBP: proteína de unión a retinol; RI: resistencia a la insulina; SM: síndrome metabólico; TGFβ: factor de crecimiento transformador beta; TNFα: factor de necrosis tumoral alfa.
Adaptado de Ronti et al20.
Durante muchos años se ha creído que el crecimiento hiperplásico del tejido adiposo se debía a la existencia de una población unipotente de células progenitoras, los preadipocitos. Sin embargo, en 2001 Zuk et al22 identificaron la existencia de CMM en el tejido adiposo con capacidad autorrenovadora y multipotencial. Desde entonces, el tejido adiposo ha sido considerado como una fuente de células CMM para su uso en la terapia celular22.
Origen de las células madre derivadas del tejido adiposoDesde que se definió que los adipocitos y sus progenitores derivaban de las CMM23, se ha señalado que las CMTA podrían proceder de células de linaje mesenquimal de la médula ósea. De hecho, las células de la FVE presentan varias similitudes con las de la médula ósea. Ambos estromas contienen una población heterogénea de CMM con capacidad de diferenciación a varios linajes (adipocítico, condrocítico y miogénico) en función de las condiciones de cultivo24. Mansilla et al25 indican que la médula ósea es el órgano central productor de CMM que abastece a las poblaciones de CMM que se encuentran en los demás órganos periféricos (reservorios periféricos). Es más, apuntan que las células se mantienen en estado quiescente e indiferenciado hasta que son «llamadas» a proliferar y movilizarse a los tejidos requeridos. De hecho, a pesar de que en individuos sanos prácticamente no hay CMM en la circulación, estas son movilizadas hacia zonas dañadas donde participan en la reparación y la regeneración del tejido26. Por ello se podría inferir que el tejido adiposo obeso, al ser una fuente importante de factores quimiotácticos, actuaría como nicho donde las CMM circulantes podrían anidar y diferenciarse a adipocitos25.
Características de las células madre derivadas del tejido adiposoLas CMTA presentan las características típicas de las CMM propuestas por el Mesenchymal and Tissue Stem Cell Committee of the International Society for Cellular Therapy27:
- •
Deben adherirse al material plástico mientras se mantengan en condiciones de cultivo estándar.
- •
Deben presentar la habilidad de diferenciarse a los linajes osteogénico, adipogénico y condrogénico (figura 2).
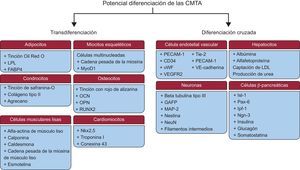
Figura 2.Potencial de diferenciación de las células madre derivadas del tejido adiposo. Las células madre derivadas del tejido adiposo tienen la capacidad de diferenciarse a otros tipos celulares de su mismo linaje mesodérmico (transdiferenciación) u otros tipos celulares de otro linaje (diferenciación cruzada). CMTA: células madre derivadas del tejido adiposo; FABP4: proteína 4 de unión a los ácidos grasos; GAFP: proteína gliofibrilar ácida; Ipf-1: factor promotor de insulina 1; Isl-1: gen potenciador de la insulina 1; LDL: lipoproteína de baja densidad; LPL: lipoproteinlipasa; MAP-2: proteína asociada a microtúbulos 2; MyoD1: proteína de diferenciación miogénica 1; NeuN: antígeno nuclear neuronal; Ngn-3: neurogenina 3; Nkx2,5: NK2 homeobox 5; OCN: osteocalcina; OPN: osteopontina; Pax-6: proteína de la caja emparejada 6; PECAM-1: molécula de citoadhesión endotelial plaquetaria 1; RUNX2: factor de transcripción 2 asociado a Runt; Tie-2: receptor de la angiopoyetina 2; VE: vascular endotelial; VEGFR2: factor de crecimiento endotelial vascular 2; vWF: factor de von Willebrand.
(0.4MB). - •
Deben expresar los marcadores de superficie CD105, CD73 y CD90 y no expresar CD45, CD34, CD14 o CD11b, CD79a o CD19 ni moléculas de superficie HLA-II.
Las CMTA no presentan un único marcador de superficie que permita identificarlas, sino que expresan los marcadores característicos de las CMM junto con algunos que se expresan en líneas no progenitoras (tabla 2).
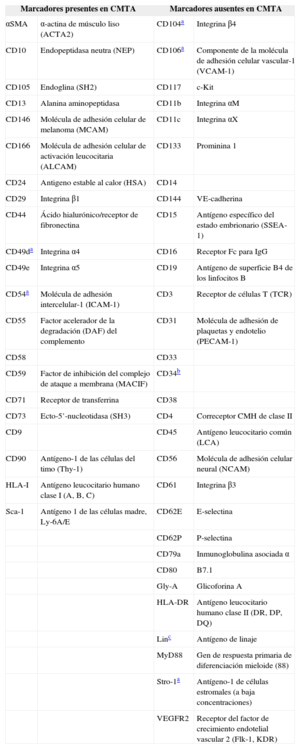
Marcadores de superficie característicos de las células madre derivadas del tejido adiposo
| Marcadores presentes en CMTA | Marcadores ausentes en CMTA | ||
|---|---|---|---|
| αSMA | α-actina de músculo liso (ACTA2) | CD104a | Integrina β4 |
| CD10 | Endopeptidasa neutra (NEP) | CD106a | Componente de la molécula de adhesión celular vascular-1 (VCAM-1) |
| CD105 | Endoglina (SH2) | CD117 | c-Kit |
| CD13 | Alanina aminopeptidasa | CD11b | Integrina αM |
| CD146 | Molécula de adhesión celular de melanoma (MCAM) | CD11c | Integrina αX |
| CD166 | Molécula de adhesión celular de activación leucocitaria (ALCAM) | CD133 | Prominina 1 |
| CD24 | Antigeno estable al calor (HSA) | CD14 | |
| CD29 | Integrina β1 | CD144 | VE-cadherina |
| CD44 | Ácido hialurónico/receptor de fibronectina | CD15 | Antígeno específico del estado embrionario (SSEA-1) |
| CD49da | Integrina α4 | CD16 | Receptor Fc para IgG |
| CD49e | Integrina α5 | CD19 | Antígeno de superficie B4 de los linfocitos B |
| CD54a | Molécula de adhesión intercelular-1 (ICAM-1) | CD3 | Receptor de células T (TCR) |
| CD55 | Factor acelerador de la degradación (DAF) del complemento | CD31 | Molécula de adhesión de plaquetas y endotelio (PECAM-1) |
| CD58 | CD33 | ||
| CD59 | Factor de inhibición del complejo de ataque a membrana (MACIF) | CD34b | |
| CD71 | Receptor de transferrina | CD38 | |
| CD73 | Ecto-5’-nucleotidasa (SH3) | CD4 | Correceptor CMH de clase II |
| CD9 | CD45 | Antígeno leucocitario común (LCA) | |
| CD90 | Antígeno-1 de las células del timo (Thy-1) | CD56 | Molécula de adhesión celular neural (NCAM) |
| HLA-I | Antígeno leucocitario humano clase I (A, B, C) | CD61 | Integrina β3 |
| Sca-1 | Antígeno 1 de las células madre, Ly-6A/E | CD62E | E-selectina |
| CD62P | P-selectina | ||
| CD79a | Inmunoglobulina asociada α | ||
| CD80 | B7.1 | ||
| Gly-A | Glicoforina A | ||
| HLA-DR | Antígeno leucocitario humano clase II (DR, DP, DQ) | ||
| Linc | Antígeno de linaje | ||
| MyD88 | Gen de respuesta primaria de diferenciación mieloide (88) | ||
| Stro-1a | Antígeno-1 de células estromales (a baja concentraciones) | ||
| VEGFR2 | Receptor del factor de crecimiento endotelial vascular 2 (Flk-1, KDR) | ||
CMM-MO: células madre mesenquimales derivadas de la médula ósea; CMTA: células madre derivadas del tejido adiposo.
Marcador que se expresa de manera opuesta entre células madre derivadas del tejido adiposo y células madre mesenquimales derivadas de la médula ósea.
Las CMTA, al ser células metabólicamente activas, tienen un papel muy importante en la revascularización de los tejidos dañados, la inhibición de la apoptosis y la inmunomodulación. Se ha descrito que las CMTA secretan gran cantidad de factores de la matriz extracelular y gran número de citocinas y factores de crecimiento, angiogénicos y antiapoptóticos28. De hecho, se cree que gran parte de los efectos beneficiosos que tiene la terapia celular con el uso de CMTA se debe a la gran secreción de factores que actúan de manera paracrina. Es importante recalcar que los factores angiogénicos y antiapoptóticos son secretados en cantidades bioactivas, y que esta secreción se ve incrementada en condiciones de hipoxia29.
Diferencias en las células madre derivadas del tejido adiposo según su origenSe ha propuesto que la diferencia metabólica que se observa entre el tejido adiposo subcutáneo y el visceral se debe a las características intrínsecas que presentan las células residentes en cada tejido, incluidas las CMTA. De hecho, se ha observado que adipocitos diferenciados in vitro a partir de CMTA derivadas de ambas fuentes presentan diferencias inherentes a ambos tejidos30, y que estas diferencias son estables y se mantienen incluso después de que las CMTA se hayan aislado y cultivado in vitro31. Varios estudios han descrito que las CMTA de diferentes tejidos adiposos presentan diferencias en su potencial de proliferación, diferenciación y apoptosis, así como en el patrón de expresión genética32–34. De hecho, se ha descrito que las CMTA del tejido adiposo subcutáneo presentan mayor capacidad de diferenciación adipogénica que las CMTA del tejido adiposo visceral32. Esta baja capacidad de diferenciación de las CMTA viscerales podría explicar en parte que la grasa se acumule en los adipocitos ya existentes y, como consecuencia, el tamaño de sus vacuolas lipídicas se incremente. En cambio, la mayor capacidad de diferenciación de las CMTA subcutáneas resultaría en acumulación lipídica en adipocitos nuevos y con vacuolas más pequeñas35. De hecho, el tamaño de las vacuolas lipídicas de los adipocitos viscerales se correlacionan con las concentraciones lipídicas circulantes, mientras que el grado de hiperplasia y el tamaño de los adipocitos subcutáneos están más relacionados con las concentraciones plasmáticas de glucosa e insulina y la sensibilidad a la insulina36. Sin embargo, aún se desconoce cómo y en qué momento del desarrollo las CMTA presentes en cada tejido adiposo adquieren su fenotipo característico. Podría ser que las características regionales de las diferentes CMTA fueran reguladas epigenéticamente, apareciendo durante etapas tempranas del desarrollo y estableciéndose posteriormente por el ambiente de cada tejido adiposo, y de cada individuo. El conocimiento de las diferencias de las CMTA de los diferentes tejidos adiposos sería de gran interés para una mejor comprensión de la biología del tejido y el desarrollo de sus diferentes depósitos.
Efecto de los factores de riesgo cardiovascular en las células madre derivadas del tejido adiposoDiversos estudios han demostrado que la presencia de hipercolesterolemia, diabetes mellitus tipos 1 y 2, hipertensión o tabaquismo afecta de forma negativa a las células madre/progenitoras endógenas. Recientemente, en este grupo se ha descrito que la diabetes mellitus tipo 2 afecta negativamente a las capacidades de pluripotencialidad y autorrenovación de las CMTA alterando las principales vías implicadas en el mantenimiento de las células madre y su potencial de diferenciación y angiogénico37.
La obesidad también se ha descrito como una enfermedad que afecta a las CMTA. Van Harmelen et al38 observaron que la capacidad de diferenciación adipogénica de las CMTA del tejido adiposo subcutáneo mamario disminuía en mujeres con un índice de masa corporal elevado. Posteriormente, Nair et al39 identificaron que las CMTA de tejido adiposo subcutáneo de los indios Pima obesos presentaban mayor expresión de genes proinflamatorios que las de los delgados. Recientemente, se ha descrito que los individuos con obesidad mórbida presentan unas CMTA que tienen afectadas sus capacidades de proliferación, diferenciación y angiogénesis, lo que afecta negativamente a la capacidad regenerativa de estas células40. También se ha demostrado que las CMTA de pacientes obesos presentan una disminución de los marcadores de multipotencialidad, se encuentran comprometidas en mayor grado hacia un linaje adipocítico y presentan un incremento en la expresión de genes proinflamatorios en comparación con las obtenidas de pacientes delgados41. Además, el efecto de la obesidad en las CMTA se observa tanto en las derivadas del tejido adiposo subcutáneo como en las del visceral42.
CÉLULAS MADRE DERIVADAS DEL TEJIDO ADIPOSO EN TERAPIA CELULARDurante muchos años se han utilizado las CMM derivadas de la medula ósea como fuente principal de células madre para la medicina regenerativa y como alternativa al uso de células madre embrionarias43. Sin embargo, las CMTA han aparecido como una importante fuente alternativa con grandes ventajas en comparación con las CMM derivadas de la médula ósea, debido a su fácil obtención y aislamiento y la gran cantidad obtenida44,45. Inicialmente se propuso que la capacidad reparadora/regenerativa de las CMTA se debía a su capacidad de diferenciarse a otras líneas celulares46. Sin embargo, estudios realizados en los últimos años han reforzado el papel primordial de los factores paracrinos liberados por las CMTA en su potencial reparador44,45.
Células madre derivadas del tejido adiposo en la enfermedad isquémica coronariaEstudios experimentalesEn los últimos años se han llevado a cabo gran número de estudios preclínicos y algunos clínicos que han analizado la seguridad, el comportamiento y la efectividad de las CMTA en el tratamiento de lesiones isquémicas, especialmente las de origen cardiaco47–51. El primer estudio se realizó en un modelo de rata de daño cardiaco por criolesión, en el que se inyectaron CMTA recién aisladas en la cavidad del ventrículo izquierdo, simulando una administración intracoronaria51. Ese estudio demostró, por vez primera, que las CMTA anidaban en el miocardio y expresaban marcadores específicos de célula cardiaca. Del mismo modo, análisis funcionales y patológicos revelaron en los animales tratados con CMTA una mejora significativa en la función cardiaca global y un aumento de la densidad capilar en el área fronteriza de la lesión en comparación con los respectivos controles51. Desde entonces, la capacidad de generar cardiomiocitos y células vasculares a partir de CMTA se ha convertido en un tema de gran interés experimental, como queda reflejado en la tabla 351–91 (estudios llevados a cabo en roedores y conejos) y la tabla 492–101 (estudios llevados a cabo en modelos porcinos). Cabe destacar que hay controversia en torno a la eficacia de las CMTA. Mientras que algunos estudios han encontrado CMTA anidadas y que expresan marcadores cardiacos específicos (troponina I y cadena ligera de la miosina)51,102–105, factor de von Willebrand y/o actina del músculo liso, otros estudios observan ausencia de esta capacidad de diferenciación en las CMTA (tablas 3 y 4)52,92. Estas diferencias observadas en el potencial de diferenciación in vivo de las CMTA podrían deberse a las diferentes fuentes de CMTA, los diferentes procesos de obtención o de medios de cultivo utilizados y a los modelos animales utilizados, las vías de administración o los límites del análisis histológico. Diversos grupos han descrito el mismo resultado de baja capacidad de diferenciación de las CMTA en estudios in vivo52,53,92. Todas estas observaciones han cuestionado que los beneficios derivados de la administración de CMTA estén relacionados directamente con los procesos de diferenciación o si, en cambio, están condicionados por la secreción de factores paracrinos por las CMTA106–108.
Estudios experimentales con modelos animales de roedores y conejos
| Autores | Fuente de células | Modelo animal | Lesión | Resultado |
|---|---|---|---|---|
| Strem et al51 | CMTA de tejido adiposo subcutáneo de ratón | Ratón | IAM por criolesión | Las CMTA implantadas expresan marcadores específicos de cardiomiocito |
| Miyahara et al55 | Láminas de CMTA de tejido adiposo subcutáneo de rata | Rata | IAM por ligadura de la DA | Mejora de la lesión y la función cardiacas |
| Zhang et al56 | CMTA de conejo | Conejo blanco de Nueva Zelanda | IAM por ligadura de la DA | Mejora de la función cardiaca |
| Mazo et al57 | CMTA de tejido adiposo subcutáneo, CMG-TA, CMN-MO de ratones-GFP | Rata SD | IAM por ligadura de la DA | Las CMTA mejoran la función cardiaca y la viabilidad tisular, aumentan la angionénesis y disminuyen la fibrosis |
| Cai et al52 | CMTA de tejido adiposo subcutáneo humano | Rata | IAM por ligadura de la DA | Las CMTA mejoran la función cardiaca y la viabilidad tisular, aumentan la angionénesis y disminuyen la fibrosis |
| Léobon et al58 | CMG-TA de tejido adiposo subcutáneo | Ratón | IAM seguido de inyección de AD-CMG | Tras 4 semanas, el grupo tratado con CMG-TA presenta una reducción del remodelado y la estabilidad del FEVI y un aumento de la angiogénesis en las zonas periinfarto |
| Schenke-Layland et al59 | CMTA de tejido adiposo subcutáneo de rata | Rata | IAM por oclusión de DA y reperfusión | Mejora de la función cardiaca a pesar de la baja implantación celular |
| Van der Bogt et al60 | CMTA de tejido adiposo subcutáneo y CMM-MO de ratón | Ratón transgénico FVB | IAM | Ninguna mejora detectada. Aumento de la apoptosis |
| Wang et al61 | CMTA de tejido adiposo subcutáneo de rata | Rata | IAM por oclusión de DA | Tras 1 mes, mejor FEVI, engrosamiento de la pared cardiaca, aumento de la densidad capilar. Solo el 0,5% de las CMTA implantadas fueron positivas para los marcadores específicos de célula cardiaca |
| Zhu et al62 | CMTA de tejido adiposo subcutáneo humano que sobrexpresan HGF | Rata SD | IAM | Las CMTA mejoran la función cardiaca y disminuyen la fibrosis |
| Bai et al53 | CMTA de tejido adiposo subcutáneo humano | Ratón SCID | IAM | Mejora de la función cardiaca, diferenciación cardiomiogénica y aumento de angiogénesis |
| Bayes-Genis et al63 | CMTA de tejido adiposo cardiaco humano | Rata y ratón | IAM | Mejora de la función cardiaca, diferenciación cardiomiogénica y aumento de vasculogénesis |
| Danoviz et al64 | CMTA de tejido adiposo subcutáneo de rata. Inyectadas con fibrina α, colágeno o medio de cultivo | Rata | IAM | Inhibición del proceso negativo de remodelado cardiaco |
| Hwangbo et al65 | CMTA humanas | Rata SD | IAM por ligadura permanente de DA | Tras 4 semanas, mejora de la función cardiaca, diferenciación cardiomiogénica y aumento de la densidad capilar |
| Lin et al66 | CMTA de tejido adiposo epididimal de rata tratada con sildenafilo | Rata Lewis | Cardiomiopatía dilatada | Menor apoptosis y fibrosis, mejora de la función cardiaca y aumento de angiogénesis |
| Okura et al67 | CMTA de tejido adiposo omental humanas diferenciadas a cardiomiocitos | Rata Nude | IAM | Mejora de la función cardiaca y aumento de la diferenciación cardiomiogénica |
| Zhang et al68 | CMTA de tejido adiposo subcutáneo de ratas coinyectadas con fibrina | Rata | IAM | CMTA + fibrina mejoran la implantación celular, la lesión tisular, la función cardiaca y la densidad vascular |
| Bai et al69 | CMTA de tejido adiposo subcutáneo humano | Ratón Nude | IAM por ligadura permanente de DA | Implantación de CMTA; el 3,5% de las células se diferenciacion a cardiomiocitos o células endoteliales |
| Berardi et al70 | CMTA humanas tratadas con SNAP | Rata | IAM | CMTA tratadas con SNAP mejoran la función cardiaca y aumenta la expresión de troponina T y factor de von Willebrand |
| Cai et al71 | CMTA de tejido adiposo subcutáneo de rata cocultivadas con cardiomiocitos | Rata | IAM | Pretratamiento de las CMTA mejora su implantación y su actividad reparadora de la función cardiaca |
| Gaebel et al72 | CMTA, CMM-MO, CMM humanas de sangre del cordón umbilical | Ratón SCID | Ligadura de DA | Las CMM humanas derivadas de diferentes tejidos presentan diferencias en su capacidad reparadora de la función cardiaca. Las células CD105+ presentan mejor supervivencia en corazones infartados |
| Hamdi et al73 | CMTA de tejido adiposo subcutáneo de rata en forma de láminas | Rata | Ligadura coronaria | Las ratas tratadas con láminas de CMTA sobreviven mejor que las que recibieron inyección de células. Disminución del remodelado del ventrículo izquierdo, mejora del volumen diastólico final y mejora de la implantación celular |
| Ii et al54 | CMTA humanas | Rata Nude | IAM | Mejora de la función cardiaca, aumento de la densidad capilar, no existe transdiferenciación a linaje cardiaco o vascular |
| Van Dijk et al74 | Células de la FVE y CMTA de tejido adiposo subcutáneo de rata | Rata | IAM | FVE y CMTA disminuyen significativamente la zona infartada cuando se inyectan a los 7 días tras el infarto, no el primer día |
| Bagno et al75 | CMTA de tejido adiposo subcutáneo de rata + matrigel | Rata Wistar | Tras 6 semanas, mejora de la función cardiaca y disminuye la cicatriz | |
| Beitnes et al76 | CMTA de tejido adiposo subcutáneo y CMM de músculo esquelético humano | Rata Nude | IAM | Mejora de la función cardiaca y disminución del tamaño de la cicatriz |
| Fang et al77 | Células epiteliales amnióticas, células CMM del cordón umbilical y células CMTA de tejido adiposo subcutáneo humanas | Rata Nude atímica | IAM | Mejora de la función cardiaca y disminución del tamaño de la cicatriz |
| Hoke et al78 | CMTA de tejido adiposo epicárdico humano tratadas con inhibidor de la fosfodiesterasa-5 | Ratón CD-1 | IAM | Mejora de la función cardiaca, disminución de la fibrosis, aumento de la densidad vascular, disminución de la apoptosis, aumento de la secreción de VEGF, b-FGF y Ang1 |
| Li et al79 | CDC, CMM-MO, CMTA y CMN-MO humanas | Ratón | IAM | Tras 3 semanas, mejora de la función cardiaca, aumento de las células implantadas y diferenciadas hacia linaje miogénico |
| Liu et al80 | CMTA de tejido adiposo subcutáneo de rata en hidrogel de quitosano | Rata SD | IAM por ligadura de la DA | Aumento de las células madre implantadas que han sobrevivido y anidado |
| Paul et al81 | CMTA humanas inyectadas en microcápsulas de genipina y quitosano-alginato | Rata Lewis | IAM por oclusión de DA | Mejora de la retención de células implantadas, disminución de la zona infartada, aumento de la vasculogénesis y mejora de la función cardiaca |
| Paul et al82 | CMTA humanas que sobrexpresan Ang-1 | Rata | IAM | Aumento de las células retenidas y la densidad capilar, disminución de la zona infartada y aumento de la función cardiaca |
| Shi et al83 | CMTA de tejido adiposo subcutáneo de rata que sobrexpresan eNOS | Rata | IAM | Disminución de la zona infartada |
| Yang et al84 | HO-1-CMTA de tejido adiposo subcutáneo de conejo | Conejo | IAM | Mejora de la función cardiaca, el tamaño del ventrículo izquierdo y la diferenciación cardiomiogénica y angiogénica |
| Paul et al85 | CMTA y CMM-MO humanas | Rata | IAM | Mejora de la función cardiaca |
| Wang et al86 | CMTA humanas con/sin shPHD2 silenciado | Ratón | IAM | CMTA disminuyen la apoptosis de los cardiomiocitos, la fibrosis y la zona infartada y mejoran la función cardiaca. shPHD2-CMTA aumentan esta mejora e inducen mayor supervivencia de las CMTA. Medio condicionado de las shPHD2-CMTA disminuye la apoptosis cariomiocítica y aumenta el IGF-1 |
| Godier-Furnémont et al87 | Parches de CMM humanas condicionadas con TGFß-1 | Rata Nude | Oclusión de DA | Disminución de la apoptosis de los miocitos |
| Karpov et al88 | CMM-MO y CMTA inyectadas 7 días tras el infarto | Rata | Oclusión y reperfusión de DA | Animales trasplantados con CMM-MO preservan mejor la función del ventrículo izquierdo y disminuyen el tamaño de la cicatriz |
| Jiang et al89 | CMM | Rata | Ligadura de DA y poscondicionamiento isquémico de la zona remota | El poscondicionamiento isquémico de la zona remota aumenta la concentración de SDF-1a y aumenta la retención de las CMM inyectadas |
| Hong et al90 | CMTA, CPE, CMTA + CPE | Rata | Ligadura DA | Aumento de la FEVI y aumento de angiogénesis en la zona periinfarto en los tres grupos |
| Sun et al91 | CMTA sobre malla de fibrina rica en plaquetas | Rata | IAM por oclusión de DA | Mejora de la función y el remodelado vascular administrando las CMTA sobre la malla de fibrina rica en plaquetas, en vez de directamente |
Ang-1: angiopoyetina 1; b-FGF: factor de crecimiento fibroblástico básico; CDC: células madre mesenquimales; CMG-TA: células madre derivadas del tejido adiposo diferenciadas a célula cardiomiogénica; CMM: célula madre mesenquimal; CMM-MO: células madre mesenquimales derivadas de la médula ósea; CMN-MO: célula mononuclear de la médula ósea; CMTA: células madre derivadas del tejido adiposo; CPE: célula progenitora endotelial; DA: arteria coronaria descendente anterior izquierda; eNOS: óxido nítrico sintasa endotelial; FEVI: fracción de eyección del ventrículo izquierdo; FVE: fracción vascular estromal; GFP: proteína verde fluorescente; HGF: factor de crecimiento hepático; HO-1-CMTA: células madre derivadas del tejido adiposo transducida con hemooxigenasa 1; IAM: infarto agudo de miocardio; IGF-1: factor de crecimiento insulinoide tipo 1; SCID: síndrome de inmunodeficiencia combinada grave; SD: Sprague Dawley; shPHD2: prolyl hydroxylase domain protein 2; SNAP: S-nitroso-N-acetil-DL-penicilamina; TGFβ-1: factor de crecimiento transformador β1; VEGF: factor de crecimiento vascular endotelial.
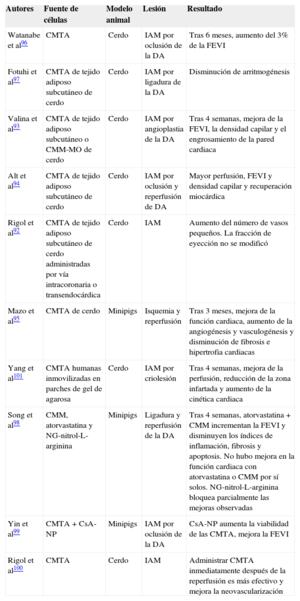
Estudios preclínicos con modelos porcinos
| Autores | Fuente de células | Modelo animal | Lesión | Resultado |
|---|---|---|---|---|
| Watanabe et al96 | CMTA | Cerdo | IAM por oclusión de la DA | Tras 6 meses, aumento del 3% de la FEVI |
| Fotuhi et al97 | CMTA de tejido adiposo subcutáneo de cerdo | Cerdo | IAM por ligadura de la DA | Disminución de arritmogénesis |
| Valina et al93 | CMTA de tejido adiposo subcutáneo o CMM-MO de cerdo | Cerdo | IAM por angioplastia de la DA | Tras 4 semanas, mejora de la FEVI, la densidad capilar y el engrosamiento de la pared cardiaca |
| Alt et al94 | CMTA de tejido adiposo subcutáneo de cerdo | Cerdo | IAM por oclusión y reperfusión de DA | Mayor perfusión, FEVI y densidad capilar y recuperación miocárdica |
| Rigol et al92 | CMTA de tejido adiposo subcutáneo de cerdo administradas por vía intracoronaria o transendocárdica | Cerdo | IAM | Aumento del número de vasos pequeños. La fracción de eyección no se modificó |
| Mazo et al95 | CMTA de cerdo | Minipigs | Isquemia y reperfusión | Tras 3 meses, mejora de la función cardiaca, aumento de la angiogénesis y vasculogénesis y disminución de fibrosis e hipertrofia cardiacas |
| Yang et al101 | CMTA humanas inmovilizadas en parches de gel de agarosa | Cerdo | IAM por criolesión | Tras 4 semanas, mejora de la perfusión, reducción de la zona infartada y aumento de la cinética cardiaca |
| Song et al98 | CMM, atorvastatina y NG-nitrol-L-arginina | Minipigs | Ligadura y reperfusión de la DA | Tras 4 semanas, atorvastatina + CMM incrementan la FEVI y disminuyen los índices de inflamación, fibrosis y apoptosis. No hubo mejora en la función cardiaca con atorvastatina o CMM por sí solos. NG-nitrol-L-arginina bloquea parcialmente las mejoras observadas |
| Yin et al99 | CMTA + CsA-NP | Minipigs | IAM por oclusión de la DA | CsA-NP aumenta la viabilidad de las CMTA, mejora la FEVI |
| Rigol et al100 | CMTA | Cerdo | IAM | Administrar CMTA inmediatamente después de la reperfusión es más efectivo y mejora la neovascularización |
CMM: células madre mesenquimales; CMM-MO: células madre mesenquimales derivadas de la médula ósea; CMTA: células madre derivadas del tejido adiposo; CsA-NP: emulsión de nanopartículas de ciclosporina A; DA: arteria coronaria descendiente anterior izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio.
Otra función importante de las CMTA en el ámbito de la enfermedad isquémica deriva de su potencial angiogénico52,109. Se ha descrito que las CMTA secretan gran número de citocinas proangiogénicas y factores citoprotectores, lo que las convierte en una fuente celular idónea para la terapia angiogénica y la inhibición de la apoptosis29,110–112. Un estudio in vivo demostró que la inyección intramiocárdica de CMTA humanas promovía significativamente la angiogénesis e inhibía la apoptosis de las células de un corazón infartado 4 semanas después de su inyección54. Además, las CMTA presentaban un aumento en la expresión de los factores de crecimiento endotelial vascular y fibroblástico, y del factor derivado de células estromales–154. De hecho, se ha descrito que la interacción del factor derivado de células estromales–1 con su receptor induce la movilización rápida de las células madre/progenitoras de la médula ósea113, lo cual es una función esencial para la revascularización de los sistemas orgánicos114. Todo esto indica que las CMTA inyectadas tienen un efecto cooperativo con las células madre/progenitoras de la médula ósea a través de los mecanismos de movilización celular, promovidos por el factor derivado de células estromales–1 y que ayudan a la angiogénesis y vasculogénesis del miocardio isquémico54.
La respuesta funcional de las CMTA también puede verse afectada por la concentración de oxígeno29,115. Rehman et al29 encontraron que las CMTA secretaban hasta 5 veces más factores de crecimiento endotelial vascular si se cultivan en condiciones de hipoxia. De hecho, el sobrenadante condicionado de CMTA cultivadas en condiciones de hipoxia causa un aumento del crecimiento de las células endoteliales y disminuye su apoptosis. Recientemente, un estudio ha demostrado que el precondicionamiento de las CMTA en hipoxia aumenta su supervivencia celular y sus efectos paracrinos a través del factor inducible por hipoxia–1116. De hecho, en este grupo se ha descrito que cultivar las CMTA en condiciones de hipoxia mejora en gran medida su capacidad proliferatva40. Estos resultados muestran que las CMTA responden a situaciones de isquemia y promueven la angiogénesis gracias a la secreción de factores de crecimiento endotelial vascular. Como ya se ha mencionado, varios estudios experimentales han demostrado la seguridad y la eficacia del uso de las CMTA (tablas 3 y 4). Como se observa en la tabla 4, dos estudios muestran un aumento de la densidad capilar en la zona que rodea el corazón infartado y un aumento de la función cardiaca 1 mes después del infarto de miocardio cuando los animales se han tratado con CMTA, resultados similares a los observados tras administrar CMM derivadas de la médula ósea93,94. Un estudio de seguimiento a largo plazo muestra que, a pesar de que no se detectan CMTA en el miocardio 3 meses después de inyectarlas, el trasplante de las CMTA está asociado a aumento de la función cardiaca, remodelado positivo y aumento de la angiogénesis y la vasculogénesis, lo que confirma el efecto paracrino de las CMTA a largo plazo95. Sin embargo, estas observaciones ponen de manifiesto que, a pesar de todas las ventajas que presentan las CMTA, su baja capacidad de anidar en el tejido isquémico es un obstáculo a la hora de utilizarlas en el ámbito clínico117. Por eso se están llevando a cabo varias estrategias para solventar el problema de la supervivencia y el anidamiento de las CMTA en el tejido huésped, como sería la administración de las CMTA junto con una combinación de factores de crecimiento118, inyectar CMTA modificadas genéticamente119 y/o el uso de injertos/soportes de biomateriales120,121. Finalmente, es necesario mencionar que varios estudios han indicado que las CMTA, tanto in vitro como in vivo, son capaces de aumentar la vasculatura al diferenciarse a pericitos, células capaces de estabilizar los microvasos, prevenir la regresión vascular y promover su mantenimiento a largo plazo122,123.
Ensayos clínicosLa evidencia encontrada en los estudios experimentales sobre el potencial de las CMTA de reparar el miocardio isquémico y restaurar su capacidad funcional ha estimulado la realización de ensayos clínicos en esta área. Sin embargo, mientras algunos investigadores creen que en los próximos años las CMTA se utilizarán como terapia celular destinada a reparar el corazón dañado, otros investigadores opinan que aún quedan muchas incógnitas por resolver antes de usarlas en el ámbito clínico. Hoy por hoy se han utilizado satisfactoriamente las CMTA para tratar algunas enfermedades como las fístulas de Crohn, la osteogénesis imperfecta o la reconstrucción mamaria tras una mastectomía parcial, entre otras (tabla 5). Sin embargo, el uso de las CMTA en el ámbito de la cardiopatía isquémica aún se encuentra en fases I–II. Actualmente hay varios ensayos clínicos para conocer la factibilidad, la seguridad y la eficacia del uso de las CMTA en pacientes que han tenido un infarto agudo de miocardio (APOLLO, ADI-ME-CHF-002, ADVANCE y ACUTE MI), presentan cardiopatía isquémica crónica (PRECISE, MyStromalCell, ATHENA y ATHENA II) o una cardiomiopatía de origen no isquémico (ADI-ME-CHF-001). De todos ellos, se han completado los ensayos APOLLO124, PRECISE125 y MyStromalCell126. Los estudios muestran que el uso de las CMTA es seguro y factible. Además, los resultados indican que el uso de las CMTA preserva la función cardiaca, mejora la perfusión cardiaca y hasta reduce el tamaño de la cicatriz, lo que refuerza los hallazgos de estudios preclínicos previos.
Ensayos clínicos realizados con células madre derivadas del tejido adiposo
| Trastornos | Estudios, n |
|---|---|
| Enfermedad metabólica | |
| Lipodistrofia | 2 |
| Diabetes mellitus | 5 |
| Enfermedad cardiovascular | |
| Enfermedad vascular | 2 |
| Cardiopatía isquémica | 11 |
| Ictus | 2 |
| Trastornos reumáticos | |
| Tendón | 1 |
| Artritis | 6 |
| Enfermedad degenerativa discal | 1 |
| Necrosis | 1 |
| Trastornos renales y urológicos | |
| Incontinencia urinaria | 4 |
| Insuficiencia renal | 1 |
| Trastornos de la uretra | 1 |
| Enfermedades del sistema endocrino | 1 |
| Trastornos respiratorios | 2 |
| Enfermedad del sistema nervioso | |
| Ataxia | 1 |
| Hemiatrofia facial | 1 |
| Esclerosis múltiple | 2 |
| Parkinson | 1 |
| Lesiones de la médula espinal | 3 |
| Daño cerebral | 2 |
| Trastorno mental | 1 |
| Enfermedades del sistema digestivo | |
| Trastornos intestinales | 2 |
| Cirrosis hepática | 1 |
| Fibrosis | 11 |
| Enfermedades mamarias | 4 |
| Enfermedad de injerto contra huésped | 7 |
| Enfermedad de Crohn | 2 |
| Injerto de grasa autóloga | 3 |
| Síndrome de fragilidad | 1 |
Las CMTA están apareciendo como una gran alternativa para la terapia celular en varios campos de la medicina, lo que implica una mejor comprensión de los mecanismos por los que las células o sus factores paracrinos podrían llevar a cabo la regeneración/recuperación tisular así como los factores moleculares clave que promueven la diferenciación de las CMTA a los diferentes linajes. Es más, queda por determinar si el lugar anatómico del que se aíslan, el sexo y la edad del donante o la presencia de comorbilidades pueden afectar a la eficacia terapéutica. Es importante considerar también la posibilidad de usar tanto CMTA autólogas como alogénicas, ya que varios estudios independientes han determinado bajo grado de inmunoestimulación por las CMTA127,128.
FINANCIACIÓNParte del trabajo contenido en este trabajo ha sido financiado por el Programa Nacional de Salud (SAF 2013-42962-R concedido a L. Badimon; SAF 2012-40208 concedido a G. Vilahur), el Instituto de Salud Carlos III (TerCel [Red de Terapia Celular] RD12/0019/0026) y la Fundación Jesús Serra (FIC-Barcelona).
CONFLICTO DE INTERESESNinguno.
Agradecemos a la Fundación Jesús Serra de Barcelona su continuo apoyo. G. Vilahur es investigadora Ramón y Cajal con un contrato con la Secretaría de Estado de Investigación, Desarrollo e Innovación del Ministerio de Economía y Competitividad de España (RyC-2009-5495).