Palabras clave
INTRODUCCIÓN
La reestenosis intra-stent ha sido considerada durante mucho tiempo la principal limitación en la eficacia de los stents a largo plazo. Sin embargo, el uso de stents con capacidad de liberación de fármacos, como los stents con liberación de sirolimus (Cypher) y los que permiten la liberación de paclitaxel (TAXUS), se ha asociado con una disminución importante de la reestenosis en varios ensayos clínicos efectuados con asignación aleatoria y también en varios registros1-4. Actualmente, los stents con capacidad de liberación de fármacos se utilizan en la mayor parte de los procedimientos intracoronarios en los que es necesario un stent. Sin embargo, todavía aparecen cuadros de reestenosis en algunos pacientes y también se han detectado algunos problemas específicos, como la trombosis tardía tras la interrupción del tratamiento antiplaquetario5.
Recientemente se han introducido otros abordajes en el tratamiento de la enfermedad coronaria. Se están evaluando abordajes percutáneos en los que se utiliza la circulación venosa adyacente para revascularizar la arteria obstruida, y también métodos basados en endoprótesis para conseguir un bypass desde el ventrículo a la arteria coronaria. Además, se están estudiando métodos terapéuticos de angiogénesis y miogénesis. La investigación actual respecto a la terapia génica mediante angiogénesis y la transferencia de células progenitoras puede facilitar la introducción de opciones terapéuticas adicionales para los pacientes con isquemia miocárdica.
Sin embargo, a pesar de los avances realizados en el tratamiento de los pacientes con enfermedad coronaria, todavía se observan cuadros de muerte súbita de causa cardíaca. La mitad de los fallecimientos por causas cardíacas corresponde a cuadros de muerte súbita, y en más del 70% de estos fallecimientos la causa es la rotura de una placa6,7. Además, la rotura «silente» de la placa y el consiguiente crecimiento acelerado de ésta como consecuencia de su proceso de curación constituyen fenómenos más frecuentes en las arterias que presentan una estenosis luminal menos severa8.
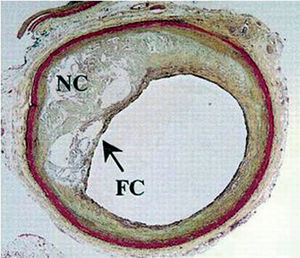
Se ha demostrado que la composición de la placa aterosclerótica es una determinante clave en la evolución de estas lesiones9. Se considera que las placas con una zona central necrótica rica en lípidos que ocupa un gran porcentaje de la placa muestran una elevada capacidad trombogénica y tendencia a la rotura9,10. Además, en la rotura de la placa y en su lesión precursora más frecuente, el fibroateroma de cápsula fina (FACF) (fig. 1), se observan a menudo concentraciones elevadas de colesterol libre e imágenes correspondientes a cristales de colesterol6,11.
Fig. 1. Lesión de fibroateroma con cápsula fina. NC: zona central necrótica; FC: cubierta fibrosa fina. Tomada de Virmani et al6. Reproducida con autorización de Lippincott Williams & Wilkins.
En un estudio previo realizado en un grupo importante de pacientes con muerte súbita se demostró que la causa subyacente del 60% de los trombos agudos era la rotura de lesiones con FACF. Además, el 70% de estos pacientes mostraba lesiones de FACF adicionales sin datos de rotura12. Actualmente se han desarrollado nuevas técnicas invasivas de imagen para identificar las características de las lesiones con FACF13. Estas técnicas permiten definir las características principales de las lesiones con FACF: core lipídico grande, cubierta fina (¾ 65 μm) y signos de remodelado positivo. La detección de estas placas de riesgo alto, ricas en lípidos y no obstructivas, podría influir de forma importante en la prevención del infarto miocárdico agudo y de los cuadros de muerte súbita.
BYPASS CORONARIO MEDIANTE CATÉTER
Arterialización venosa coronaria percutánea in situ
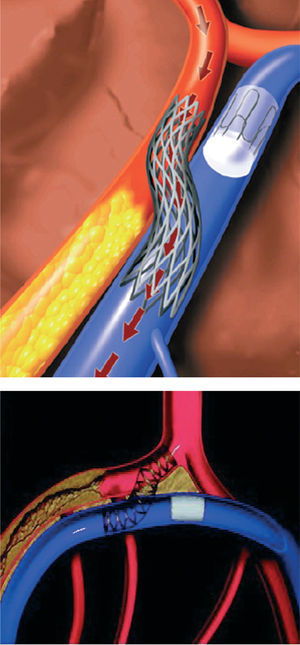
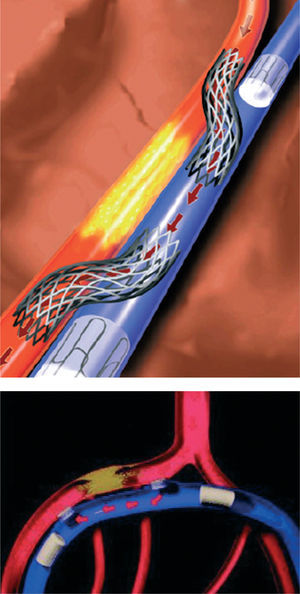
Las técnicas de bypass coronario mediante catéter se introdujeron en 199514,15. Actualmente se están evaluando abordajes percutáneos en los que se utiliza la circulación venosa adyacente para reperfundir una arteria obstruida. En la técnica de arterialización venosa coronaria percutánea in situ (AVPIS) se ponen en conexión una arteria coronaria y su vena adyacente en un punto anterior a la lesión, dirigiendo de esta manera el flujo de sangre oxigenada hacia la vena (fig. 2). Así, la sangre oxigenada discurre a través del sistema venoso en dirección inversa a la habitual para la perfusión del miocardio. En la técnica de bypass arterial coronario percutáneo in situ se crean dos conductos vasculares entre la arteria coronaria y la vena adyacente, uno de ellos antes de la lesión y otro después de ésta (fig. 3). La sangre se introduce en el conducto vascular anterior a la lesión, discurre a través de la vena aislada evitando el paso por la lesión y, finalmente, vuelve a introducirse en los segmentos sanos distales de la arteria a través del conducto vascular creado después de la lesión. Oesterle et al15 publicaron su experiencia clínica inicial con AVPIS. Esta técnica fue aplicada en 11 pacientes con angina severa en los que no se consideraban adecuadas las opciones de la angioplastia o la revascularización quirúrgica. En 6 pacientes no fue posible aislar adecuadamente la vena adyacente para su sutura; así, la técnica de AVPIS sólo se pudo realizar con buenos resultados en 5 pacientes. Dos de estos 5 pacientes presentaron complicaciones de carácter catastrófico y fallecieron en las primeras 48 h del procedimiento. Los 3 pacientes restantes mostraron una mejoría de su sintomatología anginosa. Sin embargo, en la coronariografía de seguimiento realizada a los 3 meses se observó la obstrucción del conducto vascular de la AVPIS en 2 de los pacientes. Tras esta experiencia clínica inicial, actualmente se están efectuando modificaciones importantes en los distintos dispositivos (una nueva estrategia de técnicas de imagen y dispositivos de conexión y bloqueo modificados) y se está realizando un estudio clínico específico.
Fig. 2. Arterialización venosa coronaria percutánea in situ (AVPIS). Tomada de Oesterle et al15. Reproducida con autorización de John Wiley & Sons Ltd. All rights reserved.
Fig. 3.Bypass arterial coronario in situ percutáneo (DCPIS). Tomada de Oesterle et al15. Reproducida con autorización de John Wiley & Sons Ltd. All rights reserved.
Abordaje mediante stents para la bypass desde el ventrículo a la arteria coronaria
Un abordaje alternativo, que también se realiza mediante esternotomía, es el bypass del ventrículo a la arteria coronaria. En este procedimiento se utiliza un dispositivo de endoprótesis (VSTENT) para crear un conducto vascular entre el ventrículo izquierdo y la arteria coronaria izquierda, incrementando de esta manera el flujo en dicha arteria coronaria. La ventaja de este abordaje es que no se requiere ninguna forma de injerto y se puede realizar rápidamente. Sólo se ha publicado un caso de procedimiento de revascularización experimental16.
PERFUSIÓN RETRÓGRADA
La retroperfusión sincronizada con sangre arterial de las venas coronarias es una técnica que ha permitido reducir parcialmente la isquemia miocárdica en los pacientes intervenidos mediante angioplastia coronaria transluminal percutánea (ACTP)17. En general, se considera que los pacientes con estenosis del tronco coronario izquierdo o con alguna forma equivalente de estenosis muestran un riesgo elevado en la ACTP. Pohl et al18 publicaron los resultados obtenidos al cabo de un año de seguimiento en un estudio prospectivo y aleatorizado efectuado en un solo centro (Myoprotect I) sobre 44 pacientes con lesiones sintomáticas del tronco izquierdo o con lesiones equivalentes, que fueron distribuidos aleatoriamente al grupo de endoprótesis (n = 23) o al grupo de cirugía de bypass (n = 21)18. En todos los pacientes asignados aleatoriamente al grupo de tratamiento percutáneo, durante las fases de isquemia se aplicó la retroperfusión selectiva y regulada mediante presión de la sangre arterial hacia la vena cardíaca anterior. La mortalidad a los 28 días y al cabo de 1 año, así como las puntuaciones de calidad de vida, fueron similares en ambos grupos. Aunque en el grupo de ACTP con stents hubo, en comparación con el grupo de cirugía coronaria, una supervivencia sin complicaciones menor y una tasa de revascularización de la lesión diana mayor, la implantación de stents con soporte mediante retroperfusión se asoció con una reducción significativa de los costes y se podría considerar una opción terapéutica alternativa en subgrupos seleccionados de pacientes de riesgo alto.
ANGIOGÉNESIS Y VASCULOGÉNESIS TERAPÉUTICAS
Los desequilibrios crónicos entre el aporte y la demanda miocárdica de oxígeno a consecuencia de una estenosis u oclusión de una arteria coronaria favorecen el desarrollo de la circulación coronaria colateral. La angiogénesis y la vasculogénesis son respuestas adaptativas de la circulación coronaria colateral a la isquemia miocárdica.
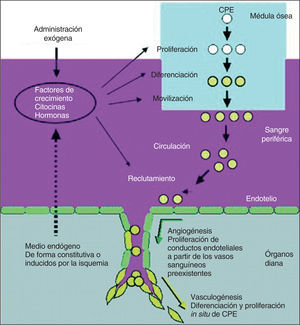
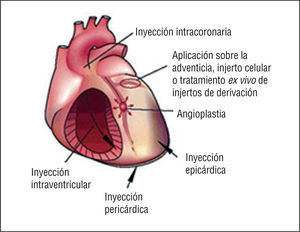
Las técnicas de angiogénesis y vasculogénesis terapéuticas, que conllevan la administración de factores de crecimiento angiogénicos, citocinas o células progenitoras para estimular la formación de vasos colaterales y para mejorar la perfusión miocárdica, se están evaluando como estrategias alternativas en los pacientes con angina refractaria que no responden al tratamiento médico y que no son candidatos para tratamientos de revascularización mecánica (fig. 4).
Fig. 4. Factores de crecimiento, citocinas y hormonas liberados por el medio endógeno en respuesta a la isquemia tisular, o bien administrados exógenamente para la neovascularización terapéutica para inducir la proliferación de las células progenitoras endoteliales (CPE) y para la diferenciación y movilización desde la médula ósea (a través de la circulación periférica) hasta los focos neovasculares. Tomada de Isner et al19. Reproducida con autorización de Journal of Clinical Investigation.
Citocinas angiogénicas
En estudios preclínicos se han establecido los fundamentos para el desarrollo racional de la angiogénesis terapéutica20-23. Hay varios factores de crecimiento y quimiocinas que incrementan de manera convincente la formación de vasos sanguíneos de pequeño calibre en modelos experimentales. En la mayor parte de los ensayos clínicos efectuados hasta el momento se han utilizado factor de crecimiento endotelial vascular (VEGF) o factor de crecimiento de fibroblastos (FGF) aplicados mediante estrategias diferentes (fig. 5)24.
Fig. 5. Vías posibles para el aporte clínico de genes. Tomada de Yla-Herttuala et al25. Reproducida con autorización de Nature Publishing Group.
Transferencia de proteínas
Tras la introducción de la tecnología del ADN recombinante, actualmente es posible producir grandes cantidades de proteínas purificadas para su uso terapéutico (tabla 1)25. Las ventajas de la administración local de factores angiogénicos purificados son la facilidad en las modificaciones de la dosis, la posibilidad de su administración repetida si fuera necesario y la rapidez de su metabolismo, que impide la toxicidad25. Las desventajas principales han sido la ausencia de eficacia en estudios controlados con placebo y la necesidad de su administración durante la cirugía de revascularización coronaria. Actualmente se están desarrollando sistemas de liberación lenta de proteínas angiógenas.
Terapia génica
La terapia génica es un abordaje terapéutico en el que se realiza la transferencia del material genético que induce la producción de una proteína, más que de la proteína en sí misma. Para la transferencia del ADN al miocardio se han utilizado distintos vehículos, como ADN purificado, complejos ADN-lípido, virus relacionados con los adenovirus o los mismos adenovirus24,25. Una ventaja de este método parece ser la producción localizada y sostenida, aunque no indefinida, de factores de angiogénesis26. Sus aparentes desventajas son la posibilidad de toxicidad inducida por el vector, la respuesta inmunitaria frente al vector utilizado en la propia terapia génica, y la localización incorrecta de la transferencia génica, que puede dar lugar a la angiogénesis en un tumor o en la retina.
Actualmente, la eficacia de los abordajes de transferencia génica para conseguir una angiogénesis terapéutica se está evaluando en ensayos clínicos (tabla 2)25,27-33. En los ensayos clínicos preliminares efectuados sin grupo control y con un diseño abierto se obtuvieron en general resultados positivos, aunque en estos estudios no se pudo excluir la posibilidad de un efecto placebo. Los ensayos clínicos de fase II realizados con grupo control están aportando resultados positivos, aunque no definitivos. Éste es un método prometedor debido a que los pacientes en los que está indicado no han presentado respuesta a otras formas de tratamiento y no son candidatos idóneos para la intervención quirúrgica. Sin embargo, la mayor parte de los parámetros de eficacia evaluados hasta el momento son criterios de valoración subrogados, como el tiempo de tolerancia al ejercicio, la angina o la perfusión. Aunque estos parámetros son &uac ute;tiles para indicar eficacia clínica, es necesario el estudio de criterios de valoración clínicos de carácter definitivo, como la mortalidad, el infarto miocárdico y la necesidad de revascularización. También son necesarios datos de seguimiento a largo plazo. Una observación importante es que los resultados de seguridad obtenidos en estos estudios no indican la presencia de problemas graves. En los ensayos clínicos efectuados no se han observado efectos adversos, como el empeoramiento de la aterosclerosis, la retinopatía o el cáncer.
Se han realizado 2 ensayos clínicos de fase III de gran envergadura (AGENT 3 y 4) para evaluar los grados de seguridad y eficacia de Ad5FGF-431. Ambos estudios se efectuaron con asignación aleatoria y controles doble ciego y placebo. En cada uno de estos estudios, el objetivo de participación fue de 450 pacientes, que fueron asignados aleatoriamente a 3 grupos (grupo placebo, grupo de administración de Ad5FGF-4 a una dosis de 109 vp, y grupo de administración de Ad5FGF-4 a una dosis de 1010 vp). En enero de 2004 se interrumpió la fase de inclusión de los pacientes (416 pacientes en el estudio AGENT 3 y 115 en el estudio AGENT 4) debido a que el análisis preliminar de los datos correspondientes al estudio AGENT 3 indicaba que en estos estudios no iba a ser posible obtener una evidencia de eficacia suficiente. Sin embargo, los pacientes que ya habían iniciado su participación siguieron el estudio y se espera que dentro de poco estén disponibles los resultados finales.
Terapia celular
Otro método alternativo para incrementar la vascularización coronaria es el trasplante de células progenitoras34,35. Estas células no sólo producen diversos factores de crecimiento y citocinas, sino que también participan estructuralmente en la formación del nuevo tejido vascular y de nuevos miocitos.
Los resultados prometedores obtenidos en estudios experimentales indujeron el inicio de ensayos clínicos36,38. Actualmente se están evaluando las células progenitoras en pacientes con infarto agudo de miocárdico y con cardiopatía isquémica crónica (tablas 3 y 4)35,39-46. En la mayor parte de los pacientes se ha observado un incremento en la movilidad parietal y en la perfusión. Sin embargo, el único ensayo clínico realizado con control y con asignación aleatoria ha sido el estudio BOOST42. En este estudio, un grupo de 60 pacientes con infarto miocárdico con elevación del segmento ST fue distribuido aleatoriamente a un grupo control en el que se aplicó el tratamiento médico óptimo postinfarto, o bien a un grupo en el que se aplicó el tratamiento médico óptimo además de la transferencia intracoronaria de células autólogas de la médula ósea 4,8 días después de la intervención coronaria percutánea. Al cabo de 6 meses, la fracción de eyección ventricular izquierda global había aumentado significativamente en el grupo de aplicación de células de la médula ósea en comparación con el grupo control. No obstante, la mayor parte de los estudios que se han realizado hasta el momento ha tenido limitaciones a consecuencia del escaso número de pacientes, y recientemente en algunos artículos se ha señalado que las células progenitoras hematopoyéticas procedentes de la médula ósea no muestran diferenciación hacia miocitos cardíacos en el miocardio isquémico47,48.
TRASPLANTE PERCUTÁNEO DE MIOBLASTOS
La mayor parte de la experiencia preclínica se refiere al trasplante de mioblastos esqueléticos en el miocardio con infarto49-52. En estos estudios se ha demostrado que los mioblastos esqueléticos trasplantados en el miocardio lesionado pueden injertarse, inducir la formación de miofilamentos y sobrevivir a largo plazo. Se han publicado varios ensayos clínicos sobre el trasplante percutáneo de mioblastos a través de abordajes transendocárdico y transvenoso.
Abordaje transendocárdico
El grupo de Rotterdam ha publicado un estudio piloto sobre la seguridad y la viabilidad del trasplante percutáneo de mioblastos esqueléticos autólogos mediante inyección transendocárdica en 5 pacientes con insuficiencia cardíaca de origen isquémico50. Los mioblastos esqueléticos autólogos se obtuvieron a partir del músculo cuádriceps y fueron cultivados in vitro para conseguir la expansión celular. Mediante un sistema de catéter guiado con el dispositivo NOGA®, se realizó la inyección transendocárdica de 196 ± 105 millones de células en la zona del infarto. Al cabo de 3 meses, la fracción de eyección del ventrículo izquierdo había mejorado y en el estudio de las características de la pared ventricular mediante resonancia magnética se observaba un incremento significativo del grosor parietal en la zona tratada. A la vista de estos resultados preliminares favorables, se ha iniciado un estudio multicéntrico europeo sin grupo control. En este estudio participan 15 pacientes que han sido tratados mediante inyección transendocárdica de mioblastos esqueléticos, y sus resultados definitivos se presentarán pronto.
Abordaje transvenoso
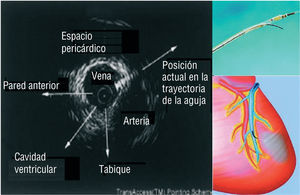
También se ha desarrollado un sistema endovascular novedoso basado en un catéter que permite la inyección miocárdica directa, bajo control con ecografía intravascular (EIV), mediante punciones con aguja a través del sistema venoso coronario (sistema TRANSAccess®) (fig. 6)53. En el estudio POZAN participaron 10 pacientes en los que se realizó una inyección intramiocárdica mediante el sistema TRANSA- ccess®,54. El procedimiento no tuvo éxito en 1 paciente, pero en todos los demás pacientes mejoró la clase funcional de la New York Heart Association (NYHA) y en 6 de 9 pacientes la fracción de eyección aumentó en un 3-8% tras un período de seguimiento de 6 meses.
Fig. 6. Inyección miocárdica directa mediante punciones con aguja guiadas con ecografía intravascular a través del sistema venoso coronario.
Arritmias ventriculares
Se han observado cuadros de arritmias ventriculares tras la inyección intramiocárdica de mioblastos esqueléticos. En el estudio de Menasche et al52 fue necesaria la colocación de un cardioversor-desfibrilador implantable (DAI) debido a la aparición de arritmias ventriculares en 4 de 10 pacientes intervenidos mediante trasplante autólogo de mioblastos con esternotomía50,52. Uno de los 5 pacientes que participaron en el estudio del trasplante percutáneo de mioblastos esqueléticos autólogos mediante abordaje transendocárdico también presentó episodios de taquicardia ventricular con necesidad de DAI. Posiblemente, este problema está relacionado con: a) la heterogeneidad de los potenciales de acción entre las células originales y las trasplantadas; b) el potencial arritmógeno intrínseco de las células inyectadas; c) el incremento en la proliferación de terminaciones nerviosas inducido por la inyección de células progenitoras, y d) la lesión o el edema local secundaria inducidos por la punción miocárdica y por la respuesta inflamatoria secundaria a ésta.
PERSPECTIVAS FUTURAS RESPECTO A LA DETECCIÓN DE LA PLACA VULNERABLE MEDIANTE MÉTODOS INVASIVOS
Placas ateromatosas ricas en core lipídico
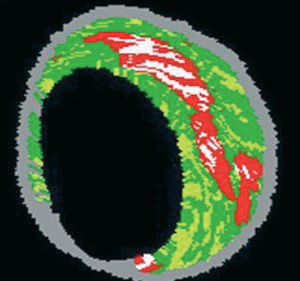
La EIV ofrece una visión tomográfica precisa de las arterias coronarias y ha demostrado presentar una correlación elevada con las muestras histológicas en los estudios de validación in vitro55-57. Sin embargo, la caracterización precisa de la placa mediante la interpretación visual de la EIV en escala de grises, especialmente en lo que se refiere a las placas con lípidos abundantes sigue siendo un problema no resuelto56. Por el contrario, el análisis espectral de los datos de radiofrecuencia de la EIV (EIV-Virtual Histology® [EIV-VH]) ha sido una técnica útil para ofrecer información cuantitativa detallada de la composición de la placa y su resultados han sido validados en estudios efectuados sobre explantes de segmentos coronarios humanos (fig. 7)58.
Fig. 7. Imagen de histología virtual. En rojo, zona central lipídica; en blanco, calcio; en amarillo, tejido fibroadiposo; en verde, fibrosis; en gris, capa media.
En estudios de validación previos, las placas con coloración amarillenta en la angioscopia se han relacionado con las placas ateromatosas59. No obstante, esta técnica sólo permite evaluar la superficie luminal de la capa íntima y, por tanto, no ofrece datos cuantificables del tamaño de la parte central de la placa rica en lípidos.
La espectroscopia Raman es una técnica que permite definir la composición química de los tejidos60. En estudios realizados in vitro se ha demostrado que diversos algoritmos diagnósticos permiten la discriminación del tejido arterial coronario en tres categorías: placas no ateroescleróticas, placas no calcificadas y placas calcificadas61. No obstante, esta técnica tampoco ofrece información de carácter geométrico respecto al vaso y sólo facilita información relativa a su superficie.
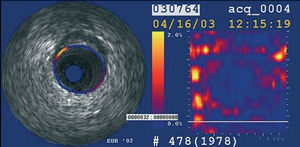
La elastografía y la palpografía mediante ecografía intravascular son técnicas que permiten la evaluación de las propiedades tisulares mecánicas a nivel local (fig. 8)62,63. Para un cambio de presión definido, los componentes de los tejidos blandos (ricos en lípidos) muestran una deformación mayor que los componentes tisulares duros (fibrosis-calcificación)64. No obstante, estas técnicas no permiten una determinación cuantificable de los componentes de la placa.
Fig. 8. Imagen de palpografía. En amarillo, zona de deformación intensa.
Por último, recientemente se ha introducido la resonancia magnética intravascular como una posible herramienta para identificar la lesión de FACF, debido a que puede determinar con precisión la presencia de lípidos en el interior de la pared arterial65,66. Sin embargo, todavía no se ha determinado la viabilidad in vivo de esta técnica; además, es necesario mejorar los tiempos de adquisición y del análisis de las imágenes.
Cápsula fibrosa fina
El umbral para definir como «fina» la cápsula de una placa ha sido establecido previamente en < 65 μm67. No obstante, es evidente que durante la deshidratación del tejido se produce una disminución general den68. Durante las fases de secado inmediato, secado libre y secado al aire se observan disminuciones de volumen del 60, el 15 y el 80%, respectivamente69. Además, la contracción de las arterias tras el fallecimiento del paciente contribuye todavía más a dificultar la cuantificación anatomopatológica de la aterosclerosis70. Por tanto, creemos que el umbral debe ser > 65 μm. Dado que la resolución axial de la EIV se sitúa entre 100 y 150 μm, las técnicas como la EIV-VH que poseen capacidad para cuantificar cada componente de la placa y para identificar la localización de la zona central lipídica en relación con la luz pueden poner de manifiesto las tres características de las lesiones de FACF.
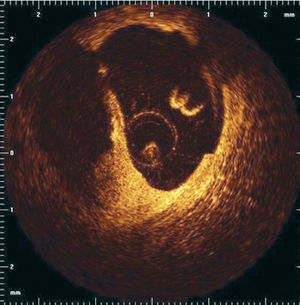
La tomografía de coherencia óptica (TCO) es una técnica que permite la obtención de imágenes de alta resolución (resolución axial de 15 μm) en los medios biológicos (fig. 9)71. Así, la TCO facilita la visualización in vivo, en tiempo real, de la cápsula fibrosa fina. Los datos más recientes obtenidos in vivo con esta técnica indican además la posibilidad de detectar los macrófagos en las placas ateroscleróticas72.
Fig. 9. Imagen de tomografía con coherencia óptica tras la rotura de la placa.
La sensibilidad y la especificidad de la palpografía para la detección de las placas vulnerables ha sido evaluada recientemente en arterias coronarias humanas estudiadas en autopsia; los valores de sensibilidad y especificidad de esta técnica fueron del 88 y del 89%, respectivamente63.
Remodelado positivo
El aumento de tamaño compensador y expansivo de las arterias coronarias en respuesta a un incremento en la superficie ocupada por las placas de ateroma se denomina remodelado positivo o expansivo73. En varios estudios se ha observado que los vasos con remodelación positiva muestran un incremento en las concentraciones de marcadores inflamatorios, junto con un aumento de tamaño en las zonas centrales lipídicas y un adelgazamiento pronunciado de la capa media74-76. Recientemente se ha evaluado mediante EIV la relación entre el patrón de remodelado vascular y la composición de la placa77-79. En estos estudios, el índice de remodelado en las lesiones blandas fue significativamente mayor que el observado en las lesiones fibrosas/mixtas y calcificadas77-79. Además de la EIV convencional en escala de grises, la EIV-VH también permite identificar con precisión el tamaño de la parte central lipídica, la lesión FACF y las características geométricas del vaso.
Síndromes pancoronarios
En varios estudios en los que se han utilizado angiografía, EIV, angioscopia y palpografía se ha observado una incidencia elevada de placas de riesgo alto en todo el árbol coronario80-83. En el estudio efectuado por Rioufol et al81 se detectó la rotura de al menos una placa alejada de la lesión inicial en el 80% de los pacientes, de una placa en una arteria diferente de la arteria con la lesión inicial en el 71% y de placas en 2 arte rias distintas de la arteria con la lesión inicial en el 12,5% de los pacientes81.
Los pacientes con infarto agudo miocárdico pueden presentar placas coronarias complejas adicionales no relacionadas con el infarto. Además, se ha demostrado que estas placas complejas y múltiples son factores predictivos independientes de la aparición futura de complicaciones clínicas80.
Las estrategias de actuación local potencialmente preventivas podrían no tener una rentabilidad económica adecuada en los casos en los que las técnicas de angiografía, angioscopia, EIV y palpografía detectan un elevado número de placas de riesgo alto en todo el árbol coronario8,80-83. Por el contrario, la aplicación de un abordaje terapéutico sistémico de «estabilización de las placas» con estatinas o inhibidores de la enzima de conversión de la angiotensina podría permitir un «enfriamiento» del proceso inflamatorio global84.
CONCLUSIONES
Se han desarrollado numerosos abordajes terapéuticos percutáneos, así como herramientas diagnósticas, para la detección de las placas vulnerables y el tratamiento de un número cada vez mayor de pacientes con isquemia miocárdica. La proliferación de estas estrategias y la necesidad de efectuar múltiples abordajes terapéuticos en los pacientes individuales indican que el problema de la isquemia miocárdica todavía no ha sido resuelto. La investigación actualmente en marcha respecto a los stents con capacidad de liberación de fármacos, la realización de bypass coronarios mediante catéteres, los abordajes terapéuticos con angiogénesis y miogénesis, y los dispositivos basados en catéteres para la detección de la vulnerabilidad de la placa y la definición de su composición pueden proporcionar opciones diagnósticas y terapéuticas adicionales en los pacientes con enfermedad coronaria.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: P.W. Serruys MD, PhD.
Thoraxcenter, Bd 406. Erasmus MC, Dr Molewaterplein 40. 3015 GD Rotterdam. Países Bajos.
Correo electrónico: p.w.j.c.serruys@erasmusmc.nl