El síndrome cardiorrenal se ha definido como la disfunción simultánea de corazón y riñón. El empeoramiento de la función renal en pacientes con insuficiencia cardiaca aguda se ha clasificado como síndrome cardiorrenal tipo 1. En este contexto, el empeoramiento de la función renal es un hecho frecuente y se produce como resultado de procesos fisiopatológicos complejos, multifactoriales y no del todo conocidos, que incluyen factores hemodinámicos (hipoperfusión arterial renal y congestión venosa renal) y no hemodinámicos. Tradicionalmente, el empeoramiento de la función renal se ha asociado a peor pronóstico; sin embargo, algunas observaciones han puesto de manifiesto unos resultados diversos y heterogéneos, y tal vez ello sugiera que un mismo fenotipo puede corresponder a diversas situaciones fisiopatológicas y clínicas. La interpretación de la magnitud y la cronología de las alteraciones renales junto con la situación basal de la función renal, el estado de sobrecarga de líquidos y la respuesta clínica al tratamiento podrían ser útiles para establecer la trascendencia clínica de las alteraciones de la función renal que se producen durante un episodio de descompensación de la insuficiencia cardiaca. En este artículo se presenta una revisión crítica de la evidencia actual sobre la fisiopatología y los aspectos clínicos del empeoramiento de la función renal en la insuficiencia cardiaca aguda.
Palabras clave
La insuficiencia cardiaca (IC) es la primera causa de hospitalización en las personas de edad igual o superior a 65 años y es la causa de un porcentaje sustancial del total de ingresos hospitalarios y de los costes de la asistencia sanitaria1. La IC es un síndrome complejo que afecta a casi todos los órganos y sistemas del organismo. La disfunción renal es una de las comorbilidades más importantes en los pacientes con IC crónica y se acentúa o se hace más evidente durante los episodios de insuficiencia cardiaca aguda (ICA)2–4. La asociación entre el corazón y el riñón en los pacientes con ICA es compleja, y no se ha esclarecido por completo esta interacción bidireccional5,6. En el contexto de la ICA, el empeoramiento de la función renal (EFR) es un trastorno prevalente que se da en un 10-40% de los pacientes. A pesar de su alta prevalencia, el EFR continúa comportando un verdadero reto para el diagnóstico, el pronóstico y el tratamiento2–4. En este artículo se presenta una revisión crítica de la fisiopatología y las implicaciones clínicas del EFR en la ICA, sobre todo por lo que respecta a revisar antiguos paradigmas.
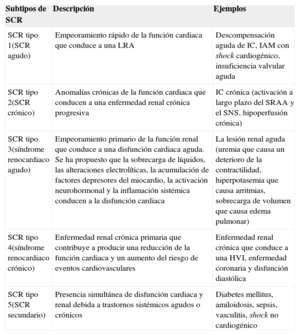
DEFINICIÓNEl síndrome cardiorrenal (SCR) se ha definido como la disfunción simultánea del corazón y los riñones, con independencia de cuál de estos 2 órganos haya sufrido la lesión inicial y su estado funcional previo6. Este síndrome ha sido clasificado desde un punto de vida académico por el grupo de trabajo Acute Dialysis Quality Initiative, que propone un esquema de clasificación de 5 subtipos5,6. Esta clasificación en 5 apartados se basa en lo siguiente: a) si el órgano que presenta la disfunción inicial es el corazón, el riñón o un tercer proceso independiente que afecta a ambos órganos, y b) el carácter agudo o crónico de la enfermedad. En la tabla 1 se resumen los 5 subtipos actuales del SCR.
Clasificación y definición del síndrome cardiorrenal
| Subtipos de SCR | Descripción | Ejemplos |
|---|---|---|
| SCR tipo 1(SCR agudo) | Empeoramiento rápido de la función cardiaca que conduce a una LRA | Descompensación aguda de IC, IAM con shock cardiogénico, insuficiencia valvular aguda |
| SCR tipo 2(SCR crónico) | Anomalías crónicas de la función cardiaca que conducen a una enfermedad renal crónica progresiva | IC crónica (activación a largo plazo del SRAA y el SNS, hipoperfusión crónica) |
| SCR tipo 3(síndrome renocardiaco agudo) | Empeoramiento primario de la función renal que conduce a una disfunción cardiaca aguda. Se ha propuesto que la sobrecarga de líquidos, las alteraciones electrolíticas, la acumulación de factores depresores del miocardio, la activación neurohormonal y la inflamación sistémica conducen a la disfunción cardiaca | La lesión renal aguda (uremia que causa un deterioro de la contractilidad, hiperpotasemia que causa arritmias, sobrecarga de volumen que causa edema pulmonar) |
| SCR tipo 4(síndrome renocardiaco crónico) | Enfermedad renal crónica primaria que contribuye a producir una reducción de la función cardiaca y un aumento del riesgo de eventos cardiovasculares | Enfermedad renal crónica que conduce a una HVI, enfermedad coronaria y disfunción diastólica |
| SCR tipo 5(SCR secundario) | Presencia simultánea de disfunción cardiaca y renal debida a trastornos sistémicos agudos o crónicos | Diabetes mellitus, amiloidosis, sepsis, vasculitis, shock no cardiogénico |
HVI: hipertrofia ventricular izquierda; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; LRA: lesión renal aguda; SCR: síndrome cardiorrenal; SNS: sistema nervioso simpático; SRAA: sistema renina-angiotensina-aldosterona.
Aunque esta clasificación constituye un nuevo avance en el esfuerzo por comprender la complejidad de la interacción cardiorrenal, su aplicación en la práctica clínica no resulta fácil. Así pues son necesarias nuevas propuestas para diferenciar y clasificar mejor los tipos de SCR. Los párrafos que siguen se centrarán en el EFR que se produce en el contexto de una descompensación de ICA de una IC crónica o de una IC de nueva aparición (SCR tipo 1).
Tradicionalmente, la lesión renal aguda (LRA) en los pacientes con ICA se define por el EFR durante la hospitalización, lo cual se ha definido en términos generales como una alteración de la creatinina sérica que va de ≥ 0,3 a 0,5mg/dl4. No obstante, esta definición no alcanza un consenso universal7. De hecho parece haber un notable desacuerdo entre las directrices para la IC y las de nefrología respecto a cuáles son los mejores criterios para definir el EFR7–10.
Además, las definiciones actuales de la LRA, en su mayor parte, se han validado en escenarios en los que no había IC. En la tabla 2 se resumen diversas definiciones actuales de la LRA que incluyen las de RIFLE8(Risk, Injury, Failure, Loss of Kidney Function, and End-stage Kidney Disease), AKIN9, KDIGO10 y los criterios de EFR.
| Definición | Criterios de creatinina sérica | Periodo mínimo para que se produzca la LRA |
|---|---|---|
| RIFLE8 | • Riesgo: aumento de la CrS ≥ 1,5 veces el valor basal o disminución del FGe ≤ 25%• Lesión: aumento de CrS ≥ 2,0 veces el valor basal o disminución del FGe ≥ 50%• Fallo: aumento de la CrS ≥ 3,0 veces el valor basal o disminución del FGe ≥ 75% o bien una cifra absoluta de CrS ≥ 4 mg/dl (≥ 354μmol/l) con un aumento agudo de al menos 0,5 mg/dl (44μmol/l) | Cambios de la CrS a lo largo de 1-7 días, mantenidos durante más de 24 h |
| AKIN9 | • Estadio 1: aumento de la CrS de 0,3 mg/dl (≥ 26,2μmol/l) o aumento hasta un valor ≥ 150-199% (1,5 a 1,9 veces) respecto al valor basal• Estadio 2: aumento de la CrS hasta el 200-299% (≥ 2 a 2,9 veces) respecto al valor basal• Estadio 3: aumento de la CrS hasta el 300% (≥ 3 veces) respecto al valor basal o CrS ≥ 4 mg/dl (≥ 354μmol/l) con una elevación aguda ≥ 0,5 mg/dl (44μmol/l) o aparición de TSR | Cambios agudos de la CrS que se producen en un periodo de 48 h durante una hospitalización |
| KDIGO10 | • Estadio 1: ≥ 1,5 veces el valor basal o aumento de 0,3 mg/dl• Estadio 2: ≥ 2 veces el valor basal• Estadio 3: ≥ 3 veces el valor basal o aumento de la CrS a ≥ 4,0 mg/dl | La definición de la LRA requiere que se haya producido un cambio de la CrS ≥ 1,5 veces el valor basal en un plazo de 7 días, o bien debe producirse un aumento de 0,3 mg/dl de la CrS en un periodo de 48 h |
| EFR | • Aumento de la CrS respecto al valor basal ≥ 0,3 mg/dl (26,5μmol/l) | El cambio de la CrS puede producirse en cualquier momento durante el ingreso |
AKIN, Acute Kidney Injury Network; CrS: creatinina sérica; EFR: empeoramiento de la función renal; FGe: filtración glomerular estimada; KDIGO, Kidney Disease: Improving Global Outcomes; LRA: lesión renal aguda; RIFLE, Risk, Injury, Failure, Loss of Kidney Function, and End-stage Kidney Disease; TSR: terapia sustitutiva renal.
Tal vez, esta discrepancia en los criterios de la LRA en la ICA se haya visto alimentada por las vías fisiopatológicas complejas y multifactoriales subyacentes y también por las diferencias en las poblaciones utilizadas en los distintos estudios. Todos estos factores en conjunto explican las diferencias más importantes en la epidemiologia y las implicaciones clínicas de las alteraciones de la función renal que se observan entre los distintos estudios (tabla 3)11–28.
Definición, incidencia y consecuencias pronósticas del empeoramiento de la función renal en la insuficiencia cardiaca aguda
| Autores | Definición del EFR | Incidencia de EFR | Conclusiones |
|---|---|---|---|
| Mullens et al11 | Aumento de la CrS ≥ 0,3 mg/dl | El 40% de los pacientes ingresados por ICA | La congestión venosa es el factor hemodinámico más importante que conduce al EFR en los pacientes con una descompensación de una IC avanzada |
| Metra et al12 | Aparición de un aumento de la CrS ≥ 25% o ≥ 0,3 mg/dl | El 34% de los pacientes ingresados por ICA | El EFR es una observación frecuente en los pacientes hospitalizados por ICA y se asocia a un mal pronóstico. La gravedad de la IC y la dosis diaria de furosemida son los factores predictivos más importantes para la aparición de un EFR |
| Damman et al13 | Aumento de la CrS > 26,5μmol/l y > 25% | Durante la hospitalización, el EFR se produjo en un 11% de los pacientes, mientras que un 16 y un 9%, respectivamente, presentó un EFR entre los 0 y los 6 meses y entre los 6 y los 12 meses después del alta | Tanto el EFR intrahospitalario como el extrahospitalario muestran una relación independiente con el mal pronóstico en los pacientes con IC, lo cual sugiere que en los pacientes con IC debe realizarse una vigilancia de la función renal durante mucho tiempo después del alta |
| Forman et al14 | Aumento de la CrS > 0,3 mg/dl (26,5μmol/l) | El 27% de los pacientes ingresados por ICA | El EFR se produce con frecuencia en los pacientes con IC hospitalizados, y se asocia a una evolución significativamente peor. Las características clínicas disponibles en el momento del ingreso en el hospital pueden usarse para identificar a los pacientes con un mayor riesgo de presentar un EFR |
| Voors et al15 | Aumento de la CrS ≥ 0,3 mg/dl al llegar al día 5 tras el ingreso | El 30% de los pacientes ingresados por ICA | El empeoramiento de la función renal en los pacientes con ICA hospitalizados está relacionado con una mala evolución clínica y puede predecirse por una mayor reducción temprana de la PAS |
| Akhter et al16 | Aumento de la CrS ≥ 0,5 mg/dl | El 24,8% de los pacientes ingresados por ICA | Un aumento de la CrS en el hospital da lugar a una prolongación significativa de la duración de la estancia en el hospital y tiene un efecto independiente sobre la mortalidad a largo plazo |
| Chittineni et al17 | Aumento de la CrS de 0,5 mg/dl | El 21% de los pacientes ingresados por ICA | La IRA es una complicación frecuente en los pacientes hospitalizados por IC congestiva y se asocia a un aumento del riesgo de evolución clínica adversa. Determinadas características clínicas presentes en el momento del ingreso son útiles para identificar a los pacientes de riesgo elevado |
| Gottlieb et al18 | Diversas definiciones del empeoramiento de la función renal | El 72% de los pacientes presentó un aumento de la CrS durante la hospitalización, y un 20% de ellos desarrolló un aumento de ≥ 0,5 mg/dl | Este análisis pone de relieve que toda disminución detectable de la función renal se asocia a un aumento de la mortalidad y a una estancia prolongada en el hospital. Esto sugiere que las intervenciones terapéuticas que mejoran la función renal podrían tener efectos beneficiosos |
| Aronson y Burger19 | Aumento de la CrS ≥ 0,5 mg/dl por encima del valor basal en cualquier momento.Persistente cuando laCrS se mantuvo envalores ≥ 0,5 mg/dl por encimadel basal durante todo el periodo transcurrido hasta el día 30, y transitoria cuando los valores de CrS disminuyeron luego hasta un valor<0,5 mg/dl por encima de la cifra basal | Se produjo un EFR en 115 pacientes (n=467), y fue transitorio en 39 pacientes (33,9%) | El EFR transitorio es frecuente en los pacientes con ICA. Mientras que el EFR persistente predice un aumento de la mortalidad, el EFR transitorio parece asociarse a una mejor evolución en comparación con la insuficiencia renal persistente |
| Cowie et al20 | Aumento de la CrS > 26μmol/l (aproximadamente 0,3 mg/dl) desde el momento del ingreso | El 29% de los pacientes ingresados por ICA con antecedentes de una FEVI ≤ 40% | El EFR es frecuente en los pacientes ingresados en hospitales europeos por una descompensación de la IC. Estos pacientes tienen ingresos hospitalarios más largos, pero con una tasa de mortalidad y de rehospitalizaciones similar a la de los pacientes sin EFR (si se excluye a los pacientes que sufren una complicación intrahospitalaria grave) |
| Blair et al21 | Aumento de la CrS ≥ 0,3 mg/dl durante el periodo de hospitalización (asignación aleatoria al alta o el día 7) y el periodo posterior al alta (alta o entre 7 días y 4 semanas después del alta) | El 13,8% en los pacientes hospitalizados y 11,9% en los pacientes después del alta con reducción de la FEVI (≤ 40%) | La prevalencia de la disfunción renal es alta en los pacientes hospitalizados por una IC. El empeoramiento de la función renal puede producirse no tan solo durante la hospitalización, sino también en el periodo inmediato posterior al alta. Dado que el empeoramiento de la función renal durante la hospitalización se asocia a una disminución significativa de los signos y síntomas de congestión, el peso corporal y los péptidos natriuréticos, que son buenos indicadores pronósticos, deberá volver a evaluarse el empeoramiento de la función renal durante la hospitalización como variable de valoración en los ensayos clínicos |
| Krumholz et al22 | Aumento de la CrS > 0,3 mg/dl durante la hospitalización | El 28% de los pacientes ingresados por ICA | El EFR, que se produce con frecuencia en pacientes ancianos hospitalizados por una IC, comporta una carga sustancial para los pacientes y para el sistema de asistencia sanitaria y puede predecirse mediante 6 características evaluables al ingreso |
| Kociol et al23 | Aumento de la CrS ≥ 0,3 mg/dl | El 17,8% de los pacientes de edad ≥ 65 años hospitalizados por una IC dados de alta con vida | El EFR en los pacientes hospitalizados por una IC se asoció de manera independiente a la mortalidad a largo plazo |
| Damman et al24 | Aumento de laCrS ≥ 0,2 mg/dl o unadisminución correspondiente de la FGe ≥ 5 ml × min × 1,73 m2 | Se produjo un EFR en el 25% de los pacientes | El EFR predice unas tasas de mortalidad y hospitalización sustancialmente superiores en los pacientes con IC |
| Klein et al25 | Disminución > 25% de la FGe o aumento > 25% del BUN | En el momento del alta, un 12% de los pacientes presentaba una disminución de la FGe > 25% y un 39% mostraba un aumento del BUN > 25% | Un número sustancial de pacientes ingresados por una IC presenta un empeoramiento de la función renal durante la hospitalización. Un valor más alto del BUN al ingreso y un BUN creciente durante la hospitalización, con independencia de los valores existentes al ingreso, se asocian a una peor tasa de supervivencia. El uso de milrinona en esos pacientes de alto riesgo no mejora los resultados a pesar de una mejoría de carácter menor en la función renal |
| Testani et al26 | La MFR se definió como una mejoría de la FGe ≥ 20% y el EFR como un deterioro ≥ 20% | El 31,4% de los pacientes presentó una MFR | La MFR se asocia a una supervivencia significativamente peor y puede reflejar la resolución del EFR previo al ingreso inducido por la congestión venosa. A diferencia del EFR, la disfunción renal en los pacientes con MFR se produce de manera independiente de los efectos de confusión causados por la descongestión aguda y pueden aportar una información adicional para el estudio de las interacciones cardiorrenales |
| Smith et al27 | Diferentes definiciones del EFR (elevaciones de los valores absolutos de creatinina ≥ 0,1 a ≥ 0,5 mg/dl y elevación relativa de un 25% respecto al valor basal) | Se produjo una elevación de la CrS ≥ 0,1 mg/dl en el 75% de los pacientes, y hubo una elevación ≥ 0,5 mg/dl en el 24% de los pacientes | Las elevaciones más pronunciadas de la creatinina predicen el máximo riesgo de muerte, si bien los cambios incluso de carácter menor de la función renal se asocian a una evolución adversa. La elección de la «mejor definición» del EFR tiene repercusiones en cuanto al número de pacientes en los que se identifica este factor de riesgo y la magnitud del riesgo de mortalidad |
| Belziti et al28 | Aumento de la CrS > 0,3 mg/dl y, además, de al menos un 25% respecto al valor basal durante la hospitalización | El 23% de los pacientes presentó un EFR | El EFR es una complicación frecuente en los pacientes con ICA y se asocia a una estancia más prolongada en el hospital y a un aumento del riesgo de mortalidad o reingresos por IC |
BUN: nitrógeno de urea en sangre; CrS: creatinina sérica; EFR: empeoramiento de la función renal; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtración glomerular estimada; IC: insuficiencia cardiaca; ICA: insuficiencia cardiaca aguda; IRA: insuficiencia renal aguda; MFR: mejoría de la función renal; PAS: presión arterial sistólica.
La insuficiencia renal crónica es extraordinariamente frecuente en los pacientes con IC, y su prevalencia oscila entre el 20 y el 57% en los pacientes con IC crónica estable y entre el 30 y el 67% en los registros amplios de pacientes con ICA29. En los pacientes ingresados por una ICA, la frecuencia del EFR se sitúa entre el 10 y el 40%2–4,11–28. Como se ha mencionado antes, esta amplia variabilidad puede atribuirse, al menos en parte, a las diferencias en los valores de corte utilizados para definir el EFR, las diferencias en el periodo en riesgo, las características distintas de la población en estudio y los grados de exactitud diagnóstica diversa que tienen los métodos disponibles.
Hay varios factores de riesgo que se han asociado a la aparición de un EFR, como son la edad13,15,17, el sexo masculino13, la insuficiencia renal previa conocida12–15,17–19,21,22,28, la diabetes mellitus13,14,17,22, antecedentes previos de IC30, antecedentes previos de EFR31, la presión arterial sistólica alta o baja, una disminución significativa de la presión arterial sistólica13–15,22, la fibrilación auricular20, el sodio en suero bajo17, la disfunción diastólica17, el edema pulmonar13,20, la dosis de furosemida12 o el bloqueo secuencial de la nefrona con el empleo combinado de diuréticos del asa y tiazidas32. Es de destacar que la fracción de eyección ventricular izquierda no constituye un factor de riesgo bien establecido para la aparición de un EFR33.
FISIOPATOLOGÍALos mecanismos fisiopatológicos responsables del SCR tipo 1 son complejos, multifactoriales y no del todo conocidos. Se ha propuesto la existencia de un desajuste entre una activación neurohormonal hemodinámica anormal, respuestas inflamatorias, un daño tubular intrínseco y una respuesta heterogénea a las intervenciones terapéuticas6,34.
Mecanismos hemodinámicosBajo gasto cardiaco-hipoperfusión renalExisten diversos datos experimentales y clínicos que indican que la hemodinámica desempeña un papel importante, si no el más importante de todos, en la fisiopatología del SCR tipo 1. Tradicionalmente, el EFR se ha atribuido a la hipoperfusión del riñón a causa del bajo gasto cardiaco14. La reducción del gasto cardiaco y la redistribución central de los líquidos son el preludio de una disminución de la perfusión renal. Como mecanismos de compensación, la estimulación del sistema nervioso simpático, el sistema renina-angiotensina-aldosterona y la secreción de vasopresina conducen a una intensificación de la reabsorción de sodio y agua, en un intento de preservar la perfusión renal y el filtrado glomerular (FG); sin embargo, a largo plazo, este tipo de respuesta induce efectos nocivos en el corazón y el riñón al fomentar la fibrosis, la apoptosis y el remodelado ventricular35. Además, la hipoperfusión persistente puede conducir a una isquemia del parénquima/la cortical, que de por sí puede comprometer en mayor medida la función renal35.
La interpretación actual reconoce que el bajo gasto cardiaco puede explicar tan solo una parte menor de la patogenia del SCR tipo 1, y no parece ser el factor determinante principal del EFR en la práctica clínica diaria. En los registros amplios, la proporción de pacientes con un perfil «frío» o hipotensión al ingreso es relativamente baja36,37. De igual modo, las reducciones importantes de la presión arterial sistólica relacionadas con un EFR no se observan con tanta frecuencia en la práctica clínica habitual15. En este sentido, los resultados del ensayo ESCAPE38 no mostraron correlación alguna entre el EFR y el índice cardiaco o los valores de las resistencias vasculares sistémicas38. De igual modo, Mullens et al11 señalaron que los pacientes que desarrollaban un EFR no tenían un índice cardiaco al ingreso inferior al de los pacientes que no presentaron un EFR. Considerada en conjunto, la mayor parte de la evidencia actual no respalda que el bajo gasto cardiaco sea el factor determinante principal del EFR en los pacientes con ICA.
Sobrecarga de líquidos-congestión venosa renalHace ya algunas décadas, los investigadores experimentales demostraron que la elevación transitoria aislada de la presión venosa central (PVC) reducía el flujo sanguíneo renal y el FG39,40. Winton observó que la diuresis producida por un riñón de perro aislado se reducía notablemente a una presión venosa renal de 20mmHg y quedaba completamente abolida a presiones>25mmHg40. En uno de los primeros experimentos realizados en individuos normales, el hecho de alcanzar una presión intraabdominal de 20mmHg mediante una compresión abdominal redujo de manera notable el FG41. En estudios recientes, estos datos experimentales históricos se han trasladado a la práctica clínica actual, en la que se ha descrito una asociación entre los valores elevados de la presión venosa y el EFR, que parece ser superior al efecto de la presión arterial, el índice cardiaco o la presión capilar pulmonar enclavada como factor predictivo del SCR tipo 111,42,43. Los mecanismos que se han propuesto para explicar estos resultados incluyen los siguientes: a) el aumento de la presión a lo largo de las venas renales reduce el gradiente de presión existente a lo largo del glomérulo, con lo que reduce el FG; b) el aumento a que ello da lugar en la presión intersticial renal puede conducir a una compresión tubular, hipoxia del parénquima3 y una reducción adicional del FG, y c) la compresión extrínseca (p. ej., el aumento de la presión abdominal) de las venas renales y el parénquima deteriora también, según se ha demostrado, la función renal3,5,6,11,42,43.
Sin embargo, el EFR asociado a una presión venosa elevada no ha sido una observación constante38,44,45 y otros estudios experimentales y clínicos sugieren que las elevaciones de la PVC adquieren una gran trascendencia, sobre todo en situaciones en las que la hemodinámica es notablemente anormal. En un modelo animal de la hipertensión venosa renal, el FG se redujo tan solo cuando había de forma simultánea un deterioro del gasto cardiaco46. De igual modo, en estudios clínicos recientes se ha señalado que la PVC fue un factor predictivo independiente para el EFR, pero sobre todo cuando había un bajo gasto cardiaco11,44. Estos resultados, aparentemente contradictorios, pueden reflejar la naturaleza multifactorial de esta interacción. Es preciso resaltar que la PVC no es un indicador sustitutivo fiable de la sobrecarga de líquidos, ya que el sistema de presión venosa muestra una baja correlación con el volumen47. La gran elasticidad del sistema venoso facilita una desconexión relativa de la presión respecto al volumen, por lo que cambios importantes del volumen se asocian a cambios tan solo pequeños de la presión. Además, la presión venosa viene determinada por la combinación del volumen con el tono venoso. El tono venoso se produce, fundamentalmente, por una activación neurohormonal, con lo que la PVC no depende tan solo del volumen sino también de la respuesta neurohormonal sistémica desencadenada47. Esto podría explicar por qué algunos autores no han podido demostrar una correlación significativa entre la PVC y las medidas del estado del volumen48, y por qué la presión auricular derecha y sus cambios no fueron un indicador indirecto fiable de la magnitud de la descongestión en la ICA y, por tanto, no predecía mal el riesgo de EFR49. Aunque no se dispone de parámetros indicadores sustitutivos fiables de la congestión sistémica se ha evaluado, con este fin, la impedancia bioeléctrica o biomarcadores como el antígeno carbohidrato 125 y los resultados han sido alentadores50,51. Parece claro que son necesarios nuevos estudios en este campo. Con objeto de caracterizar mejor el papel que desempeña la congestión en la fisiopatología del SCR, es necesaria una evaluación exhaustiva del estado de hidratación tras el ingreso de un paciente por ICA.
Activación neurohormonal y actividad simpáticaHay varias vías neurohormonales e inflamatorias que están involucradas en la fisiopatología de la disfunción renal en la ICA35. La activación del sistema renina-angiotensina-aldosterona tiene como finalidad mantener el FG en situaciones de hipoperfusión aguda; no obstante, su estimulación de modo persistente desempeña un papel clave en la lesión renal producida a través de una hipertrofia celular, una estimulación de la fibrosis, un estrés oxidativo y una activación de mecanismos inflamatorios52. La angiotensina II es un potente vasoconstrictor sistémico que fomenta la constricción arteriolar, con lo que reduce el flujo sanguíneo renal, y estimula el sistema nervioso simpático. El sistema nervioso simpático aumenta el tono vascular sistémico y tiene efectos indeseables directos en el corazón y en el riñón, al fomentar la apoptosis y la fibrosis52. La estimulación de los receptores adrenérgicos en las células de los túbulos proximales potencia la reabsorción de sodio, mientras que los receptores adrenérgicos situados en el aparato yuxtaglomerular estimulan en mayor medida el sistema renina-angiotensina-aldosterona. La secreción de aldosterona provoca una retención hidrosalina, y ello contribuye a producir el edema y la congestión6,52. Además se ha descrito también un componente neurohormonal del sistema renina-angiotensina-aldosterona intrarrenal que modula intrínsecamente la función renal3.
Además, la actividad simpática elevada es un factor desencadenante reconocido en la descompensación de la IC, y ello se refleja en la observación de que es la redistribución del volumen intravascular, y no el cambio de la cantidad total de sal o agua, lo que constituye una fuerza impulsora importante, sin que haya un aumento del líquido corporal total ni del aumento de peso previo6,53. Por ejemplo, Fallick et al53 afirman que los cambios agudos en la capacitancia venosa vascular esplácnica regulada por el tono simpático pueden dar lugar a una translocación brusca del volumen hacia la zona circulatoria efectiva, causando una hipertensión venosa central aguda.
Respuesta inflamatoriaHay varios estudios que han respaldado el concepto de que la IC es un escenario de alteración de la regulación inmunitaria54. Se han documentado elevaciones de las citocinas y de otros marcadores de la inflamación en pacientes con ICA55. Se ha propuesto que las citocinas inflamatorias, como el factor de necrosis tumoral-α, desempeñan un papel en la retención de sodio, la disfunción miocárdica, la LRA, la disfunción vascular y la sobrecarga de líquidos extravascular6. Además, la inflamación parece asociarse en gran medida a unas presiones de perfusión renal insuficientes, edema peritubular, reducción patológica del FG y lesión tubular (añadida al efecto de la isquemia)6. En un modelo experimental humano de la congestión venosa, Colombo et al56 han puesto de manifiesto recientemente que, en los individuos normales, la congestión venosa periférica causa de por sí una liberación de mediadores inflamatorios, neurohormonas, y una activación de las células endoteliales.
Lesión tubular intrínsecaSe han propuesto diferentes mecanismos para explicar la generación de un daño tubular intrínseco en la ICA. Probablemente, los más importantes son la disminución de la perfusión local y las presiones venosas elevadas, que dan lugar a una isquemia y unas presiones intersticiales intrarrenales elevadas57. En los últimos años se han explorado nuevos marcadores del daño tubular sensibles y específicos, como la lipocalina asociada a gelatinasa de neutrófilos (NGAL), en la IC, y se ha observado que este marcador de la lesión tubular aparece en la orina y en el plasma mucho antes de que aumente la creatinina sérica58. En una cohorte de 2011, pacientes con IC crónica, Damman et al59 han demostrado recientemente que los marcadores del daño tubular están estrechamente asociados al riesgo de EFR. La presencia de los marcadores de la lesión tubular en el contexto crónico podría reflejar una hipoxia renal crónica y un aumento de la vulnerabilidad a los cambios hemodinámicos y las respuestas neurohormonales que aparecen en las descompensaciones de la IC. Todavía no se conoce bien de qué modo estos episodios de LRA pueden causar un daño en las unidades de nefronas y conducir, por tanto, a una futura disfunción renal y/o a resultados adversos.
Intervenciones terapéuticasLos diuréticos del asa se utilizan de manera casi universal para el alivio de la congestión y para mejorar los síntomas en la IC, y continúan siendo la piedra angular del tratamiento durante las descompensaciones de la IC. Sin embargo existe cierta preocupación respecto a su perfil de seguridad, debido a su asociación con una activación neurohormonal nociva, disfunción renal e incluso una mala evolución clínica6,60. En la ICA, la respuesta clínica individual a los diuréticos y su efecto sobre la función renal son muy heterogéneos61. El EFR inducido por un tratamiento diurético intensivo puede ser consecuencia de varias situaciones fisiopatológicas y clínicas. De hecho se ha sugerido que esta arma de doble filo sobre la función renal viene determinada, en gran parte, por un delicado equilibrio entre la perfusión renal y la congestión venosa62,63. Por lo que respecta a los efectos nocivos, estos pueden dar lugar a una depleción del volumen intravascular, una reducción de la perfusión renal y un deterioro de la función renal. En el aspecto beneficioso, los diuréticos del asa pueden reducir la congestión venosa y, por consiguiente, proporcionar una mejora del FG62,63.
Además, algunos estudios recientes han sugerido que, al menos en algunos pacientes, el EFR podría ser un indicador indirecto de la hemoconcentración aparecida después de una descongestión enérgica, y podría asociarse, al menos de manera transitoria, con un mejor resultado clínico64–67. En el ensayo DOSE (Diuretic Optimization Strategies Evaluation), un EFR transitorio con el empleo de diuréticos a dosis altas se asoció a una mejoría clínica temprana y no comportó un peor pronóstico a los 60 días65. En 599 pacientes con ICA consecutivos, Metra et al66 observaron que el valor pronóstico del EFR venía dado, principalmente, por la presencia de congestión; en ausencia de congestión, los aumentos de los valores de creatinina sérica no tuvieron valor pronóstico alguno; en cambio, el EFR mostró una asociación intensa con un mayor riesgo de evolución adversa en los pacientes con una congestión persistente. De igual modo, en un análisis del ensayo ESCAPE, Testani et al67 pusieron de manifiesto que la hemoconcentración se asociaba al EFR y a una mejor evolución clínica. Estos datos sugieren que los diuréticos en dosis altas tienen efectos beneficiosos en una situación de sobrecarga de volumen, pero pueden ser peligrosos en los pacientes con una sobrecarga de líquidos leve o una redistribución de los líquidos. En resumen, este efecto bimodal de los diuréticos sobre la función renal resalta la heterogeneidad de los síndromes de ICA y pone de relieve la importancia de una determinación exacta de la sobrecarga de líquidos para ajustar de manera individualizada la dosis de diuréticos.
IMPLICACIONES CLÍNICASDiagnósticoCreatinina y ureaLos marcadores tradicionales de la función renal, como la creatinina sérica o el nitrógeno ureico en sangre, se han utilizado clásicamente como indicadores indirectos de la función renal, pero se han planteado varios motivos de preocupación respecto a su utilidad, sobre todo en las descompensaciones de la IC64–69. La creatinina sérica se emplea de manera casi universal, pero se ve influida por factores extrarrenales importantes, como la masa muscular, el sexo, la edad y la raza. La creatinina sérica infravalora la función renal en las personas de mayor edad y en las mujeres, así como en los individuos con un peso bajo, lo cual corresponde a un perfil que se da con frecuencia en los pacientes con ICA. En cambio, los cambios de la creatinina sobrevaloran la lesión renal cuando ya existe una disfunción renal70. Además se sabe que la creatinina es un marcador que se eleva tardíamente tras la LRA (está aumentada hasta 24h después de la lesión renal) y ello constituye otra limitación importante69. Como se ha mencionado antes, un aumento de la creatinina puede producirse como consecuencia de la hemoconcentración, incluso en ausencia de todo daño renal, como suele ocurrir a menudo en pacientes con ICA a los que se administra un tratamiento diurético intensivo64–67.
De igual modo, los valores de urea también se ven influidos de manera sustancial por la activación neurohormonal, el consumo de proteínas y los procesos catabólicos. La activación del sistema renina-angiotensina-aldosterona eleva la reabsorción de la urea en el túbulo proximal, y este proceso está ligado a la reabsorción de sodio y agua, mientras que los valores de vasopresina potencian la captación en el túbulo colector a través de la activación de transportadores de urea29. En consecuencia, los valores de urea reflejan una activación persistente e inapropiada del sistema renina-angiotensina-aldosterona y la vasopresina en la IC, y no necesariamente estan relacionados con una disminución del FG71. Estos inconvenientes en la utilidad de los marcadores clásicos de la función renal han estimulado la búsqueda de otros indicadores de la función renal más específicos y exactos, como la cistatina C, y de nuevas fórmulas para el cálculo del FG, como la del estudio Modification of Diet in Renal Disease Study o la de la Chronic Kidney Disease Epidemiology Collaboration, que parece proporcionar una evaluación más exacta de la función renal en la IC70.
Nuevos biomarcadoresDaño glomerular. La cistatina C, que ha surgido como nuevo marcador del daño molecular, es una proteína de 122 aminoácidos y 13 kDa, que forma parte de la familia de los inhibidores de la cisteína proteinasa, y está producida por todas las células nucleadas a un ritmo constante. Su superioridad respecto a los demás marcadores de la función renal radica en el hecho de que es filtrada libremente por el glomérulo y no se secreta, aun cuando sí presenta una ligera reabsorción por parte de las células tubulares, en las que se cataboliza. A diferencia de la creatinina y el nitrógeno ureico en sangre, la cistatina A es independiente de la masa muscular, el consumo de proteínas o el catabolismo, y este es el motivo por el que se ha propuesto su empleo como marcador más específico y exacto del FG52. En la ICA se ha demostrado que sus valores al ingreso muestran una asociación independiente con la mortalidad y con los reingresos hospitalarios72. Tiene interés señalar que la evidencia reciente respalda la utilidad pronóstica a largo plazo de este biomarcador más allá de lo que aporta el FG, especialmente en los pacientes con IC con una disfunción renal moderada (FG, 30-60ml/min/1,73 m2)73. Serán necesarios nuevos datos sobre la utilidad clínica de la cinética de la cistatina C en los pacientes con ICA.
Marcadores del daño tubular. La necesidad clínica de un diagnóstico temprano y más exacto de la LRA ha impulsado la investigación para explorar el uso de nuevos biomarcadores relacionados con la lesión tubulointersticial, como la NGAL, la molécula de lesión tubular renal 1 y la N-acetil-β-D-glucosaminidasa, que pueden aportar un diagnóstico temprano del daño tubular en diferentes escenarios clínicos52. La NGAL es una proteína de 178 aminoácidos que forma parte de la familia proteica de la lipocalina. En circunstancias normales, tan solo puede identificarse en el plasma y en la orina una cantidad pequeña de NGAL. Sin embargo, en respuesta a una LRA, la NGAL es liberada con gran rapidez (en un plazo de 2h), con lo que sus concentraciones aumentan de forma drástica52. La utilidad de la NGAL para el diagnóstico de la LRA y como marcador pronóstico se ha resaltado en un metanálisis74. Se ha demostrado que la NGAL es un marcador más sensible y específico que la creatinina para el diagnóstico de la LRA en diferentes escenarios, incluida la ICA58,75. Además, la NGAL en el suero y también en la orina muestra una intensa asociación con la mortalidad o el reingreso hospitalario en la ICA y la IC y crónica, lo cual constituye un valor añadido de este parámetro, que va más allá del que aportan los péptidos natriuréticos y otros índices renales76–78.
La molécula de lesión tubular renal 1 es una glucoproteína transmembranaria de tipo 1 que interviene en la conversión de las células en fagocitos y desempeña un papel en la respuesta inmunitaria a la lesión. Se trata de un nuevo marcador del daño tubular proximal59, que se determina en la orina y solamente está presente en situaciones patológicas. En una cohorte de 2011 pacientes con IC crónica, Damman et al59 han puesto de relieve recientemente que la molécula de lesión tubular renal 1 fue el marcador tubular más potente para la predicción del EFR, con unos resultados superiores a los de la NGAL o la N-acetil-β-D-glucosaminidasa y, además, los pacientes con un aumento de los valores urinarios de molécula de lesión tubular renal 1 presentan una disminución significativamente más rápida del FG a lo largo del tiempo59.
La N-acetil-β-D-glucosaminidasa es una enzima del borde en cepillo lisosómico liberada por las células del túbulo proximal renal a la orina cuando se ha producido una lesión tubular52. Junto con la molécula de lesión tubular renal 1 puede determinarse tan solo en la orina y se asocia a una evolución adversa, de manera independiente del FG59. Sin embargo, aunque tanto la molécula de lesión tubular renal 1 como la N-acetil-β-D-glucosaminidasa se han evaluado en diversos trastornos clínicos agudos, todavía no se dispone de una evidencia sólida respecto a su utilidad en el contexto de las descompensaciones de la IC. Otros futuros biomarcadores que se encuentran en fase de investigación, y que podrían estar asociados al SCR tipo 1, son la interleucina 18, la proteína de fijación de ácidos grasos de tipo hepático, la osteopontina, el factor derivado de células de estroma 1, la galectina 3, la endoglina y los exosomas.
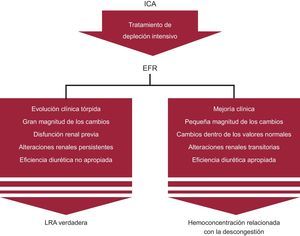
Evaluación del riesgoClásicamente se ha observado que la aparición de un EFR en el contexto de una IC crónica y una ICA se asocia a un pronóstico adverso2–4. Globalmente, el EFR en el contexto de una ICA se ha asociado a unos costes de hospitalización superiores, una estancia más prolongada en el hospital y una peor evolución clínica2,4,29. En la tabla 3 se resumen los estudios más relevantes y los resultados pronósticos obtenidos. Un reciente metanálisis de 28 estudios (49.890 pacientes con ICA) señaló que un 23% de los pacientes presentó un EFR, según la definición específica utilizada en cada uno de los estudios (y que difería de un estudio a otro)4. Después de una media de seguimiento de 418±594 días, el EFR se asoció a un aumento del riesgo de mortalidad (odds ratio: 1,75; intervalo de confianza del 95%, 1,47-2,08; p<0,001), pero este efecto fue más pronunciado en los pacientes con IC crónica (odds ratio: 1,96; intervalo de confianza del 95%, 1,48-2,61; p<0,001)4. En este estudio, los autores señalaron que había una gran heterogeneidad entre los resultados, lo cual reflejaba la complejidad de los síndromes de ICA y las diferencias en los criterios utilizados para la definición del EFR. En este sentido, el reto más importante que queda por afrontar es diferenciar entre una LRA verdadera y una hemoconcentración relacionada con la descongestión (figura). Para intentar facilitar a los clínicos la interpretación de las alteraciones de la función renal sugerimos que se tengan en cuenta las siguientes características:
Curso clínico. Al evaluar las alteraciones de la función renal es imprescindible adoptar un enfoque global, en el que se tengan en cuenta los síntomas, las constantes vitales y el volumen de diuresis, entre otros factores.
Estado de sobrecarga de líquidos. Algunas observaciones recientes han indicado que el EFR no guarda relación alguna con los resultados clínicos cuando se da en pacientes con una hemoconcentración concomitante64–67. Así pues, en los pacientes hiperhidratados a los que se aplica un tratamiento diurético intensivo, el EFR puede ser un indicador indirecto de la descongestión y, como tal, un indicador de una respuesta apropiada al tratamiento y, potencialmente, de una mejor evolución clínica64–67. Por el contrario, el EFR que aparece en el contexto de unos signos de congestión persistentes o bien en pacientes con una presumible hipoperfusión renal podría comportar un peor pronóstico15,44,63–67.
Función renal basal y magnitud de las alteraciones renales. Algunas observaciones recientes han indicado que la trascendencia clínica de las alteraciones de la función renal dentro de las primeras 48 a 72h siguientes al ingreso hospitalario por ICA viene dada, en gran parte, por la presencia de una insuficiencia renal al ingreso y por la magnitud de las alteraciones79. De hecho, en los pacientes con insuficiencia renal al ingreso en el hospital, el aumento de la creatinina mostró una asociación independiente con el mayor riesgo de mortalidad a 1 año y el exceso de riesgo alcanzó significación estadística, incluso con aumentos pequeños. En cambio, en los pacientes con una función renal normal o levemente deteriorada al ingreso, los cambios pequeños de la creatinina observados en la práctica clínica diaria no se asociaron de manera significativa a la mortalidad y tan solo las alteraciones importantes de la creatinina (superiores a 1mg) presentaron una relación con una peor evolución clínica79. En consonancia con estos resultados, el ensayo RELAX-AHF, en el que se incluyó a pacientes con disfunción renal, un aumento de la creatinina ≥ 0,3mg/dl y un aumento de la cistatina C ≥ 0,3mg/l a los 2 días se asociaron a un riesgo superior de mortalidad a los 180 días (hazard ratio = 1,76; intervalo de confianza del 95%, 1,11-2,82, y hazard ratio = 2,10; intervalo de confianza del 95%, 1,38-3,20, respectivamente)80. Se postula que los cambios pequeños en pacientes sin una insuficiencia renal establecida corresponden a la hemoconcentración más que a un deterioro renal de la función renal.
Tiempo hasta el inicio y duración. A diferencia de lo que ocurre en el EFR persistente, que suele asociarse a alteraciones hemodinámicas y a un mal pronóstico, el EFR transitorio que aparece como consecuencia de un tratamiento de descongestión enérgico puede no asociarse a una mala evolución clínica19.
TratamientoLa mayor parte de los tratamientos recomendados para la ICA carecen de una evidencia bien sustentada7. Además, los ensayos controlados y aleatorizados que se han llevado a cabo en la IC crónica y la ICA han excluido sistemáticamente a los pacientes con una disfunción renal grave. En la mayoría de los casos, los tratamientos actuales incluyen el uso de diuréticos, fármacos vasoactivos inotrópicos y antagonistas neurohormonales.
DiuréticosLos diuréticos del asa son el tratamiento farmacológico de elección para el control de la sobrecarga de líquidos en los pacientes con ICA7. Sin embargo, su empleo es en gran parte empírico y suele asociarse a efectos nocivos significativos, como el EFR y un mayor riesgo de mala evolución clínica60. En consecuencia, se ha considerado que los diuréticos son un arma de doble filo, con efectos nocivos en los pacientes con insuficiencia renal y una congestión venosa leve, y efectos beneficiosos (en cuanto a la función renal y al pronóstico) en los pacientes con una sobrecarga de líquidos grave e insuficiencia renal60,62,63. Lamentablemente, no se dispone de datos procedentes de estudios amplios y bien controlados realizados con el objetivo de determinar las dosis óptimas de diuréticos en los pacientes con SCR tipo 1. De hecho, en el estudio DOSE, un ensayo clínico aleatorizado que tuvo como objetivo investigar el método óptimo de uso de los diuréticos del asa en 308 pacientes con ICA, los autores observaron que una estrategia de dosis altas, en comparación con una estrategia de dosis bajas, se asociaba a un efecto superior en cuanto a la pérdida neta de líquidos, la reducción de peso y el alivio de la disnea, pero también a un EFR transitorio65. Lamentablemente, todavía no se dispone de estudios controlados en los que se haya evaluado la estrategia diurética óptima en el SCR tipo 1.
UltrafiltraciónEl estudio UNLOAD81 fue un ensayo prospectivo, aleatorizado y multicéntrico en el que se compararon los efectos de la ultrafiltración temprana utilizada sola con los de los diuréticos intravenosos solos por lo que respecta a la reducción de peso, los síntomas y las hospitalizaciones a corto plazo en pacientes con ICA y una sobrecarga de volumen, con una media de creatinina sérica de 1,5±0,5mg/dl. En dicho estudio, los autores no observaron cambios renales significativos entre los grupos, pero hubo una superioridad de la ultrafiltración por lo que respecta a las variables de valoración de la eficacia. Sin embargo, más recientemente, Bart et al82 han evaluado la eficacia y la seguridad de la ultrafiltración en 188 pacientes con una descompensación aguda de la IC, complicada por una congestión persistente y un EFR. A las 96h de la inclusión en el estudio, los pacientes del grupo de ultrafiltración presentaron un efecto similar al de los pacientes que recibieron un tratamiento farmacológico escalonado por lo que respecta a la reducción de peso. Sin embargo, hubo un incremento superior de los valores de creatinina en suero en el grupo de ultrafiltración en comparación con el grupo de tratamiento farmacológico (0,23±0,70 frente a 0,04±0,53mg/dl; p=0,003); del mismo modo, el grupo de ultrafiltración presentó un aumento de la incidencia de acontecimientos adversos graves82.
DopaminaClásicamente se ha indicado el tratamiento con dopamina para facilitar la diuresis, presumiblemente con una mejoría del flujo sanguíneo renal a través de un aumento modesto del gasto cardiaco. En 60 pacientes con ICA descompensada incluidos en el ensayo DAD-HF I83, el EFR se produjo con mayor frecuencia en el grupo de tratamiento con dosis altas de furosemida en comparación con el grupo en el que se utilizaron dosis bajas de furosemida combinadas con dopamina a dosis bajas (el 30% en el grupo de furosemida a dosis altas frente al 6,7% en el de dosis bajas; p=0,042). No obstante, en un ensayo clínico controlado reciente (ROSE)84, en el que participaron 360 pacientes con ICA y disfunción renal (FG estimado entre 15-60ml/min/1,73 m2), no se pudo demostrar una superioridad del tratamiento con dopamina por lo que respecta al volumen acumulativo de diuresis y los cambios de la cistatina C en plasma a las 72h respecto al valor basal84.
Antagonistas del sistema renina-angiotensina-aldosteronaEl papel del bloqueo del sistema renina-angiotensina-aldosterona, con el empleo de inhibidores de la enzima de conversión de la angiotensina o antagonistas de receptores de angiotensina en el SCR no está claro. Los pacientes con ICA pueden desarrollar una hipotensión y/o un EFR durante el tratamiento inicial7. En los pacientes hospitalizados con un EFR significativo, las guías actuales recomiendan una reducción o una suspensión transitoria de los inhibidores de la enzima de conversión de la angiotensina o los antagonistas de receptores de angiotensina hasta que mejora la función renal7. En este sentido, la evidencia que respalda el papel de los antagonistas de la aldosterona en el SCR es aún más escasa7.
Relaxina y otros tratamientosEn el ensayo RELAX-AHF80, el empleo de serelaxina (una formulación sintética de la hormona relaxina) se asoció a una menor incidencia de EFR el día 2, unos valores inferiores de creatinina en suero y de cistatina C en plasma en los primeros 5 días siguientes a la inclusión, y una reducción del riesgo de mortalidad a 180 días. En cambio, en un amplio ensayo clínico aleatorizado de 2.033 pacientes hospitalizados por ICA y disfunción renal, el antagonista de receptores de adenosina A1, rolofilina, no mostró una superioridad en cuanto a los cambios de la creatinina y la aparición de un EFR persistente85.
Otros tratamientos, como los antagonistas de vasopresina, los péptidos natriuréticos y levosimendán, con posibles efectos favorables en los pacientes con un SCR de tipo 1, o bien no han sido estudiados de manera rigurosa, o bien, tras unos resultados preliminares prometedores, se encuentran aún en fase de investigación34.
CONCLUSIÓNEl EFR que se produce en la ICA es una observación frecuente, que tiene una fisiopatología compleja y que no se conoce bien. Sin embargo, las alteraciones de la función renal que se observan durante las descompensaciones de la IC deben situarse en un contexto adecuado para diferenciar con exactitud la LRA verdadera del EFR que es consecuencia de una descongestión enérgica. Así pues debe realizarse una evaluación exhaustiva de estas alteraciones de la función renal en la ICA. Serán precisos nuevos estudios para obtener una mayor perspectiva respecto a los mecanismos fisiopatológicos del SCR tipo 1 y para buscar formas de mejorar la exactitud diagnóstica y pronóstica de los métodos actuales, así como para explorar métodos de tratamiento efectivos.
FINANCIACIÓNEste estudio fue financiado por subvenciones del Instituto de Salud Carlos III, Red de Investigación Cardiovascular, Programa 7 (RD12/0042/0010 y RD12/0042/0068) del Fondo Europeo de Desarrollo Regional.
CONFLICTO DE INTERESESNinguno.