La insuficiencia cardiaca aguda es una de las causas de hospitalización más frecuentes y continúa conllevando dificultades para la elección del mejor tratamiento para mejorar la evolución clínica del paciente. Según lo indicado por las guías internacionales, en cuanto los pacientes con insuficiencia cardiaca aguda llegan al servicio de urgencias, el enfoque terapéutico habitual tiene como objetivo la mejoría de los signos y síntomas, corregir la sobrecarga de volumen y mejorar la hemodinámica cardiaca aumentando la perfusión de los órganos vitales. El tratamiento recomendado para tratar de manera inmediata la insuficiencia cardiaca aguda se caracteriza por el uso de diuréticos intravenosos, oxigenoterapia y vasodilatadores. Aunque estas medidas alivian los síntomas del paciente, no tienen una influencia favorable en la mortalidad a corto y largo plazo. Por consiguiente, hay una necesidad acuciante de nuevos fármacos para el tratamiento de la insuficiencia cardiaca aguda, lo que hace que la investigación en este campo aumente en todo el mundo.
Palabras clave
La insuficiencia cardiaca aguda (ICA) es una de las principales causas de hospitalización en todo el mundo. El tratamiento de la insuficiencia cardiaca crónica está bien definido en las guías y se ha demostrado que mejora la esperanza de vida de los pacientes afectados1,2. Sin embargo, en el caso de la ICA, los diuréticos, la oxigenoterapia y los vasodilatadores actualmente disponibles se utilizan ampliamente, pero no se ha demostrado que reduzcan la mortalidad. Además, hay pocos ensayos clínicos grandes sobre el tratamiento de la ICA en servicios de urgencias (SU), y las recomendaciones de las guías actuales están respaldadas solo por niveles de evidencia bajos1,2.
No obstante, hoy se acepta ampliamente que el primer paso en el tratamiento de la ICA es el tratamiento inmediato en el SU3,4.
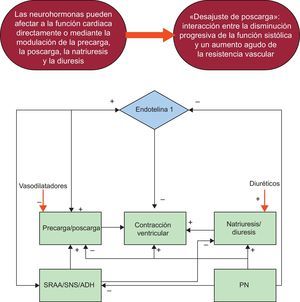
El enfoque actual del tratamiento de los pacientes con ICA en el SU tiene como objetivo la mejoría de los signos y síntomas del paciente, corregir la sobrecarga de volumen, aumentar la perfusión de los órganos finales y mejorar el estado hemodinámico contrarrestando la hiperactivación neurohormonal que constituye el principal mecanismo fisiopatológico de la enfermedad (figura 1). Se ha demostrado que un abordaje enérgico y apropiado del tratamiento de la ICA resulta útil para mejorar la evolución clínica de los pacientes5,6. Actualmente, el tratamiento farmacológico tradicional se caracteriza por el uso de diuréticos, oxigenoterapia y vasodilatadores, que siguen siendo la piedra angular del tratamiento inmediato de la ICA7,8.
A pesar del inicio más temprano del tratamiento, y aun cuando este sea enérgico, la mortalidad de los pacientes con ICA sigue siendo muy elevada, lo cual pone de manifiesto la necesidad de mejorar los resultados clínicos mediante nuevas estrategias terapéuticas9,10.
DIURÉTICOSLos diuréticos siguen siendo la piedra angular del tratamiento de la ICA. Las guías internacionales actuales consideran que los diuréticos de asa por vía intravenosa (i.v.) son el tratamiento de primera línea para los pacientes con ICA2,3,11. Este enfoque tiene como objetivo mejorar la congestión12, pero ha sido escasa la evaluación en ensayos clínicos aleatorizados de su eficacia para prolongar la supervivencia en la ICA13. La furosemida, la torasemida y la bumetanida son los diuréticos más comúnmente empleados; el primero de ellos es el fármaco que más se usa en los pacientes con ICA. Estos fármacos tienen mecanismos catabólicos diferentes: la furosemida se elimina principalmente a través del riñón, mientras que la torasemida y la bumetanida se eliminan principalmente a través del hígado14. Estudios recientes de López et al15 en modelos animales han demostrado que la torasemida, pero no la furosemida, tiene un efecto inhibidor de la actividad de la aldosterona que da lugar a una disminución del remodelado fibrótico de los miocitos. Además, se ha propuesto que la torasemida puede tener un efecto diferente en la activación del sistema simpático16.
Dada la mayor biodisponibilidad de los diuréticos cuando se administran por vía intravenosa vez de por vía oral, se recomienda la administración i.v. en los pacientes con ICA, lo que permite que el proceso de diuresis se inicie entre 30 y 60min tras la administración. De manera similar a lo que ocurre con la morfina, los diuréticos de asa por vía i.v. tienen un efecto dilatador venoso inicial que reduce la congestión pulmonar antes del inicio de la diuresis17,18. Hay controversia respecto a la relación dosis-respuesta con los diuréticos i.v., y a menudo la dosis inicial se elige de forma empírica. Las guías recomiendan una dosis inicial de diurético i.v. que iguale o supere la dosis diaria de los pacientes en tratamiento de mantenimiento11. El análisis del ensayo ESCAPE19 demostró que hay un riesgo de mortalidad dependiente de la dosis con los diuréticos i.v., especialmente con la furosemida si se superan los 300 mg/día. En un estudio unicéntrico, se observó que el cuartil más alto de dosis diaria de diurético (> 160 mg) es el que tiene la tasa más alta de riesgo-mortalidad20. Peacock et al21 observaron que los diuréticos podían causar un empeoramiento de la función renal a dosis altas, con la consiguiente mala evolución clínica del paciente. Sin embargo, estos datos se vieron influidos por diferentes variables (insuficiencia cardiaca avanzada, insuficiencia renal, comorbilidades) que aumentan el riesgo individual de peor evolución clínica.
En una revisión Cochrane de ocho ensayos clínicos sobre ICA en pacientes asignados aleatoriamente a diuréticos de asa en administración continua o en bolo, los pacientes que recibieron la infusión continua presentaron un aumento de la diuresis. Dado que la infusión continua da lugar a un aporte más constante del diurético en el túbulo renal, su uso reduce el rebote de retención de sodio tras el diurético y mantiene una diuresis más uniforme22. Sin embargo, recientemente, en el ensayo a doble ciego DOSE (Diuretic Optimization Strategies Evaluation), se ha asignado aleatoriamente a los pacientes un tratamiento con dosis bajas o altas de furosemida i.v., y la administración continua o intermitente de furosemida i.v. Los resultados pusieron de manifiesto una tendencia a mayor alivio de los síntomas en el grupo de dosis alta, con mejora de la reducción de volumen y disminución del peso a las 72 h. En el grupo de dosis alta, la concentración de creatinina aumentó, pero esto no influyó en la duración de la hospitalización ni en la supervivencia. Además, se demostró también que la eficacia de la infusión continua era similar a la del tratamiento con bolos intermitentes23.
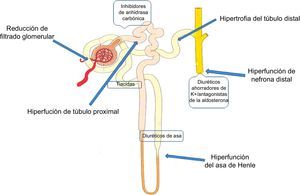
Las tiacidas son diuréticos menos activos en el tratamiento de la ICA. Pueden usarse cuando los pacientes con ICA parecen presentar una respuesta insuficiente a los diuréticos de asa, lo que sucede a menudo en caso de resistencia a los diuréticos17 (figura 2). La combinación de metolazona con diuréticos de asa ha mostrado gran eficacia24.
El mecanismo compensatorio neurohumoral en la ICA, activado por el tratamiento diurético con estimulación del sistema nervioso simpático y el sistema renina-angiotensina-aldosterona, puede tener un efecto de conservación del gasto cardiaco, pero su activación prolongada puede conllevar efectos nocivos25. Los antagonistas de los receptores mineralocorticoideos podrían ser útiles en el tratamiento de los pacientes con ICA no solo porque aumentan la diuresis, sino también porque atenúan los efectos de la activación del sistema de la aldosterona a causa del empleo de diuréticos de asa25,26. Además, atenúan la depleción de potasio y magnesio causada por los diuréticos de asa. No obstante, la espironolactona es un diurético débil cuando se emplea sola, y solamente puede utilizarse en combinación con diuréticos de asa. En las fases muy iniciales de la ICA, debe usarse en dosis i.v. más altas que las del tratamiento de mantenimiento. Esto limita su utilidad debido a que muchos pacientes con insuficiencia cardiaca tienen una enfermedad renal crónica que podría agravarse con el uso de dosis altas de antagonistas de los receptores mineralocorticoideos27.
VASODILATADORESLos vasodilatadores, junto con los diuréticos, son los fármacos más comúnmente utilizados para la ICA en el SU. Estos fármacos reducen la precarga, la poscarga o ambas al producir una dilatación arterial y venosa, con lo que disminuye la presión de llenado ventricular izquierda, aumenta el volumen de eyección y mejora el aporte periférico de oxígeno17. Un reciente análisis del registro ADHERE12 ha puesto de manifiesto que los pacientes tratados con fármacos vasoactivos en un plazo de 6 h tras el ingreso en el hospital presentan una tasa de mortalidad intrahospitalaria significativamente inferior y hospitalizaciones más cortas17. En un estudio llevado a cabo en pacientes ingresados en la unidad de cuidados intensivos a causa de una ICA, el uso de dosis altas de nitroglicerina (NTG) produjo la resolución inmediata de los síntomas, con disminución de la congestión pulmonar y menor necesidad de ventilación mecánica28. Las guías internacionales recomiendan usar vasodilatadores en pacientes con ICA como adyuvante al tratamiento diurético para una resolución rápida de los síntomas congestivos de los pacientes normotensos o hipertensos que no presentan una valvulopatía obstructiva grave2,3,11.
Los vasodilatadores más comúnmente utilizados en el tratamiento de la ICA son la NTG, el nitroprusiato y la nesiritida.
La NTG es un nitrato orgánico que ejerce su acción mediante la vasodilatación del músculo por acción del óxido nítrico. Reduce las presiones de llenado cardiacas y aumenta el gasto cardiaco. Se utiliza principalmente para pacientes con presión arterial alta o normal y para los que no responden o presentan una respuesta parcial a los diuréticos. Se emplea con preferencia para pacientes con síndromes coronarios agudos. Su efecto es breve y rápido. La dosis inicial debe ser de 10-20μg/min y se aumenta en incrementos de 10–20μg hasta que los síntomas del paciente mejoran17,29. No se debe superar la dosis de 200μg/min. Un estudio en el que se trató a pacientes con ICA utilizando NTG i.v. sola o en combinación con furosemida puso de manifiesto que los pacientes tratados con ambos fármacos tuvieron una estancia hospitalaria más corta30 y disminución de péptidos natriuréticos y alcanzaron una supervivencia a los 36 meses superior a la de los pacientes tratados con uno de los dos fármacos solamente.
En el ensayo VMAC31, los pacientes tratados con NTG i.v. presentaron una mejora de la presión capilar pulmonar enclavada a las 3 h de iniciarse el tratamiento. En un estudio pequeño de comparación entre morfina más furosemida y NTG más acetilcisteína, tan solo se observaron pequeñas diferencias entre los grupos de tratamiento y no se apreció ventaja alguna en un grupo respecto al otro32.
El nitroprusiato es un vasodilatador directo, potente y rápido, con un mecanismo similar al de la NTG. Requiere la interrupción lenta de su administración debido a un posible rebote de vasoconstricción29. La administración de este fármaco se inicia con 10μg/min y se incrementa en 10–20μg cada 10–20min. Su semivida es muy breve (2 min), lo que permite la instauración inmediata en situaciones de emergencia17. Son pocos los ensayos clínicos en que se ha evaluado la eficacia del nitroprusiato. En un estudio retrospectivo, se observó una mejoría sustancial del índice cardiaco, reducción de la mortalidad por cualquier causa y menor frecuencia de efectos adversos en el seguimiento a largo plazo, en comparación con los pacientes a los que no se administró nitroprusiato33. Un estudio de unicéntrico en el que se evaluó el uso del nitroprusiato en pacientes con estenosis aórtica grave y disfunción ventricular izquierda puso de manifiesto que el fármaco mejoraba de forma rápida y significativa el índice cardiaco a las 6 y a las 24 h34. La principal preocupación con el empleo del nitroprusiato es la toxicidad de sus catabolitos, en especial en los pacientes con insuficiencia renal y hepática, cuando se emplea una posología > 3μg/kg/min durante más de 72 h35.
La nesiritida es la forma recombinante del péptido natriurético tipo B. Aumenta la dilatación arterial y venosa incrementando la concentración intracelular de monofosfato cíclico de guanosina (GMPc). Se administra en una dosis de carga de 2μg/kg, y luego una infusión de 0,01-0,03μg/kg/min durante 72 h. En los ensayos principales, la duración media ha sido de 24 h31. El mecanismo de acción principal es la disminución de la presión de llenado del ventrículo izquierdo. Se ha demostrado que este fármaco reduce la presión capilar pulmonar enclavada y la resistencia vascular pulmonar y que mejora significativamente el gasto cardiaco en comparación con la NTG y el placebo31. Tiene una semivida superior a la de otros vasodilatadores y, por consiguiente, la hipotensión, como efecto adverso, puede persistir durante más tiempo. Se ha expresado preocupación por los efectos adversos del fármaco en la función renal y el aumento de la mortalidad a corto plazo36,37; por este motivo, se ha producido una disminución del uso de este fármaco38. Un reciente metanálisis intentó contrarrestar los resultados de estas publicaciones y puso de manifiesto que, primero, no había un aumento de la creatinina dependiente de la dosis en respuesta al fármaco cuando se usaba en dosis en la franja normal y, segundo, había una tendencia a aumento de la mortalidad a los 30 días, pero no a los 180 días. Los autores señalan que no se debe usar la nesiritida para reemplazar los diuréticos ni para potenciar su acción39. En un amplio estudio reciente ASCEND-HF (Acute Study of Clinical Effectiveness of Nesiritide and Decompensated Heart Failure) en el que se combinó nesiritida o placebo con el tratamiento estándar, se describió una mejoría de la disnea en el grupo de nesiritida, pero también un riesgo significativo de hipotensión sintomática o asintomática. Sin embargo, tiene interés señalar que no hubo diferencias de mortalidad o de disfunción renal entre los dos grupos40. En un ensayo multicéntrico, controlado y aleatorizado, Peacock et al41 observaron que no había diferencias significativas en la tasa de hospitalizaciones al añadir nesiritida al tratamiento estándar de la ICA.
MORFINAEl uso de la morfina en el tratamiento de la ICA es incierto. Se ha descrito que la morfina reduce la precarga y la frecuencia cardiaca y tiene propiedades sedantes. Su efecto neto es el de una reducción de la demanda miocárdica de oxígeno29. Mientras que la guía de la Sociedad Europea de Cardiología respalda el uso de opiáceos en el tratamiento de la ICA, no ocurre lo mismo con la de la American Heart Association1,2,11. Específicamente, la morfina debe usarse en caso de edema pulmonar agudo. Un reciente análisis observacional del registro ADHERE apunta que el uso de morfina se asoció a peor evolución clínica, incluidos necesidad de ventilación mecánica, hospitalizaciones más largas, más ingresos en la unidad de cuidados intensivos y mayor mortalidad ajustada por el riesgo42. La guía de la Heart Failure Society of America no hace una recomendación formal respecto a la morfina, pero sostiene que se debe utilizar con precaución1. Se deberá realizar un nuevo ensayo prospectivo y aleatorizado para evaluar la utilidad o falta de utilidad de la morfina en la ICA.
OXIGENOTERAPIALa oxigenoterapia es con frecuencia una de las medidas de primera línea que se aplican en la ICA, junto con los diuréticos y los vasodilatadores. La cantidad de oxígeno se evalúa y se administra en función de la saturación de oxígeno y la gasometría arterial. Se la considera un dato clave en la clasificación de los pacientes43. Se debe considerar el apoyo con ventilación mecánica en algunos casos seleccionados de pacientes con ICA, mediante presión positiva continua de vías aéreas o presión positiva binivel (bilevel). Esto podría reducir la necesidad de intubación, acortar la estancia en la unidad de cuidados intensivos y reducir la mortalidad44,45. La ventilación no invasiva se utiliza ampliamente, pero el efecto de este enfoque en la mortalidad no está bien establecido.
DIGOXINALa digoxina podría ser útil en el tratamiento de los pacientes con ICA, a pesar de que no se la considera tratamiento de primera línea. Este fármaco tiene efectos vagomiméticos y reduce la actividad del sistema renina-angiotensina y la resistencia venosa sistémica y aumenta el gasto cardiaco. Aunque la guía de la Sociedad Europea de Cardiología considera el uso de digoxina en la ICA para controlar la frecuencia cardiaca2, en especial en presencia de fibrilación auricular aguda, las guías de la American Heart Association y la Heart Failure Society of America no indican su empleo1,11. No se han realizado todavía estudios en los que se haya examinado los resultados clínicos para determinar el efecto terapéutico favorable de la digoxina en la ICA46.
INHIBIDORES DE LA ENZIMA DE CONVERSIÓN DE LA ANGIOTENSINAAunque los inhibidores de la enzima de conversión de la angiotensina (IECA) se usan ampliamente en la insuficiencia cardiaca crónica, su uso i.v. en la ICA se ha estudiado poco. Ello se debe principalmente a sus efectos adversos, como hipotensión, disfunción renal y desequilibrio electrolítico. En consecuencia, los IECA no tienen un papel preciso en la ICA29. En un pequeño ensayo aleatorizado a doble ciego, se evaluó el uso de enalaprilato i.v. en el edema pulmonar agudo, en comparación con placebo. El enalaprilato produjo mayor reducción de la presión capilar pulmonar enclavada y mejora del flujo sanguíneo renal, pero se administró entre 6 y 18 h después de la llegada de los pacientes al SU, lo cual impide que estos datos sean útiles en el contexto de un tratamiento de emergencia47. En otro estudio sobre la eficacia de enalaprilato en pacientes con crisis hipertensivas en el SU, se evaluó su efecto en una cohorte pequeña de pacientes con ICA, y se demostró que no tenía efectos adversos graves y que el fármaco es útil en el tratamiento de la ICA48. Sin embargo, estos dos estudios no recomiendan el uso de IECA en la ICA y las guías internacionales no avalan su empleo precoz1,2,11.
FÁRMACOS INOTRÓPICOSLos fármacos inotrópicos se emplean en la ICA grave con hipotensión y mala función cardiaca17. Los datos del registro ADHERE indican que el 14% de los pacientes con ICA de ese registro fueron tratados con fármacos inotrópicos y que estos pacientes tuvieron una tasa de mortalidad superior (19%) a la del conjunto de los demás pacientes. En otro estudio de exacerbaciones de la insuficiencia cardiaca crónica, se observó que el tratamiento con milrinona se asoció a una incidencia significativamente superior de hipotensión y arritmias auriculares (ensayo OPTIME)6,49. El registro ALARM-HF50 observó que la tasa de mortalidad intrahospitalaria fue muy superior entre los pacientes tratados con fármacos inotrópicos i.v. (25,9%) en comparación con los pacientes que no recibieron estos fármacos (5,2%) (p < 0,0001). Teniendo en cuenta estos resultados, las guías actuales resaltan el uso de fármacos inotrópicos para el alivio de los síntomas y la mejora de la disfunción de los órganos finales en los pacientes con presión arterial sistólica baja (< 90 mmHg) y signos de bajo gasto1,2,11. En algunos pacientes podría obtenerse un efecto beneficioso con el empleo de fármacos inotrópicos como tratamiento puente al trasplante cardiaco, el implante de dispositivo de ayuda ventricular o la revascularización29. Los fármacos inotrópicos disponibles son dopamina, dobutamina (ambos agonistas betaadrenérgicos) y milrinona (un inhibidor de la fosfodiesterasa de tipo III). La dobutamina tiene efectos inotrópicos y vasodilatadores favorables, con menos efectos adversos en la disfunción renal (hipotensión) que la milrinona, lo cual hace que sea el fármaco preferido para el tratamiento de los pacientes con ICA y síndrome de bajo gasto. Se administra a una dosis inicial de 1–2μg/kg/min, que se ajusta según la respuesta clínica. Las dosis > 10μg/kg/min pueden asociarse a un aumento de la incidencia de arritmias51.
Se puede considerar el uso de la milrinona como tratamiento de mantenimiento junto con bloqueadores beta, puesto que estos reducen los efectos arritmogénicos de la milrinona52, y como tratamiento de primera línea, con preferencia sobre la dobutamina, en casos de ICA e hipertensión pulmonar grave debido a sus propiedades vasodilatadoras más pronunciadas53.
LEVOSIMENDÁNEl levosimendán es un nuevo fármaco inotrópico, sensibilizador del calcio, que potencia la contractilidad miocárdica al aumentar la afinidad de la troponina C por el calcio sin elevar las concentraciones intracelulares de este17. No causa vasoconstricción, ya que no aumenta las concentraciones de adrenalina o noradrenalina y mejora el gasto cardiaco y el volumen de eyección54. Este fármaco se administra a una dosis inicial de 6–12μg/kg en 10min y en infusión i.v. de 0,1μg/kg/min durante 24 h. Se ha estudiado ampliamente55–57. El estudio LIDO55 mostró la superioridad del levosimendán respecto a la dobutamina para reducir la presión capilar enclavada y la muerte a los 6 meses en pacientes con ICA. Sin embargo, en el ensayo SURVIVE56, no hubo diferencias de mortalidad a los 180 días entre el grupo de pacientes con ICA tratados con dobutamina y el grupo tratado con levosimendán. Un ensayo reciente ha indicado que no hubo superioridad del levosimendán respecto a la dobutamina, con una tendencia favorable al levosimendán a las 24 h de iniciarse la infusión57. Dos metanálisis mostraron que el levosimendán aporta un efecto beneficioso en cuanto a la supervivencia a largo plazo en comparación con la dobutamina58,59. Sin embargo, los resultados de los diversos estudios realizados con levosimendán son muy diversos. En un reciente análisis secundario del ensayo REVIVE60, levosimendán mejoró los síntomas de ICA a costa de un aumento de eventos adversos como arritmias e hipotensión. Según la guía de la Sociedad Europea de Cardiología, se debe considerar el uso de levosimendán para pacientes con ICA que no tienen hipotensión grave cuando se cree que el bloqueo beta contribuye a causar la hipoperfusión (clase B, nivel C)2.
NUEVOS TRATAMIENTOS MÉDICOS PARA LA INSUFICIENCIA CARDIACA AGUDAAntagonistas de los receptores de vasopresinaEstos nuevos fármacos contrarrestan los efectos de la arginina vasopresina, que está aumentada en la insuficiencia cardiaca y conduce a retención de líquidos51. El antagonismo de estos receptores en la circulación sistémica causa vasodilatación y eliminación de agua libre en el riñón29. Los antagonistas de los receptores de vasopresina actualmente conocidos son conivaptán y tolvaptán. El tolvaptán está indicado para el tratamiento de la ICA. Un ensayo amplio sobre la eficacia del tolvaptán es el estudio EVEREST61, pero no se observaron diferencias en mortalidad (tanto de causa cardiovascular como por cualquier causa) y hospitalizaciones. Al añadir tolvaptán a los tratamientos tradicionales, se observó una mejoría modesta de la hemodinámica, la disnea, el peso corporal y la hiponatremia. El conivaptán parece comportarse de manera similar al tolvaptán en los pacientes con ICA62. Ambos fármacos han sido autorizados por la Food and Drug Administration para el tratamiento de la hiponatremia. Sin embargo, las actuales guías internacionales no incluyen recomendaciones sobre el uso de esos fármacos en la ICA1,2,11.
UlaritidaLa ularitida es un péptido natriurético, estudiado en diversos ensayos63, que aumenta la natriuresis y la diuresis al unirse a receptores del péptido natriurético auricular en el riñón. Este fármaco mejora la hemodinámica y los signos/síntomas de ICA, al parecer sin causar un empeoramiento de la función renal, pero no es infrecuente que cause hipotensión grave63,64. El TRUE-AHF (TRial of Ularitide's Efficacy and safety in patients with Acute Heart Failure) es un ensayo clínico aleatorizado de fase III actualmente en marcha, diseñado para evaluar el posible papel de ularitida administrada en infusión i.v., al añadirla al tratamiento convencional de los pacientes con ICA. La variable de valoración principal será una variable combinada clínica jerárquica, que incluye evaluación centrada en el paciente de la progresión clínica, evaluación de la ausencia de mejora o el empeoramiento de la ICA que requiera una intervención preespecificada, y la muerte.
RelaxinaEl análogo recombinante de la hormona humana endógena relaxina se está estudiando actualmente para la ICA. La relaxina es un péptido que desempeña un papel central en la regulación de los cambios hemodinámicos y vasculorrenales que se producen durante el embarazo17. Libera óxido nítrico, inhibe la endotelina y la angiotensina II y produce factor de crecimiento endotelial y metaloproteinasas de matriz65. Recientemente, ha crecido el interés por esta molécula en el tratamiento de la ICA. Un estudio piloto inicial ha demostrado que la relaxina tiene efectos favorables en los pacientes con insuficiencia cardiaca, como disminución de la presión de llenado ventricular y aumento del gasto cardiaco66. Un amplio estudio controlado con placebo (Pre-RELAX-AHF)67 puso de manifiesto que la relaxina se asocia a alivio de la disnea y disminución de la variable de valoración combinada formada por muerte cardiovascular y reingreso a los 60 días. En una reciente continuación de este estudio, el ensayo RELAX-AHF68,69, los pacientes asignados aleatoriamente al tratamiento con relaxina presentaron una disminución significativamente superior de la disnea en una escala analógica visual a lo largo de 5 días. Además, los signos clínicos de congestión mejoraron con mayor rapidez y la dosis total de diuréticos i.v. fue significativamente inferior. Las estancias en el hospital y en la unidad coronaria se redujeron significativamente en el grupo de relaxina. Se reclutó a los pacientes más precozmente que en otros ensayos clínicos en el contexto de un SU68. Metra et al69 indican que la serelaxina puede producir también efectos beneficiosos en los marcadores de la lesión de órganos diana; de hecho, los parámetros cardiacos, renales y hepáticos mejoraron en los pacientes tratados con serelaxina, con una disminución significativa de creatinina, péptidos natriuréticos, transaminasas y troponinas de alta sensibilidad, todos los cuales son marcadores pronósticos de la mortalidad. Esta mejora de los péptidos natriuréticos, como la obtenida tras un tratamiento con serelaxina69, se debe tener muy en cuenta, puesto que los cambios positivos del péptido natriurético tipo B después del tratamiento de la insuficiencia cardiaca constituyen un objetivo cada vez más importante para confirmar el efecto beneficioso real en la evolución clínica futura de los pacientes70. No obstante, serán necesarios más datos para determinar el papel definitivo que debe desempeñar la relaxina en los pacientes con ICA descompensada.
RolofyllinaLa rolofyllina es un antagonista de la adenosina. Se cree que la adenosina contribuye a reducir el filtrado glomerular en la insuficiencia cardiaca. En cambio, este antagonista induce la diuresis, al inhibir el receptor A1 de adenosina en las arteriolas aferentes del riñón. Sobre la base de este posible efecto beneficioso en la ICA, la rolofyllina se evaluó en un ensayo clínico inicial que demostró que, al añadirla a la furosemida, aumentaba la diuresis y prevenía la disminución del aclaramiento de creatinina71. Sin embargo, en un reciente ensayo más grande (PROTECT)72, este fármaco no produjo mejoría alguna de los síntomas de ICA en comparación con el placebo y no redujo la mortalidad cardiovascular ni las rehospitalizaciones. Dada su correlación con un aumento de los eventos adversos neurológicos, se abandonó su desarrollo73.
Omecamtiv mecarbiloEsta molécula es un activador de la miosina cardiaca que aumenta la transición del complejo actina-miosina e inhibe la hidrolisis no productiva del trifosfato de adenosina (ATP)74. El efecto final es un aumento del tiempo de eyección sistólica y el volumen de eyección y una mejora del consumo miocárdico de oxígeno75. El único estudio publicado sobre este nuevo fármaco se ha realizado en pacientes con insuficiencia cardiaca crónica, pero no en la ICA. Un ensayo controlado con placebo puso de manifiesto que el omecamtiv mecarbilo mejora la función cardiaca de los pacientes con insuficiencia cardiaca causada por disfunción ventricular izquierda76. Estos datos bastaron para llevar a cabo un nuevo estudio en pacientes con ICA (ATOMIC AHF [Acute Treatment with Omecamtiv Mecarbil to Increase Contractility in Acute Heart Failure]) al objeto de evaluar con mayor detalle el posible papel del omecamtiv mecarbilo. Aunque no se alcanzó el objetivo principal de reducir la disnea, la cohorte tratada con la dosis más alta del fármaco presentó un alivio de la disnea superior al del grupo tratado con placebo, y hubo también otras tendencias favorables relacionadas con la dosis y con la concentración (datos no publicados de Teerlink et al77).
CledivipinaLa clevidipina es un nuevo antagonista del calcio de acción corta que dilata selectivamente las arteriolas y carece de efectos en la contractilidad miocárdica51. Se evaluó por primera vez en un análisis secundario de un pequeño estudio sobre el tratamiento de la hipertensión en el SU. El fármaco también redujo rápidamente la presión arterial en los pacientes con ICA sin causar empeoramiento de la insuficiencia cardiaca78. La cledivipina se estudió posteriormente en un estudio aleatorizado abierto, llevado a cabo en pacientes con ICA que tenían presión arterial sistólica > 160mmHg en el SU. Los pacientes tratados con clevidipina presentaron una mejoría significativa de la disnea durante un periodo de hasta 3 h y mejora de la presión arterial en comparación con los pacientes tratados con vasodilatadores estándares79. Estos resultados van a favor de un uso habitual de la cledivipina, pero es necesaria precaución en el ajuste de la dosis, dado que en estos pacientes se observa un exceso de efecto en la presión arterial significativamente superior.
IstaroximaLa istaroxima es un péptido que estimula la Na-K/ATPasa ligada a la membrana y potencia la actividad de la Ca/ATPasa tipo 2a del retículo sarcoplásmico. Aumenta la inotropía y mejora la lusitropía, sin causar efectos hemodinámicos adversos80. En el ensayo HORIZON81, un estudio prospectivo y a doble ciego de determinación de dosis, la infusión de istaroxima redujo significativamente la presión pulmonar enclavada, mejoró la función diastólica y el índice cardiaco y aumentó la presión arterial sistólica de pacientes con ICA en comparación con placebo80. Estos resultados ponen de manifiesto que este prototipo de un nuevo fármaco podría tener un efecto beneficioso para los pacientes con ICA de bajo gasto81.
CinaciguatEl cinaciguat es un nuevo vasodilatador que actúa mediante la activación de la guanilato ciclasa soluble, con lo que aumenta la producción de GMPc en las células de músculo liso82. Parece que cinaciguat produce mayor vasodilatación que los nitratos en casos de gran estrés oxidativo. Aparentemente, los datos preliminares de pacientes con ICA muestran efectos beneficiosos del cinaciguat, con disminución de la presión arterial sistólica y mejora del gasto cardiaco82. El programa COMPOSE83 desarrolló un conjunto de tres ensayos clínicos aleatorizados, a doble ciego y controlados con placebo, en dosis fijas, multicéntricos, multinacionales y de fase IIb, destinados a definir el posible papel del cinaciguat en la ICA. El fármaco fue bien tolerado en el estudio clínico piloto, pero un estudio de fase II se interrumpió prematuramente a causa de que los efectos hipotensores habían superado los niveles aceptables en los pacientes tratados con dosis ≥ 200μg/h. En el ensayo COMPOSE EARLY, se produjo hipotensión en el 27,9% de los pacientes con ICA (en comparación con el 5,3% de los tratados con placebo) al utilizar cinaciguat, y los acontecimientos adversos graves aparecidos durante el tratamiento se dieron en el 16,3% de los casos (en comparación con el 10,5% del grupo de placebo). No hubo ningún efecto apreciable en el índice cardiaco ni evidencia alguna de efectos beneficiosos en cuanto a la disnea, lo cual llevó a los investigadores a poner en duda la utilidad del cinaciguat en la ICA. Se están realizando nuevos estudios sobre el posible uso de cinaciguat en situaciones de emergencia.
CenderitidaLa cenderitida es una proteína quimérica creada mediante la fusión de partes de los péptidos natriuréticos C y D, con objeto de combinar sus efectos beneficiosos en los pacientes con ICA. El primero aumenta el flujo sanguíneo renal y el segundo da lugar a dilatación venosa con efectos antialdosterónicos84. Hasta ahora, la cenderitida se ha evaluado en voluntarios sanos y en una reducida población de pacientes con insuficiencia cardiaca congestiva e hipotensión. El fármaco se ha estudiado en infusión subcutánea continua para un uso tras el periodo de hospitalización aguda por insuficiencia cardiaca. En 2011 se completó un estudio de farmacocinética y farmacodinámica de fase I que mostró efectos dependientes de la dosis en la presión arterial a lo largo de 24 h de infusión85. Se planificó, pero no llegó a iniciarse, un ensayo de fase II en el que se pretendía evaluar el remodelado cardiaco, la función renal, la rehospitalización y la mortalidad como variables de valoración después de 90 días de tratamiento continuo con cenderitida mediante una bomba de administración subcutánea en pacientes dados de alta del hospital tras una ICA.
CXL-1020El CXL-1020 es un donante de nitroxilo puro que proporciona unos efectos lusitrópicos e inotrópicos positivos directos independientes del monofosfato cíclico de adenosina, así como una dilatación venosa y arterial combinada86. Sin embargo, no se han realizado estudios en pacientes con ICA y se están llevando a cabo nuevas evaluaciones del CXL–1020.
TRV120027El TRV120027 es un ligando del receptor de la angiotensina II tipo 1 sesgado para la beta-arrestina desarrollado recientemente para un posible uso en pacientes con ICA. Este fármaco actúa como un antagonista convencional de los receptores de la angiotensina, inhibiendo la vasoconstricción que produce la angiotensina II. En 2014 se inició un estudio de fase II de determinación de dosis, a doble ciego y controlado con placebo, en el que se pretende incluir a pacientes hospitalizados por ICA (NCT01187836).
CONCLUSIONESEn conclusión, el tratamiento farmacológico de la ICA continúa basándose en el empleo de diuréticos por vía i.v., solos o en combinación con una serie de fármacos como vasodilatadores (levosimendán y nitratos), inhibidores de la enzima de conversión de la angiotensina, oxigenoterapia, digoxina y morfina. Debe usarse dopamina en los pacientes con ICA complicada por un shock cardiogénico. En la actualidad existen evidencias crecientes y un gran interés por el uso de «nuevos» fármacos que son vasodilatadores potentes con mecanismos diuréticos y natriuréticos, como ularitida y relaxina. Además, se están estudiando otras moléculas que actúan a diversos niveles sobre las células de músculo liso cardiaco, las arteriolas o el flujo sanguíneo renal. Los resultados son alentadores, y es probable que esos fármacos se sumen muy pronto al tratamiento tradicional para el manejo útil de la ICA.
CONFLICTO DE INTERESESNinguno.