SEC 2021 - El Congreso de la Salud Cardiovascular
Introducción
Dr. Héctor Bueno
Presidente del Comité Científico del Congreso
Comité ejecutivo
Comité de evaluadores
Listado de sesiones
Índice de autores
4018. Insuficiencia cardiaca: genética y biomarcadores
4018-2. EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
1Universidad de Murcia. 2Hospital Clínico Veterinario, Murcia. 3Hospital Clínico Universitario Virgen de la Arrixaca, Murcia. 4Cardiovascular Research Institute, Mount Sinai Hospital, Nueva York (Estados Unidos).
Introducción y objetivos: La caracterización de la cardiotoxicidad (CTx) por doxorrubicina (Dx) es esencial para diseñar terapias capaces de proteger al paciente. Recientemente, identificamos a Yin yang1 (Yy1) como un factor relacionado con la transcripción de sST2 tras infarto de miocardio. Aquí, hemos caracterizado el nexo entre miR106b-5p (mi106) con Yy1 en relación con la expresión cardiaca de sST2 por Dx.
Métodos: Ratones C57BL6 sometidos a 5 ciclos con Dx (5 mg/kg; i.v.) fueron sacrificados a las 8 semanas del 1er ciclo. Un grupo control fue generado usando salino. La administración de antimiR106 y de un bloqueador del sitio diana para mi106 (SB) (20 mg/kg, i.v.) fue simultánea con Dx. Las dimensiones y la función cardiaca se analizaron mediante ecocardiografía antes del 1er ciclo y previo al sacrificio. Los análisis bioquímicos se realizaron usando el ventrículo izquierdo (VI). Cardiomiocitos (hiPsCMs) en presencia de Dx (5 μM, 15h) y protocolos de transfección (secuencias, 50nM) se usaron como modelo traslacional. La cuantificación de mi106, así como niveles de ARNm se evaluaron por RT-qPCR y la expresión de proteínas por western blot. Se utilizó análisis in silico para predecir los objetivos de mi106 y ensayos de co-inmunoprecipitación para confirmar la interacción entre proteínas. Los niveles de sST2 y cTnT se cuantificaron mediante ELISA.
Resultados: Un incremento significativo de mi106 y sST2 fue evaluado en el VI y plasma de animales tratados con Dx, lo que se asoció con un incremento de fibrosis, pérdida de viabilidad y disfunción cardiaca. El silenciamiento de mi106 disminuyó la expresión de sST2, previno fibrosis y mejoró la función cardiaca. Por análisis in silico, luciferasa y posterior confirmación usando un SB específico, miR106 redujo la expresión de PP55α lo que bloqueó la desfosforilación de HDAC4. La terapia con antimiR106 favoreció la desfosforilación de HDAC4 que al interaccionar con Yy1 en la fracción nuclear, impidió la transcripción de sST2. Resultados similares se obtuvieron en hiPsCMs. La sobreexpresión de mi106 con mimic, la de PP55α por AAV6 o el uso de sST2-Fc, confirmó la implicación del eje PP55α/Yy1/sST2 en la CTx.
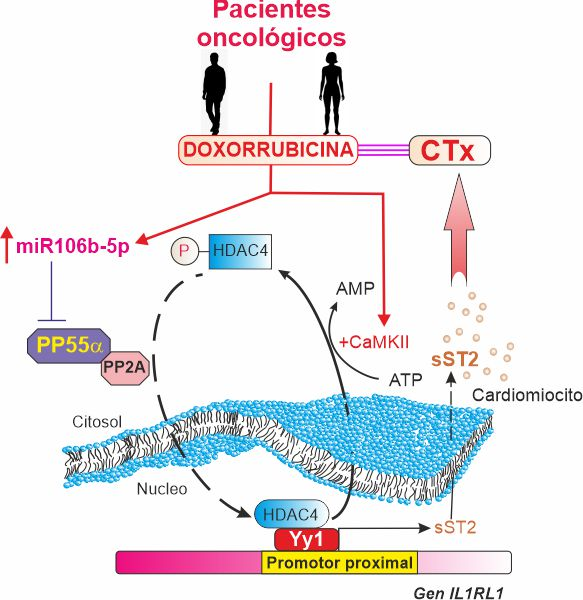
Esquema representativo del eje molecular PP55a/Yy1/sST2 y su relación con la cardiotoxicidad por antraciclinas.
Conclusiones: La sobreexpresión de PP55α por antimiR106 favorece la fosforilación de HDAC4, lo que bloquea la actividad de Yy1 y la transcripción de sST2 lo que mejora en la función cardiaca. La manipulación de esta vía ofrece nuevas opciones terapéuticas contra la CTx.
Comunicaciones disponibles de "Insuficiencia cardiaca: genética y biomarcadores"
- 4018-1. MODERADORA
- Evelyn Santiago Vacas, Barcelona
- 4018-2. EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
- María del Carmen Asensio López1, Álvaro Hernández Vicente1, María Josefa Fernández del Palacio2, César Caro Martínez3, Damián López García1, Silvia Pascual Oliver1, Fernando Soler Pardo1, Yassine Sassi4, Domingo Andrés Pascual Figal3 y Antonio Manuel Lax Pérez1
1Universidad de Murcia. 2Hospital Clínico Veterinario, Murcia. 3Hospital Clínico Universitario Virgen de la Arrixaca, Murcia. 4Cardiovascular Research Institute, Mount Sinai Hospital, Nueva York (Estados Unidos).
- 4018-3. ALTERACIONES EN EL SISTEMA TERRA Y SU RELACIÓN CON LA FUNCIÓN CARDIACA EN CORAZONES HUMANOS ISQUÉMICOS
- Estefanía Tarazón1, Lorena Pérez-Carrillo2, Isaac Giménez-Escamilla2, Juan Carlos Triviño3, Luis Martínez-Dolz1, Manuel Portolés1 y Esther Roselló Lletí1
1IIS La Fe-Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV), Madrid. 2IIS La Fe-Fundación para la Investigación del Hospital Universitario y Politécnico La Fe, Valencia. 3Sistemas Genómicos-ASCIRES, Paterna, Valencia.
- 4018-4. VALOR PRONÓSTICO DEL NT-PROBNP Y CA125 EN INSUFICIENCIA CARDIACA AGUDA EN FUNCIÓN DE LA TASA DE FILTRADO GLOMERULAR ESTIMADA
- Mauricio José Pellicer Bañuls1, Rafael de la Espriella Juan1, Antoni Bayés Genís2, Pau Llácer Iborra3, Patricia Palau Sampío1, Gema Miñana Escrivà1, Enrique Santas Olmeda1, Miguel González Rico4, José Luis Górriz Teruel4, Vicente Bodí Peris1, Juan Sanchis Forés1 y Julio Núñez Villota1
1Servicio de Cardiología, Hospital Clínico Universitario de Valencia, Universitat de Valencia, INCLIVA, Valencia. 2Unidad de Insuficiencia Cardiaca, Servicio de Cardiología, Hospital Universitari Germans Trias i Pujol, Universidad Autónoma de Barcelona, CIBERCV, Badalona, Barcelona. 3Servicio de Medicina Interna, Hospital Ramón y Cajal, Madrid. 4Servicio de Nefrología, Hospital Clínico Universitario de Valencia, INCLIVA, Universitat de Valencia.
- 4018-5. UTILIDAD DEL ANTÍGENO CARBOHIDRATO 125 EN LA PLANIFICACIÓN DE LA DURACIÓN DE LA ESTANCIA HOSPITALARIA ÓPTIMA EN INSUFICIENCIA CARDIACA AGUDA
- Miguel Lorenzo Hernández1, Patricia Palau Sampío1, Pau Llácer Iborra1, Eloy Domínguez Mafé2, Gonzalo Núñez Marín1, Bruno Ventura Pérez2, Javier Solsona2, Héctor Merenciano González1, Ana Gabaldón Pérez1, Gema Miñana Escrivà1, Enrique Santas Olmeda1, Rafael de la Espriella Juan1, Juan Sanchis Forés1, Francisco Javier Chorro Gascó1 y Julio Núñez Villota1
1Hospital Clínico Universitario de Valencia. 2Hospital General de Castellón.
- 4018-6. MACF1 COMO BIOMARCADOR PARA LA DETECCIÓN DE RECHAZO CELULAR AGUDO TRAS EL TRASPLANTE CARDIACO
- Estefanía Tarazón1, Lorena Pérez-Carrillo2, José María Rodríguez2, Isaac Giménez-Escamilla2, Juan Carlos Triviño3, Ignacio Sánchez-Lázaro1, Luis Martínez-Dolz1, Manuel Portolés1 y Esther Roselló Lletí1
1IIS La Fe-Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV), Madrid. 2IIS La Fe-Fundación para la Investigación del Hospital Universitario y Politécnico La Fe, Valencia. 3Sistemas Genómicos-ASCIRES, Paterna, Valencia.
- 4018-7. UTILIDAD DE LA MONITORIZACIÓN DE LAS POBLACIONES LINFOCITARIAS EN SANGRE PERIFÉRICA PARA DETECTAR ENFERMEDAD VASCULAR DEL INJERTO EN EL TRASPLANTE CARDIACO
- Clara Simón Ramón , Laura Martínez-Martínez, Mario Salido Iniesta, Mireia Padilla López, Gemma Boera Carnicero y Sonia Mirabet Pérez
Hospital de la Santa Creu i Sant Pau, Barcelona.
Más comunicaciones de los autores
-
Asensio López, María del Carmen
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
-
Caro Martínez, César
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
-
Fernández del Palacio, María Josefa
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
-
Hernández Vicente, Álvaro
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
-
Lax Pérez, Antonio Manuel
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
-
López García, Damián
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
-
Pascual Figal, Domingo Andrés
- 6037-9 - RESULTADOS DE UNA CONSULTA TELEFÓNICA URGENTE ENTRE CARDIOLOGÍA Y ATENCIÓN PRIMARIA PREVIA A LA DERIVACIÓN DE CASOS DUDOSOS A URGENCIAS HOSPITALARIAS
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4025-7 - ESTUDIO MULTICÉNTRICO ESPAÑOL SOBRE LA MONITORIZACIÓN E INCIDENCIA DE HIPERPOTASEMIA EN PACIENTES CON INSUFICIENCIA CARDIACA Y FRACCIÓN EYECCIÓN REDUCIDA. SPANIK-HF
- 4025-6 - SPANIK-HF-ESTUDIO MULTICÉNTRICO ESPAÑOL SOBRE LA PREVALENCIA, INCIDENCIA Y PRONÓSTICO DE HIPERPOTASEMIA EN PACIENTES CON INSUFICIENCIA CARDIACA: DATOS BASALES
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 6013-4 - IMPACTO DE LA FUNCIÓN RENAL EN LA FARMACOCINÉTICA Y FARMACODINÁMICA DE TICAGRELOR EN PACIENTES CON SCASEST. RESULTADOS DE UN ESTUDIO MECANICÍSTICO
- 5005-7 - EFICACIA DE LA ESTIMULACIÓN EN EL ÁREA DE LA RAMA IZQUIERDA EN PACIENTES CON INDICACIÓN DE TERAPIA DE RESINCRONIZACIÓN CARDIACA
- 6006-9 - RELACIÓN ENTRE LA PRESENCIA DE LÍQUIDO INTERSTICIAL PULMONAR Y LOS CAMBIOS QUE SE PRODUCEN EN LA FISIOLOGÍA CARDIOPULMONAR TRAS LA PRÁCTICA DE BUCEO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
-
Pascual Oliver, Silvia
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
-
Sassi, Yassine
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
-
Soler Pardo, Fernando
- 4018-2 - EL SILENCIAMIENTO DE MIR106B-5P PREVIENE LA CARDIOTOXICIDAD MEDIADA POR DOXORRUBICINA A TRAVÉS DE LA MODULACIÓN DEL EJE DE SEÑALIZACIÓN PP55-ALFA/YY1/SST2
- 5026-3 - DOXORRUBICINA INCREMENTA LA EXPRESIÓN Y SECRECIÓN DE LA ISOFORMA SOLUBLE SST2 POR EL MIOCARDIO
- 4024-7 - UNA TERAPIA BASADA EN EL USO ANTRACICLINAS INDUCE LA SOBRE-EXPRESIÓN Y SECRECIÓN DE MIR-106B-5P POR EL MIOCARDIO DAÑADO
