SEC 2024 - El Congreso de la Salud Cardiovascular
Introducción
Dr. José María de la Torre Hernández
Presidente del Comité Científico del Congreso. Vicepresidente de la SEC
Comités ejecutivo, organizador y científico
Comité de evaluadores
Listado completo de comunicaciones
Índice de autores
5017. Novedades en el manejo del paciente cardiorrenal
5017-9. Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
1Cardiología, 2Medicina de Familia y 3Unidad de Investigación. Hospital Universitario del Río Hortega, Valladolid, España.
Introducción y objetivos: La tendencia a hiperpotasemia en el seguimiento de pacientes con insuficiencia cardiaca (IC) aumenta la mortalidad, las descompensaciones también. Nuestro objetivo fue determinar si existe asociación entre hiperpotasemia y descompensación y qué parámetros se relacionan con la presencia de hiperpotasemia en el seguimiento.
Métodos: Análisis retrospectivo de pacientes atendidos en la consulta de IC. Se define como hiperpotasemia la presencia de una determinación de K > 5 mEq/l. En el seguimiento se recogen 3 determinaciones de K. Las variables resultado son presencia de hiperpotasemia en el seguimiento, descompensaciones y mortalidad.
Resultados: Se incluyeron 173 pacientes (edad media 69 ± 10 años; 81% varones). 38 pacientes (22%) tenían un K basal > 5 mEq/l y 77 (44%) desarrollaron hiperpotasemia en un seguimiento de 4,6 ± 2,7 años. La FEVI media fue de 36 ± 9%. No hubo diferencias en el uso de inhibidores del SRAA. Se descompensaron 101 pacientes (58%) y fallecieron 68 (39%). En el análisis bivariante la hiperpotasemia en el seguimiento se asoció con disfunción renal, mayor duración de la IC y más ingresos previos. La hiperpotasemia basal y en el seguimiento se asociaron con la presencia o el desarrollo de diabetes mellitus. La mortalidad fue mayor en los pacientes con hiperpotasemia en el seguimiento y en los que se descompensaron, sin embargo, no hubo asociación entre hiperpotasemia y descompensación (62 vs 55%, p = 0,344). La supervivencia acumulada a 10 años fue más baja tanto en pacientes con hiperpotasemia en el seguimiento (25 vs 61%, p = 0,005), como en descompensación (25 vs 69%, p < 0,001), reduciéndose hasta el 14% al sumar ambas condiciones. En el análisis multivariante la mortalidad se asoció a hiperpotasemia en el seguimiento (OR: 2,5; IC95%, 1,1-6,0, p = 0,034), así como al nivel basal de hs TnT, al filtrado glomerular final y al índice de Charlson, no resultando asociada con la descompensación (81,1% de explicación del modelo, p < 0,001).
|
Características basales de la población del estudio (N = 173) |
|||||||
|
Características demográficas |
Valor |
Etiología de la IC |
Valor |
Laboratorio |
Valor |
Parámetros ecocardiográficos |
Valor |
|
Edad (años) |
69 ± 10 |
Isquémica |
88 (51) |
Hemoglobina (g/dl) |
13,9 ± 1,7 |
FEVI (%) |
36 ± 9 |
|
Sexo masculino |
140 (81) |
Hipertensiva |
22 (13) |
Glucosa (mg/dl) |
116,8 ± 40,0 |
Volumen diastólico de VI (ml) |
168 ± 61 |
|
Historia médica |
|
Idiopática |
25 (14) |
Sodio (meq/l) |
138,7 ± 3,1 |
Diámetro diastólico de VI (mm) |
64 ± 9 |
|
Hipertensión |
123 (71) |
Valvular |
8 (5) |
Potasio (meq/l) |
4,7 ± 0,4 |
Septo interventricular |
11,4 ± 2,5 |
|
Diabetes mellitus |
61 (35) |
Por quimioterapia |
6 (3) |
Urea (mg/dl) |
62,0 ± 29,4 |
Alteraciones segmentarias |
91 (53) |
|
Dislipemia |
96 (55) |
Enólica |
7 (4) |
Creatinina (mg/dl) |
1,2 ± 0,4 |
Insuficiencia mitral |
52 (30) |
|
Ingresos previos por IC |
126 (73) |
Taquicardiomiopatía |
9 (5) |
TFGe ((ml/min/1,73 m2) |
68,6 ± 32,7 |
Diámetro AI (mm) |
49 ± 8 |
|
Fibrilación auricular |
62 (36) |
Miocardiopatía hipertrófica |
2 (1) |
Ácido úrico (mg/dl) |
7,3 ± 1,7 |
Volumen AI (ml/m2) |
53 ± 23 |
|
EPOC/Asma |
32 (19) |
Miocardiopatía diabética |
3 (2) |
Ferritina (ng/ml) |
113,1 ± 125,5 |
Relación E/e´ |
13 ± 6 |
|
SAHS |
21 (12) |
Miocardiopatía dilatada familiar |
2 (1) |
Saturación Transferrina (%) |
26,2 ± 13,6 |
Función VD (TAPSE) (mm) |
17 ± 4 |
|
Clase funcional de la NYHA |
|
Amiloidosis |
1 (1) |
Colesterol total (mg/dl) |
163,8 ± 38,4 |
PSAP (mmHg) |
42 ± 14 |
|
I |
65 (38) |
Exploración física |
|
LDL-colesterol (mg/dl) |
96,0 ± 30,7 |
Tratamiento previo |
|
|
II |
95 (55) |
Peso (kg) |
78 ± 16 |
NT-proBNP (pg/ml) |
2598,3 ± 2852,8 |
Betabloqueante |
169 (98) |
|
III |
13 (7) |
IMC |
28 ± 5 |
hsTnT (pg/ml) |
23,7 ± 17,2 |
IECA o ARA2 |
163 (94) |
|
Electrocardiograma |
|
TA sistólica (mmHg) |
128 ± 17 |
Adherencia al tratamiento (Morinski) |
118 (68) |
Antialdosterónico |
75 (44) |
|
Duración del QRS (ms) |
128 ± 33 |
TA diastólica (mmHg) |
73 ± 11 |
KCCQ |
51 ± 12 |
Diurético |
158 (91) |
|
Índice comorbilidad Charlson |
4 ± 2 |
FC (lpm) |
70 ± 13 |
Test de los 6 minutos |
379 ± 115 |
Estatina |
123 (71) |
|
Los datos se expresan como frecuencia absoluta y porcentaje o media ± desviación estándar. AI: aurícula izquierda; ARA2: antagonista del receptor de angiotensina tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; FC: frecuencia cardiaca; FEVI: función sistólica del ventrículo izquierdo; hsTnT: troponina T ultrasensible; IC: insuficiencia cardiaca; IECA: inhibidor del enzima convertidor de angiotensina; IMC: índice de masa corporal; KCCQ: Kansas City Cardiomyopathy Questionnaire; NT-proBNP: fracción N-terminal del péptido natriurético tipo B; NYHA: New York Heart Association; PSAP: presión sistólica de la arteria pulmonar; SAHS: síndrome de apnea hipopnea del sueño; TA: tensión arterial; TAPSE: elevación sistólica de plano del anillo tricúspide; VD: ventrículo derecho; VI: ventrículo izquierdo. |
|||||||
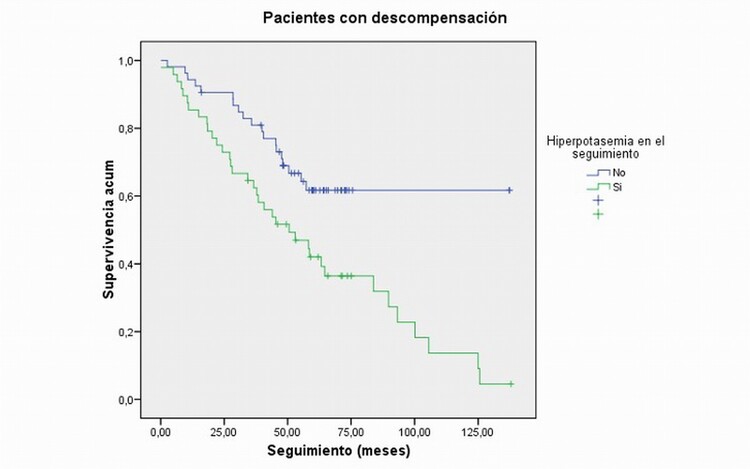
Curva de supervivencia de Kaplan-Meier en pacientes con descompensación en función de la presencia o no de hiperpotasemia en el seguimiento.
Conclusiones: La hiperpotasemia en el seguimiento a largo plazo de pacientes con IC y FEVI reducida es predictor independiente de mortalidad y, aunque no se asocia con la descompensación, la combinación de ambas variables ensombrece significativamente el pronóstico. Debido a la creciente relevancia de la hiperpotasemia en el manejo farmacológico de estos pacientes, serían interesantes estudios dirigidos a investigar su mecanismo patológico subyacente.
Comunicaciones disponibles de "5017. Novedades en el manejo del paciente cardiorrenal"
- 5017-1. Modera
- Beatriz Díaz Molina, Hospital Universitario Central de Asturias, Oviedo
- 5017-2. Una nueva arma en la nefropatía por contraste en el paciente cardiorrenal. Uso del sistema RenalGuard en pacientes con insuficiencia cardiaca con FEVI deprimida y enfermedad renal crónica
- Jose Maria Viéitez Flórez1, María Abellás Sequeiros1, Margarita Regueiro Abel1, Andrea López López1, Raymundo Ocaranza Sánchez1, Charigan Abou Jokh Casas1, Rosa Alba Abellas Sequeiros1, Jeremías Bayón Lorenzo1, Ramón Ríos Vázquez1, Pablo Otero Alonso2, Jesús Calviño Varela2 y Carlos González Juanatey1
1Cardiología y 2Nefrología. Hospital Universitario Lucus Augusti, Lugo, España.
- 5017-3. CA-125 en el epicardio y su asociación con indicadores inflamatorios y fibroblásticos
- Sonia Eiras Penas1, Rafael de la Espriella Juan2, Xiaoran Fu3, Diego Iglesias-álvarez4, Rumeysa Basdas3, José Ramón Núñez-Camamaño5, José Manuel Martínez-Cereijo4, Laura Reija4, Ángel Luis Fernández4, David Sánchez-López3, David García-Vega3, Gema Miñana6, Julio Núñez2 y José Ramón González-Juanatey4
1Cardiología Traslacional. Instituto de Investigación Sanitaria Santiago de Compostela (IDIS), Universidad de Santiago de Compostela, Santiago de Compostela (A Coruña), España, 2Hospital Clínico Universitario de Valencia. Servicio de Cardiología. INCLIVA. Universitat de València, Valencia, España, 3Instituto de Investigación Sanitaria Santiago de Compostela (IDIS), Universidad de Santiago de Compostela, Santiago de Compostela (A Coruña), España, 4Complexo Hospitalario Universitario de Santiago de Compostela, Santiago de Compostela (A Coruña), España, 5Instituto de Investigación Sanitaria Santiago de Compostela (IDIS), Santiago de Compostela (A Coruña), España y 6Hospital Clínico Universitario de Valencia. Servicio de Cardiología. INCLIVA. Universitat de València, Valencia, España.
- 5017-4. Resultados clínicos, utilización de recursos y costes de acuerdo a la función renal en pacientes con insuficiencia cardiaca
- Jorge Vélez García1, Miguel Hernández Gómez1, Claudia Yuste Lozano2, Martín Romo Pardo3, Nicolás Rosillo Ramírez4, Guillermo Moreno Muñoz5, Lourdes Vicent Alaminos1, Pablo Pérez Ruiz6, José Luis Bernal Sobrino1 y Héctor Bueno Zamora1
1Grupo de Investigación Cardiovascular Multidisciplinar Traslacional (GICMT), Instituto de Investigación del Hospital 12 de Octubre, Madrid, España, 2Servicio de Nefrología. Hospital Universitario 12 de Octubre, Madrid, España, 3Servicio de Cardiología. Hospital Universitario 12 de Octubre, Madrid, España, 4Grupo de Investigación Cardiovascular Multidisciplinar Traslacional (GICMT), Instituto de Investigación del Hospital 12 de Octubre., Madrid, España, 5Facultad de Enfermería, Fisioterapia y Podología. Universidad Complutense, Madrid, España y 6Servicio de Medicina Preventiva. Hospital Clínico San Carlos, Madrid, España.
- 5017-5. Prevalencia e impacto pronóstico de la hipocloremia en pacientes con insuficiencia cardiaca aguda
- Juan Carlos López-Azor García1, Marta Cobo Marcos1, Esther Montero2, Julia González3, María Luisa Martín4, Aránzazu Martín4, Daniel de Castro1, Fernando Domínguez1, Ana Sáinz4, Camino Gómez4, Pablo García Pavía1 y Javier Segovia Cubero5
1Unidad de Insuficiencia Cardiaca y Miocardiopatías, 2Unidad de Insuficiencia Cardiaca. Servicio de Medicina Interna, 3Unidad de Insuficiencia Cardiaca y Miocardiopatía Familiares, 4Servicio de Urgencias y 5Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España.
- 5017-6. Diferencias en la optimización del tratamiento farmacológico en pacientes con insuficiencia cardiaca y fracción de eyección reducida y enfermedad renal crónica avanzada
- Rafael González Manzanares1, María Anguita Gámez2, Manuel Anguita Sánchez1, Juan Luis Bonilla Palomas3, Alejandro Recio Mayoral4, Juan Carlos Castillo Domínguez1, Javier Muñiz García5, Nieves Romero Rodríguez6, Ángel Cequier Fillat7, Francisco Javier Elola Somoza8 y Luis Rodríguez Padial9
1UGC de Cardiología. Hospital Universitario Reina Sofía, Córdoba, España, 2Instituto Cardiovascular. Hospital Clínico San Carlos, Madrid, España, 3Unidad de Cardiología. Hospital San Juan de la Cruz, Úbeda (Jaén), España, 4Servicio de Cardiología. Hospital Universitario Virgen Macarena, Sevilla, España, 5Instituto Universitario de Ciencias de la Salud, Universidad de A Coruña, A Coruña, España, 6Servicio de Cardiología. Hospital Universitario Virgen del Rocío, Sevilla, España, 7Servicio de Cardiología. Hospital Bellvitge, L'Hospitalet de Llobregat (Barcelona), España, 8Fundación IMAS, Madrid, España y 9Hospital Virgen de la Salud, Toledo, España.
- 5017-7. Estudio comparativo sobre el perfil de pacientes derivados desde nefrología y cardiología a una unidad cardiorrenal
- Javier León Santana1, Mario Galván Ruiz1, Juan Carlos Quevedo Reina2, María del Val Groba Marco1, Adonay Santana Quintana2, Miguel Fernández de Sanmamed Girón1, Daniela Medina García2, Yuliana Daruiz d'Orazio2, Patricia Fernández Navarro2, Miriam Valcárcel Herrera2, Julio Vázquez Reguera1, Eduardo Caballero Dorta1 y Antonio García Quintana1
1Servicio de Cardiología y 2Servicio de Nefrología. Hospital Universitario de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria (Las Palmas), España.
- 5017-8. Trayectoria longitudinal de la presión arterial sistólica y riesgo de mortalidad en el paciente cardiorrenal: encontrando el punto óptimo
- Gonzalo Núñez Marín, Rafael de la Espriella Juan, Marco Montomoli, Miguel González, Sandra Villar, Miguel Lorenzo Hernández, Enrique Santas Olmeda, Jorge Montiel, Andrea Gasull, Patricia Palau Sampío, José Luis Górriz, Juan Sanchis Forés y Julio Núñez Villota
Hospital Clínico Universitario de Valencia, Valencia, España.
- 5017-9. Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
- Teresa Miriam Pérez Sanz1, Cristina Tapia Ballesteros1, Carmen de Cáceres Riol2, M. del Mar de la Torre Carpente1, Belén Redondo Bermejo1, Andreea-Catalina Cristea1, Manuel González Sagrado3 y María Jesús Rollán Gómez1
1Cardiología, 2Medicina de Familia y 3Unidad de Investigación. Hospital Universitario del Río Hortega, Valladolid, España.
Más comunicaciones de los autores
- Cristea, Andreea-Catalina
-
de Cáceres Riol, Carmen
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
-
de la Torre Carpente, M. del Mar
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
-
González Sagrado, Manuel
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
-
Pérez Sanz, Teresa Miriam
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
- 5018-7 - La insuficiencia cardiaca tras el recambio valvular en la estenosis aórtica grave es un predictor de mal pronóstico
- 5018-6 - Impacto pronóstico de la insuficiencia cardiaca como indicación de intervención en la estenosis aórtica grave
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
-
Redondo Bermejo, Belén
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
-
Rollán Gómez, María Jesús
- 5018-6 - Impacto pronóstico de la insuficiencia cardiaca como indicación de intervención en la estenosis aórtica grave
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
- 5018-7 - La insuficiencia cardiaca tras el recambio valvular en la estenosis aórtica grave es un predictor de mal pronóstico
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
- 5016-9 - Remodelado del ventrículo derecho con o sin disfunción sistólica asociada en pacientes con insuficiencia tricuspídea grave. Impacto pronóstico
-
Tapia Ballesteros, Cristina
- 5017-9 - Estudio de la relación entre hiperpotasemia y descompensación en insuficiencia cardiaca crónica y fracción de eyección reducida a partir de determinaciones seriadas de potasio
- 6107-5 - Perfil del paciente con insuficiencia cardiaca aguda en el que se solicita sodio urinario e interés pronóstico
- 5018-6 - Impacto pronóstico de la insuficiencia cardiaca como indicación de intervención en la estenosis aórtica grave
- 5018-7 - La insuficiencia cardiaca tras el recambio valvular en la estenosis aórtica grave es un predictor de mal pronóstico
